T-ALL来源的骨髓基质细胞通过FGF2-FGFR2通路促进T-ALL增殖
2025-02-15杨健李敏李越洋田晨



摘要:目的探究骨髓基质细胞(BM-MSCs)对急性T淋巴细胞白血病(T-ALL)影响的作用机制,寻找靶向BM-MSCs的有效治疗策略。方法构建Notch-1过表达诱导的T-ALL小鼠模型,分选T-ALL中BM-MSCs,与T-ALL细胞系建立体外共培养系统,检测共培养后T-ALL增殖能力变化。运用RNA测序技术寻找不同来源MSCs的差异表达基因,并用PCR验证。在小鼠体内注射BGJ398,检测肿瘤生长情况。结果与T-ALL来源的MSCs共培养后,T-ALL细胞的增殖能力显著增加。RNA测序结果显示,T-ALL来源的MSCs成纤维细胞生长因子2(FGF2)分泌增加,与T-ALL细胞上的成纤维细胞生长因子2受体(FGFR2)结合可激活T-ALL细胞中PI3K/AKT/mTOR信号通路。加入BGJ398阻断FGF2和FGFR2之间的相互作用可以抑制小鼠T-ALL肿瘤的生长。结论BM-MSCs可通过FGF2/FGFR2通路促进T-ALL肿瘤生长,阻断FGF2/FGFR2通路是克服BM-MSCs介导T-ALL进展的有效策略。
关键词:前体细胞淋巴母细胞白血病淋巴瘤;成纤维细胞生长因子2;细胞增殖;骨髓基质细胞;BGJ398中图分类号:R733.71文献标志码:A DOI:10.11958/20240355
T-ALL derived bone marrow stromal stem cells promote T-ALL proliferation through"he FGF2-FGFR2 pathway
YANG Jian1,LI Min2,LI Yueyang2,TIAN Chen2△
1 Department of Surgical Oncology,Qingdao Central Cancer Hospital,Qingdao 266042,China;2 Department of Hematology,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,Key Laboratory of Cancer Prevention and Therapy,Tianjin Clinical Research Center for Cancer
△Corresponding Author E-mail:tianchen@tjmuch.com
Abstract:Objective To elucidate the mechanistic role of bone marrow mesenchymal stromal cells(BM-MSCs)in T-cell acute lymphoblastic leukemia(T-ALL),and to find effective therapeutic strategies targeting BM-MSCs.Methods A T-ALL mouse model induced by Notch-1 overexpression was constructed.An in vitro co-culture system was established to investigate the proliferative capacity of T-ALL cells upon co-culturing with leukemia-derived MSCs.RNA sequencing was performed to identify key differentially expressed genes,which were further validated by PCR.BGJ398 was injected into mice to detect tumor growth.Results Co-culturing with T-ALL-derived MSCs resulted in a significant increase in T-ALL cell proliferation.RNA sequencing results revealed that the secretion of fibroblast growth factor 2(FGF2)from T-ALL-derived MSCs was increased,which binds to fibroblast growth factor 2 receptor(FGFR2)on T-ALL cells,activating the PI3K/AKT/mTOR signaling pathway.Blocking the interaction between FGF2 and FGFR2 using BGJ398 inhibited the growth of T-ALL tumors in mice.Conclusion BM-MSCs can promote T-ALL tumor growth through FGF2/FGFR2 pathway,and blocking FGF2/FGFR2 pathway is an effective strategy to overcome BM-MSCS-mediated T-ALL progression.
Key words:precursor cell lymphoblastic leukemia-lymphoma;fibroblast growth factor 2;cell proliferation;bone marrow mesenchymal stromal cells;BGJ398
急性T淋巴细胞白血病(T-cell acute lymphoblastic leukaemia,T-ALL)是一种极具异质性的血液系统恶性肿瘤[1]。白血病细胞破坏正常骨髓(bone marrow,BM)微环境,将其转化为异常的生态位,诱导微环境中的细胞群发生变化[2]。在这一过程中,微环境中的关键细胞,如骨髓基质细胞(bone marrow mesenchymal stromal cells,BM-MSCs)为白血病细胞提供了庇护所,进一步加速了T-ALL的进展[3-4]。因此,深入了解白血病细胞与BM-MSCs间错综复杂的相互作用,并据此探寻新的治疗靶点,对T-ALL的治疗具有实践意义。研究发现,在急性B淋巴细胞白血病(B-cell acute lymphoblastic leukaemia,B-ALL)中,BM-MSCs通过直接接触的方式促进B-ALL细胞的存活和增殖[5]。在急性髓系白血病(acute myeloid leukemia,AML)中,白血病细胞与BM-MSCs的紧密接触能够抑制药物诱导的细胞凋亡[6]。尽管已有研究报道BM-MSCs介导的保护作用涉及可溶性细胞因子、生长因子和细胞相互作用分子等多种机制[7-8],但BM-MSCs在T-ALL中的支持作用机制仍需深入探索。因此,本研究旨在揭示BM-MSCs对T-ALL细胞的作用机制,以期为T-ALL的治疗寻找新的治疗策略。
1材料与方法
1.1细胞及培养T-ALL细胞系Jurkat、人骨髓基质细胞系HS-5、人胚胎肾细胞HEK293T均由中国医学科学院血液病研究所程涛教授课题组赠送。Jurkat细胞在含10%胎牛血清(FBS)的RPMI-1640培养基中培养。HS-5和HEK293T在添加10%FBS的DMEM高糖培养基中培养。所有细胞均置于37℃、5%CO2孵箱中培养。
1.2主要试剂RPMI-1640培养基、DMEM高糖培养基购自美国Gibco公司。FBS购自ZETA公司。慢病毒载体MSCV-ICN1-IRES-GFP购自优宝生物公司。外周血淋巴细胞分离液购自索莱宝公司。CD45磁珠、Lineage磁珠(Microbeads)、LS磁柱(MACS Separation Columns)购自美天旎公司。流式抗体FITC-CD31/CD44/CD45/TER119、FITC-F4/80、FITC-RatIgG2a/2b,κIsotype Ctrl、APC-SCA1、PE-CD51、V450-Lineage(CD3/B220/CD11b/Gr-1/TER119)、PE/Cy7-cKit购自BioLegend公司。PE-AnnexinV凋亡试剂盒、APC-BrdU增殖试剂盒购自BD公司。TRIzol试剂购自ambion公司。Prime Script RT Master Mix、TB Green Premix Ex Taq购自TAKARA公司。兔源磷脂酰肌醇3激酶(PI3K)、蛋白激酶B(AKT)1+AKT2+AKT3、哺乳动物雷帕霉素靶蛋白(mTOR)抗体及各自磷酸化抗体,GAPDH抗体及羊抗兔IgG二抗购自Abcam公司。慢病毒载体pLVX-FGF2-mcherry购自优宝生物公司。成纤维细胞生长因子受体(FGFR)抑制剂BGJ398(Infigratinib)购自Selleck公司。
1.3实验动物SPF级C57BL/6J(简称C57)小鼠6只、B6.SJL(简称B6)小鼠3只、NOD/SCID小鼠10只,6~8周龄,体质量18~25 g,所有小鼠均为雌性,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2021-0011;动物使用许可证号:SYXK(津)2017―0005。所有动物实验均通过天津医科大学肿瘤医院实验动物伦理委员会审批(伦理批号:DMZF-2021050)。
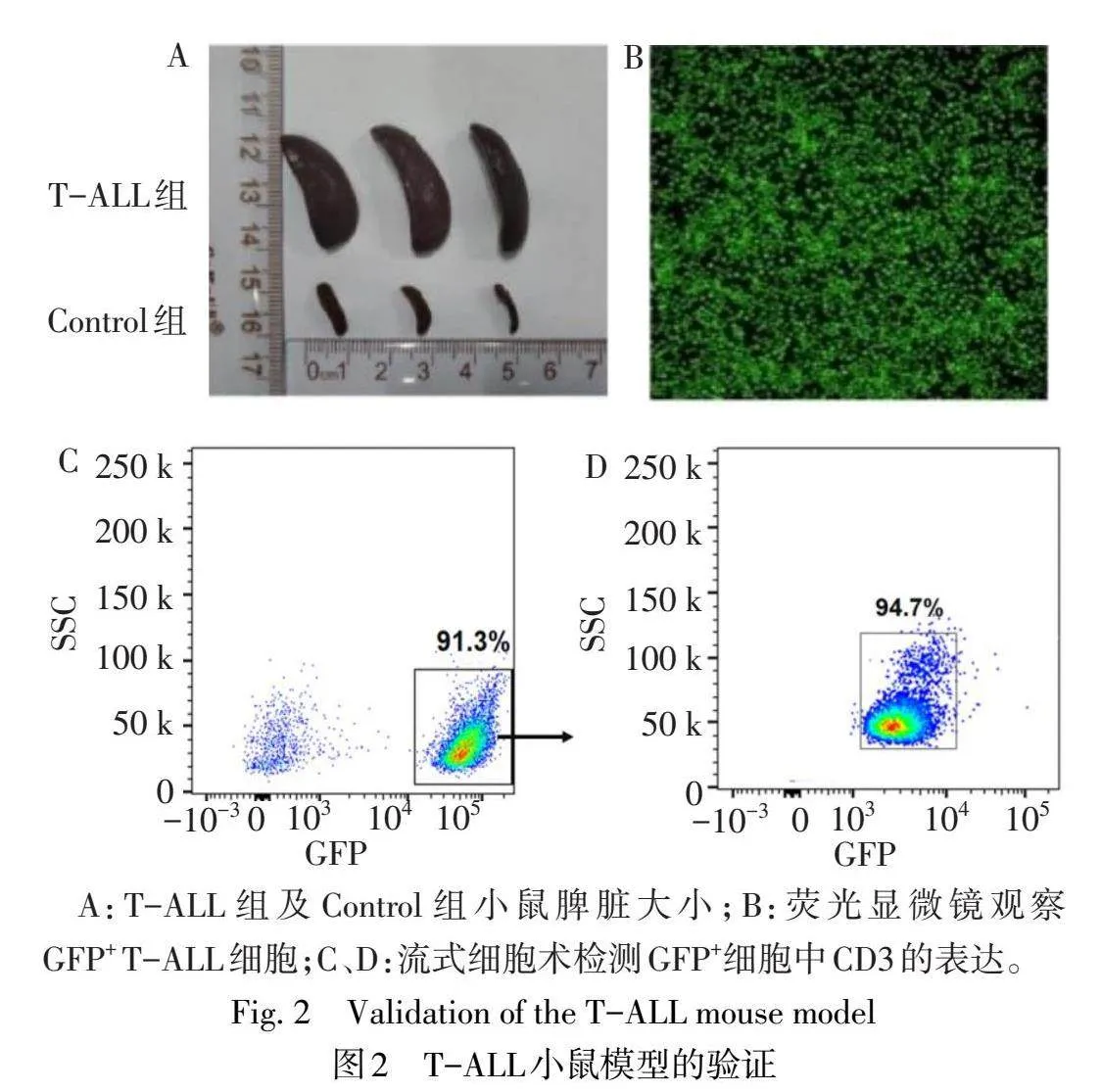
1.4 Notch-1诱导的T-ALL小鼠模型构建将过表达Notch-1的逆转录病毒载体MSCV-ICN1-IRES-GFP转染至HEK293T细胞中,继续培养293T细胞48 h后收集富含病毒原液的上清液,感染B6小鼠的骨髓细胞,构建Notch-1诱导的T-ALL细胞(即原代鼠T-ALL细胞),48 h后荧光显微镜下观察荧光评估感染情况[9]。构建流程见图1。将6只C57小鼠均分为T-ALL组(尾静脉注射原代鼠T-ALL细胞,1×106/100µL)和Control组(未作特殊处理)。注射12 d后处死2组小鼠,分离脾脏并称质量,RT-PCR验证T-ALL组BM细胞中Notch-1基因胞内段ICN1表达,倒置荧光显微镜观察GFP+T-ALL细胞表达,流式细胞仪检测GFP+细胞中CD3的表达以评估T-ALL小鼠模型构建情况。具体验证方法参考本课题组前期研究[9]。
1.5流式细胞术分选小鼠BM-MSCs用PBS冲洗Control组和T-ALL组C57小鼠的髂骨、股骨和胫骨骨髓腔获得BM细胞。用Ficoll法从BM中分离单个核细胞,用CD45磁珠去除BM细胞中的造血细胞,再使用Lineage/CD31/F4/80抗体去除其余细胞,剩余的GFP-CD45-Lin-CD31-F4/80-细胞即为目的BM-MSCs。
1.6共培养体系分别将Control组和T-ALL组的BM-MSCs与原代鼠T-ALL细胞以数目1∶3的比例(3×105个BM-MSCs细胞)置于DMEM培养基中,培养16 h后分离出悬浮的原代鼠T-ALL细胞,然后进行后续的功能实验。
1.6.1细胞增殖和凋亡检测在上述共培养后分离出的原代鼠T-ALL细胞中以10µL/mL的比例加入BrdU,孵育6 h后用抗BrdU偶联抗体标记,通过流式细胞仪分析细胞增殖情况;以5µL/mL的比例加入AnnexinV、7-AAD,冰上避光孵育15 min,1 h内通过流式细胞仪进行细胞凋亡检测。
1.6.2 RT-PCR法检测与细胞周期、凋亡及增殖相关基因的表达收集Control组与T-ALL组细胞后采用Trizol法提取总RNA。逆转录反应体系:5×Prime Script RT Master Mix 2µL,Total RNA 350 ng,RNase Free dH2O补至10µL;逆转录反应条件:37℃15 min;85℃5 s;4℃保存。RT-PCR反应体系(20µL):上、下游引物各0.8µL,2×TB Green Premix Ex TaqⅡ10µL,50×ROX Reference Dye or DyeⅡ0.4µL,cDNA溶液2µL,灭菌水6µL。RT-PCR反应条件:95℃30 s;95℃5 s,60℃34 s,40个循环,保存数据后采用2-ΔΔCt法分析数据。所有引物序列见表1。
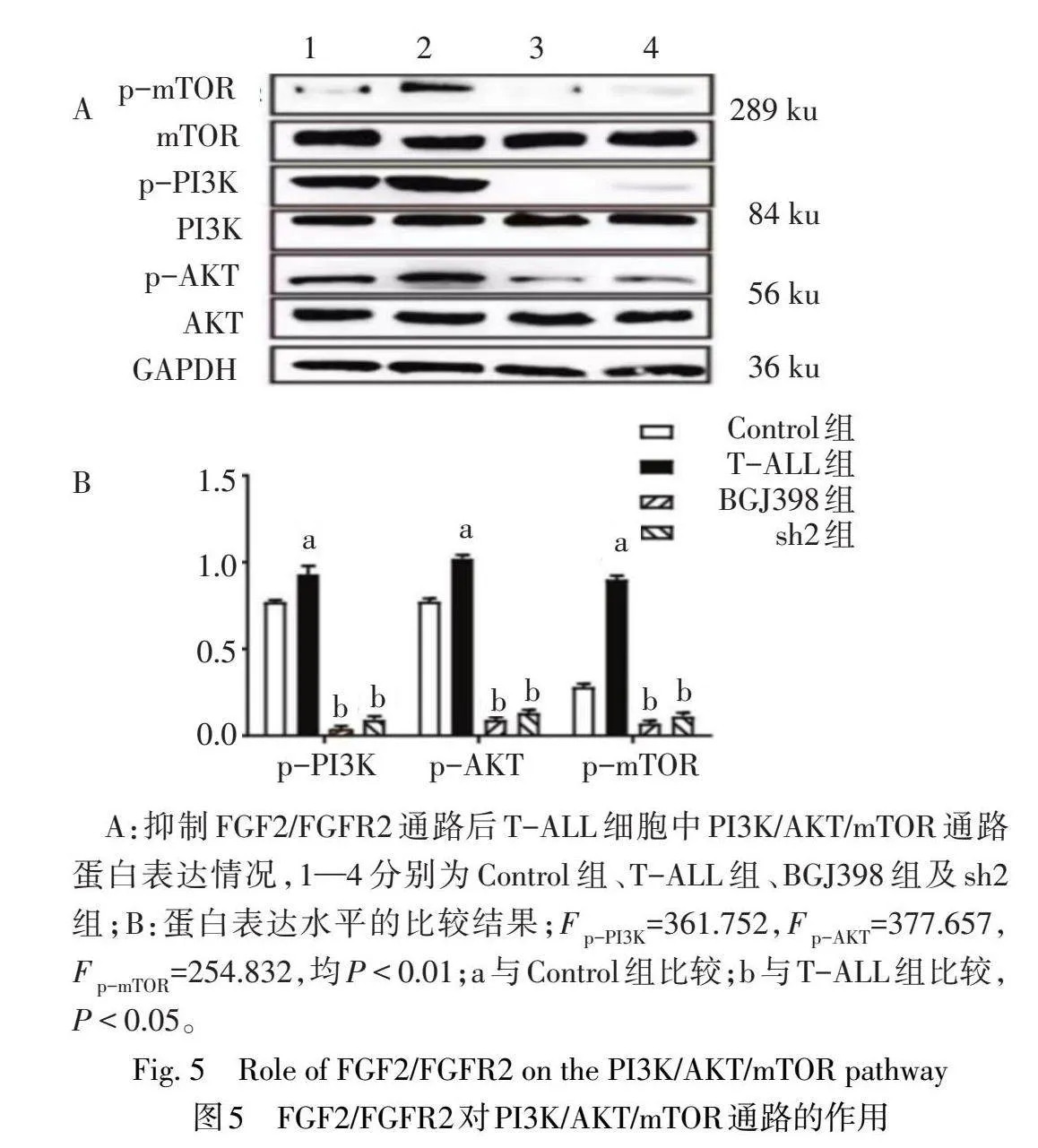
1.6.3 Western blot检测PI3K/AKT/mTOR通路相关蛋白表达RIPA裂解液提取细胞总蛋白,BCA法行蛋白定量,10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳进行蛋白分离,再将凝胶上的蛋白样本转至PVDF膜上,5%脱脂奶粉封闭PVDF膜1 h,剪膜后4℃孵育兔PI3K、AKT、mTOR、一抗(1∶1 000)过夜,TBST洗膜后,加入辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(1∶1 000)室温孵育1 h,配置化学显色试剂,化学发光仪自动曝光。将GAPDH作为蛋白内参计算目的蛋白相对表达量。
1.6.4 RNA测序分析TRIzol法提取Control组与T-ALL组BM-MSCs的总RNA后送往上海美吉生物公司(www.majorbio.com)进行RNA测序。
1.7慢病毒感染法敲降T-ALL组BM-MSCs的FGF2基因表达用pLVX-FGF2-mcherry感染HEK293T细胞,培养48 h后收集富含病毒原液的上清液。以1×106/孔的密度接种T-ALL组BM-MSCs于6孔板中,每孔加入2 mL病毒原液,并加入8 mg/L Polybrene,1 800 r/min离心90 min后弃去病毒原液,继续培养48 h后通过荧光显微镜观察红色荧光以评估感染情况。
1.8皮下成瘤及给药取雌性NOD/SCID小鼠10只,左腋下皮下接种3∶1混合的Jurkat与HS-5细胞混悬液(1×107/200µL)。保留6只肿瘤体积在100~150 mm³的小鼠,等比例分为BGJ398组及PBS组。BGJ398组每2 d腹腔注射25µL BGJ398(30 mg/kg),给药7次;PBS组同期腹腔注射25µLPBS。待PBS组小鼠肿瘤体积达1 000 mm3后中止实验,剥除各组小鼠肿瘤并称质量。
1.9统计学方法使用Graphpad Prism 8.0软件进行数据分析。正态分布的计量资料以均数±标准差(x±s)表示。2组间均数比较采用独立样本t检验,多组间均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
2结果
2.1 T-ALL小鼠模型的验证结果建模12 d后,T-ALL组C57小鼠脾脏较Control组明显增大(图2A),质量(g)增加(0.9±0.1 vs.0.1±0.0,n=3,t=45.848,Plt;0.01),Notch-1胞内段ICN1表达升高(3.8±0.3 vs.0.6±0.1,n=3,t=17.332,P<0.01)。冲洗四肢骨留取骨髓液,在荧光显微镜下发现T-ALL小鼠的BM中GFP+细胞占90%以上(图2B),T-ALL组小鼠GFP+细胞高表达CD3(图2C、D),证实T-ALL小鼠模型构建成功。
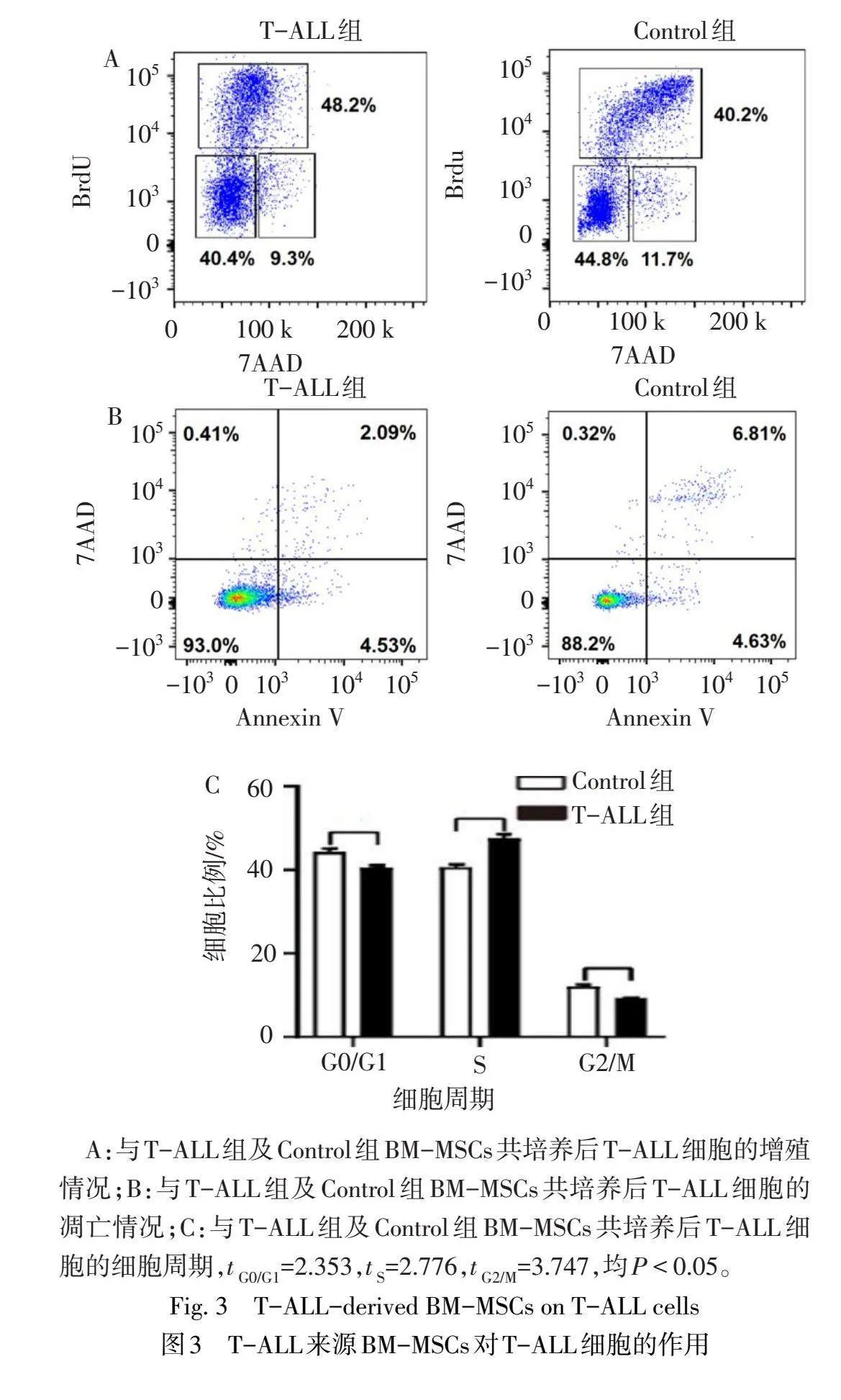
2.2 T-ALL来源的BM-MSCs促进T-ALL细胞的增殖见图3。与T-ALL组BM-MSCs共培养的T-ALL细胞数目较与Control组共培养的增多(单位:105个;6.7±0.4 vs.4.0±0.2,n=3,t=12.100,P<0.01),凋亡率降低(46.7%±6.1%vs.84.3%±7.0%,n=3,t=6.568,P<0.01),S期细胞的比例显著增加。
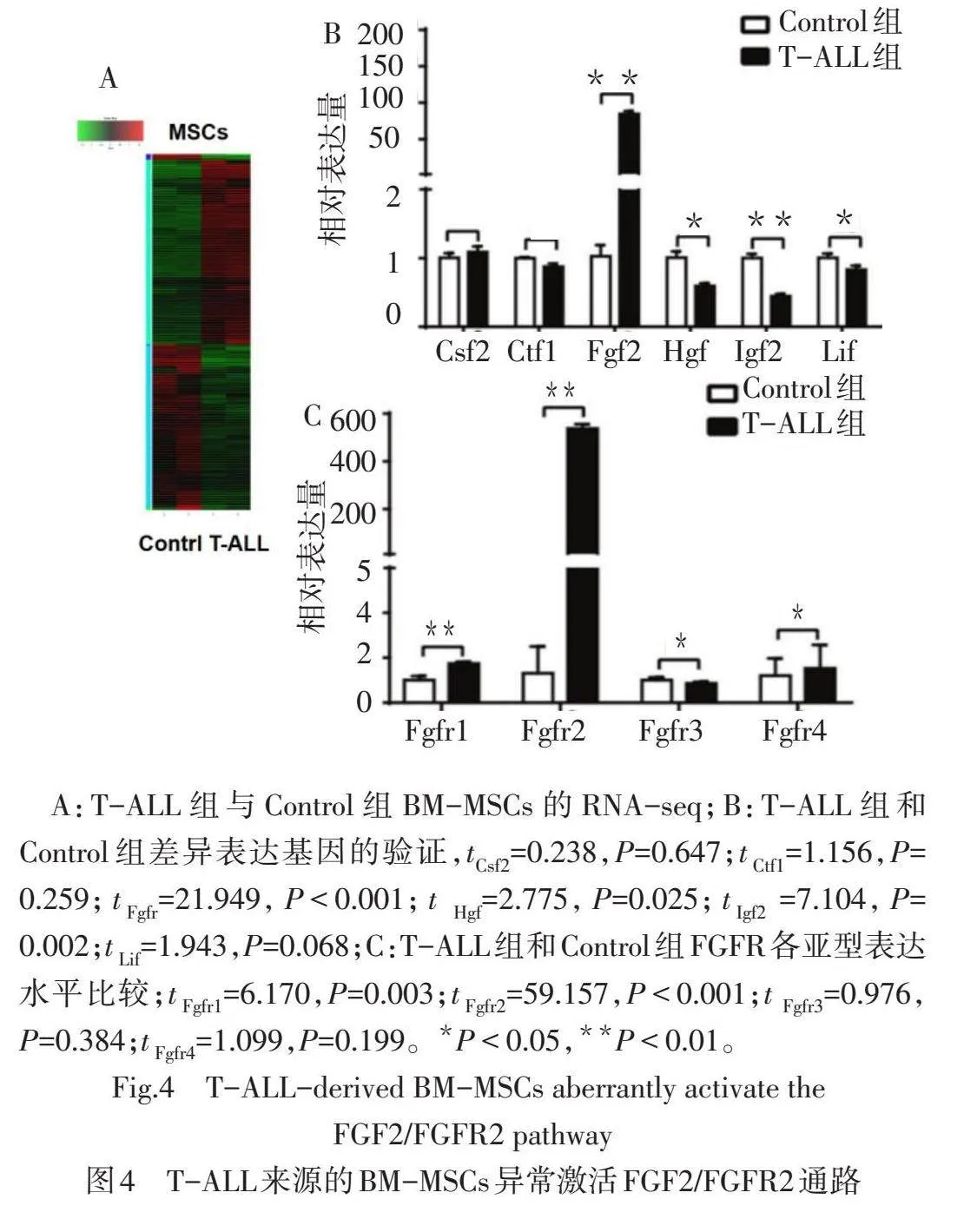
2.3 T-ALL来源的BM-MSCs异常激活FGF2/FGFR2通路RNA测序显示,T-ALL组与Control组BM-MSCs之间有74个基因存在差异表达,包括23个上调基因和51个下调基因(设置差异倍数>2,P<0.01,图4A)。74种基因中有6种与细胞周期、增殖和凋亡相关,具体为Csf2、Ctf1、Fgf2、Igf2、Hgf和Lif。PCR验证发现与Control组相比,T-ALL组BM-MSCs中Fgf2表达显著上调(图4B),与T-ALL组BM-MSCs共培养的T-ALL细胞Fgfr2表达显著上调(图4C)。
2.4 FGF2/FGFR2激活T-ALL细胞中的PI3K/AKT/mTOR通路Western-blot结果显示,与T-ALL组BM-MSCs共培养后T-ALL细胞中p-PI3K、p-AKT表达水平较Control组升高(图5A),加入BGJ398或敲降BM-MSCs中FGF2基因后,p-PI3K、p-AKT、p-mTOR蛋白表达水平显著降低(图5B)。
2.5阻断FGF2/FGFR2通路可抑制T-ALL小鼠肿瘤生长阻断FGF2/FGFR2通路后,BGJ398组小鼠肿瘤体积较PBS组明显减小,质量明显下降(单位:g;0.02±0.01 vs.0.44±0.13,t=18.290,P<0.01),见图6。
3讨论
成人T-ALL异质性强,存在原发耐药或经治疗后再次复发,导致疗效及预后欠佳。既往研究发现,骨髓微环境为白血病细胞的增殖、存活及黏附提供了支持和保护,促进了白血病的发生和发展[10-11],其中BM-MSCs的作用尤为重要。Wang等[12]发现,黏附分子ICAM-1介导Jurkat细胞与BM-MSCs的黏附,促进Jurkat细胞线粒体转移至BM-MSCs内,诱导T-ALL化疗耐药。Cai等[13]也发现,BM-MSCs可触发Drp1激活,诱导线粒体动力学变化,诱导T-ALL化疗耐药。然而,BM-MSCs对T-ALL的直接作用及发挥作用的机制尚不完全清楚,探寻具体机制对寻找骨髓微环境中的潜在T-ALL治疗靶点具有重要意义。为此笔者设计了本研究进行探索。
本研究结果显示,T-ALL来源的BM-MSCs促进T-ALL细胞的增殖,抑制T-ALL细胞的凋亡,这与Jia等[14]的研究结果一致。本研究进一步证明BM-MSCs为T-ALL细胞的生长提供了保护作用。Jia等[14]发现地塞米松通过激活甾醇调节元件结合转录因子1(SREBF1)促进BM-MSCs分化为脂肪细胞,脂肪细胞通过激活Notch1信号通路保护T-ALL细胞。本研究发现,在T-ALL微环境中,MSCs分泌大量FGF2,与T-ALL细胞上的FGFR2结合导致T-ALL细胞的PI3K/Akt/mTOR通路过度激活,进而促进T-ALL肿瘤生长。
FGFs是一类庞大的生长因子家族,可调节细胞的存活、生长和分化[15-17]。FGFs与四种FGFRs结合,可激活包括PI3K/Akt/mTOR通路在内的多条信号通路[18]。有证据表明,FGF2在血液恶性肿瘤的发病机制中起着重要作用[19],如慢性髓性白血病(chronic myelogenous leukemia,CML)、慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)和霍奇金淋巴瘤[20]。本研究首次证实,FGFs/FGF2在T-ALL的存活及进展中发挥重要作用。英菲格拉替尼,也称为BGJ398,是一种口服FGFR1-3选择性酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)。笔者发现,应用BGJ398可以使T-ALL细胞的PI3K/Akt/mTOR通路失活,抑制小鼠T-ALL肿瘤的生长,BGJ398可能是靶向T-ALL中MSCs的有效药物。
本研究为BM-MSCs对T-ALL细胞具有保护作用提供了重要的证据支持,证实BM-MSCs通过FGF2/FGFR2通路促进T-ALL肿瘤生长,为克服BM-MSCs介导的T-ALL进展提供了新靶点。FGF抑制剂BGJ398有望为T-ALL患者提供新的治疗方案,亟待临床进一步验证。当然,本研究的小鼠模型是Notch-1高表达诱导的T-ALL模型,其发生率只占T-ALL患者的10%左右,在临床上还有其他因素诱导的T-ALL[21]。因此需要临床前及临床阶段的研究,以进一步证实其他因素导致的T-ALL是否同样存在FGF2/FGFR2通路的过度激活。
参考文献
[1]ZHU H,DONG B,ZHANG Y,et al.Integrated genomic analyses identify high-risk factors and actionable targets in T-cell acute lymphoblastic leukemia[J].Blood Sci,2022,4(1):16-28.doi:10.1097/BS9.0000000000000102.
[2]COLMONE A,AMORIM M,PONTIER A L,et al.Leukemic cells create bone marrow niches that disrupt the behavior of normal hematopoietic progenitor cells[J].Science,2008,322(5909):1861-1865.doi:10.1126/science.1164390.
[3]YIN X,HU L,ZHANG Y,et al.PDGFB-expressing mesenchymal stem cells improve human hematopoietic stem cell engraftment in immunodeficient mice[J].Bone Marrow Transplant,2020,55(6):1029-1040.doi:10.1038/s41409-019-0766-z.
[4]SINGH A K,PRASAD P,CANCELAS J A.Mesenchymal stromal cells,metabolism,and mitochondrial transfer in bone marrownormal and malignant hematopoiesis[J].Front Cell Dev Biol,2023,11:1325291.doi:10.3389/fcell.2023.1325291.
[5]WU C H,WENG T F,LI J P,et al.Biology and therapeutic properties of mesenchymal stem cells in leukemia[J].Int J Mol Sci,2024,25(5):2527.doi:10.3390/ijms25052527.
[6]NWABO KAMDJE A H,SEKE ETET P F,TAGNE SIMO R,et al.Emerging data supporting stromal cell therapeutic potential in cancer:reprogramming stromal cells of the tumor microenvironment for anti-cancer effects[J].Cancer Biol Med,2020,17(4):828-841.doi:10.20892/j.issn.2095-3941.2020.0133.
[7]PARK C S,YOSHIHARA H,GAO Q,et al.Stromal-induced epithelial-mesenchymal transition induces targetable drug resistance in acute lymphoblastic leukemia[J].Cell Rep,2023,42(7):112804.doi:10.1016/j.celrep.2023.112804.
[8]SøNDERGAARD R H,HøJGAARD L D,REESE-PETERSEN A L,et al.Adipose-derived stromal cells increase the formation of collagens through paracrine and juxtacrine mechanisms in a fibroblast co-culture model utilizing macromolecular crowding[J].Stem Cell Res Ther,2022,13(1):250.doi:10.1186/s13287-022-02923-y.
[9]TIAN C,ZHENG G,CAO Z,et al.Hes1 mediates the different responses of hematopoietic stem and progenitor cells to T cell leukemic environment[J].Cell Cycle,2013,12(2):322-331.doi:10.4161/cc.23160.
[10]MAJUMDAR M K,THIEDE M A,MOSCA J D,et al.Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells(MSCs)and stromal cells[J].J Cell Physiol,1998,176(1):57-66.doi:10.1002/(SICI)1097-4652(199807)176:1lt;;57::AID-JCP7gt;;3.0.CO;2-7.
[11]邢逸,窦一鸣,王敏,等.骨髓间充质干细胞来源外泌体对炎症微环境中巨噬细胞表型及软骨细胞的调控作用[J].天津医药,2022,50(4):343-349.XING Y,DOU Y M,WANG M,et al.The regulating effect of bone marrow mesenchymal stem cell-derived exosomes on macrophage phenotype and chondrocytes in the inflammatory microenvironmen[J].Tianjin Med J,2022,50(4):343-349.doi:10.11958/20212366.
[12]WANG J,LIU X,QIU Y,et al.Cell adhesion-mediated mitochondria transfer contributes to mesenchymal stem cell-induced chemoresistance on T cell acute lymphoblastic leukemia cells[J].J Hematol Oncol,2018,11(1):11.doi:10.1186/s13045-018-0554-z.
[13]CAI J,WANG J,HUANG Y,et al.ERK/Drp1-dependent mitochondrial fission is involved in the MSC-induced drug resistance of T-cell acute lymphoblastic leukemia cells[J].Cell Death Dis,2016,7(11):e2459.doi:10.1038/cddis.2016.370.
[14]JIA R,SUN T,ZHAO X,et al.DEX-induced SREBF1 promotes BMSCs differentiation intoadipocytes to attract and protect residual T-cell acute lymphoblastic leukemia cells after chemotherapy[J].Adv Sci(Weinh),2023,10(19):e2205854.doi:10.1002/advs.202205854.
[15]IM J H,BUZZELLI J N,JONES K,et al.FGF2 alters macrophage polarization,tumour immunity and growth and can be targeted during radiotherapy[J].Nat Commun,2020,11(1):4064.doi:10.1038/s41467-020-17914-x.
[16]HOSAKA K,YANG Y,SEKI T,et al.Therapeutic paradigm of dual targeting VEGF and PDGF for effectively treating FGF-2 off-target tumors[J].Nat Commun,2020,11(1):3704.doi:10.1038/s41467-020-17525-6.
[17]ZHOU Z,LIU Z,OU Q,et al.Targeting FGFR in non-small cell lung cancer:implications from the landscape of clinically actionable aberrations of FGFR kinases[J].Cancer Biol Med,2021,18(2):490-501.doi:10.20892/j.issn.2095-3941.2020.0120.
[18]NEW J,ARNOLD L,ANANTH M,et al.Secretory autophagy in cancer-associated fibroblasts promotes head and neck cancer progression and offers a novel therapeutic target[J].Cancer Res,2017,77(23):6679-6691.doi:10.1158/0008-5472.CAN-17-1077.
[19]TRAER E,JAVIDI-SHARIFI N,AGARWAL A,et al.Ponatinib overcomes FGF2-mediated resistance in CML patients without kinase domain mutations[J].Blood,2014,123(10):1516-1524.doi:10.1182/blood-2013-07-518381.
[20]SHAH C A,BEI L,WANG H,et al.HoxA10 protein regulates transcription of gene encoding fibroblast growth factor 2(FGF2)in myeloid cells[J].J Biol Chem,2012,287(22):18230-18248.doi:10.1074/jbc.M111.328401.
[21]MELNICK A F,MULLIN C,LIN K,et al.Cdc73 protects Notch-induced T-cell leukemia cells from DNA damage and mitochondrial stress[J].Blood,2023,142(25):2159-2174.doi:10.1182/blood.2023020144.
(2024-03-23收稿2024-09-11修回)
(本文编辑胡小宁)