过度机械应力调控Piezo1介导成软骨细胞铁死亡的机制探讨
2025-02-15吴斌刘兆祥张月红王昌耀



摘要:目的探讨过度机械应力调控Piezo1通道诱发小鼠成软骨细胞铁死亡的作用机制。方法选取小鼠ATDC5成软骨细胞系进行实验,使用siRNA-Piezo1干扰质粒和Piezo1过表达质粒转染细胞,给予机械应力刺激(MS),构建对照组(Control组)、MS组、MS+siRNA-Piezo1组(MS+sh组)和MS+Piezo1过表达组(MS+OV组)。用细胞增殖和毒性检测法(CCK-8)检测各组细胞增殖活力,透射电镜观察线粒体的形态和结构,生化检测氧化应激和亚铁离子(Fe2+)水平,流式细胞术检测脂质活性氧(ROS)水平,蛋白免疫印迹法(Western blot)检测溶质载体家族7成员11(SLC7A11)、谷胱甘肽过氧化物酶4(GPX4)、Ⅱ型胶原蛋白(CollagenⅡ)、基质金属蛋白酶(MMP)-13、蛋白聚糖(Aggrecan)及p53蛋白的表达水平。结果与Control组比较,MS组细胞活力下降,Fe2+、ROS、丙二醛(MDA)水平升高,还原型谷胱甘肽(GSH)、超氧化物歧化酶(SOD)水平降低(均P<0.05),电镜示线粒体嵴减少,SLC7A11、GPX4、CollagenⅡ、Aggrecan蛋白水平下降,p53和MMP-13蛋白水平则升高(均P<0.05)。与MS组比较,MS+sh组的Fe2+、ROS、MDA水平下降,GSH、SOD水平升高(均P<0.05),SLC7A11、GPX4、CollagenⅡ、Aggrecan蛋白水平升高,MMP-13和p53蛋白水平下降(均P<0.05)。与MS组比较,MS+OV组的细胞活力下降,Fe2+、ROS、MDA水平升高,GSH、SOD水平降低,SLC7A11、GPX4、CollagenⅡ、Aggrecan蛋白水平下降,MMP-13和p53蛋白水平上升(均P<0.05)。结论过度机械应力能够通过Piezo1通道蛋白介导成软骨细胞铁死亡,促进细胞外基质降解。
关键词:骨关节炎;软骨细胞;应力,物理;铁死亡;Piezo1
中图分类号:R684.3文献标志码:A DOI:10.11958/20241259
The mechanism of excessive mechanical stress modulates Piezo1-mediatedferroptosis in chondrocytes
WU Bin1,LIU Zhaoxiang2,ZHANG Yuehong3,WANG Changyao4△
1 Department of Orthopedics,Qingdao University Linyi People's Hospital,Linyi 276000,China;2 Department of Orthopedics,Yishui Second People's Hospital;3 Department of Second Orthopedics,Dongming People's Hospital;4 Department of JointSurgery,the Affiliated Hospital of Qingdao University Medical College
△Corresponding Author E-mail:swxg.1@163.com
Abstract:Objective To explore the mechanism of excessive mechanical stress regulated ferroptosis induced by Piezo1 channel in mouse chondrocytes.Methods The experiment was performed on mouse ATDC5 chondrocytes.siRNA-Piezo1 interference plasmid and Piezo1 overexpression plasmid were used to transfect chondrocytes,and mechanical stress stimulation was given.The control group,the mechanical stress stimulation group(MS group),the MS+siRNA-Piezo1 group(MS+sh group)and the MS+Piezo1 overexpression group(MS+OV group)were constructed,respectively.The cell viability,Fe2+,ROS levels,the expression of ferroptosis-related proteins SLC7A11 and GPX4,and the expression of CollagenⅡ,MMP-13,Aggrecan and p53 proteins were detected in each group.Results Compared with the control group,the cell viability was decreased in the MS group(P<0.05).Levels of Fe2+,reactive oxygen species(ROS)and malondialdehyde(MDA)were increased(P<0.05).Levels of reduced glutathione(GSH)and superoxide dismutase(SOD)were decreased(Plt;0.05),and the mitochondrial ridge was decreased detected by transmission electron microscopy.Protein levels of SLC7A11,GPX4,CollagenⅡand Aggrecan were decreased(P<0.05),while protein levels of p53 and MMP-13 were increased(Plt;0.05).Compared with the MS group,Fe2+,ROS and MDA levels were decreased in the MS+sh group(P<0.05),GSH andSOD levels were increased(P<0.05),and protein levels of SLC7A11,CollagenⅡ,GPX4 and Aggrecan were increased(Plt;0.05).The protein levels of MMP-13 and p53 were decreased(P<0.05).Compared with the MS group,cell viability was decreased(P<0.05),Fe2+,ROS and MDA levels were increased(P<0.05),GSH and SOD levels were decreased(P<0.05),and protein levels of SLC7A11,CollagenⅡ,GPX4 and Aggrecan were decreased in the MS+OV group(P<0.05).Levels of MMP-13 and p53 protein were increased(P<0.05).Conclusion Excessive mechanical stress can induce chondrocyte ferroptosis and promote extracellular matrix degradation via Piezo1 channel protein.
Key words:osteoarthritis;chondrocytes;stress,mechanical;ferroptosis;Piezo1
骨性关节炎(OA)是一种常见的慢性关节退行性疾病,具有较高的发病率和致残率。OA以软骨损伤、软骨下骨化和骨赘形成等为主要的病理特征[1]。早期OA表现为关节疼痛、肿胀,晚期出现不同程度的关节畸形、晨僵,严重者可致残疾。据统计,全世界OA患者累计约3亿人,每年相关医疗费用支出超过3 000亿美元[2]。随着人口老龄化和肥胖问题的加剧,OA发病率与致残率逐年增加,已成为全世界面临的重要公共健康问题之一。
大量研究表明,OA的发病机制主要包括软骨细胞死亡、软骨细胞外基质的降解2个方面[3-4]。软骨细胞是关节软骨的唯一细胞类型,对机械应力刺激敏感。生理性机械应力对维持软骨细胞稳态是必需的,而过度机械应力负荷可激发软骨细胞损伤和死亡,至于具体激发机制和细胞死亡机制尚不明确[5]。在细胞死亡事件中,铁死亡是一种铁离子依赖性的新型程序性细胞死亡方式,以脂质活性氧(ROS)累积、线粒体皱缩为主要特征。Piezo1作为一种机械敏感性离子通道蛋白,主要分布在软骨细胞表面,能够把机械信号转化为细胞内的化学信号,调控软骨细胞的生物学效应[6]。最近的研究表明,铁死亡、Piezo1通道蛋白均与软骨损伤密切相关[7-8]。关闭Piezo1通道蛋白可以起到保护软骨细胞的作用[9]。铁螯合剂可抑制OA软骨细胞铁死亡相关蛋白的表达,从而减轻软骨基质的降解[10]。目前,关于机械应力调控Piezo1介导软骨细胞铁死亡的研究仍相对较少。本研究旨在探讨过度机械应力调控Piezo1介导软骨细胞铁死亡的作用机制。
1材料与方法
1.1实验细胞选取小鼠ATDC5成软骨细胞系进行本实验,购自广州吉妮欧生物科技有限公司。细胞培养使用完全培养基,在37℃、5%CO2条件下完全湿度培养箱中培养,每2~3 d换液1次。
1.2主要试剂和仪器细胞完全培养基购自美国iCell公司。细胞增殖和毒性检测法(CCK-8)试剂盒、0.25%胰蛋白酶溶液、亚铁离子(Fe2+)含量检测试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶制备试剂盒、BCA蛋白浓度测定试剂盒、高效RIPA裂解液购自北京索莱宝科技有限公司。无水乙醇、丙酮购自国药集团化学试剂有限公司。电镜固定液、Western blot一抗稀释液、二抗稀释液购自武汉赛维尔生物科技有限公司。Lipofectamine 2000购自美国Invitrogen公司。丙二醛(MDA)、ROS、还原型谷胱甘肽(GSH)、超氧化物歧化酶(SOD)检测试剂盒购自上海碧云天生物技术有限公司。PVDF膜购自美国Millipore公司。兔抗小鼠溶质载体家族7成员11(SLC7A11)、谷胱甘肽过氧化物酶(GPX)4、胶原蛋白(Collagen)Ⅱ、基质金属蛋白酶(MMP)‑13、蛋白聚糖(Aggrecan)及p53一抗购自武汉华美生物工程有限公司。羊抗兔IgG-HRP二抗购自英国Abcam公司。多功能酶标仪(美国Molecular Devices公司),CO2细胞培养箱(美国Thermo Scientific公司),透射电子显微镜(日本Hitachi公司),流式细胞仪(美国Becton-Dickinson公司),凝胶成像分析系统(美国Bio-Rad公司),机械牵张应力加载模型系统(美国Flexcell公司)。
1.3机械应力刺激(MS)通过周期性体外细胞机械牵张应力加载系统对细胞施加机械应力,为培养细胞创建一个循环拉伸应变的环境,模拟身体运动过程中的MS。具体操作如下:细胞接种到预涂有CollagenⅠ的6孔BioFlex培养板,密度为2×105/孔,暴露于参数为10%强度、0.5 Hz和1/2正弦波的周期性细胞机械应力下8 h。
1.4细胞分组和转染siRNA-Piezo1干扰质粒和Piezo1过表达质粒的构建和筛选由上海吉凯生物公司完成。使用Lipofectamine 2000试剂转染细胞,构建对照组(Control组)、MS组、MS+siRNA-Piezo1组(MS+sh组)和MS+Piezo1过表达组(MS+OV组)。细胞转染步骤:将细胞预先接种于6孔板(5×105个/孔),根据Lipofectamine 2000说明书将质粒转染到ATDC5成软骨细胞中,48 h收集细胞用于后续实验。
1.5 CCK-8法检测细胞增殖活力将对数生长期细胞接种于96孔板(3×103/孔),过夜,按照Control组、MS组、MS+sh组、MS+OV组分组情况干预细胞24 h,向每孔中加入10µL CCK-8溶液,37℃避光孵育1 h,采用酶标仪测450 nm处光密度(OD),计算细胞活力值。
1.6透射电子显微镜观察线粒体的形态与结构离心收集细胞,去培养基加入电镜固定液,4℃重悬混匀固定2~4 h,琼脂预包埋,室温条件下1%锇酸固定2 h,丙酮梯度脱水,812包埋剂浸脂,聚合制成透射电子显微镜标本,超微切片机切割成为超薄切片(80 nm),用醋酸铀酰和柠檬酸铅进行双重染色。透射电镜观察线粒体形态结构。
1.7细胞内氧化应激和Fe2+水平测定按照每5×106个细胞加入1 mL裂解液裂解细胞,并使用超声波(功率200 W,超声3 s,间隔10 s,重复30次)破碎细胞,按照检测试剂盒说明书测定GSH、SOD、MDA和Fe2+水平。
1.8流式细胞术检测脂质ROS水平将细胞接种于6孔板(5×105/孔)中过夜,各组按照相应的干预方式干预细胞24 h,去除细胞培养液,更换为无血清培养基配制的10µmol/L DCFH-DA荧光探针,37℃孵育20 min,PBS洗涤3次,流式细胞仪进行检测。使用Flow Jo软件进行定量分析。
1.9 Western blot检测蛋白表达水平将细胞以5×105/孔的密度接种于6孔板中过夜,按照Control组、MS组、MS+sh组、MS+OV组分组情况干预细胞24 h,裂解并收集各组细胞,BCA法检测蛋白浓度。蛋白样品经10%SDS-PAGE并转移到PVDF膜上,室温下用5%脱脂奶粉封闭1 h,一抗在4℃下孵育过夜,室温孵育二抗1 h,蛋白条带用ECL发光液显色,凝胶成像分析系统获取条带图像。
1.10统计学方法采用SPSS 22.0软件进行数据分析。使用Shapiro-Wilk检验分析数据的分布,正态分布的数据用均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间多重比较用LSD-t法。P<0.05为差异有统计学意义。
2结果
2.1各组细胞增殖活力比较组间比较:与Control组比较,在相同时间点(24 h、48 h和72 h),MS组、MS+sh组和MS+OV组细胞增殖活力均降低(Plt;0.05);与MS组比较,在相同时间点(24 h、48 h和72 h),MS+sh组细胞增殖活力均升高,而MS+OV组细胞增殖活力均降低(P<0.05)。组内比较:Control组、MS组和MS+sh组48 h和72 h的细胞增殖活力相比各自组24 h依次升高(P<0.05);而MS+OV组72 h时细胞增殖活力较24 h和48 h时升高(P<0.05)。见表1。
2.2各组细胞超微结构形态变化Control组线粒体结构正常,线粒体嵴排布密集,呈长条形或椭圆形;与Control组相比,MS+sh组、MS组和MS+OV组线粒体形态损伤依次加重,表现为线粒体膜发生皱缩,形态由长棒形缩为圆形,线粒体嵴明显减少,MS+sh组、MS组和MS+OV组软骨细胞的死亡方式均为铁死亡。见图1。
2.3过度机械应力对细胞氧化应激和Fe2+水平的影响与Control组相比,MS组的ROS、MDA、Fe2+水平升高,GSH、SOD水平下降(P<0.05);与MS组比较,MS+sh组的ROS、MDA、Fe2+水平下降,GSH、SOD水平升高(P<0.05),MS+OV组的ROS、MDA、Fe2+水平升高,GSH、SOD水平下降(P<0.05),见表2。
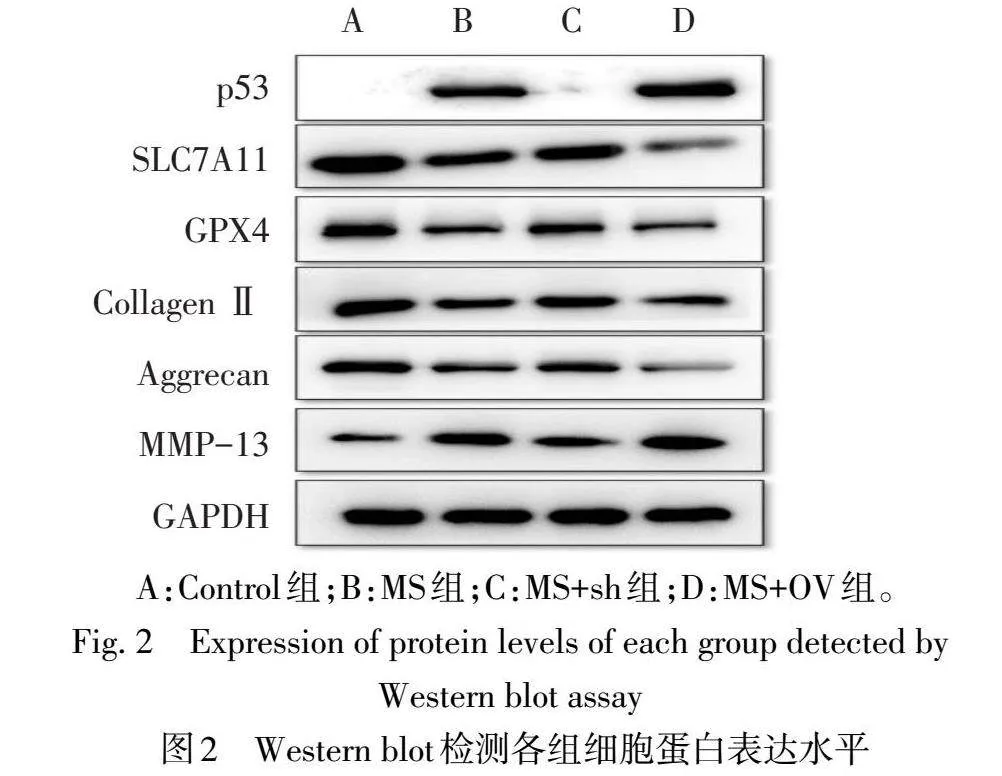
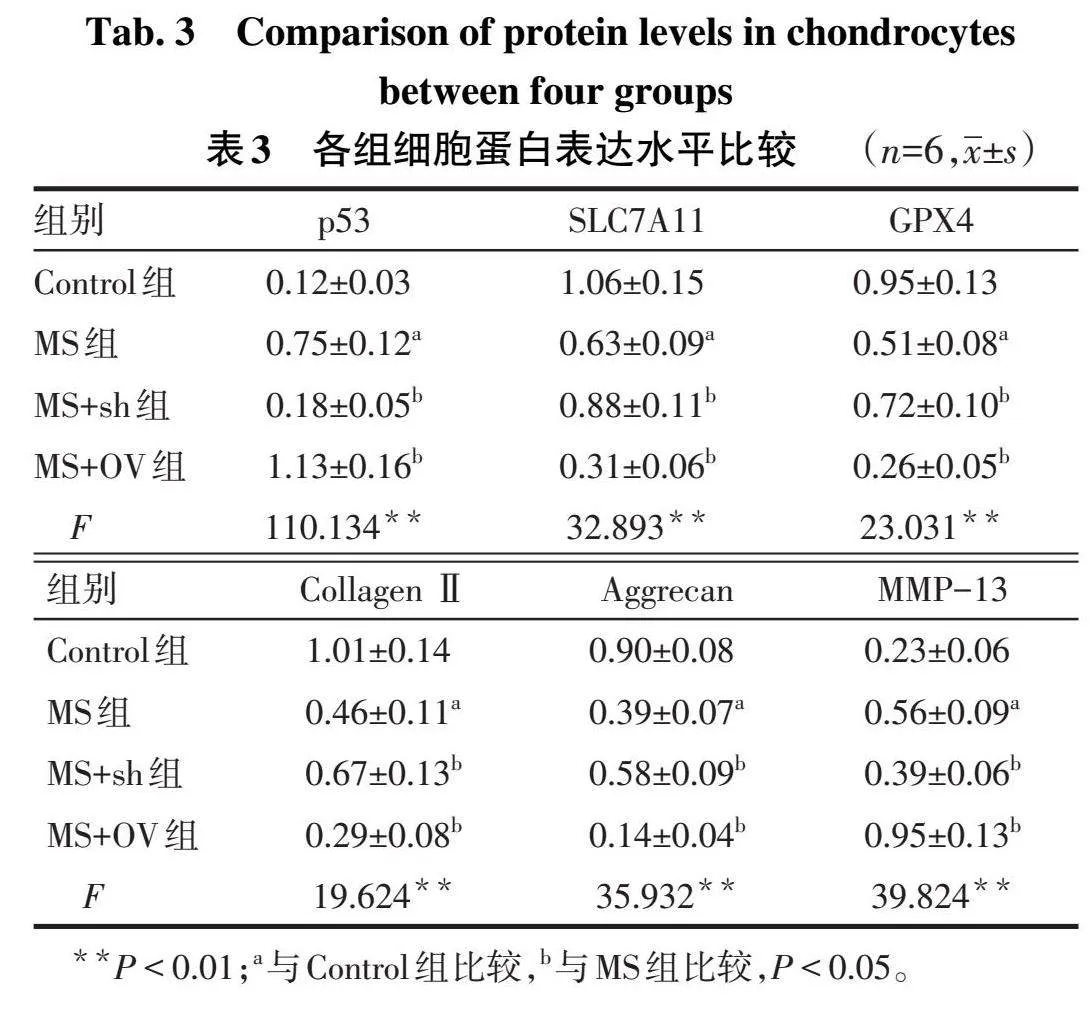
2.4各组细胞蛋白表达水平比较与Control相比,MS组SLC7A11、GPX4、CollagenⅡ、Aggrecan蛋白水平降低,MMP-13、p53蛋白水平升高(P<0.05);与MS组比较,MS+sh组的SLC7A11、GPX4、CollagenⅡ、Aggrecan蛋白水平升高,MMP-13、p53蛋白水平下降(P<0.05);与MS组比较,MS+OV组的SLC7A11、GPX4、CollagenⅡ、Aggrecan蛋白水平降低,MMP-13、p53蛋白水平升高(P<0.05)。见图2、表3。
3讨论
软骨细胞是一种机械敏感细胞,可以将机械信号转化为生化信号,参与调节软骨细胞的各种生物学过程[11]。机械应力是一把“双刃剑”,适度的机械应力刺激可保护软骨,维持软骨稳态,而过度的机械应力则是OA发病的重要危险因素之一[12]。越来越多的证据表明,软骨细胞铁死亡在OA发病机制中发挥关键作用[13-15]。然而,过度的机械应力和铁死亡在OA中的作用机制尚不完全明确。
Piezo1作为一种机械敏感的离子通道,能够将MS转化为电或化学信号,传递至胞内引起一系列生化反应[16]。有研究表明,Piezo1能够介导软骨细胞受到MS所形成的内电流,从而证实Piezo1在软骨细胞中的信号转导作用[17]。另有研究发现,行全膝关节置换术的OA患者软骨受损区的Piezo1蛋白水平显著升高[18]。以上证据表明,Piezo1在OA的病理过程中发挥重要作用。然而,Piezo1与铁死亡在OA中的关系尚不清楚。本研究通过在体外成软骨细胞中应用siRNA-Piezo1和Piezo1过表达以确定Piezo1在细胞发生铁死亡中的作用。结果发现,过度MS能够降低细胞的增殖活力,使线粒体形态发生损伤;siRNA-Piezo1能够在过度MS的基础上提高细胞的增殖活力,减轻线粒体损伤,而过表达Piezo1将在过度MS的基础上进一步降低细胞的增殖活力,加重线粒体损伤。此外,铁死亡的过程中伴随着氧化应激水平的加剧。本研究发现,过度MS能够提高细胞ROS、MDA的水平,降低GSH、SOD的水平。综合以上研究结果说明,过度MS能够通过Piezo1介导细胞铁死亡的发生。
细胞铁死亡过程受到多种蛋白的调控。SLC7A11作为一种重要的细胞膜氨基酸转运体,主要通过SLC7A11/GPX4信号通路调控铁死亡[19]。GPX4是铁死亡发生的关键调节因子,能够通过消除细胞内脂质ROS来抵抗铁死亡[20]。p53是一种典型的抑癌基因,通过转录的方式抑制SLC7A11的表达,导致胱氨酸转运障碍,抑制GPX4活性,从而使细胞对铁死亡的敏感性增加[21]。本研究结果发现,过度机械应力刺激能够使软骨细胞铁死亡通路中的相关蛋白发生明显变化,p53表达水平升高,SLC7A11和GPX4蛋白表达水平降低,这证实了p53/SLC7A11/GPX4信号通路在软骨细胞铁死亡过程中的关键作用。软骨细胞作为软骨唯一的细胞成分,参与细胞外基质(ECM)的合成。ECM主要由CollagenⅡ和Aggrecan构成[22]。MMP-13在ECM降解过程中起到重要的作用[23-24]。然而,Piezo1与ECM降解之间的关系尚不清楚。本研究结果表明,过度机械应力刺激能够通过Piezo1通道蛋白使CollagenⅡ和Aggrecan的表达明显降低,而MMP-13的表达明显上升,这表明过度机械刺激能够促进ECM降解。
综上所述,本研究结果表明,过度机械应力能够通过Piezo1通道蛋白介导软骨细胞铁死亡,促进ECM降解,这对理解过度机械应力如何导致OA提供了新的理论依据。
参考文献
[1]BARNETT R.Osteoarthritis[J].Lancet,2018,391(10134):1985.doi:10.1016/S0140-6736(18)31064-X.
[2]ABRAMOFF B,CALDERA F E.Osteoarthritis:pathology,diagnosis,and treatment options[J].Med Clin North Am,2020,104(2):293-311.doi:10.1016/j.mcna.2019.10.007.
[3]MOLNAR V,MATIŠIĆV,KODVANJ I,et al.Cytokines and chemokines involved in osteoarthritis pathogenesis[J].Int J MolSci,2021,22(17):9208.doi:10.3390/ijms22179208.
[4]JIANG Y.Osteoarthritis year in review 2021:biology[J].Osteoarthritis Cartilage,2022,30(2):207-215.doi:10.1016/j.joca.2021.11.009.
[5]ARGOTE P F,KAPLAN J T,POON A,et al.Chondrocyte viability is lost during high-rate impact loading by transfer of amplified strain,but not stress,to pericellular and cellular regions[J].Osteoarthritis Cartilage,2019,27(12):1822-1830.doi:10.1016/j.joca.2019.07.018.
[6]LAI A,COX C D,CHANDRA SEKAR N,et al.Mechanosensing by Piezo1 and its implications for physiology and various pathologies[J].Biol Rev Camb Philos Soc,2022,97(2):604-614.doi:10.1111/brv.12814.
[7]LEE W,NIMS R J,SAVADIPOUR A,et al.Inflammatory signaling sensitizes Piezo1 mechanotransduction in articular chondrocytes as a pathogenic feed-forward mechanism in osteoarthritis[J].Proc Natl Acad Sci U S A,2021,118(13):e2001611118.doi:10.1073/pnas.2001611118.
[8]孙铭远,郭文超,贾庆运,等.机械敏感离子通道蛋白Piezo1在骨关节炎中的作用研究进展[J].中国骨与关节损伤杂志,2024,39(5):496-500.SUN M Y,GUO W C,JIA Q Y,et al.Advances in the role of Piezo1,a mechanosensitive ion channel protein,in osteoarthritis[J].Chin J Bone Joint Injury,2024,39(5):496-500.doi:10.7531/j.issn.1672-9935.2024.05.010.
[9]SUN Y,LENG P,GUO P,et al.G protein coupled estrogen receptor attenuates mechanical stress-mediated apoptosis of chondrocyte in osteoarthritis via suppression of Piezo1[J].Mol Med,2021,27(1):96.doi:10.1186/s10020-021-00360-w.
[10]YAO X,SUN K,YU S,et al.Chondrocyte ferroptosis contribute to the progression of osteoarthritis[J].J Orthop Translat,2021,27:33-43.doi:10.1016/j.jot.2020.09.006.
[11]HE M,LU B,OPOKU M,et al.Metformin prevents or delays the development and progression of osteoarthritis:new insight and mechanism of action[J].Cells,2022,11(19):3012.doi:10.3390/cells11193012.
[12]ASTEPHEN WILSON J L,KOBSAR D.Osteoarthritis year in review 2020:mechanics[J].Osteoarthritis Cartilage,2021,29(2):161-169.doi:10.1016/j.joca.2020.12.009.
[13]YANG J,HU S,BIAN Y,et al.Targeting cell death:pyroptosis,ferroptosis,apoptosis and necroptosis in osteoarthritis[J].Front Cell Dev Biol,2021,9:789948.doi:10.3389/fcell.2021.789948.
[14]SUN K,HOU L,GUO Z,et al.JNK-JUN-NCOA4 axis contributes to chondrocyte ferroptosis and aggravates osteoarthritis via ferritinophagy[J].Free Radic Biol Med,2023,200:87-101.doi:10.1016/j.freeradbiomed.2023.03.008.Tianjin Med J,January 2025,Vol.53 No.1
[15]GONG Z,WANG Y,LI L,et al.Cardamonin alleviates chondrocytes inflammation and cartilage degradation of osteoarthritis by inhibiting ferroptosis via p53 pathway[J].Food Chem Toxicol,2023,174:113644.doi:10.1016/j.fct.2023.113644.
[16]HUANG H,KAMM R D,LEE R T.Cell mechanics and mechanotransduction:pathways,probes,and physiology[J].Am J Physiol Cell Physiol,2004,287(1):C1-11.doi:10.1152/ajpcell.00559.2003.
[17]SERVIN-VENCES M R,MORONI M,LEWIN G R,et al.Direct measurement of TRPV4 and PIEZO1 activity reveals multiple mechanotransduction pathways in chondrocytes[J].Elife,2017,6:e21074.doi:10.7554/eLife.21074.
[18]REN X,ZHUANG H,LI B,et al.Gsmtx4 alleviated osteoarthritis through Piezo1/Calcineurin/NFAT1 signaling axis under excessive mechanical strain[J].Int J Mol Sci,2023,24(4):4022.doi:10.3390/ijms24044022.
[19]LI P,YU J,HUANG F,et al.SLC7A11-associated ferroptosis in acute injury diseases:mechanisms and strategies[J].Eur Rev Med Pharmacol Sci,2023,27(10):4386-4398.doi:10.26355/eurrev_202305_32444.
[20]BERSUKER K,HENDRICKS J M,LI Z,et al.The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis[J].Nature,2019,575(7784):688-692.doi:10.1038/s41586-019-1705-2.
[21]XU R,WANG W,ZHANG W.Ferroptosis and the bidirectional regulatory factor p53[J].Cell Death Discov,2023,9(1):197.doi:10.1038/s41420-023-01517-8.
[22]刘平举,唐魁韩,孙立,等.龙胆苦苷对骨性关节炎软骨细胞外基质的影响[J].世界中医药,2024,19(7):957-961.LIU P J,TANG K H,SUN L,et al.Effect of gentiopicroside on extracellular matrix of cartilage cells in osteoarthritis[J].World Chin Med,2024,19(7):957-961.doi:10.3969/j.issn.1673-7202.2024.07.008.
[23]WANG M,SAMPSON E R,JIN H,et al.MMP13 is a critical target gene during the progression of osteoarthritis[J].Arthritis Res Ther,2013,15(1):R5.doi:10.1186/ar4133.
[24]张春虹,黄洪超,刘越,等.基于RNA测序和生物信息学分析鉴定椎旁肌退变中关键的铁死亡基因[J].天津医药,2024,52(9):991-995.ZHANG C H,HUANG H C,LIU Y,et al.Identification of key ferroptosis genes in paraspinal muscle degeneration based on RNA sequencing and bioinformatics analysis[J].Tianjin Med J,2024,52(9):991-995.doi:10.11958/20240587.
(2024-09-03收稿2024-11-03修回)
(本文编辑李国琪)