抗松针褐斑病湿地松胚性愈伤组织诱导及体胚产量影响因素的研究
2025-01-26柯欣费琪夏馨蕊叶建仁朱丽华
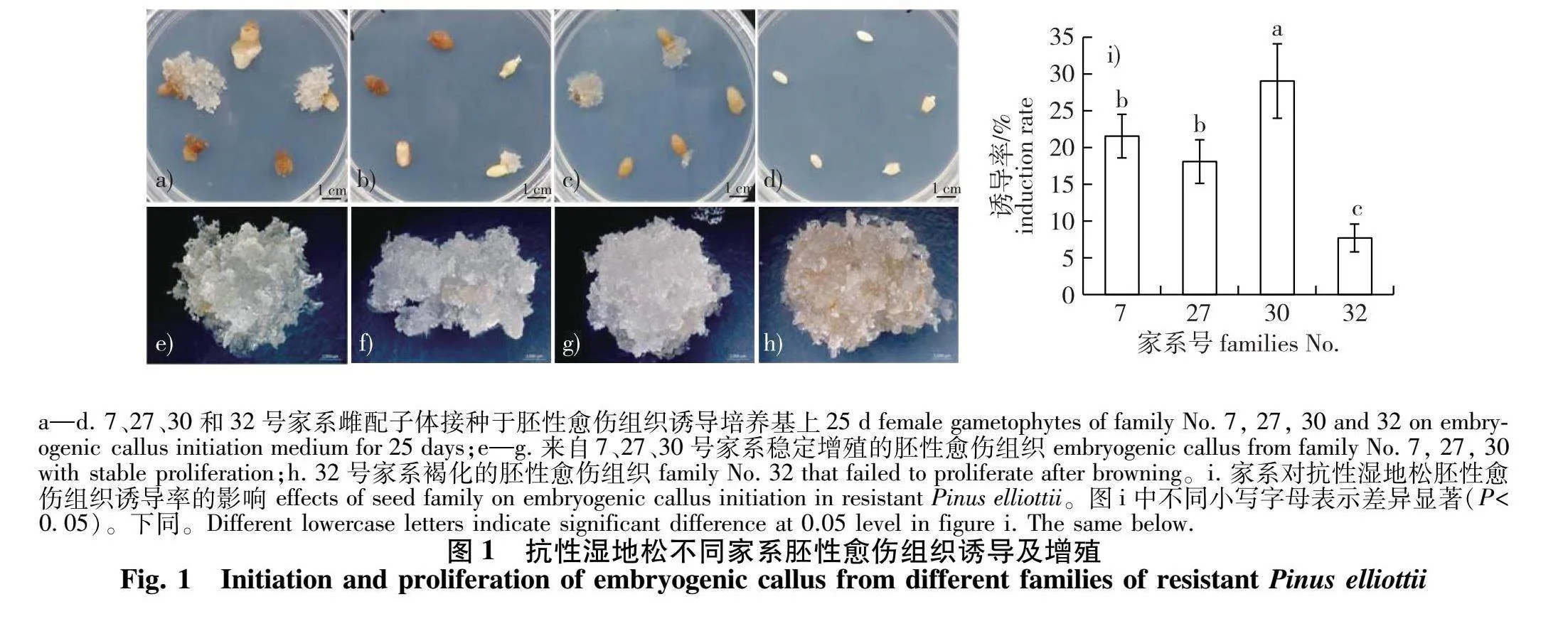


摘要:【目的】建立和优化抗性湿地松(Pinus elliottii)体胚发生体系,为湿地松优良抗性材料的大规模快速繁育奠定基础。【方法】以抗性湿地松4个家系的未成熟合子胚为材料,探究不同家系对胚性愈伤组织诱导的影响;选取增殖效果好、具有胚性胚柄细胞团(ESM)的胚性愈伤组织开展体胚成熟试验,从基因型、植物磺肽素(phytosulfokine,PSK)浓度及继代次数方面对体胚成熟条件进行研究。【结果】抗性湿地松4个家系之间胚性愈伤组织诱导率差异显著(Plt;0.05),其中,30号家系诱导率最高,为(29.8±5.6)%;32号家系诱导率最低,仅为(7.3±34)%,最终共获得37个可稳定增殖的胚性细胞系。35个供试细胞系中25.7%的细胞系可产生体胚,其中2007-3和2007-5成熟体胚产量显著高于其他细胞系,成熟子叶型胚数量平均分别为(91.3±7.0)和(89.8±8.4)个/mL,其余74.3%的细胞系未产生体胚。添加PSK对抗性湿地松体胚产量具有显著影响,其质量浓度为1 mg/L时,可显著提高体胚产量。随着继代次数的增加,成熟体胚数量呈下降趋势。其中细胞系2007-3成熟体胚数量在继代8次后逐渐下降,但第20代仍保持胚性;2007-5的成熟体胚数量随继代次数增多而下降,直至20代完全丧失胚性。【结论】家系对胚性愈伤组织的诱导影响显著。基因型和PSK含量可显著影响抗性湿地松体胚产量,同时胚性愈伤组织的胚性随继代次数的增加而降低。本研究优化了抗性湿地松体胚发生技术体系,可为湿地松优良基因型体胚繁育提供技术支撑。
关键词:湿地松;体胚发生;基因型;植物磺肽素(PSK);体胚成熟;抗病育种
中图分类号:Q943;S722"""""" 文献标志码:A
开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2025)01-0087-08
The factors influencing the embryogenic callus initiation and somatic embryo yield in Pinus elliottii resistant to pine needle brown spot disease
KE Xin, FEI Qi, XIA Xinrui, YE Jianren, ZHU Lihua*
(Co-Innovation Center for Sustainable Forestry in Southern China, College of Forestry and Grassland, Nanjing Forestry University, Nanjing 210037, China)
Abstract: 【Objective】The somatic embryogenesis induction system of resistant Pinus elliottii is established and optimized to provide technical support for the large-scale rapid propagation of high-resistant materials of P. elliottii. 【Method】The immature zygotic embryos from four families of P. elliottii are used to explore the effects of different families on the embryogenic callus initiation rate. The embryogenic callus with good proliferation rate" and" generating large quantity of embryo suspensor mass is selected to test somatic embryo maturation. The maturation conditions of somatic embryos are optimized based on genotype, phytosulfokine (PSK) concentration, and subculture times. 【Result】A significant difference is observed in the initiation frequencies of embryogenic callus among the four families (P lt; 0.05). Family No." 30 has the highest initiation rate (29.8 ± 5.6)%, while family No. 32 has the lowest (7.3 ± 3.4)%. A total of 37 embryogenic cell lines with stable proliferation are obtained. Of these, 25.7% of 35 cell lines produce matured somatic embryos, and the yields (number of somatic embryos) in 2007-3 and 2007-5 are significantly higher than that of other cell lines, with an average yield of (91.3 ± 7.0) and (89.8 ± 8.4) cotyledonary somatic embryos per mL, respectively, while the remaining 74.3% does not produce any somatic embryos. The addition of PSK significantly affects the yield of somatic embryos of resistant P. elliottii, and embryo production is considerably increased when the PSK concentration is 1 mg/L. The number of mature somatic embryos decreases with the increase in subcultures. The number of mature somatic embryos of cell lines 2007-3 gradually decreases after eight subcultures but maintains embryogenic competence in the 20th subculture. For cell lines 2007-5, the number of mature somatic embryos reduces as subcultures rise, ultimately losing maturation capacity after 20 subcultures. 【Conclusion】The initiation of embryogenic callus is greatly influenced by the genotype. Genotype and PSK concentration significantly affect the somatic embryo yield of resistant P. elliottii. The yield of somatic embryos decreases with the increase in subcultures. The somatic embryogenesis technology system of resistant P. elliottii is optimized to provide technical support for the somatic embryogenesis of excellent genotypes of P. elliottii.
Keywords:Pinus elliottii; somatic embryogenesis; genotype; phytosulfokine; somatic embryo maturation; breeding for disease resistance
湿地松(Pinus elliottii)原产美国,具有生长速度快、产脂量高、适应性强等优点,是优良的用材及园林绿化树种,于20世纪30年代引入我国,现已成为我国南方地区主要造林树种之一[1-2]。然而,自1978年起,松针褐斑病(Lecanosticta acicola)在我国湿地松人工林中陆续发生,严重制约了湿地松的推广和应用[3]。抗病育种作为防治该病害的有效方法之一,自20世纪80年代起,我国开始进行抗松针褐斑病湿地松优良家系的筛选,并建立了湿地松抗病种子园[3],但是传统的种子繁殖方式育种周期长,且面临着杂合度高、萌发率低等问题[4],扦插繁殖则受到季节等因素限制[5]。
植物体细胞胚胎发生(somatic embryogenesis,SE)简称“体胚发生”,是一种稳定性强、繁殖率高、同步化水平高的无性繁殖技术,为林木优良无性系的大规模快速繁育提供了便捷途径[6-7]。近年来,针叶树体胚发生备受关注,据不完全统计,国内外已对50多种针叶树种进行了体胚发生研究,包括冷杉属(Abies)、云杉属(Picea)、松属(Pinus)等[8]树种。松属116个树种中共有37种成功诱导了体胚,其中36个获得了完整的体胚再生植株[9]。关于湿地松体胚发生的研究,最早由Jain等[10]成功获得了胚性愈伤组织;Liao等[11]进一步获得了体胚再生植株;吴丽君等[12]成功获得了成熟的子叶胚;方珞等[13]建立了湿地松悬浮培养体系;徐康等[2]进一步提高了湿地松胚性愈伤组织诱导率; Yang等[14]提高了抗性湿地松胚性愈伤组织诱导率,获得了成熟体胚和再生植株,并对再生植株的遗传稳定性进行了分析。
体胚发生过程包括胚性愈伤组织诱导、体胚成熟及萌发等多个环节,影响因素众多。其中,基因型的影响体现在各个阶段,不同品种间以及同一品种不同基因型之间差异很大[15-16]。植物磺肽素(phytosulfokine,PSK)是近年来在植物中发现的一种新的磺化短肽类生长调节物质,不仅能够促进悬浮细胞的生长和增殖,还可以促进导管分化和胚性细胞形成[17-20]。其中PSK-α在植物的生长、发育、生殖以及对外界环境的响应中具有重要的调节作用,并与细胞生长素及分裂素介导的信号转导途径密切相关[21]。有研究表明,PSK能够提高日本柳杉(Cryptomeria japonica)的体胚发生能力[19]。另外添加0. 8 mg/L PSK-α时可以促进杂交鹅掌楸体胚产量,减少畸形胚的产生,提高植株再生率[22]。而目前鲜见PSK影响抗性湿地松体胚发生的报道。此外,在体胚发生体系中,胚性愈伤组织的保存也非常重要。在植物组织培养过程中,继代培养是其中重要的环节,而长期继代则是种质资源离体保存的必要手段[23]。已有研究发现,植物细胞在离体培养时,再生频率和再生植株的质量与培养时间密切相关[24],随着长期继代培养,胚性愈伤组织的胚性会逐渐下降,直至丧失[25],如杉木(Cunninghamia lanceolata)[26]、黑松(P. thunbergii)[27]等。在长期继代中愈伤组织是否会保持一定的体胚发生和植株再生能力,这关系到组培快繁技术的实用化问题。本研究以前期抗松针褐斑病育种获得的抗性湿地松4个优良家系未成熟球果为试验材料,比较不同家系胚性愈伤组织诱导率之间的差异,在获得胚性愈伤组织的基础上,探索基因型、PSK、继代次数对抗性湿地松体胚产量的影响,以期为抗性湿地松优良基因型的大规模快速繁育提供技术支撑。
1 材料与方法
1.1 供试材料及胚性愈伤组织诱导
供试外植体材料采自福建华安西陂国有林场抗松针褐斑病湿地松种子园(117°33′8.47″E, 25°06′34.58″N)。2020年7月6日,采集7、27、30和32号 4个抗性湿地松家系未成熟球果,4" ℃ 冰箱冷藏7 d备用。
取上述4个家系未成熟球果,先用酒精棉对其进行表面擦拭消毒,然后用剪刀和镊子取出种子,于体积分数75%乙醇溶液中灭菌1 min,再用体积分数30% 过氧化氢(H2O2)溶液灭菌10 min,无菌水冲洗3次后在超净工作台用镊子剥去种壳和外种皮,取出完整的雌配子体,接种于胚性愈伤组织诱导培养基上,每个家系接种90粒,重复3次;在(23±2) ℃ 的黑暗条件下培养60 d,观察并统计愈伤组织诱导情况。诱导培养基:LP+6 mg/L" 4-二氯苯氧乙酸( 4-D)+1 mg/L 6-苄氨基嘌呤(6-BA)+ 2 mg/L 激动素(KT)+ 5 mg/L 抗坏血酸(VC)+3.4 mg/L硝酸银+30 g/L麦芽糖+1 g/L肌醇+0.45 g/L谷氨酰胺+05 g/L水解酪蛋白 +0.25 g/L 2-吗啉乙磺酸(MES)+6.5 g/L 琼脂,pH 5.8。参考张彩云等[28]的增殖培养基配方,诱导9~10周后,将胚性愈伤组织转移到增殖培养基中,增殖培养基为:LP+1 mg/L萘乙酸(NAA)+0.3 mg/L 6-BA+ 0.3 mg/L KT+5 mg/L VC+15 g/L麦芽糖+1 g/L肌醇+0.45 g/L谷氨酰胺+0.5 g/L 水解酪蛋白+ 0.25 g/L MES,pH 5.8。每14 d转至新鲜增殖培养基中继代1次。
1.2 抗性湿地松胚性细胞悬浮培养体系的建立及显微结构观察
参照Yang等[14]的方法,称取旺盛生长的胚性愈伤组织1 g,接种于盛有30 mL基础悬浮培养液的100 mL锥形瓶中,用镊子将愈伤组织块打散,然后将锥形瓶置于黑暗中于(23±2) ℃ 的摇床上(90 r/min)进行振荡培养,培养周期为7 d,获得悬浮细胞。基础悬浮培养基为:LP+0.5 mg/L NAA+0.15 mg/L 6-BA+ 0.15 mg/L KT+ 2.5 mg/L VC+ 15 g/L麦芽糖+ 1 g/L肌醇+ 0.45 g/L 谷氨酰胺+ 0.5 g/L 水解酪蛋白+ 0.25 g/L MES,pH 5.8。
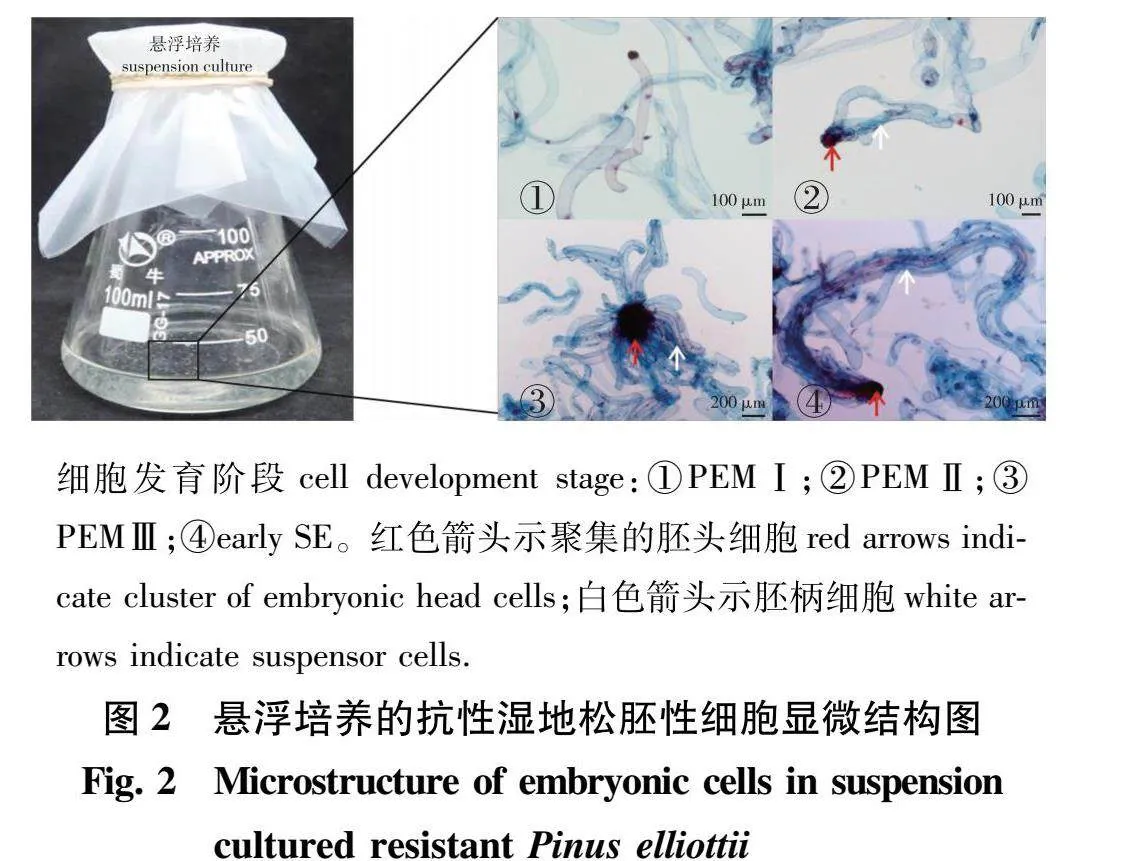
7 d后,将含有悬浮细胞液的锥形瓶静置5 min,吸取少量细胞置于载玻片上用体积分数2%醋酸洋红染色1 min,再用质量分数0.5%伊文思蓝染色30 s,盖上盖玻片于蔡司体视显微镜(SteREO Discovery.V20)下观察悬浮细胞的显微结构,根据Filonova等[29]的划分标准,分析悬浮细胞的发育状况。
1.3 抗性湿地松体胚产量影响因素的检测
1)基因型(细胞系):以2020年诱导获得的35个细胞系为试验材料建立悬浮细胞系,取细胞悬浮液接种至基本悬浮培养基中(接种比例为1∶5),振荡培养7 d后,取5 mL细胞悬浮液置于体胚成熟培养基平板上,暗培养75 d,观察并统计各细胞系产胚情况,成熟体胚数量(个/mL)为每皿体胚数量除以5。成熟培养基为:LP +2 mg/L 脱落酸(ABA) +130 g/L 聚乙二醇8000(PEG8000) +1 g/L 活性炭 + 5 mg/L VC+ 25 g/L麦芽糖+ 1 g/L肌醇 + 0.45 g/L 谷氨酰胺 + 0.5 g/L水解酪蛋白 + 3 g/L植物凝胶,pH 5.8。每组实验重复3次。
2)PSK:以细胞系2007-5第12代悬浮细胞为试验材料,接种于分别添加0、0.5、1.0、1.5 mg/L PSK的基础悬浮培养基中,悬浮培养及成熟处理同前。
3)继代次数:以2007-3和2007-5胚性细胞系为试验材料,从继代培养的第2代开始每隔2个继代周期取胚性愈伤组织进行悬浮培养后,进行成熟培养,悬浮培养及成熟处理同前,直至第20代,共10次。
1.4 数据处理
试验数据使用Excel 2010、SPSS 17.0及GraphPad Prism 8.0.2等进行方差分析和差异显著性检验。
2 结果与分析
2.1 抗性湿地松胚性愈伤组织诱导及稳定增殖
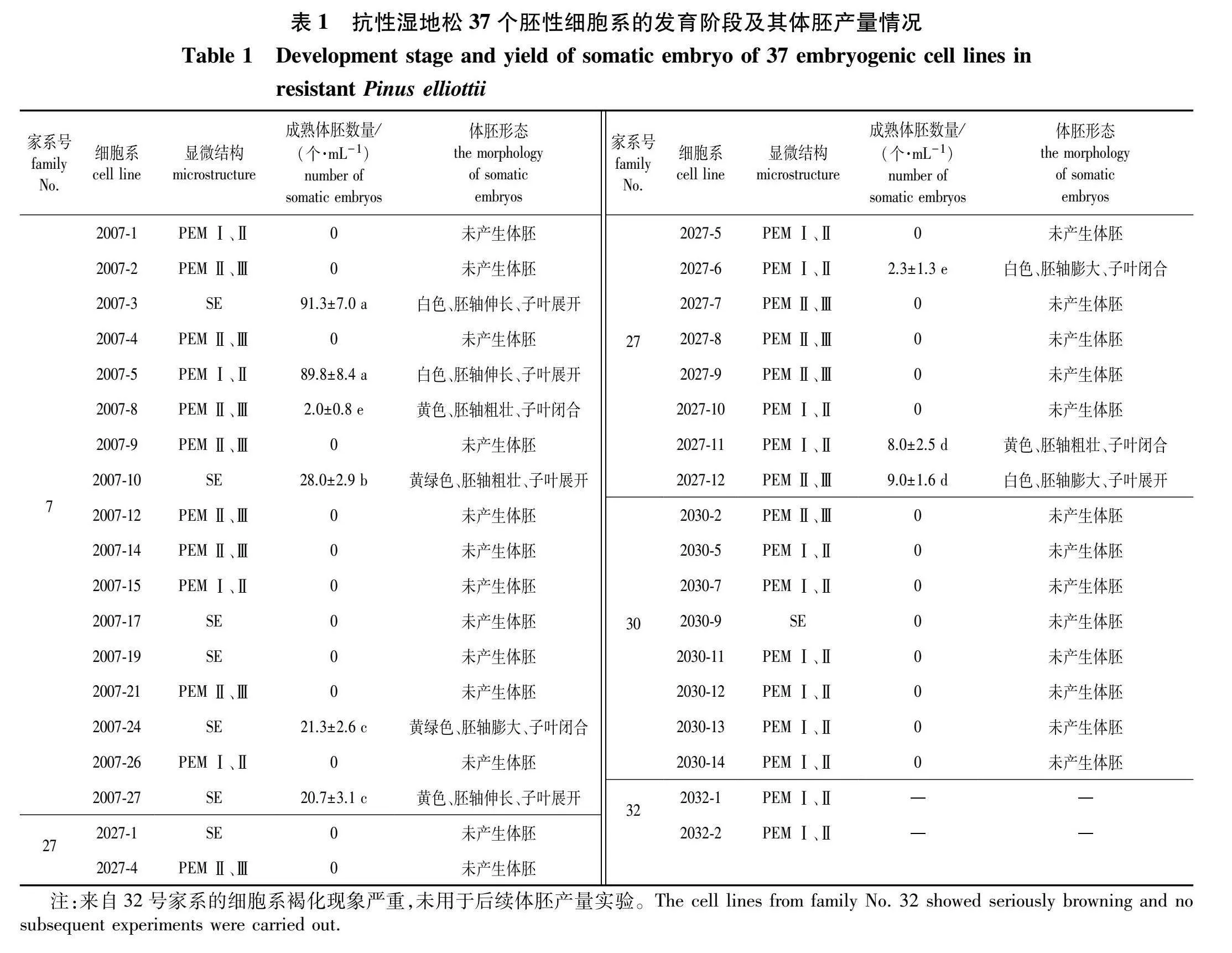
于诱导培养基上培养21~28 d后,部分雌配子体珠孔处挤出白色、透明、黏性的胚性愈伤组织,随着时间推移,增殖成直径约1 cm的组织,部分雌配子体则褐化或无响应(图1)。统计结果表明,不同家系抗性湿地松胚性愈伤组织诱导率差异显著(P<0.05)。供试的4个家系中,30号家系诱导率最高,为(29.8±5.6)%;7号家系诱导率次之,为(21.5±3.8)%;32号家系诱导率最低,仅(7.3±34)% (图1i)。70 d后,将诱导产生的愈伤组织转移至增殖培养基中进行增殖,部分胚性愈伤组织在增殖培养过程中褐化、死亡。最终共获得37个稳定增殖的细胞系,其中17个细胞系来自7号家系,10个来自27号家系,8个来自30号家系,2个来自32号家系(表1)。
2.2 抗性湿地松胚性愈伤组织的显微结构
于液体培养基中培养14 d后,取少量悬浮培养物染色后进行显微镜观察,参照Filonova等[29]的标准,本研究获得的37个细胞系均具有原胚细胞团(proembryogenic masses,PEMs)的结构特征,根据其发育程度,可划分为4个阶段,分别为:PEM Ⅰ阶段,由一个小而紧密的细胞团(胚头细胞),连接一个伸长的空泡细胞(胚柄细胞)组成(图2①);PEM Ⅱ阶段,胚头细胞增殖分化,并聚集多个胚柄细胞(图2②);PEM Ⅲ阶段,胚头细胞增殖活性增强,体积变大,聚集更多的胚柄细胞,极性发生改变(图2③);早期原胚阶段,胚柄细胞逐渐聚集并收拢,进入体胚的发育早期(图2④)。显微观察结果表明,37个细胞系中的胚性细胞处于不同发育阶段,其中43.2%(16/37)的细胞系处于PEM Ⅰ、Ⅱ阶段,35.1%(13/37)处于PEM Ⅱ、Ⅲ阶段,21.6%(8/37)处于SE 阶段(表1)。
2.3 基因型对抗性湿地松体胚产量的影响
于成熟培养基上培养75 d后,不同基因型胚性愈伤组织间体胚产量差异显著(P<0.05),在测试的35个细胞系中,9个细胞系(25.7%)可产生体胚,其中2007-3和2007-5两个细胞系的产胚量显著高于其他细胞系。2007-3产胚量最高可达(913±7.0)个/mL,其成熟体胚呈乳白色,部分体胚形态正常子叶展开、胚轴伸长,但也有部分体胚呈畸形,主要表现在胚轴膨大;2007-5的产胚量次之,为(89.8±8.4)个/mL,并且大多数成熟的体胚表现为正常形态,呈乳白色,子叶展开,但仍有部分体胚畸形,子叶未开裂;2007-10的产胚量为(28.0±2.9)个/mL,该细胞系所产体胚胚轴呈黄绿色且较粗壮,子叶呈白色,但子叶数量较多;2007-24的产胚量为(21.3±2.6)个/mL,其体胚呈黄绿色,且畸形较多;2007-27的产胚量为(20.7±3.1)个/mL,其体胚呈淡黄色,虽然数量较少,但形态大多正常,仅少量体胚子叶数量较少或不开裂;2027-11、2027-12产生体胚较少,产胚量均为10个/mL以下,且体胚较畸形;2007-8、2027-6两个细胞系仅产生少量体胚,产胚量均低于5个/mL,其成熟体胚表现为胚轴膨大、子叶闭合等形态。其余74.3%的细胞系(26个)未产生体胚,这些细胞系在成熟培养基上或未恢复生长,或水渍化、黄化,或褐化死亡(表 图3)。
由表1可见,产生体胚的9个细胞系中,有444%(4/9)为SE阶段,33.3%(3/9)为PEM Ⅰ、Ⅱ阶段,22.2%(2/9)为PEM Ⅱ、Ⅲ阶段。推测当胚性细胞发育至SE阶段时更容易进一步发育形成体胚,处于PEMⅠ、Ⅱ、Ⅲ阶段的胚性细胞发育形成体胚的能力较弱。
2.4 不同浓度植物磺肽素和继代次数对抗性湿地松体胚产量的影响
添加PSK对2007-5体胚产量具有显著影响(P<0.05),其质量浓度为1 mg/L时,产胚量最高,可达(62.6±4.4)个/mL;其次是1.5 mg/L时的产胚量为(43.4±6.5)个/mL;不添加PSK时的产胚量为(35.4±5.9)个/mL;当PSK为0.5 mg/L时,产胚量最低,为(28.8±8.4)个/mL(图4a)。
随着继代次数的增加,两个细胞系的成熟体胚数量均在呈下降趋势。不同继代次数的体胚产量差异显著(P<0.05),其中,2007-3产胚量在第2代时最高,为(91.3±7.0)个/mL;在继代8次时产胚量为(86.0±7.5)个/mL,此后逐渐下降;在第20代时仍保持胚性,产胚量为(27.5±4.8) 个/mL。2007-5的成熟体胚数量随继代次数增多而明显下降,在第2代时产胚量最高,为(89.8±8.4) 个/mL;第14代后仅有极少量体胚产生,产胚量均低于5个/mL;在第20代时彻底丧失胚性,未产生体胚(图4b)。
3 讨 论
胚性愈伤组织诱导是体胚发生的关键,其影响因素包括外植体的种类、生理状态、基因型、基本培养基以及植物激素等[30-31]。其中,基因型是主要的影响因素,不同品种以及同一品种不同基因型之间,在胚性愈伤组织的诱导及后期胚胎发育方面都有很大差异。有研究发现,在火炬松(P. taeda)32个家系中,胚性愈伤组织诱导率为0~53.4%,平均诱导率为17.9%[32];海岸松(P. pinaster)20个不同家系的诱导率为4.6%~49.1%,也不尽相同[33];红松(P. koraiensis)的4个家系诱导率差异显著,其中诱导率最高为10.35%,最低则为568%[34];程子珊等[35]发现湿地松6个不同家系诱导率为0~30%。本研究中4个不同家系在同一诱导条件下的诱导率也存在显著差异(7.3%~298%)。因此,基因型选择是成功建立松树体胚发生体系应考虑的重要因素之一。
基因型显著影响体胚产量,不同基因型的胚性愈伤组织其产胚能力差异显著[36]。据报道,西藏长叶松(P. roxburghii)的3个基因型中,PR810产胚量为(54.6±5.6) 个/g,而PR35产胚量仅(20.0±1. 9)个/g[37];海岸松的39个基因型中,能够产生体胚的占43.6%[25];石松(P. pinea)的5个基因型中仅3个能够产生体胚[38]。本研究中,35个不同基因型的胚性愈伤组织在同一成熟培养条件下,体胚产量差异显著,仅9个基因型的胚性愈伤组织产生成熟体胚,其中2007-3体胚产胚量高且质量好,而2007-10产生的成熟体胚胚轴肿胀,2007-24产生的体胚子叶未展开,还有部分基因型的细胞褐化死亡不产生体胚。
本研究供试的37个基因型细胞系中,43.2%基因型的细胞处于PEM Ⅰ、Ⅱ阶段,35.1%处于PEM Ⅱ、Ⅲ阶段,21.6%处于SE阶段;在产生体胚的9个细胞系基因型中,处于PEM Ⅰ、Ⅱ阶段的占33.3%,PEM Ⅱ、Ⅲ阶段仅占22.2%,SE阶段则占44.4%。因此,即使部分基因型的胚性细胞发育阶段相似,但其进一步发育形成体胚的能力各不相同,相较而言,当胚性细胞发育至SE阶段时,更容易形成体胚。如何促使处于PEM Ⅰ、Ⅱ、Ⅲ阶段的胚性细胞发育至SE阶段进而形成体胚,有待进一步研究。
PSK能够提高植物的体胚发生能力,在植物的生长、发育、生殖以及对外界环境的响应中具有重要的调节作用,并且与细胞生长素及分裂素介导的信号转导途径密切相关[19-21]。Kietkowska等[39]发现PSK可以刺激甘蓝(B. oleracea var. capitata)原生质体细胞分裂并促进其细胞再生。PSK还能够促进小黑麦[40]、日本柳杉[19]、地中海松(P. halepensis)[41]体胚发生。本研究中用PSK对抗性湿地松细胞系2007-5进行处理,发现添加PSK对抗性湿地松体胚产量具有显著影响,其质量浓度为1 mg/L时,植株体胚产量显著提高,可达(62.6 ± 4.4)个/mL。
在本研究中,抗性湿地松成熟体胚数量随继代次数增加均呈下降趋势。其中:细胞系2007-3成熟体胚数量由第2代时的91.3个/mL降低至第20代的27.5个/mL;2007-5第2代产胚量为(89.8±84) 个/mL,第20代时彻底丧失了胚性。长期继代培养同样导致海岸松胚性愈伤组织的胚性逐渐下降,其成熟体胚产量随继代次数的增加而减少[42]。马尾松(P. massoniana)成熟体胚数量也随继代时间的增加而减少,产胚能力从第3代开始逐渐下降[43]。目前对导致松属树种胚性愈伤组织产胚能力随继代时间逐渐降低的机制尚不十分清楚。有研究认为,长期继代培养改变了胚性愈伤组织的外观形态,从而影响正常体胚形成[4 "44]。最近研究表明,长期继代培养导致大多数胚性愈伤组织中的激素水平增加,多胺和抗氧化酶的活性也发生了显著变化[45]。Passamani等[46]发现长期继代培养过程中使用的植物生长调节剂,如 4-D,可影响多胺代谢、蛋白质合成和调节,因此降低了胚性愈伤组织的胚胎发生能力。
综上,通过对湿地松体胚发生的诱导和成熟环节进行优化,本研究总结出一套技术较为成熟的湿地松体胚发生技术体系。基因型显著影响抗性湿地松体胚发生,不同家系之间胚性愈伤组织诱导率差异显著,不同胚性细胞系之间体胚产量差异显著,添加1 mg/L PSK可以显著提高抗性湿地松的体胚产量,而胚性愈伤组织的胚性随着继代次数的增加而减弱。
参考文献(reference):
[1]李传道,韩政敏,叶建仁,等.松针褐斑病在湿地松幼林中的发展[J].南京林业大学学报(自然科学版),1987,11(1):1-7.LI C D,HAN Z M,YE J R,et al.Development of brown-spot needle blight in slash pine plantations[J].J Nanjing For Univ(Nat Sci Ed),1987,11(1):1-7.DOI: 10.3969/j.jssn.1000-2006.1987.01.001.
[2]徐康,程强强,杨春霞,等.速生湿地松良种胚性愈伤组织诱导与增殖[J].广西植物,202 41(2):283-291.XU K,CHENG Q Q,YANG C X,et al.Induction and proliferation of embryogenic callus on improved varieties of fast-growing Pinus elliottii[J].Guihaia,202 41(2):283-291.DOI: 10.11931/guihaia.gxzw201908048.
[3]叶建仁,李传道.我国湿地松抗松针褐斑病研究进展[J].林业科学研究,1996,9(2):189-195. YE J R,LI C D.Research progress of Pinus elliottii resistance to pine needle brown spot in China[J].For Res,1996,9(2):189-195.
[4]季孔庶,王潘潘,王金铃,等.松科树种的离体培养研究进展[J].南京林业大学学报(自然科学版),2015,39(1):142-148.JI K S,WANG P P,WANG J L,et al.Review on in vitro culture of tree species in Pinaceae[J].J Nanjing For Univ (Nat Sci Ed),2015,39(1):142-148.DOI: 10.3969/j.issn.1000-2006.2015.01.001.
[5]季孔庶,王章荣,王明庥,等.针叶树种扦插繁殖的研究进展及其对策[J].世界林业研究,1996,9(4):17-22. JI K S,WANG Z R,WANG M X,et al.Research progress and countermeasures of cutting propagation of coniferous species[J].World For Res,1996,9(4):17-22.
[6]黄健秋,卫志明.针叶树体细胞胚胎发生的研究进展[J].植物生理学通讯,1995(2):85-90.HUANG J Q,WEI Z M.Advances in somatic embryogenesis of conifers[J].Plant Physiol Commun,1995(2):85-90.
[7]胡继文,郭文冰,邓乐平,等.松树体细胞胚胎发生技术的发展与应用[J].林业与环境科学,2018,34(4):152-161.HU J W,GUO W B,DENG L P,et al.The development and application on pine somatic embryogenesis[J].For Environ Sci,2018,34(4):152-161.DOI: 10.3969/j.issn.1006-4427.2018.04.026.
[8]孙志强,孙占育,席梦利.针叶树体细胞胚胎发生研究进展[J].林业科技开发,2010,24(4):1-5.SUN Z Q,SUN Z Y,XI M L.Review on somatic embryogenesis of coniferous tree[J].J For Eng,2010,24(4):1-5.DOI: 10.3969/j.issn.1000-8101.2010.04.001.
[9]CHEN Y M,FEI Q,XIA X R,et al.Pinus massoniana somatic embryo maturation,mycorrhization of regenerated plantlets and its resistance to Bursaphelenchus xylophilus[J].Front Plant Sci,2023,14:1130471.DOI: 10.3389/fpls.2023.1130471.
[10]JAIN M" S,DONG N,NEWTON R J.Somatic embryogenesis in slash pine (Pinus elliottii) from immature embryos cultured in vitro[J].Plant Sci,1989,65(2):233-241.DOI: 10.1016/0168-9452(89)90070-8.
[11]LIAO Y K,AMERSON H V.Slash pine (Pinus elliottii Engelm.) somatic embryogenesis I.Initiation of embryogenic cultures from immature zygotic embryos[J].N For,1995,10(2):145-163.DOI: 10.1007/BF00033404.
[12]吴丽君,翁秋媛,陈达.湿地松体胚发育成熟的影响因子研究[J].福建农业学报,2013,28(4):372-376.WU L J,WENG Q Y,CHEN D.Factors affecting maturation of somatic embryos of slash pine[J].Fujian J Agric Sci,2013,28(4):372-376.DOI: 10.19303/j.issn.1008-0384.2013.04.014.
[13]方珞,吴小芹.抗松针褐斑病湿地松体细胞的悬浮培养[J].生物技术通报,2019,35(3):13-18.FANG L,WU X Q.Suspension culture of somatic cells of Pinus elliottii against brown spot needle blight of pine[J].Biotechnol Bull,2019,35(3):13-18.DOI: 10.13560/j.cnki.biotech.bull.1985.2018-0694.
[14]YANG F,XIA X R,KE X,et al.Somatic embryogenesis in slash pine (Pinus elliottii Engelm):improving initiation of embryogenic tissues and maturation of somatic embryos[J].Plant Cell Tissue Organ Cult (PCTOC),2020,143(1):159-171.DOI: 10.1007/s11240-020-01905-3.
[15]LELU-WALTER M A,BERNIER-CARDOU M,KLIMASZEWSKA K.Clonal plant production from self- and cross-pollinated seed families of Pinus sylvestris (L.) through somatic embryogenesis[J].Plant Cell Tissue Organ Cult(PCTOC),2008,92(1):31-45.DOI: 10.1007/s11240-007-9300-x.
[16]蒋菁,熊发前,唐秀梅,等.赤霉素、光照及基因型对花生体细胞胚诱导和植株再生的影响[J].南方农业学报,2013,44(6):903-908.JIANG J,XIONG F Q,TANG X M,et al.Effect of gibberellin,light and genotype on peanut somatic embryogenesis and plantlet regeneration[J].J South Agric,2013,44(6):903-908.
[17]MATSUBAYASHI Y,SAKAGAMI Y.Phytosulfokine,sulfated peptides that induce the proliferation of single mesophyll cells of Asparagus officinalis L[J].Proc Natl Acad Sci USA,1996,93(15):7623-7627.DOI: 10.1073/pnas.93.15.7623.
[18]MATSUBAYASHI Y,TAKAGI L,SAKAGAMI Y.Phytosulfokine-alpha,a sulfated pentapeptide,stimulates the proliferation of rice cells by means of specific high- and low-affinity binding sites[J].Proc Natl Acad Sci USA,1997,94(24):13357-13362.DOI: 10.1073/pnas.94.24.13357.
[19]IGASAKI T,AKASHI N,UJINO-IHARA T,et al.Phytosulfokine stimulates somatic embryogenesis in Cryptomeria japonica[J].Plant Cell Physiol,2003,44(12):1412-1416.DOI: 10.1093/pcp/pcg161.
[20]陈新建,杨艳会,陈军营,等.植物新型肽类生长调节物质:植物磺肽素[J].植物生理学通讯,2005,41(5):669-673.CHEN X J,YANG Y H,CHEN J Y,et al.A new peptide plant growth regulation substance,phytosulfokine (PSK)[J].Plant Physiol J,2005,41(5):669-673.
[21]MATSUBAYASHI Y,MORITA A,MATSUNAGA E,et al.Physiological relationships between auxin,cytokinin,and a peptide growth factor,phytosulfokine-α,in stimulation of asparagus cell proliferation[J].Planta,1999,207(4):559-565.DOI: 10.1007/s004250050518.
[22]陈金慧,张艳娟,吴亚云,等.植物磺肽素在杂交鹅掌楸体胚发生中的作用[J].林业科学,2013,49(2):33-38.CHEN J H,ZHANG Y J,WU Y Y,et al.Effects of phytosulfokine on the somatic embryogenesis of Liriodendron hybrids(L.chinense × L.tulipifera)[J].Sci Silvae Sin,2013,49(2):33-38.DOI: 10.11707/j.1001-7488.20130206.
[23]刘玲梅,汤浩茹,刘娟.试管苗长期继代培养中的形态发生能力与遗传稳定性[J].生物技术通报,2008(5):22-27.LIU L M,TANG H R,LIU J.Morphogenetic capacity and genetic stability of tissue in vitro cultures in long-term subculturing[J].Biotechnol Bull,2008(5):22-27.
[24]薛美凤,郭余龙,李名扬,等.长期继代对棉花胚性愈伤组织体胚发生能力及再生植株变异的影响[J].西南农业学报,200 15(4):19-21.XUE M F,GUO Y L,LI M Y,et al.Effects of long-term subculture on embryogenesis capability of cotton callus and somatic variation[J].Southwest China J Agric Sci,200 15(4):19-21.DOI: 10.16213/j.cnki.scjas.2002.04.005.
[25]TRONTIN J, REYMOND I, QUONIOU S, et al. An overview of current achievements and shortcomings in developing Maritime pine somatic embryogenesis and enabling technologies in France [C]//PARK Y S, BONGA J M, PARK S Y.Advances in somatic embryogenesis of trees and its application for the future forests plantations. Suwon: 1st IUFRO2.09.02 Conference, 2010.
[26]苏秀城.杉木无性系不同继代代数组培苗差异研究[J].福建林学院学报,2000(4):353-356.SU X C.Study on the differences of the seedling of different generations from successive tissue culture of Chinese fir clone[J].J Fujian Coll For,2000(4):353-356.
[27]王艳丽,孙婷玉,沈李元,等.继代培养时间对抗性黑松体胚发生的影响[J].西南林业大学学报(自然科学),2019,39(2):78-85.WANG Y L,SUN T Y,SHEN L Y,et al.Effects of subculture time on somatic embryogenesis of nematode-resistant Pinus thunbergii[J].J Southwest For Univ (Nat Sci),2019,39(2):78-85.DOI: 10.11929/j.swfu.201808046.
[28]张彩云,朱丽华,谈家金,等.抗松针褐斑病湿地松体细胞胚胎发生与植株再生[J].东北林业大学学报,2016,44(6):17-22.ZHANG C Y,ZHU L H,TAN J J,et al.Somatic embryogenesis and plantlet regeneration of disease-resistant slash pine(Pinus elliottii Engelm.) to brown spot needle blight[J].J Northeast For Univ,2016,44(6):17-22.DOI: 10.13759/j.cnki.dlxb.20160510.011.
[29]FILONOVA L H,BOZHKOV P V,VON ARNOLD S.Developmental pathway of somatic embryogenesis in Picea abies as revealed by time-lapse tracking[J].J Exp Bot,2000,51(343):249-264.DOI: 10.1093/jexbot/51.343.249.
[30]PINTO G,SILVA S,PARK Y S,et al.Factors influencing somatic embryogenesis induction in Eucalyptus globulus Labill.:basal medium and anti-browning agents[J].Plant Cell Tissue Organ Cult(PCTOC),2008,95(1):79-88.DOI: 10.1007/s11240-008-9418-5.
[31]胡继文,郭文冰,邓乐平,等.湿地松及其杂种的体细胞胚胎发生与植株再生[J].华南农业大学学报,2019,40(1):107-115.HU J W,GUO W B,DENG L P,et al.Somatic embryogenesis and plantlet regeneration in Pinus elliottii and its hybrids[J].J South China Agric Univ,2019,40(1):107-115.DOI: 10.7671/j.issn.1001-411X.201804001.
[32]PULLMAN G S,JOHNSON S.Somatic embryogenesis in loblolly pine (Pinus taeda L.):improving cultureinitiation rates[J].Ann For Sci,200 59(5/6):663-668.DOI: 10.1051/forest:2002053.
[33]MIGUEL C,GONALVES S,TERESO S,et al.Somatic embryogenesis from 20 open-pollinated families of Portuguese plus trees of maritime pine[J].Plant Cell Tissue Organ Cult(PCTOC),2004,76(2):121-130.DOI: 10.1023/B:TICU.0000007253.91771.e3.
[34]陈士刚,秦彩云,王聪慧,等.红松5个家系未成熟种子的胚性愈伤组织诱导研究[J].森林工程,202 37(1):13-17.CHEN S G,QIN C Y,WANG C H,et al.Embryogenic callus induction of Korean pine immature seeds from five families[J].For Eng,202 37(1):13-17.DOI: 10.16270/j.cnki.slgc.2021.01.003.
[35]程子珊,易敏,宋才玲,等.湿地松体细胞胚胎发生胚性愈伤组织诱导条件优化[J].江西农业大学学报,202 43(5):1054-1064.CHENG Z S,YI M,SONG C L,et al.Optimization of embryogenic callus induction conditions for somatic embryogenesis of Pinus elliottii[J].Acta Agric Univ Jiangxiensis,202 43(5):1054-1064.DOI: 10.13836/j.jjau.2021114.
[36]D AZ-SALA C.Molecular dissection of the regenerative capacity of forest tree species:special focus on conifers[J].Front Plant Sci,2019,9:1943.DOI: 10.3389/fpls.2018.01943.
[37]MALABADI R B,NATARAJA K.Influence of triacontanol on somatic embryogenesis of Pinus roxburghii Sarg[J].Balt For,2007,13(1):39-44.
[38]CARNEROS E,CELESTINO C,KLIMASZEWSKA K,et al.Plant regeneration in Stone pine (Pinus pinea L.) by somatic embryogenesis[J].Plant Cell Tissue Organ Cult (PCTOC),2009,98(2):165-178.DOI: 10.1007/s11240-009-9549-3.
[39]KIEKOWSKA A,ADAMUS A.Peptide growth factor phytosulfokine-α stimulates cell divisions and enhances regeneration from B.oleracea var. capitata L.protoplast culture[J].J Plant Growth Regul,2019,38(3):931-944.DOI: 10.1007/s00344-018-9903-y.
[40]ASIF M,EUDES F,RANDHAWA H,et al.Phytosulfokine alpha enhances microspore embryogenesis in both triticale and wheat[J].Plant Cell Tissue Organ Cult (PCTOC),2014,116(1):125-130.DOI: 10.1007/s11240-013-0379-y.
[41]PEREIRA C,MONTALBN I A,PEDROSA A,et al.Regeneration of Pinus halepensis (Mill.) through organogenesis from apical shoot buds[J].Forests,202 12(3):363.DOI: 10.3390/f12030363.
[42]BRETON D,HARVENGT L,TRONTIN J F,et al.Long-term subculture randomly affects morphology and subsequent maturation of early somatic embryos in maritime pine[J].Plant Cell Tissue Organ Cult(PCTOC),2006,87(1):95-108.DOI: 10.1007/s11240-006-9144-9.
[43]XIA X R,YANG F,KE X,et al.Somatic embryogenesis of Masson pine (Pinus massoniana):initiation,maturation and genetic stability analysis at SSR loci[J].Plant Cell Tissue Organ Cult (PCTOC),202 145(3):667-677.DOI: 10.1007/s11240-021-02036-z.
[44]FU C H,LI L Q,WU W J,et al.Assessment of genetic and epigenetic variation during long-term Taxus cell culture[J].Plant Cell Rep,201 31(7):1321-1331.DOI: 10.1007/s00299-012-1251-y.
[45]LI Q F,DENG C,ZHU T Q,et al.Dynamics of physiological and miRNA changes after long-term proliferation in somatic embryogenesis of Picea balfouriana[J].Trees,2019,33(2):469-480.DOI: 10.1007/s00468-018-1793-x.
[46]PASSAMANI L Z,REIS R S,VALE E M,et al.Long-term culture with" 4-dichlorophenoxyacetic acid affects embryogenic competence in sugarcane callus via changes in starch,polyamine and protein profiles[J].Plant Cell Tissue Organ Cult (PCTOC),2020,140(2):415-429.DOI: 10.1007/s11240-019-01737-w.
(责任编辑 郑琰燚)
