钙磷生物陶瓷支架的常温自强式3D打印技术与工艺研究
2025-01-25贾倩倩赵雪妮袁海泉李玲娜石国朱智鹏刘朝阳谷泽鑫
















摘 要:在常温不添加高分子聚合物粘接剂的情况下,首次研发了自强式钙磷生物陶瓷的无需高温后处理的3D打印成型技术与工艺.通过材料表征、孔隙率、力学性能测试和降解性测试对不同配比和不同打印间距的支架进行研究.结果表明,随着HA含量从70 wt.%减小至50 wt.%,浆料粘度与打印成型性变差,孔隙尺寸减小,而60 wt.% HA含量浆料具有良好的打印成型性,所打印的支架结构稳定、均匀.压缩强度随着HA含量的减少而增大,60 wt.%和50 wt.%含量的HA打印的钙磷生物陶瓷支架压缩强度分别为3.61±0.194 MPa (0.6-HTC)和5.28±0.629 MPa(0.5-HTC),能够匹配松质骨的要求.此外,随着打印间距(1 mm、2 mm和4 mm)的增加,支架的压缩强度也随之降低.随着HA含量的增加,钙磷生物陶瓷支架的孔隙率先增大后减小.60 wt.% HA含量的支架孔隙率最大(51.4%),降解性能优异,且降解后能保持完整性.此创新的3D打印技术能够根据临床手术现场患者实际植入部位结构尺寸要求直接打印并调整支架结构和形状,具有极大的应用前景.
关键词:3D打印; 钙磷生物陶瓷; 支架; 力学性能; 生物降解性
中图分类号:R318.08
文献标志码: A
Study on technology and process of room temperature self-strengthening 3D printing of calcium phosphate bioceramic scaffold
JIA Qian-qian, ZHAO Xue-ni*, YUAN Hai-quan, LI Ling-na, SHI Guo-wen,ZHU Zhi-peng, LIU Zhao-yang, GU Ze-xin
(College of Mechanical and Electrical Engineering, Shaanxi University of Science amp; Technology, Xi′ an 710021, China
)
Abstract:In this paper,the 3D printing technology and process of self-strengthening calcium phosphate bioceramics without high temperature post-treatment were developed for the first time without adding polymer binder at room temperature.The scaffolds with different ratios and different printing spacing were studied by material characterization,porosity,mechanical properties test and degradability test.The results show that with the decrease of HA content from 70 wt.% to 50 wt.%,the viscosity and printability of the slurry become worse,and the pore size decreases.The slurry with 60 wt.% HA content has good printability,and the printed scaffold structure is stable and uniform.The compressive strength increased with the decrease of HA content.The compressive strength of calcium phosphate bioceramic scaffolds printed with 60 wt.% and 50 wt.% HA was 3.61±0.194 MPa (0.6-HTC) and 5.28±0.629 MPa ( 0.5-HTC ),respectively,which could meet the requirements of cancellous bone.In addition,with the increase of printing spacing ( 1 mm,2 mm and 4 mm ),the compressive strength of the scaffolds also decreased.With the increase of HA content,the porosity of calcium phosphate bioceramic scaffold increased first and then decreased.The scaffold with 60 wt.% HA content had the largest porosity ( 51.4% ),excellent degradation performance and integrity after degradation.This innovative 3D printing technology can directly print and adjust the structure and shape of the stent according to the structural size requirements of the actual implantation site of the patient at the clinical surgery site,and has great application prospects.
Key words:3D printing; calcium phosphate bioceramic; scaffolds; mechanical properties; biodegradability
0 引言
用于骨组织工程和再生的理想生物材料应具有良好的力学性能、生物可降解性和生物相容性[1].生物陶瓷是一类广泛应用于替代或修复受损的骨组织工程的生物活性材料[2].羟基磷灰石(HA)是最常用于骨支架和骨植入物的生物陶瓷之一,钙磷比为1.67,是一种具有生物活性、可生物降解的磷酸钙,占骨量的近65%,是骨组织中无机成分的主要成分[3,4].传统上,陶瓷骨支架的制备方法包括溶剂铸造、颗粒浸出、冷冻干燥、注射成型、压缩成型、静电纺丝和水凝胶等\.然而传统制造技术难以制造出具有复杂的几何形状和相互连接的多孔结构的支架,3D打印具有设计灵活性、可定制性、减少材料浪费、生产速度快、能够控制孔隙率和改善力学性能的优点,广泛应用于骨植入物的制造\.
Li等[11]基于立体光刻3D打印技术,将HA/β-Ca3(PO4)2 (β-TCP)粉末与可光固化的聚合物混合,逐层固化后再进一步烧结得到复合支架.烧结温度在1 050 ℃时,其30 wt.% HA/β-TCP复合支架的抗压强度仅0.13 MPa,无法满足骨植入物压缩强度的需求(松质骨2~12 MPa、皮质骨130~225 MPa)[12],其可光固化的聚合物可能有毒.Eshraghi等[13]以聚己内酯(PCL)和HA为原料,采用选择性激光烧结3D打印制备了生物支架,但打印制备的支架精度和表面质量不高,而且打印中的高温工艺可能会破坏原料的化学成分.
与其他技术相比,挤出生物3D打印技术可以兼容多种材料,打印速度快,精度高[14].该技术利用机械活塞或气压挤压含墨水挤出容器,通过微喷嘴挤出生物墨水[15].该技术不涉及加热过程,因此,可以很容易地添加细胞和生物活性物质[16].Wang等[17]采用低温挤出打印技术以及冷冻干燥的后处理,以高分子聚合物为粘接剂,制备了磷酸钙(Ca-P)纳米颗粒/聚乳酸(PLA)纳米复合支架,其不同成分制备出的支架中最高的抗压强度仅达1.12 MPa,并且因为高聚物的引入,其支架在两周内仅降解了1.6%左右.
目前,通过3D打印技术制备修复骨缺损的生物陶瓷支架时,通常会添加高分子粘结剂(需要脱脂3~8 h,影响支架的降解性),且打印后需要进一步高温后处理(16~32 h),获得一定力学性能和生物学性能的陶瓷支架,进而由临床医生进行手术植入.但此打印技术和后处理时间长,且涉及高温后处理,难以在临床手术现场直接制备并使用,因此不能根据手术现场植入部位结构尺寸打印并进行精准调整,极大地限制了3D打印陶瓷支架的广泛应用.
为了平衡力学性能与生物降解性,本文基于挤出生物3D打印技术,在常温不添加高分子聚合物粘接剂的情况下,首次开发了自强式钙磷生物陶瓷的3D打印成型技术,该3D打印技术无需高温后处理,即可获得力学性能优异的钙磷生物陶瓷支架,同时该支架因没有经过高温后处理,具有优良的降解性.研究了不同原料配比、打印间距对陶瓷支架的形貌、微观结构、力学性能、孔隙率、降解性能的影响.此创新3D打印技术及工艺为后续添加细胞和生物活性物质创造有利条件,并为陶瓷材料支架用于替代和修复骨缺损的骨组织工程提供重要理论基础和实践意义.
1 实验部分
1.1 主要材料
HA(≥97%,particle size,0~100 nm,[Ca5(OH)(PO4)3]x)购自上海阿拉丁生化科技股份有限公司,四水硝酸钙(98.5%,Ca(NO3)2·4H2O)和磷酸氢二铵(分析纯 AR,(NH4)2HPO4 )、氨水(分析纯,NH4OH)、磷酸二氢钙一水合物(分析纯 AR,Ca(H2PO4)2·H2O)、一水合柠檬酸(分析纯 AR,C6H8O7·H2O)、丙三醇(分析纯 AR,C3H8O3,甘油)均购自国药集团化学试剂有限公司.
1.2 仪器设备
采用101-0AB型电热恒温鼓风干燥箱干燥粉体及样品,采用KSL-1100X-S小型马弗炉(合肥科晶材料技术有限公司)煅烧粉体,采用KQ2200DV型数控超声波清洗器(昆山市超声仪器有限公司)混匀浆料,采用STX-202A型金刚石线切割机(沈阳科晶自动化设备有限公司)切割样品,采用RAISE 3D Pro 2打印机(上海复志信息科技股份有限公司)移动平台加装自主设计加工的挤出装置,打印支架.采用SC-3A25型超声波式加湿器(美的集团股份有限公司),调至大约100 mL/h雾量,将其放置在封闭的容器中维持固化所需的环境.
1.3 β-TCP的制备
(1)用去离子水分别配制浓度为0.6 mol/L Ca(NO3)2·4H2O和0.4 mol/L (NH4)2HPO4的溶液.
(2)室温条件下,取400 mL的Ca(NO3)2·4H2O溶液,缓慢滴加400 mL的(NH4)2HPO4溶液,同时磁力搅拌均匀后,滴加氨水调节pH=8.
(3)(2)中的混合溶液搅拌均匀后,分瓶装入离心管中,静置24 h.
(4)采用离心机以4 200 r/min速度,离心10 min,离心后将离心管中上清液倒出,再加入新的去离子水清洗离心,去除杂质,重复三次.
(5)离心后将白色沉淀物放入鼓风干燥箱,在80 ℃下干燥至固态.
(6)将白色块体放入马弗炉中,以5 ℃/min升温至800 ℃,然后煅烧3 h.
(7)在研钵中研磨得细小粉体,装入离心管备用.
1.4 复合支架的3D打印
配制1.5 mol/L的C6H8O7·H2O溶液,量取10 mL,然后称取8 g C3H8O3,将C3H8O3与C6H8O7·H2O溶液混合均匀,制成液相.将称量好的HA、β-TCP、Ca(H2PO4)2·H2O粉末按比例混合,然后按1.4 g/mL 的固液比加入液相,超声搅拌3 min,使其混合均匀,用于后续3 D打印.根据HA配比(如表1所示),将样品标记为50 wt.% HA/β-TCP/Ca(H2PO4)2·H2O (0.5-HTC)、60 wt.% HA/β-TCP/Ca(H2PO4)2·H2O (0.6-HTC)、70 wt.% HA/β-TCP/Ca(H2PO4)2·H2O (0.7-HTC).
根据打印间距,将样品标记为0.6-1 HTC、0.6-2 HTC、0.6-4 HTC.将支架设计为空间网格结构,并使用G代码编辑模型的打印路径,层高设为0.5 mm,喷嘴移动速度为200 mm/min,棒料间距分别为1 mm、2 mm和4 mm,并以gcode格式保存.然后,将配制好的浆料转移进料筒,将料筒连接气泵,气压设定为0.2~0.5 MPa,使用直径为1.35 mm的喷嘴,在软件(Simplify 3D,美国)中输入gcode格式文档,打印支架(20×20×10 mm3),打印过程如图1所示.打印结束后,将支架放置在室温下潮湿环境中24 h,让其自强化.
1.5 表征与测试
采用JSM66460F场发射扫描电子显微镜(SEM)对打印支架的微观组织结构进行分析.采用KH-8700超景深显微镜观察支架形态和孔结构.采用D/max2200PC X射线衍射仪(XRD)对材料和支架的物相组成进行表征.采用VERTEX-80傅里叶变换红外光谱仪(FT-IR))对支架的物相组成进行表征.采用DHR-1型流变仪对不同配比的钙磷生物陶瓷浆料的流变学性能进行表征.采用阿基米德排水法测定多孔钙磷生物陶瓷支架的孔隙率.采用1036PC万能试验机对钙磷生物陶瓷支架(5×5×10 mm3)的压缩性能进行表征,加载速度为0.2 mm/min.采用Tris-HCl 缓冲液浸泡法来评定支架的生物降解性.将钙磷生物陶瓷支架浸入初始pH值为7.4的Tris缓冲液中,每次浸泡24 h后,将钙磷生物陶瓷支架取出,在无水乙醇中清洗,然后在80 ℃下干燥12 h后称重,计算浸泡前后样品的质量变化.
2 结果与讨论
2.1 钙磷生物陶瓷支架的物相组成
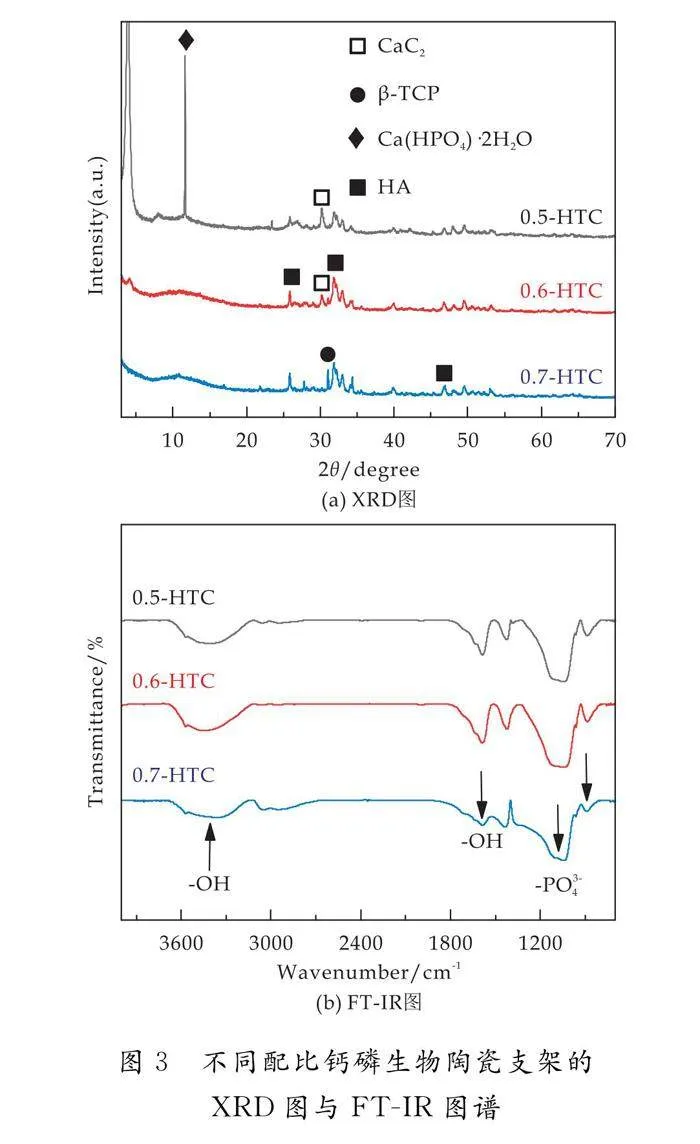
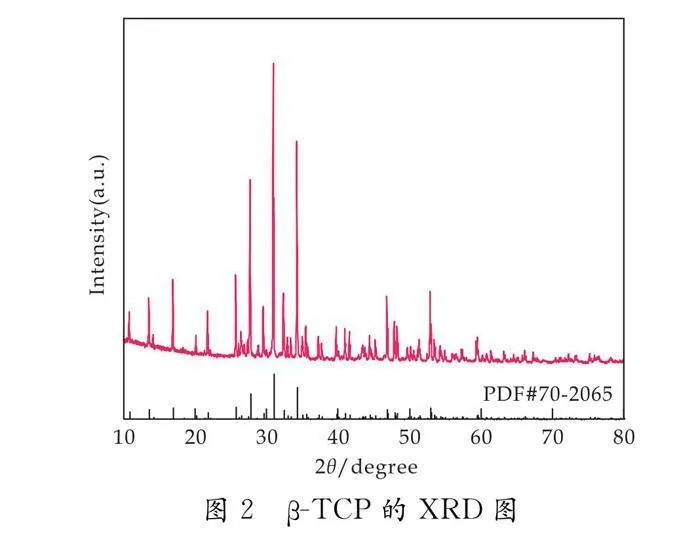
生物陶瓷β-TCP的XRD图谱如图2所示.对应β-TCP的标准卡片,制备得到的β-TCP的衍射峰与标准峰完全重合,说明Ca(NO3)2·4H2O中的Ca2+和(NH4)2HPO4中的PO43-充分反应生成了Ca3(PO4)2.
图3为不同配比打印的钙磷生物陶瓷支架的XRD、FT-IR图谱.如图3 (a) 所示,0.7-HTC支架由HA和少量的β-TCP组成.0.6-HTC支架由HA和少量CaC2组成,可能是柠檬酸与HA发生了反应.而0.5-HTC支架由大量的透钙磷石(Ca(HPO4)·2H2O)和少量的HA、CaC2组成.在打印过程中,在相同固液比下,不同的粉体配比(50 wt.% HA:27.5 wt.% β-TCP:22.5 wt.% Ca(H2PO4)2·H2O、60 wt.% HA:22 wt.% β-TCP:18 wt.% Ca(H2PO4)2·H2O和70 wt.% HA:16.5 wt.% β-TCP:13.5 wt.% Ca(H2PO4)2·H2O),会导致浆料粘度不同,从图3能看出,0.5-HTC复合支架的浆料更稀,添加的液相可以让β-TCP和Ca(H2PO4)2·H2O充分反应,从而生成Ca(HPO4)·2H2O,如公式(1)所示:
β-Ca3(PO4)2 + Ca(H2PO4)2·H2O + 7 H2O=4 Ca(HPO4)·2H2O
(1)
不同配比所打印出的钙磷生物陶瓷支架的FT-IR图谱如图3 (b) 所示.制备HTC支架的粉体为HA、 β-TCP、Ca(H2PO4)2·H2O,三者都含有-PO43-,以及HA和Ca(H2PO4)2·H2O都还有羟基-OH.FT-IR图谱中在(3 408、3 450、3 378 cm-1)出现了-OH的伸缩振动峰,且峰形较宽,同时在(1 592、1 588、1 594 cm-1)出现了-OH吸收峰.880~1 142 cm-1为-PO43-的伸缩振动带,其波段较宽,吸收峰分别为(1 052、1 054、1 057 cm-1)和(885、889、888 cm-1).
2.2 不同配比钙磷生物陶瓷支架的力学性能
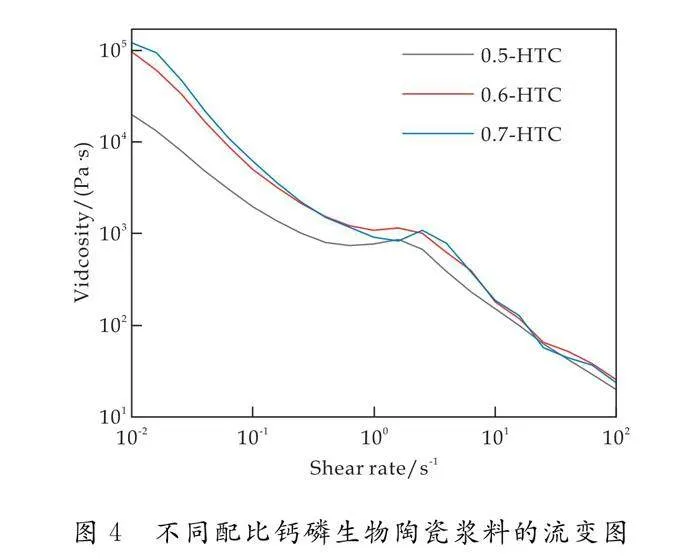
图4为不同配比的钙磷生物陶瓷浆料的流变图.由图可知,当剪切速率较低时,浆料粘度较高,流动性较差,0.5-HTC浆料的粘度最低,0.7-HTC浆料的粘度最高,粘度随着HA含量的增加而增加.当剪切速率增大时,三种浆料都表现出剪切变稀流动行为,粘度也随之降低,适合3D打印[18].
图5为不同配比下打印的钙磷生物陶瓷支架的外观图.图5 (a)、(b)、(c) 分别为0.5-HTC、0.6-HTC和0.7-HTC支架的外观图.从图中可以看出,在相同的打印参数和喷嘴直径下,不同配比所打印出的支架间距不同,随着HA含量的减少,所打印支架的间距越来越接近所设计的打印间距,这是因为不同配比下的浆料,粘度与流变性有所不同.从图5 (a) 可以看到,50 wt.% HA的配比打印的浆料不太连续,外形有缺陷,并且挤出后的棒料形状不太完整,导致支架间距大小不一致,甚至有些已经闭合.从图5 (b) 可以看出,60 wt.% HA的配比打印的支架间距大小均匀,支架外观完整.从图5 (c) 可以看出,70 wt.% HA的配比所挤出的棒料直径更接近喷嘴直径,支架间距也更接近所设计的打印间距.
图6为不同配比钙磷生物陶瓷支架的SEM图.与图5一致,随着HA含量的增多,支架的间距越大.图6(a)为0.5-HTC支架的正面图,支架的间距为0.8 mm左右,比设计的打印间距(2 mm)缩小了60%,并且棒料的直径为1.56 mm左右,比喷嘴直径(1.35 mm)扩大了15.5%.图6(c)为0.6-HTC支架的正面图,支架的间距平均值为0.9 mm左右,比2 mm缩小了55%,图6(b)为0.5-HTC支架的侧面图,层与层之间已经融合.图6(d)为0.6-HTC支架的侧面图,棒料直径的平均值为1.3 mm左右,比1.35 mm缩小了3%.
图6 (e) 为0.7-HTC支架的正面图,可以看出棒料略有凹陷,表面较为粗糙,支架间距的平均值为1.2 mm左右,比2 mm缩小了40%,图6 (f) 为0.7-HTC支架的侧面图,棒料直径的平均值为1.1 mm左右,比1.35 mm缩小了18.5%.结合各钙磷生物陶瓷支架的结果,说明50 wt.% HA配比的浆料所打印的棒料没有支撑性,支架的层与层之间已完全融合,已经不符合所设计的支架的多孔结构.而0.6-HTC支架的棒料直径接近喷嘴直径,说明挤出的浆料成型性较好,更适合3D打印.而0.7-HTC支架的棒料的直径收缩较大,可能会导致支架棒与棒之间的结合更差.
图7所示不同配比下钙磷生物陶瓷支架的孔隙率.采用排水法测量了多孔支架的孔隙率.同时对于此法进行改进,采用浸泡介质法,通过加热介质使液体充满整个开孔孔隙,来测定孔隙率.0.6-HTC支架的孔隙率最大为51.4%,0.5-HTC支架的孔隙率为43.5%,0.7-HTC支架的孔隙率为37.7%.研究表明,孔隙率为50%~60%的骨移植材料能够有效的促进骨愈合[19].设计的大孔孔隙(棒料间距)与实际打印出的并不一致,因浆料的配比不同,流动性与塑性不一致,并且浆料的流变性还会随着打印时间而改变.0.5-HTC支架的大孔高度仅占支架高度的1%左右,0.6-HTC支架的大孔高度占支架高度的80%左右,而0.7-HTC支架中的大孔完全连通.结合前述图5与图6,0.5-HTC支架的大孔孔隙率为0.4%,0.6-HTC为8.6%,0.7-HTC为18.9%.综合排水法所测结果,0.5-HTC支架的总孔隙率为43.9%,0.6-HTC支架的总孔隙率为60%,0.7-HTC支架的总孔隙率为56.6%.结果表明,并非HA的含量越少或是越多,支架的孔隙率就越大.
良好的骨植入物不仅要求可控的孔隙率,还需求可匹配的力学性能,为此研究了不同配比的钙磷生物陶瓷材料对支架力学性能的影响.0.5-HTC、0.6-HTC和0.7-HTC支架的压缩强度柱状图以及应力应变曲线图如图8所示.
图8 (a)是钙磷生物陶瓷支架的压缩柱状图.压缩强度随着HA含量的增加而减少,0.7-HTC支架的压缩强度(0.49±0.169 MPa)明显低于0.6-HTC支架(3.61±0.194 MPa)和0.5-HTC(5.28±0.629 MPa).这可能是因为,不同配比下钙磷生物陶瓷支架孔隙率的不同对支架力学性能的影响.这可能也与支架棒料之间的间距即支架的抵抗外力载荷的实际表面积,以及层与层之间的结合有关.由前述图6也能看到,0.5-HTC支架的棒料直径最大,间距最小,支架棒料之间的融合较多,并且侧面也已经完全融合,抵抗外力载荷的实际表面积最大,所以可能导致0.5-HTC支架的抗压强度最大.
而0.6-HTC支架的间距均匀,层与层之间也略有融合,从图8(b)所示的应力应变曲线中也能看出,0.6-HTC支架在受到外载荷后,曲线呈现了一个先下降后上升的小趋势,这可能是因为所施加的载荷将支架层与层之间的结合处压得更为紧密,后载荷加大,而0.5-HTC支架的应力应变曲线并未出现这个小波动.0.7-HTC支架抵抗外力载荷的实际面积最小,并且层与层之间的结合也较差,所以可能导致其力学性能较差.
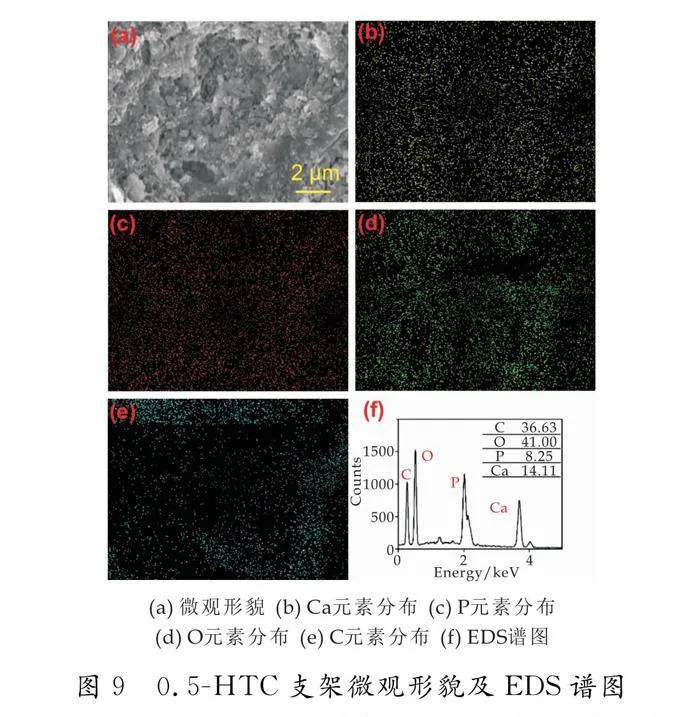
0.5-HTC支架的微观形貌、元素分布以及EDS谱图如图9所示.图9 (a)是支架的微观形貌图,图9 (b)~(e)是Ca、P、O和C的元素分布,图9 (f) 是EDS谱图.其元素分布均匀,Ca/P=1.71.图中孔隙较多,其中层层堆叠,成片层状和层叠状的晶体,是典型的透钙磷石晶体结构[20],并且透钙磷石的大块板条状结构可以使其具备较好的强度和韧性[21],这也是0.5-HTC支架压缩强度最高的原因之一.
图10是0.6-HTC支架的微观形貌、元素分布以及EDS谱图.图10 (a)是支架的微观形貌图,图10 (b)~(e)是Ca、P、O和C的元素分布,图10 (f) 是EDS谱图.各元素分布均匀,Ca/P=1.62.图中有明显的大孔存在,孔隙最多.
0.7-HTC支架的微观形貌、元素分布以及EDS谱图如图11所示.图11 (a)是支架的微观形貌图,图11 (b)~(e) 是Ca、P、O和C的元素分布,图11 (f) 是EDS谱图.其元素分布均匀,Ca/P=1.82.图中大量的球状颗粒是纳米HA,并且孔隙最少.
2.3 不同打印间距钙磷生物陶瓷支架的力学性能
为了验证支架间距是否会影响支架的力学性能,选用60 wt.% HA的配比,打印了不同间距的钙磷生物陶瓷支架.图12为不同打印间距的钙磷生物陶瓷支架的外观图.图12 (a)为0.6-1 HTC支架的外观图,图12 (b)为0.6-2 HTC支架的外观图,图12 (c)为0.6-4 HTC支架的外观图.各支架随着打印间距的参数增大,间距也随着增大.0.6-1 HTC支架的四周能看出已经融合.
0.6-1 HTC、0.6-2 HTC和0.6-4 HTC支架的超景深图如图13所示.
由图13可知,随着打印间距参数的增大,支架的间距也随之增大.0.6-1 HTC支架的实际打印间距为0.48 mm左右,比设计的打印间距(1 mm)缩小了52%左右.0.6-2 HTC支架的实际打印间距为0.9 mm左右,比2 mm缩小了55%.0.6-4 HTC支架的实际打印间距为3 mm左右,比4 mm缩小了25%.图13(b)是0.6-1 HTC支架的侧面图,因为打印间距较小,所有层与层之间已经融合,仅留有同层棒料之间的间距.图13 (d)是0.6-2 HTC支架的侧面图,层与层之间略有融合,但依旧可以看出层与层之间的界限.图13 (f)是0.6-4 HTC支架的侧面图,层与层之间出现部分的间隙,结合较差.
图14为0.6-1 HTC、0.6-2 HTC和0.6-4 HTC支架的孔隙率.0.6-1 HTC与0.6-2 HTC支架的孔隙率差距较小,其中0.6-1 HTC支架的孔隙率为48.7%,0.6-2 HTC支架的孔隙率为51.4%,0.6-4 HTC支架的孔隙率为17.1%.
0.6-1 HTC、0.6-2 HTC和0.6-4 HTC支架的压缩强度柱状图以及应力应变曲线图如图15所示.0.6-1 HTC支架的压缩强度为5.12±0.524 MPa,误差值较大.0.6-2 HTC支架的压缩强度为3.61±0.194 MPa.0.6-1 HTC支架的压缩强度略高于0.6-2 HTC.0.6-4 HTC支架的压缩强度仅为0.79±0.162 MPa.因为其间距过大,在样品尺寸统一的情况下,0.6-4 HTC支架的抵抗外力载荷的实际表面积最小,所以其压缩强度最低.而0.6-1 HTC支架的抵抗外力载荷的实际表面积最大,并且其层与层的结合也更好(前述图13(b)),所以其应力应变曲线前期并未出现0.6-2 HTC支架的应力应变曲线所呈现出的小波动(如图15(b)所示).综上所述,随着支架的棒料间距增大,压缩强度随之降低.
2.4 不同配比钙磷生物陶瓷支架的降解性能
可生物降解的支架为新骨组织的形成提供了初始的多孔结构和稳定性,并随着组织的形成而降解,为基质沉积和组织生长提供了空间,之后随着骨愈合,支架自身的强度相应降低,但向内生长的新生骨组织不断增加其强度[22].将不同配比钙磷生物陶瓷支架在37 ℃的Tris-HCl中浸泡7天,研究支架的降解性能.
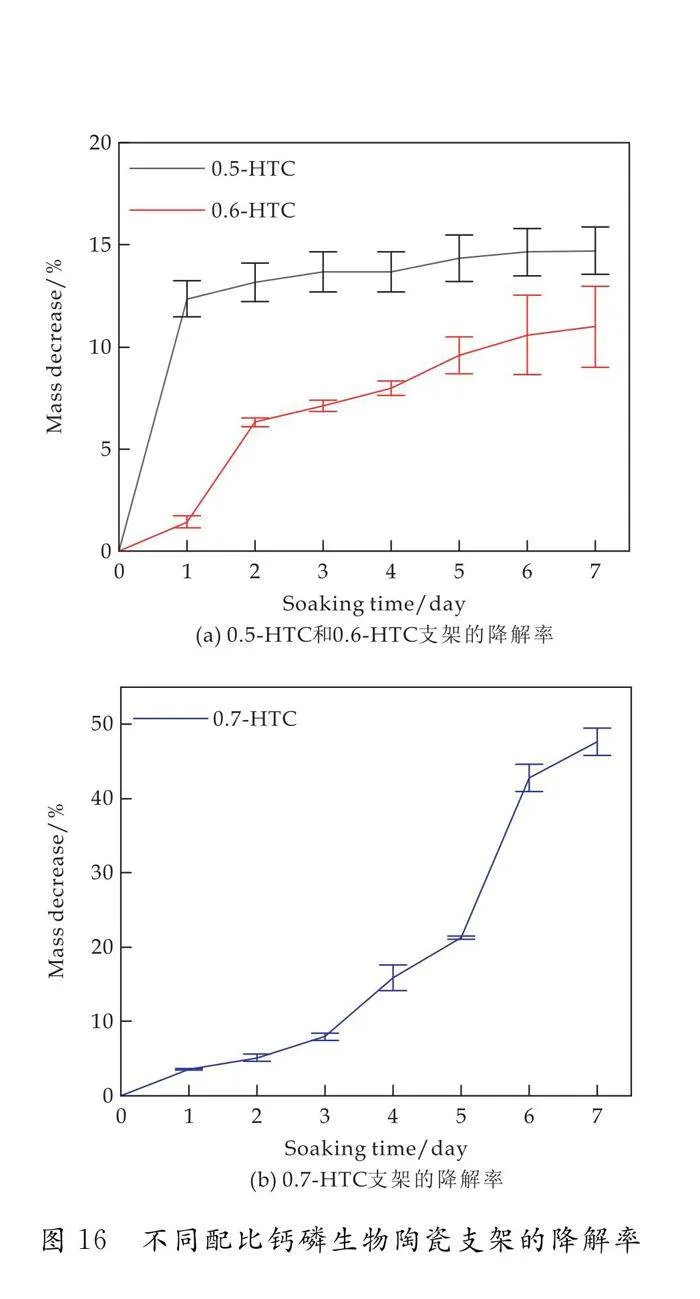
图16为在7天内钙磷生物陶瓷支架的质量变化.0.5-HTC和0.6-HTC支架的质量变化如图16 (a)所示.0.5-HTC支架的失重率(14.7%)明显优于0.6-HTC(10.9%).XRD图中,0.5-HTC支架有着非常尖锐的透钙磷石峰 (前述图3 (a)),而与羟基磷灰石相比,透钙磷石在生物体内的生物降解能力明显优于羟基磷灰石.但0.5-HTC支架仅在第一天显示出了较高的降解,随后随时间的延长降解趋于平缓,而0.6-HTC支架一直保持着一个上升的趋势.
0.7-HTC支架的失重率高达47.6%,与0.5-HTC和0.6-HTC支架相比,其降解过快,这是因为0.7-HTC支架在Tris-HCl缓冲液中浸泡3天后,支架开始局部溃散,导致支架降解加剧,在图16 (b)中也能看到,0.7-HTC支架前三天的降解较为缓慢,但是第4天开始剧增.
3 结论
本文在常温不添加高分子聚合物粘接剂的情况下,采用不同配比的HA、β-TCP、Ca(H2PO4)2·H2O为主要原料,创新性的打印了兼具优异力学性能与降解性能的钙磷生物陶瓷支架.研究了不同原料配比和不同打印间距对钙磷生物陶瓷支架的形貌、微观结构、力学性能、孔隙率、降解性能的影响.研究结论如下:
(1)随着HA的含量从70 wt.%减小至50 wt.%,浆料粘度与打印成型性变差,孔隙尺寸减小,当HA含量为50 wt.%时,支架的棒料成型稳定性不佳,所设计的支架的多孔结构难以保证,当HA含量为70 wt.%时,支架间距虽最为接近所设计的间距尺寸,但支架表面粗糙,棒料的收缩较大.而60 wt.% HA含量(HA∶β-TCP∶Ca(H2PO4)2·H2O=60∶22∶18)浆料具有良好的打印成型性,所打印的支架结构稳定、均匀.
(2)钙磷生物陶瓷支架的压缩强度随着HA含量的减少而增大,60 wt.%和50 wt.%含量的HA打印的陶瓷支架压缩强度分别为3.61±0.194 MPa (0.6-HTC)和5.28±0.629 MPa(0.5-HTC).随着HA含量的降低,打印过程中β-TCP和Ca(H2PO4)2·H2O与液相反应生成的板条状结构有效提升了支架的强度和韧性,支架的有效载荷承力面积增大,层与层之间的结合较好.此外,随着打印间距(1 mm、2 mm和4 mm)的增加,支架的压缩强度也随之降低.
(3)随着HA含量从70 wt.%减小到60 wt.%,钙磷生物陶瓷支架的孔隙率增大.当HA的含量继续减小到50 wt.%时,支架的孔隙率反而减小,降解从10.9%增加到14.7%.其中0.6-HTC支架的孔隙率最大(51.4%),保持完整性同时又具有优异的降解性能.
本文的打印技术及工艺能够根据临床手术现场患者实际植入部位结构尺寸要求直接打印并调整支架结构和形状,打印的钙磷生物陶瓷支架同时具有优异的力学性能和的降解性能,为后续添加细胞和生物活性物质创造有利条件.研究为陶瓷支架用于替代和修复骨缺损的骨组织工程提供重要理论基础和实践意义.
参考文献
[1] Budharaju H,Suresh S,Sekar M P,et al.Ceramic materials for 3D printing of biomimetic bone scaffolds-current state-of-the-art amp; future perspectives[J].Materials amp; Design,2023,231:1-30.
[2] Roy M,Bandyopadhyay A,Bose S,et al.Materials for bone disorders[M].New York:Academic Press,2017.
[3] El Ghannam A,Ducheyne P.Comprehensive biomaterials[M].Amsterdam:Elsevier Science,2011.
[4] Lowe B,Hardy J G,Walsh L J.Optimizing nanohydroxyapatite nanocomposites for bone tissue engineering[J].ACS Omega,2019,5(1):1-9.
[5] Cao D,Malakooti S,Kulkarni V N,et al.Nanoindentation measurement of core-skin interphase viscoelastic properties in a sandwich glass composite[J].Mechanics of Time-Dependent Materials,2020,25(3):353-363.
[6] Collins M N,Ren G,Young K,et al.Scaffold fabrication technologies and structure/function properties in bone tissue engineering[J].Advanced Functional Materials,2021,31(21):1-22.
[7] Sundaramurthi D,Jaidev L R,Ramana L N,et al.Osteogenic differentiation of stem cells on mesoporous silica nanofibers[J].RSC Advances,2015,5(85):69 205-69 214.
[8] Bahraminasab M.Challenges on optimization of 3D-printed bone scaffolds[J].BioMedical Engineering OnLine,2020,19(1):1-33.
[9] Budharaju H,Subramanian A,Sethuraman S.Recent advancements in cardiovascular bioprinting and bioprinted cardiac constructs[J].Biomaterials Science,2021,9(6):1 974-1 994.
[10] Shao H,Zhao D,Lin T,et al.3D gel-printing of zirconia ceramic parts[J].Ceramics International,2017,43(16):13 938-13 942.
[11] Li X,Yuan Y,Liu L,et al.Chen 3D printing of hydroxyapatite/tricalcium phosphate scaffold with hierarchical porous structure for bone regeneration[J].Bio-Design and Manufacturing,2019,3(1):15-29.
[12] Zhao X,Liu M,Wang P,et al.Highly efficient preparation of multi-angle continuous carbon fibre reinforced hydroxyapatite composites by electrostatic splitting method[J].Journal of the European Ceramic Society,2022,42(16):7 631-7 647.
[13] Eshraghi S,Das S.Micromechanical finite-element modeling and experimental characterization of the compressive mechanical properties of polycaprolactone-hydroxyapatite composite scaffolds prepared by selective laser sintering for bone tissue engineering[J].Acta Biomaterialia,2012,8(8):3 138-3 143.
[14] Johnson B N,Lancaster K Z,Zhen G,et al.3D printed anatomical nerve regeneration pathways[J].Advanced Functional Materials,2015,25(39):6 205-6 217.
[15] Jia X,Johnson B.3D printed nerve guidance channels:Computer-aided control of geometry,physical cues,biological supplements and gradients[J].Neural Regeneration Research,2016,11(10):1 568-1 569.
[16] Ozbolat I T,Hospodiuk M.Current advances and future perspectives in extrusion-based bioprinting[J].Biomaterials,2016,76:321-343.
[17] Wang C,Zhao Q,Wang M.Cryogenic 3D printing for producing hierarchical porous and rhBMP-2-loaded Ca-P/PLLA nanocomposite scaffolds for bone tissue engineering[J].Biofabrication,2017,9(2):1-12.
[18] Peng E,Zhang D,Ding J,et al.Ceramic robocasting:Recent achievements,potential,and future developments[J].Advanced Materials,2018,30(47):1-14.
[19] 魏森森,赵雪妮,刘 傲,等.碳纤维增强微孔镁掺杂羟基磷灰石生物陶瓷的制备及其性能[J].陕西科技大学学报,2022,40(1):124-132.
[20] 彭 磊,丁秀明,陈克伟,等.羟基磷灰石体系透钙磷灰石骨水泥的理化性能[J].中国组织工程研究,2018,22(6):821-826.
[21] 杨迪诚,钟 建,刘 涛,等.透钙磷石骨水泥制备及其载药性能[J].中国组织工程研究, 2015,19(3):427-433.
[22] Zhao X,Liu A,Zhou L,et al.3D printing of bioactive macro/microporous continuous carbon fibre reinforced hydroxyapatite composite scaffolds with synchronously enhanced strength and toughness[J].Journal of the European Ceramic Society,2022,42(10):4 396-4 409.
【责任编辑:蒋亚儒】
