肠道菌群体外酵解不同种类单糖研究
2025-01-25郝俊宇孙玉姣高润凝姚佳轩













摘 要:碳水化合物的结构特征影响着其被微生物的利用效果,为了探究其结构对肠道菌群的影响,本文从单糖组成角度入手,研究了以葡萄糖、甘露糖、阿拉伯糖、半乳糖、岩藻糖、木糖、鼠李糖、葡萄糖醛酸和半乳糖醛酸这九种单糖作为碳源,在进行体外培养的过程中,肠道菌群及其代谢产物发生的变化.主要检测了OD600、糖消耗量、短链脂肪酸和乳酸含量等指标.经过筛选后,对七种中性单糖混合发酵的培养基进行了单糖组成分析,明确了七种中性单糖在酵解过程中的被利用顺序.以16S rRNA高通量测序分析了肠道菌群群落多样性和丰度变化,发现不同单糖在被乳酸杆菌等有益菌利用的过程中存在竞争关系,甘露糖和半乳糖有利于肠道中的乳酸杆菌属等有益菌的生长繁殖,研究结果将为多糖与肠道菌群的构效关系研究提供了理论依据.
关键词:单糖组成; 体外酵解; 短链脂肪酸; 肠道菌群; 多样性分析
中图分类号:TS201.4
文献标志码: A
Study on the in vitro fermentation of different types of monosaccharides by gut microbiota
HAO Jun-yu1, SUN Yu-jiao1,2*, GAO Run-ning1, YAO Jia-xuan1
(1.School of Food Science and Engineering, Shaanxi University of Science amp; Technology, Xi′an 710021, China; 2.Shaanxi Agricultural Products Processing Technology Research Institute, Xi′an 710021, China)
Abstract:The structural characteristics of carbohydrates affect their utilization efficiency by microorganisms.In order to explore the effect of their structure on gut microbiota,this article starts from the perspective of monosaccharide composition and studies the changes in gut microbiota and its metabolites during in vitro culture using nine monosaccharides including glucose,mannose,arabinose,galactose,fucose,xylose,xylose,rhamnose,glucuronic acid,and galacturonic acid as carbon sources.Mainly tested indicators such as OD600,sugar consumption,short chain fatty acids,and lactate content.After screening,the monosaccharide composition of the culture medium for mixed fermentation of seven neutral monosaccharides was analyzed,and the utilization order of the seven neutral monosaccharides in the fermentation process was clarified.The diversity and abundance changes of gut microbiota were analyzed using high-throughput sequencing of 16S rRNA.It was found that different monosaccharides compete with beneficial bacteria such as lactobacilli in the process of utilization.Mannose and galactose are beneficial for the growth and reproduction of beneficial bacteria such as Lactobacilli in the gut.The research results will provide a theoretical basis for the study of the structure-activity relationship between polysaccharides and gut microbiota.
Key words:monosaccharide composition;" in vitro fermentation; short chain fatty acids; gut microbiota; diversity analysis
0 引言
多糖是一类由醛糖或酮糖等单糖通过糖苷键组成的复杂高分子化合物.多糖来源广泛,可从动物、植物和微生物中获取,具有多种生物活性,在生物、制药、食品等领域得到了广泛的研究和应用[1].但由于多糖结构复杂多样,导致其确切的构效关系研究仍不清楚.
单糖作为组成多糖的最基本单位,是影响多糖结构特征的重要因素.单糖组成可以通过影响多糖的糖苷键、官能团和空间构象等结构特征,进而影响多糖的溶解度、流变性和生物活性[2].研究发现单糖会影响多糖的抗氧化、抗炎等活性.例如阿拉伯糖、半乳糖和糖醛酸含量的升高,使牛膝多糖提取物对ABTS、DPPH、羟基自由基和超氧阴离子的体外清除活性增强[3];香菇多糖中甘露糖和鼠李糖的含量的增加与其抗氧化活性呈正相关,而葡萄糖和阿拉伯糖的含量的增加则呈负相关[4];高含量的岩藻糖和半乳糖会增强从日本糖精中纯化的岩藻聚糖(LJNF3)的抗炎活性[5];而高含量的阿拉伯糖和半乳糖可以显著提高枸杞多糖(LBGP-I-3)的抗炎活性[6].
肠道作为人体内最大的微生态系统,栖息着数量及种类庞杂的肠道菌群来维持宿主健康[7].有些多糖具有选择性地刺激有益微生物群生长的能力,这些多糖可以添加到功能食品中,以改善肠道菌群和调节机体健康[8].而这种调节肠道菌群并发挥多种生物活性的能力,在很大程度上依赖于其结构特征[9].研究发现单糖的组成和比例会影响多糖对肠道菌群的调节作用,单糖通过影响多糖的利用率和被肠道菌群降解的代谢产物类型来影响多糖的益生活性.多糖的单糖组成越复杂,调节细菌活性的能力越强[10].甜菜中果胶多糖侧链上的中性糖更容易被肠道菌群利用发酵,并有助于双歧杆菌、乳杆菌的增加[11].富含阿拉伯糖和甘露糖的多糖更容易被肠道菌群利用,提高植物乳杆菌、发酵乳杆菌的比例[12].但当前研究多是以多糖为整体研究对象,推测单糖对肠道菌群的调节功能,具体各种单糖的酵解特征及其发挥的调节功能尚不清楚.因此,本文以多糖中常见的9种单糖入手,从单糖组成的角度研究其具体的酵解行为.研究结果可为深入研究多糖结构对肠道菌群的调节作用和筛选具有益生功能的多糖提供理论依据.
1 材料与方法
1.1 实验材料与仪器
1.1.1 主要材料
鼠李糖(Rhamnose,Rha)、岩藻糖(Fucose,Fuc)、阿拉伯糖(Arabinose,Ara)、木糖(Xylose,Xyl)、甘露糖(Mannose,Man)、葡萄糖(Glucose,Glc)、半乳糖(Galactose,Gal)、葡萄糖醛酸(Glucuronic acid,GlcA)及半乳糖醛酸(Galacturonic acid,GalA)" 上海阿拉丁化工有限公司;粪便样品由年龄22~25岁的三位志愿者提供,所选志愿者身体状况良好、健康,饮食正常,6个月内无肠道疾病,3周内未服用过益生菌或抗生素.
1.1.2 主要仪器
GC-2010 Pro气相色谱仪 日本岛津公司;SW-CJ-1FD超净工作台 苏州净化设备有限公司;ZDX-250B厌氧培养箱 天津市通利信达仪器厂;T2600紫外分光光度计 上海佑科仪器仪表有限公司;CT15RT台式高速冷冻离心机 上海天美生化仪器设备公司;BXM-30R立式高压蒸汽灭菌锅 上海圣科仪器公司;ABI7300荧光定量 PCR仪 Applied Biosystems.
1.2 实验方法
1.2.1 培养基的配置
称取胰蛋白胨2 g/L、酵母浸粉2 g/L、氯化钠0.1 g/L、磷酸氢二钾0.04 g/L、磷酸二氢钾0.04 g/L、硫酸镁0.01 g/L、氯化钙0.01 g/L、碳酸氢钠2 g/L、半胱氨酸盐酸盐0.5 g/L、牛胆盐0.5 g/L、血红素0.05 g/L、VK3 0.01 g/L、吐温80 2 mL/L,糖添加量为0.5%[13],充分搅拌,于121 ℃高温灭菌20 min备用.
1.2.2 九种单糖的体外酵解
将人体肠道菌群样本用PBS溶液冲洗,四层纱布过滤,收集滤液离心,弃上清取沉淀,重复2~3次后,将分离所得人体粪便菌群样本与60%无菌甘油1∶1(v/v)混合保存在冻存管,于-80 ℃冰箱储存.
体外酵解前利用培养基将菌群样本于37 ℃活化培养24 h,并按10%接种量分别接种于以Rha、Fuc、Ara、Xyl、Man、Glc、Gal、GlcA及GalA为碳源的培养基中[14],以未加碳源组为空白对照.在37 ℃厌氧培养24 h后,于600 nm处测定OD值,离心分离上清液和菌体沉淀,分别冻存.
1.2.3 九种单糖体外酵解的理化性质测定
(1)酵解前后糖消耗量的测定
采用苯酚硫酸法检测总糖含量[15].称取葡萄糖标品10 mg,定容至100 mL,得浓度为0.1 mg/mL的标准品溶液.依次吸取0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL、1.0 mL,补水至2.0 mL,加80%(w/w)苯酚溶液50 μL,98%浓硫酸2.5 mL,充分振摇,室温放置20 min.于490 nm波长处测定吸光度.取50 μL酵解前后培养基上清液,重复上述操作,测定其吸光度,计算样品的总糖含量和总糖消耗量.
(2)短链脂肪酸的测定
采用气相色谱法测定短链脂肪酸及乳酸含量.短链脂肪酸衍生化:酵解后样品离心取上清液,加入硫酸,混匀,加入乙醚,混匀,离心吸取上层有机相,进行气相色谱分析.乳酸衍生化:酵解后样品离心取上清液,100 ℃水浴10 min,加入硫酸溶液并摇匀,加入甲醇,58 ℃水浴30 min,加入蒸馏水和二氯甲烷,混匀,离心吸取上层有机相,进行气相色谱分析[16].
气相色谱检测条件:使用岛津公司GC-2010 Pro气相色谱仪,AT-LZP-930色谱柱(50.0 m×0.32 mm×0.32 mm),火焰离子检测器.以5 ℃/min的速率从80 ℃升温至120 ℃,以60 ℃/min的速率从120 ℃升温至200 ℃,再以6 ℃/min的速率从215 ℃升温至240 ℃.载气:氮气流速:3.63 mL/min;线速:48.3 mL/min;进样体积:1 μL;分流比47.8∶1.进样口温度和检测器温度均为250 ℃.
1.2.4 九种单糖体外酵解后乳酸菌含量的测定
(1)引物设计
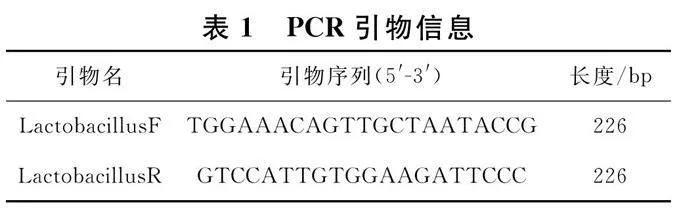
在NCBI上查找得到乳酸菌通用引物LactobacillusF_LactobacillusR,由上海生工公司合成.引物序列信息如表1所示.
(2)样品DNA的提取
向经不同单糖酵解收集所得的沉淀物内分别加入1 mL无菌水,混匀后即可得到供试菌株DNA样本.
(3)实时荧光定量PCR检测
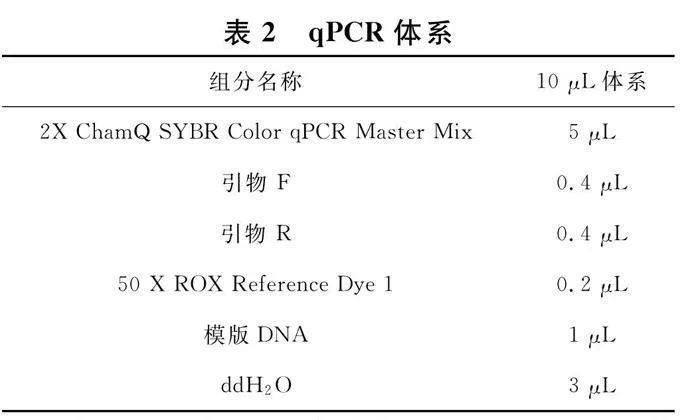
按照表2所示,在冰上配置反应液.
完成上述步骤后,将样本置于ABI 7300型荧光定量PCR仪中,以表3所示条件反应,通过标准曲线进行定量分析[17].
1.2.5 七种单糖体外酵解后单糖组成测定
根据上述研究,选择糖消耗量较高、短链脂肪酸和乳酸产量较高的七种单糖进行混合酵解培养,包括葡萄糖、甘露糖、阿拉伯糖、半乳糖、岩藻糖、木糖、鼠李糖.体外酵解方法同章节1.2.2.
采用GC测定样品的单糖组成,根据我们之前的方法进行样品的衍生化[18].在进行气相检测时,使用内标物肌醇和七种单糖标准品:Rha、Fuc、Ara、Xyl、Man、Glc、Gal进行相同衍生化处理.气相色谱检测条件:使用GC-2010 Pro气相色谱仪,Rtx-50色谱柱(30.0 m×0.25 mm×0.25 mm),火焰离子检测器(FID).具体如下:升温程序:以5 ℃/min的速率从80 ℃升温至120 ℃,以60 ℃/min的速率从120 ℃升温至200 ℃,再以6 ℃/min的速率从215 ℃升温至240 ℃,240 ℃保温半小时.载气:氢气;流速:0.88 mL/min;进样体积:0.5 μL;分流比19∶1.进样口温度和检测器温度分别为270 ℃和280 ℃.
1.2.6 七种单糖体外酵解后多样性分析
(1)细菌基因组DNA的提取
在0.1 g小鼠粪便(小鼠模型来自前人实验)中加入1 mL无菌双蒸水于1.5 mL的EP管中,浸泡10 min后充分振荡摇匀15 s,于100 ℃水浴10 min,冷却后10 000 r/min、离心10 min,取上清待用[19].
(2)16S rRNA基因高通量测序
在Illumina Miseq官方平台采用通用引物338F和806R对DNA样本进行PCR扩增,对16S rRNA 基因的V3-V4可变区进行高通量测序.获得的序列数据经过严格的质量控制和筛选,确保数据的准确性.对样本进行区分,执行操作分类单元(operational taxonomic unit,OTU)的聚类分析及物种的分类学鉴定.基于OTU的结果,采用Mothur(v.1.30.2)进行稀释曲线和Alpha多样性分析;采用R Core Team(v.3.3.1)进行样品的Beta多样性分析和物种组成分析[20],所有数据均在美吉云在线平台上进行分析.
1.3 数据分析
每组实验数据平行测定3次以上取平均值,实验结果用平均值±标准差(M±SD)的形式表示.使用SPSS Staistics 26.0处理数据,进行相关性和显著性检验,plt;0.05表示差异显著,使用Origin 9.8作图.
2 结果与讨论
2.1 九种单糖的体外酵解结果分析
通过测定各个单糖培养基酵解后的OD600值,可知肠道菌群体外酵解的生长情况[21],其结果如图1所示.半乳糖、甘露糖、葡萄糖、岩藻糖和阿拉伯糖的OD600值较高,说明其培养基中肠道菌群生长情况较好.而葡萄糖醛酸和半乳糖醛酸培养基中的OD600值较低,可能是由于酸性糖更不利于肠道菌群繁殖.
2.2 酵解前后糖消耗量的测定结果分析
测定九种单糖培养基酵解前后糖含量,结果如表4所示.肠道菌群在不同单糖培养基中进行厌氧培养,九种单糖的消耗量具有显著性差异(p<0.05).其中岩藻糖、阿拉伯糖、甘露糖、木糖和半乳糖的糖消耗量最高,分别为64.61±7.96%、60.50±6.43%、68.46±6.32%、66.19±8.43%和64.30±11.16%;葡萄糖醛酸和半乳糖醛酸的消耗量较低,分别为43.79±5.87%和37.47±11.14%.这表明肠道菌群更偏好利用中性单糖,对酸性单糖的利用程度较低.这与Onumpai等[22]的研究结果一致,中性糖比酸性糖更容易发酵.
2.3 短链脂肪酸的测定结果分析
采用气相色谱法测定培养基中乙酸、丙酸、丁酸和乳酸含量,其结果如表4所示.各组培养基中,短链脂肪酸含量具有显著性差异(p<0.05),乙酸、丙酸含量差异较小,鼠李糖和阿拉伯糖培养基的短链脂肪酸产量较高,而丁酸未有检出;乳酸产量差异较大,其中阿拉伯糖、甘露糖、葡萄糖和半乳糖培养基中的乳酸产量较高,分别为14.45±0.21 mmol/L、15.44±1.22 mmol/L、13.98±1.04 mmol/L以及13.46±0.25 mmol/L.
由结果可知,在各组培养基之间,乳酸产量变化比短链脂肪酸更大,可能是不同单糖对肠道乳酸菌的生长影响不同.在肠道菌群利用碳水化合物产生短链脂肪酸的过程中,乳酸可在乳酸脱羧酶的催化下进一步转化为乙酸,因而可促进乙酸的堆积[23].大量乳酸的堆积势必会导致乙酸含量的上升.而乙酸作为最主要的短链脂肪酸,可促进胆固醇和脂肪酸的合成,也可抑制促炎因子的产生,有利于宿主代谢调节[24].因此后续将研究肠道菌群中乳酸菌的变化,乳酸菌含量的增加有利于短链脂肪酸含量的增加.
2.4 酵解后乳酸菌含量的测定
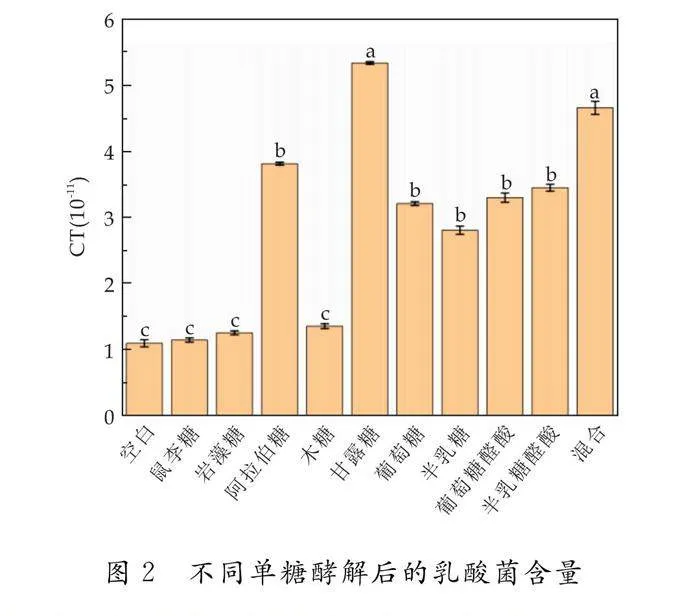
乳酸的大量堆积可能是由于肠道菌群中乳酸菌的大量繁殖,因此采用qPCR技术对酵解后菌体中的乳酸菌含量进行检测,以空白培养基和九种单糖及其混合培养基酵解后的菌体沉淀互为对照,结果如图2所示.阿拉伯糖、甘露糖、葡萄糖及半乳糖培养基酵解后的菌体沉淀中乳酸菌的含量较高.这表明六碳糖更容易被乳酸菌酵解利用.而葡萄糖醛酸和半乳糖醛酸培养基菌体沉淀中乳酸菌的含量较高,是由于乳酸菌可以在这两种酸性糖培养基中生长繁殖,但葡萄糖醛酸和半乳糖醛酸作为碳源不能促进有机酸的产生,即不能产生短链脂肪酸[25].研究发现,葡萄糖醛酸和半乳糖醛酸与多糖的益生元活性呈负相关,葡萄糖醛酸和半乳糖醛酸含量的增加不利于肠道菌群对多糖的酵解[26].
2.5 肠道菌群糖利用途径分析
通过KEGG分析并绘制在厌氧条件下的微生物利用糖途径,如图3所示.肠道菌群利用不同种单糖过程的差异可能受微生物所产生酶的多少、利用途径的长短影响,这种影响可能导致单糖在被肠道菌群消耗和利用时存在优先级顺序和竞争关系.
由图3可知,在葡萄糖、半乳糖和甘露糖这三种六碳糖中,葡萄糖的利用途经最短且所需酶种类更少,故推测葡萄糖被优先利用,其次是甘露糖和半乳糖;五碳糖中木糖和阿拉伯糖的利用途径较为类似,且利用途径中可相互转换,可能同时被利用,而岩藻糖利用途径中所需的酶种类多且存在稀少,利用途径更长,所以可能在最后被利用.综上所述,经推断七种中性单糖的利用顺序为葡萄糖gt;甘露糖gt;半乳糖gt;木糖和阿拉伯糖gt;鼠李糖gt;岩藻糖.
2.6 七种单糖体外酵解后单糖组成分析
基于上述研究,将七种中性单糖进行体外混合酵解培养,对不同时间段的培养基上清液进行单糖组成分析.经衍生化后,使用气相色谱法测定每种单糖的消耗情况,肌醇作为内参标记[27],结果如图4、图5所示.
葡萄糖在酵解的前3 h消耗完全;甘露糖在第6 h消耗完全;半乳糖在第12 h消耗完全;木糖、阿拉伯糖在第24 h消耗完全;鼠李糖在第48 h消耗完全;而在第72 h仍然能检测到岩藻糖.
由此可知,七种中性单糖在酵解过程中,首先消耗六碳糖,之后消耗五碳糖,而岩藻糖可能在酵解中较少被利用.这表明肠道菌群在体外酵解过程中,单糖是分别被消耗利用的,这种利用在先后关系上是具有选择性的.对于由不同单糖组成的多糖,显然也会受这种选择性的影响,产生被利用效率上的差异.推测七种中性单糖被肠道菌群利用的顺序依次为葡萄糖、甘露糖、半乳糖、木糖、阿拉伯糖、鼠李糖、岩藻糖.与Liu等[28]研究结果一致,在多糖的单糖组成中,益生菌优先利用多糖中的葡萄糖,其次是甘露糖、半乳糖和木糖等其他单糖.
2.7 七种单糖体外酵解微生物多样性分析
2.7.1 微生物多样性的Alpha多样性分析
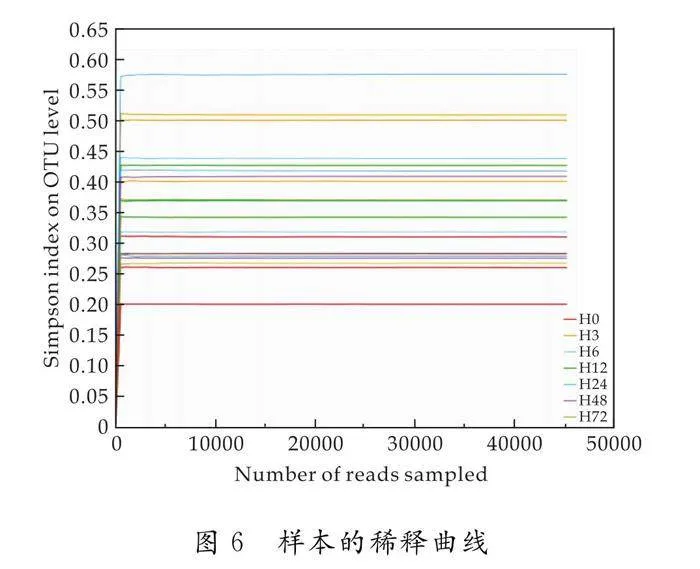
Alpha多样性常用来指示某个特定的区域或者生态系统内的物种或种群的物种丰度和多样性[29].对七种中性单糖体外发酵0 h(H0)、3 h(H3)、6 h(H6)、12 h(H12)、24 h(H24)、48 h(H48)、72 h(H72)的肠道菌群进行丰富度和多样性分析,需先通过样本的稀释曲线图来评估各个样本是否处于合适的测序深度.对各个样本在不同的测序深度下的OTU水平丰度分布进行随机抽样,绘制出稀释曲线,如图6所示.曲线趋向平坦,说明测序数据量渐进合理,本次测序量足够覆盖样本中的“所有”微生物,更多的数据量只会产生少量的OTU.而稀释曲线最终都趋于平缓,表明测序数据深度和样本量的科学可行.图中H3和H24的测序深度较高,说明其物种多样性较高.
进行Alpha多样性指数分析,比较不同样本之间的丰富度和多样性,结果如表5所示.随着时间的推移,肠道菌群的ACE值和Chao1指数趋近同一水平,从0 h开始直至24 h达到峰值,随后又开始下降.由Shannon指数和Simpson指数可知在整个酵解过程中,肠道菌群丰度经历了先升高再降低的过程,其峰值位于第24 h.这表明第24 h的群落多样性最高.检测同时采用the Good′s coverage衡量物种覆盖度,各个样本的coverage值均较高,故样本中各物种的测出率较高[30].综上所述,在肠道菌群体外酵解的第24 h时微生物的丰度和多样性最高,结果与稀释曲线所示一致.
2.7.2 微生物多样性的Beta多样性分析
Beta多样性分析主要用于从菌群丰度以及物种组成两个层面考察样本间的差异[31].研究七种中性单糖进行混合体外酵解过程中,不同时间段肠道菌群的差异性.样本层级聚类分析如图7所示,基于OTU的样本层级聚类树显示了各组样本的聚类情况,H0、H48、H72和H3、H6、H12、H24分开聚类.其中在酵解0~48 h内,肠道菌群主要利用除岩藻糖外的其余六种单糖,OTU组成比例发生变化,H3、H6、H12、H24被聚为一类.酵解48 h后,仅剩岩藻糖被肠道菌群利用,其余单糖均消耗完全,肠道菌群的丰度和多样性组成恢复至与H0时相近的状态,H0、H48、H72被聚为一类.
基于Bray-Curtis距离进行样本层级聚类分析并得到距离Heatmap图,如图8所示,表明不同时间样品在OTU水平上的微生物群落丰富度和多样性存在显著差异.综上所述,H3、H6、H12和H24的物种丰度和多样性相似,其中H24的物种丰度最高,而H48和H72与其他时间段物种丰度间的差异可能是因为肠道菌群酵解的单糖发生改变.
对各个样本在数据库中注释所得OTU水平的组成谱进行PCoA分析,研究不同时间体外酵解下肠道菌群的差异性.由图9(a)可知,主坐标分析中PC1和PC2贡献率分别为54.85%和13.02%,且H0、H48和H72的样本聚集在同一区域,说明三组样本的菌群结构较为相似;H3、H6、H12和H24的样本聚集在同一区域,说明这四组样本的菌群结构相似.基于Bray-Curtis距离样本层级聚类分析与PCoA主坐标分析结果一致,不同单糖被肠道菌群利用时具有显著差异性.为进一步反应各个样本距离矩阵的数值排列信息,进行OTU水平上的非度量多维尺度分析(Non-metric multidimensional scaling,NMDS),NMDS是保留对象间原始关系不变,将多维空间的研究对象简化到低维空间进行定位、分析和归类的数据分析方法[32],结果如图9(b)所示.
进一步验证了H0、H48和H72之间以及H3、H6、H12和H24之间菌群结构的相似性,并且各时间段的样本分离的较开,这反映了肠道菌群在利用不同单糖时具有差异性.其中stress<0.1,证明NMDS结果具有良好的代表性.
2.8 七种单糖体外酵解后物种组成分析
对不同时间段肠道菌群样本测序,绘制菌群物种分类组成和丰度分布柱状图,进一步对各个样本的群落结构组成及相对丰度研究,其具体物种分类组成和丰度分布如图10所示.肠道菌群的菌落结构随时间的推移在门水平上发生了变化,主要鉴定出3个优势菌门,包括厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria).其中Firmicutes在酵解的前24 h占据主导地位(H0:84.71%,H3;98.29%,H6:92.16%,H12:98.96%,H24:94.79%);而酵解的第48 h,Proteobacteria的占比有上升(H48:52.11%,H72:44.17%);在酵解的第24 h,Actinobacteria的丰度大幅增加.Firmicutes是主要的优势菌门,后续将主要对其从属水平进行研究.
如图11所示,肠道菌群在科水平上鉴定的主要优势菌科有乳酸杆菌科(Lactobacillaceae)、链球菌科(Streptococcaceae)、肠杆菌科(Enterobacteriaceae)、明串珠菌科(Leuconostocaceae)、肠球菌科(Enterococcaceae)以及动球菌科(Planococcaceae).不同时间段的微生物群落具有较大差异.在酵解前的H0,优势菌科分别为Lactobacillaceae:31.62%、Streptococcaceae:11.16%、Enterobacteriaceae:15.24%、Leuconostocaceae:30.30%、Enterococcaceae:11.61%;在酵解的24 h阶段,样本的微生物群落发生变化,在物种丰富度和多样性上有大幅提高,其优势菌科分别为Lactobacillaceae:5.20%、Streptococcaceae:59.93%、Enterobacteriaceae:3.73%、Leuconostocaceae:19.97%、Enterococcaceae:1.44%、Planococcaceae:5.27%、Bacillacea:1.01%以及Clostridiaceae:0.88%;在酵解的后期,样本的微生物丰富度降低,其优势菌科分别为Lactobacillaceae(H48:38.03%、H72:51.03%)、Streptococcaceae(H48:6.72%、H72:2.84%)、Enterobacteriaceae(H48:52.08%、H72:44.16%)、Leuconostocaceae(H48:3.00%、H72:1.08%).作为主要的优势菌科,乳酸杆菌产乳酸,并在调节机体免疫和维持肠道屏障功能方面发挥重要作用,是肠道中重要的有益菌[33],因此有必要研究Lactobacillaceae科下菌属在酵解中的变化.
如图12所示,在属水平上肠道菌群的优势菌属包括乳酸杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、克雷伯菌属(Klebsiella)、魏斯氏菌属(Weissella)、肠球菌属(Enterococcus)以及大肠杆菌志贺菌属(Escherichia-Shigella),不同酵解时间的微生物群落具有较大差异.作为可以调节人体免疫的有益菌,Lactobacillus的丰度在酵解过程中经历了升高、降低、再升高的过程(H0:31.62%、H24:5.20%、H48:38.03%、H72:51.03%),在酵解24 h丰度降低到最低.根据之前对单糖组成的研究,推测Lactobacillus的丰度变化可能是不同时间利用的单糖不同所致.在酵解0~3 h中,主要利用的是葡萄糖,Lactobacillus的丰度有所下降.在酵解3~6 h中,主要利用的是甘露糖,Lactobacillus的丰度大幅增加.在酵解6~12 h中,主要利用的是半乳糖,Lactobacillus的丰度有所下降,但仍比酵解0 h时高.在酵解12~24 h中,主要利用的是木糖和阿拉伯糖,Lactobacillus的丰度大幅降低,降至酵解最低丰度.在酵解24~48 h中,主要利用的是鼠李糖,Lactobacillus的丰度大幅增加.在酵解48~72 h中,Lactobacillus的丰度有所增加,这可能是利用了少量的岩藻糖.综上所述,甘露糖、半乳糖和鼠李糖有利于Lactobacillus的生长繁殖,葡萄糖、木糖和阿拉伯糖会抑制Lactobacillus的丰度增加,而岩藻糖虽然只有少量被利用,但仍然导致了Lactobacillus的丰度增加,推测可能是岩藻糖被Lactobacillus的利用效率更高.Wang等[34]证实,由半乳糖和葡萄糖等中性糖组成的油菜籽多糖显著(plt;0.05)促进了乳酸杆菌等益生菌的生长.
Lactococcus是潜在的益生菌,有助于防止代谢紊乱[35].其丰度在酵解过程中变化较大(H0:11.16%、H24:59.92%、H48:6.72%、H72:2.84%),其丰度在24 h最高,可能是木糖和阿拉伯糖有利于Lactococcus繁殖.部分Weissella菌株作为潜在的有益菌受到越来越多的关注,它们在控制牙周病方面具有很高的潜力[36].其丰度在酵解过程中变化较大(H0:30.30%、H24:19.97%、H48:3.01%、H72:1.88%),其丰度在12 h和24 h较高,可能是半乳糖、木糖和阿拉伯糖有利于Weissella繁殖.Patel等[37]发现,木寡糖提高了Weissella的乳酸和乙酸产量,表明其具有较好的益生潜力.
由此可见,多糖的单糖组成可能会影响多糖被肠道菌群利用的方式和程度,这可能对肠道菌群的组成及代谢物的产生具有一定的影响.
3 结论
本研究利用九种单糖对肠道菌群进行体外酵解培养,探讨了单糖对肠道菌群多样性和丰度的影响.发现阿拉伯糖和甘露糖有利于总肠道菌群丰度的增加和总代谢产物的产生.对七种中性单糖体外酵解的培养基上清液进行单糖组成测定,发现肠道菌群对单糖的利用存在先后顺序,依次为葡萄糖、甘露糖、半乳糖、木糖、阿拉伯糖、鼠李糖、岩藻糖.对肠道菌群进行微生物多样性分析,其中甘露糖、半乳糖、鼠李糖和岩藻糖有利于Lactobacillus的生长繁殖,葡萄糖、木糖和阿拉伯糖会抑制Lactobacillus的丰度增加.而木糖和阿拉伯糖有利于Lactococcus繁殖.半乳糖、木糖和阿拉伯糖有利于Weissella繁殖.这为后续研究多糖结构对肠道菌群的调节作用提供了理论支撑.
参考文献
[1] Sun Y J,Cui X Y,Duan M M,et al.In vitro fermentation of κ-carrageenan oligosaccharides by human gut microbiota and its inflammatory effect on HT29 cells[J].Journal of Functional Foods,2019,59:80-91.
[2] Wang Z,Zhou X,Sheng L,et al.Effect of ultrasonic degradation on the structural feature,physicochemical property and bioactivity of plant and microbial polysaccharides:A review[J].International Journal of Biological Macromolecules,2023,236(11):123 924.
[3] Yi J,Li X,Wang S,et al.Steam explosion pretreatment of Achyranthis bidentatae radix:Modified polysaccharide and its antioxidant activities[J].Food Chemistry,2022,375(2):131 746.
[4] Lo T C T,Chang C A,Chiu K H,et al.Correlation evaluation of antioxidant properties on the monosaccharide components and glycosyl linkages of polysaccharide with different measuring methods[J].Carbohydrate Polymers,2011,86(1):320-327.
[5] Chen X,Ni L,Fu X,et al.Molecular mechanism of anti-inflammatory activities of a novel sulfated galactofucan from Saccharina japonica[J].Marine Drugs,2021,19(8):430.
[6] Gong G,Dang T,Deng Y,et al.Physicochemical properties and biological activities of polysaccharides from Lycium barbarum prepared by fractional precipitation[J].International Journal of Biological Macromolecules,2018,109:611-618.
[7] Lee S G,Kaya A,Avanesova S,et al.Age-associated molecular changes are deleterious and may modulate life span through diet[J].Science Advances,2017,3(2):e1 601 833.
[8] Tan H Z,Nie S P.Functional hydrocolloids,gut microbiota and health:Picking food additives for personalized nutrition\.FEMS Microbiology Reviews,2021,45(4):1-18.
[9] Chen Q,Fan J,Lin L,et al.Combination of Lycium barbarum L.and Laminaria japonica polysaccharides as a highly efficient prebiotic:Optimal screening and complementary regulation of gut probiotics and their metabolites[J].International Journal of Biological Macromolecules,2023,246:125 534.
[10] Zhang D,Liu J,Cheng H,et al.Interactions between polysaccharides and gut microbiota:A metabolomic and microbial review[J].Food Research International,2022,160:111 653.
[11] Yu C,Ahmadi S,Shen S,et al.Structure and fermentation characteristics of five polysaccharides sequentially extracted from sugar beet pulp by different methods[J].Food Hydrocolloids,2022,126:107 462.
[12] Huang F,Liu H J,Zhang R F,et al.Physicochemical properties and prebiotic activities of polysaccharides from longan pulp based on different extraction techniques[J].Carbohydrate Polymers,2019,206:344-351.
[13] Ramnani P,Chitarrari R,Tuohy K.In vitro fermentation and prebiotic potential of novel low molecular weight polysaccharides derived from agar and alginate seaweeds[J].Anaerobe,2012,18(1):1-6.
[14] 龚 雯,唐 婕,韦雅渊,等.金花茶多糖的体外消化及酵解特性研究[J].食品工业科技,2021,42(24):31-39.
[15] 唐婷范,李雪松,卢梦影,等.陈皮多糖提取工艺及其抗氧化活性研究[J].中国调味品,2024,49(5):183-187,204.
[16] Sun Y J,Liu Y,Ai C Q,et al.Caulerpa lentillifera polysaccharides enhance the immunostimulatory activity in immunosuppressed mice in correlation with modulating gut microbiota[J].Food and Function,2019,10(7):4 315-4 329.
[17] 俞 漪,顾晨荣,张娜娜,等.定量PCR技术检测杀菌型产品中乳酸菌[J].食品安全质量检测学报,2020,11(13):4 507-4 513.
[18] 孙玉姣.硫酸化寡糖与多糖的质谱分析研究[D].西安:西北大学,2016.
[19] 张 杰,张晓鹏,李鹏高,等.小鼠粪便细菌基因组DNA提取方法比较[J].实验技术与管理,2017,34(12):50-53,57.
[20] Chi T Y,Zhao Q C,Wang P L,et al.Fecal 16S rRNA gene sequencing analysis of changes in the gutMicrobiota of rats with low-dose aspirin-relatedIntestinal injury[J].BioMed Research International,2021,2021(1):1-15.
[21] 侯恒威,陈 冲,欧阳辉,等.粉葛多糖促植物乳杆菌P9生长代谢及发酵液抗氧化活性研究[J].食品安全质量检测学报,2023,14(13):221-228.
[22] Onumpai C,Kolida S,Bonnin E,et al.Microbial utilization and selectivity of pectin fractions with various structures[J].Applied and Environmental Microbiology,2011,77(16):5 747-5 754.
[23] Xu T,Wu X Y,Liu J,et al.The regulatory roles of dietary fibers on host health via gut microbiota-derived short chain fatty acids[J].Current Opinion in Pharmacology,2022,62:36-42.
[24] 陆松翠,郑 楠,王加启,等.短链脂肪酸的生物学功能研究进展[J].动物营养学报,2024,36(6):3 514-3 524.
[25] 欧阳忠华.基于质谱技术探讨血浆中糖醛酸途径代谢产物与肺动脉高压的相关性[D].长沙:中南大学,2022.
[26] Yu C X,Ahmadi S,Shen S H,et al.Structure and fermentation characteristics of five polysaccharides sequentially extracted from sugar beet pulp by different methods[J].Food Hydrocolloids,2022,126:107 462.
[27] 谭 亮,杨 洋,张 琦,等.柱前衍生化GC法测定旱芹非淀粉多糖中各单糖组分含量[J].沈阳药科大学学报,2011,28(1):40-46.
[28] Liu T T,Zhao M,Zhang Y M,et al.Integrated microbiota and metabolite profiling analysis of prebiotic characteristics of Phellinus linteus polysaccharide in vitro fermentation[J].International Journal of Biological Macromolecules,2023,242:124 854.
[29] 户行宇,赖田甜,刘同吉,等.低聚半乳糖植物乳杆菌发酵乳的代谢组学分析及其肠道菌群调节活性研究[J].中国乳品工业,2023,51(12):4-10,35.
[30] 马 涛,纪 鹏,魏彦明,等.基于16Sr DNA高通量测序技术研究金银花和黄芩及其配伍对急性肺炎小鼠肠道菌群的影响\.动物医学进展,2024,45(8):45-52.
[31] 付连港,刘伊笑,赵 剑,等.槲皮万寿菊素对断奶仔猪生长性能、抗氧化能力、免疫功能和盲肠菌群的影响[J].动物营养学报,2024,36(1):199-209.
[32] 李世杰,张金辉,王英民,等.不同性别湖羊早期定植肠道菌群分析[J].河南农业大学学报,2024,58(2):249-258.
[33] Salazar N,Gueimonde M,Clara G D L R,et al.Exopolysaccharides produced by lactic acid bacteria and bifidobacteria as fermentable substrates by the intestinal microbiota[J].Critical Reviews in Food Science and Nutrition,2016,56(9):1 440-1 453.
[34] Wang X,Huang M Y,Yang F,et al.Rapeseed polysaccharides as prebiotics ongrowth and acidifying activity of probiotics in vitro[J].Carbohydrate Polymers,2015,125:232-240.
[35] Burakova I,Smirnova Y,Gryaznova M,et al.The effect of short-term consumption of lactic acid bacteria on the gut microbiota in obese people[J].Nutrients,2022,14(16):3 384.
[36] Fusco V,Quero G M,Cho G,et al.The genus Weissella:Taxonomy,ecology and biotechnological potential[J].Frontiers in Microbiology,2015,6:155.
[37] Patel A,Falck P,Shah N,et al.Evidence for xylooligosaccharide utilization in Weissella strains isolated from Indian fermented foods and vegetables[J].FEMS Microbiology Letters,2013,346(1):20-28.
【责任编辑:陈 佳】
