微塑料与氯氰菊酯农药复合污染对上海青生长的影响
2025-01-25花莉王美婷赵丹洋






摘 要:针对微塑料与农药复合污染问题,以上海青(Brassica chinensis L)为供试植物,研究传统微塑料聚乙烯(PE MPs)和可降解微塑料聚乳酸(PLA MPs)单独存在及与氯氰菊酯农药复合作用对植物生长影响的差异.结果显示,PE MPs处理组对上海青生长表现出“低促高抑”的规律.而低添加量PLA MPs处理就会对上海青生长产生抑制作用,且抑制效应随微塑料添加量增加而增加.相比微塑料单独污染,氯氰菊酯农药联合作用对上海青生长的抑制作用影响更显著.PLA MPs对上海青的胁迫作用大于PE MPs,需要对可降解微塑料的环境行为开展进一步评估.
关键词:微塑料; 氯氰菊酯农药; 复合污染; 生物量; 生理生化指标
中图分类号:X53
文献标志码: A
Effects of combined pollution of microplastics and cypermethrinpesticide on the growth of Chinese cabbage
HUA Li1*, WANG Mei-ting1, ZHAO Dan-yang2
(1.School of Environmental Science and Engineering,Shaanxi University of Science amp; Technology, Xi′an 710021, China;" 2.Shaanxi Nuozen Biological Technology Co., Ltd., Weinan 715500, China)
Abstract:In response to the problem of combined pollution of microplastics and pesticides,Chinese cabbage (Brassica chinensis L) was used as the test plant to study the differences in the effects of traditional microplastic polyethylene (PE MPs) and biodegradable microplastic polylactic acid (PLA MPs) alone and combination with cypermethrin pesticide on plant growth.The results showed that the PE MPs treatment group exhibited a pattern of \"low promotion and high inhibition\" towards Chinese cabbage.In contrast,the treatment of PLA MPs at low additive levels then inhibited the growth of Chinese cabbage and the inhibitory effect increased with the increase of microplastic concentration.Compared to microplastic alone,the combined effect of cypermethrin pesticides has a greater negative impact on Chinese cabbage.The inhibitory effect of PLA MPs on Chinese cabbage is greater than that of PE MPs,and further evaluation of the environmental behavior of biodegradable microplastics is needed.
Key words:microplastics; cypermethrin pesticide; complex contamination; biomass; physiological and biochemical indexes
0 引言
我国是农业大国,大量的塑料薄膜被用于农业生产领域.塑料薄膜在农业耕作后难以回收,经过物理磨损、光降解、氧化降解和生物降解等过程会分解成更小的颗粒(<5mm),被称为微塑料[1].微塑料会对土壤造成损害,从而影响作物的质量.可降解地膜替代传统地膜成为防控微塑料污染的重要途径,而全面提升其生态影响认知,成为可降解地膜有效推广和监管政策提出的必要前提.国家《“十四五”塑料污染治理行动方案》要求开展不同类型可降解塑料降解机理及影响研究,科学评估其环境安全性和可控性.
此外,微塑料很可能会吸附和传递其他污染物质,形成复合污染物,进而造成更严重的危害[2,3].例如,微塑料可能会吸附农田中施用的农药,从而改变两者的环境行为[4].目前的研究主要集中在微塑料与重金属或与抗生素等的复合污染,而对于微塑料与农药的复合污染以及它们在复杂土壤系统中共迁移的研究十分有限.氯氰菊酯农药因其高效、低毒、杀虫谱广等优点得以广泛应用.该农药具有累积毒性,长期使用会对人类和环境造成严重危害.因此,探究微塑料与氯氰菊酯农药复合污染对植物生长和品质的影响具有重要的现实意义.本文选取典型农作物上海青作为供试植物,探究传统微塑料和可生物降解微塑料在与农药复合污染条件下的环境行为以及上海青的响应机制.
1 实验部分
1.1 实验材料与试剂
本次实验选用的植物为上海青(Brassica chinensis L),上海青种子购自北京华耐农业发展有限公司.播种前用3% H2O2浸泡5 min进行消毒处理,风干后以备后续播种.PE和PLA微塑料购自广源塑化有限公司,粒径为50~500 μm;PE微塑料密度为0.941~0.960 g/cm3,PLA微塑料密度为1.25~1.28 g/cm3.微塑料使用前用75%乙醇预处理,自然干燥.氯氰菊酯农药购置于阿拉丁试剂(上海)有限公司.
1.2 模拟污染土壤配制
称取10 g的聚乙烯微塑料(Polyethylene Microplastic,PE MPs)缓慢加入990 g土壤中,不断搅拌直至混合均匀,记为PE1;称取20 g的PE MPs缓慢加入980 g土壤中,不断搅拌直至混合均匀,记为PE2.采用同样的方法分别制备PE3、PE5、PLA1、PLA2、PLA3和PLA5.不含PE MPs的土壤对照组记为CK,不含PLA MPs的土壤对照组记为CK′,未添加氯氰菊酯农药的土壤对照组记为C1′.CK和CK′为不同批次的盆栽试验.PE2C1为2% PE MPs与500 mg/ kg氯氰菊酯农药混合添加到土壤中.采用同样的方法分别制备PE5C1、PLA2C1、PLA5C1.每个处理设置4个重复实验.
1.3 盆栽实验
将处理后的盆栽置于植物培养室(白天25 ℃、晚上21 ℃、湿度60%、光照16 h、黑暗8 h)进行培养,土壤水分保持在最大田间容量的60%.上海青发芽生长至10 d时,按农田施用量喷洒氯氰菊酯农药.
供试土壤为种植蔬菜专用营养土(含水率约为30%),土壤理化性质如下:pH=6.7、有机质含量为50.14 g/kg、总氮4.9 g/kg、硝态氮55.33 mg/kg、铵态氮51.30 mg/kg.该土壤中未见微塑料未添加氯氰菊酯农药.土壤过10目筛网去除植物残留物和石头混合均匀备用.
1.4 上海青生长参数的测定
生物量测定:上海青出苗后第30 d进行取样,105 ℃杀青30 min,80 ℃烘至恒重,再于分析天平测其地上部分及根部干重.
叶绿素含量按照Qi等[5]的方法测定.MDA含量用硫代巴比妥酸法测定[6].CAT活性采用紫外吸收法测定.POD活性测定采用愈创木酚法.SOD活性采用氮蓝四唑法测定[7].可溶性糖的含量测定采用蒽酮法.可溶性蛋白质含量测定采用考马斯亮蓝染色法[8].
1.5 老化前后微塑料形态分析
土壤填埋老化实验:称取配置好的不同污染土壤1 000 g于盆栽中,设置PE MPs、PLA MPs、PE5C1、PLA5C1共4个处理.将处理后的盆栽置于植物培养室(条件同1.3节)进行培养.用不锈钢勺子充分搅拌、混合均匀,使得微塑料与外部环境之间可以充分进行物质交换.在微塑料加入第42天采集土壤样品.
微塑料样品处理方法:先使用筛分法,将风干的土壤样品通过1或5 mm的网筛使微塑料颗粒按不同粒径分离,达到初步筛分的目的.后采用密度浮选法,利用微塑料与土壤样品的密度差异并结合搅拌、离心等使微塑料与土壤介质分离.分离后用去离子水反复清洗,去除表面黏附土壤等杂质,直至清水不再浑浊,将清洗干净的微塑料烘干备用.老化前后微塑料形态分析:使用扫描电子显微镜(SEM)(Zeiss-Merlin-Compact,德国 ZEISS)观测微塑料表面形态特征.
1.6 数据统计与分析
实验数据结果以(平均值±标准偏差)来表示,并采用SPSS 26.0软件对数据进行显著性差异分析,图形绘制均采用origin2023b软件完成.
2 结果与讨论
2.1 微塑料和氯氰菊酯农药对上海青生物量的影响
上海青生物量的变化如表1所示.PE2处理组地上部分鲜重和干重较CK组相比,分别增加了28.13%和82.81%.而PE5处理下根部鲜重和干重差异显著,分别减少了38.45%和43.36%.PE2C1处理组上海青地上部分和根部增加明显,分别增加了84.50%和30.81%.而在PE5C1处理组,上海青地上部分和根部显著减少.PE MPs单独处理时,各处理组呈现出“低促高抑”的规律[9-11].这可能是因为低添加量(2%)的微塑料可以改善土壤结构、含水量和土壤养分有效性[12].而高添加量(5%)微塑料可能聚集附着在上海青根部的表层,堵塞根部毛孔[13],从而影响上海青根部对水分的吸收,甚至抑制根的形成,最终导致上海青生物量的减少.而PLA MPs处理组中,对植物生物量的抑制效应随微塑料添加量增加而增加.
两种微塑料高添加量下与氯氰菊酯农药复合处理时,上海青地上部分和根部生长量明显减少.这说明与微塑料单独处理相比,复合污染对植物的毒性效应更强.当微塑料与环境中的其他污染物共存时,微塑料可以作为污染物的载体,改变其生物利用度,从而改变污染物的毒性[14].研究表明,复合污染处理下上海青生物量的减少可能是因为微塑料的添加导致土壤中农药的富集程度增加,从而加剧对植物生长的抑制效应.
2.2 微塑料和氯氰菊酯农药对上海青叶片中叶绿素含量的影响
叶绿素含量是表征植物生长状态的重要指标.在不利条件下植物会降低自身叶绿素含量,减少叶绿体的数目或者破坏叶绿体的结构[15].
PE MPs处理组对上海青叶片叶绿素含量的影响如图1(a)所示,叶绿素含量呈现先增后减的趋势.这表明低添加量(2%)PE MPs促进了上海青叶片中叶绿素含量的增加,而高添加量(5%)PE MPs抑制了上海青叶片中叶绿素的生成,且相同添加量下,相比PE MPs单独处理,PE MPs与氯氰菊酯农药的复合处理对上海青的抑制作用更大.
PLA MPs处理组对上海青叶片叶绿素含量的影响如图1(b)所示.随着PLA添加量的增加,三种叶绿素含量均呈现下降的趋势.添加量为5%时,叶绿素含量最低.这可能是由于PLA MPs会影响氮转化过程并降低植物根系氮含量.从而导致叶绿素含量降低,光合效率降低[16,17].
2.3 微塑料和氯氰菊酯农药对上海青根部MDA含量影响
MDA是脂质过氧化的产物,能体现出机体脂质过氧化的速度和程度,从而间接表明机体过氧化损伤程度.植物体内MDA浓度越高,表明植物受损越严重.因此,植物组织中的MDA含量可以作为检验植物受胁迫程度的重要生理指标.
如图2所示,PE MPs和PLA MPs单独处理时,上海青根部MDA含量随微塑料添加量增加而增加.说明高添加量(5%)的微塑料会导致上海青地上部分及根部细胞膜的氧化损伤[18].而低添加量(2%)微塑料导致的氧化损害作用,会通过植物自身抗氧化系统进行调节而得到缓解.
PE MPs和PLA MPs与氯氰菊酯农药复合处理时,PE5C1处理组与CK组相比MDA增加了75.84%.PLA5C1处理下,MDA含量最高,与CK′组相比增加了91.84%,这说明微塑料与氯氰菊酯农药对上海青的氧化胁迫表现出协同作用.可能是因为微塑料吸附氯氰菊酯农药进入到上海青植株内,使得微塑料和农药在上海青体内的大量积累,破坏了细胞膜结构,导致活性氧含量增加从而加重了上海青的氧化损伤.
2.4 微塑料和氯氰菊酯农药对上海青CAT、POD及SOD的影响
CAT、POD和SOD是植物抗氧化保护系统中的关键酶,三者共同协作维持着植物体内自由基的平衡,以避免由自由基过量而引起的植物生理和生化过程的变化,其活性水平能够反映植物受外界逆境影响的程度[19].
PE MPs处理组上海青叶片中CAT、POD和SOD的活性如图3(a)~(c)所示.PE MPs单独处理或与氯氰菊酯农药复合处理时,随着微塑料添加量的增加,上海青叶片中的CAT、POD和SOD活性均呈现先升高后降低的趋势.在PE2C1处理下,CAT、POD活性均达到最大,与CK相比,分别增加了70.40%和53.29%,SOD活性与CK组比差异不显著;PE5C1处理时,CAT、POD、SOD活性皆达到最低,与 CK相比分别降低了51.44%、23.23%、44.49%.
PLA MPs处理组上海青叶片CAT、POD和SOD的活性如图3(d)~(f)所示.
随着微塑料添加量的增加,上海青的CAT、SOD和POD活性均呈下降趋势.在本研究中,相同添加量下的PLA MPs对上海青叶片中CAT、POD和SOD活性的影响大于PE MPs.为了对抗氧化损伤,植物有一个由抗氧化酶组成的防御系统[20].在PE MPs处理组中,抗氧化酶活性随着PE MPs添加量的先增后减,这表明低添加量下植物会产生抗氧化酶来清除ROS并抵消PE MPs的有害作用,但随着微塑料添加量的增加,抗氧化酶活性降低,植物抗氧化防御能力逐渐减弱.而在PLA MPs处理下,抗氧化酶活性随微塑料添加量增加而降低.这表明,PLA MPs单独使用及与氯氰菊酯农药复合作用下会直接损伤上海青体内的防御系统,导致抗氧化酶活性降低.因此,PLA MPs对上海青的胁迫效应大于PE MPs.
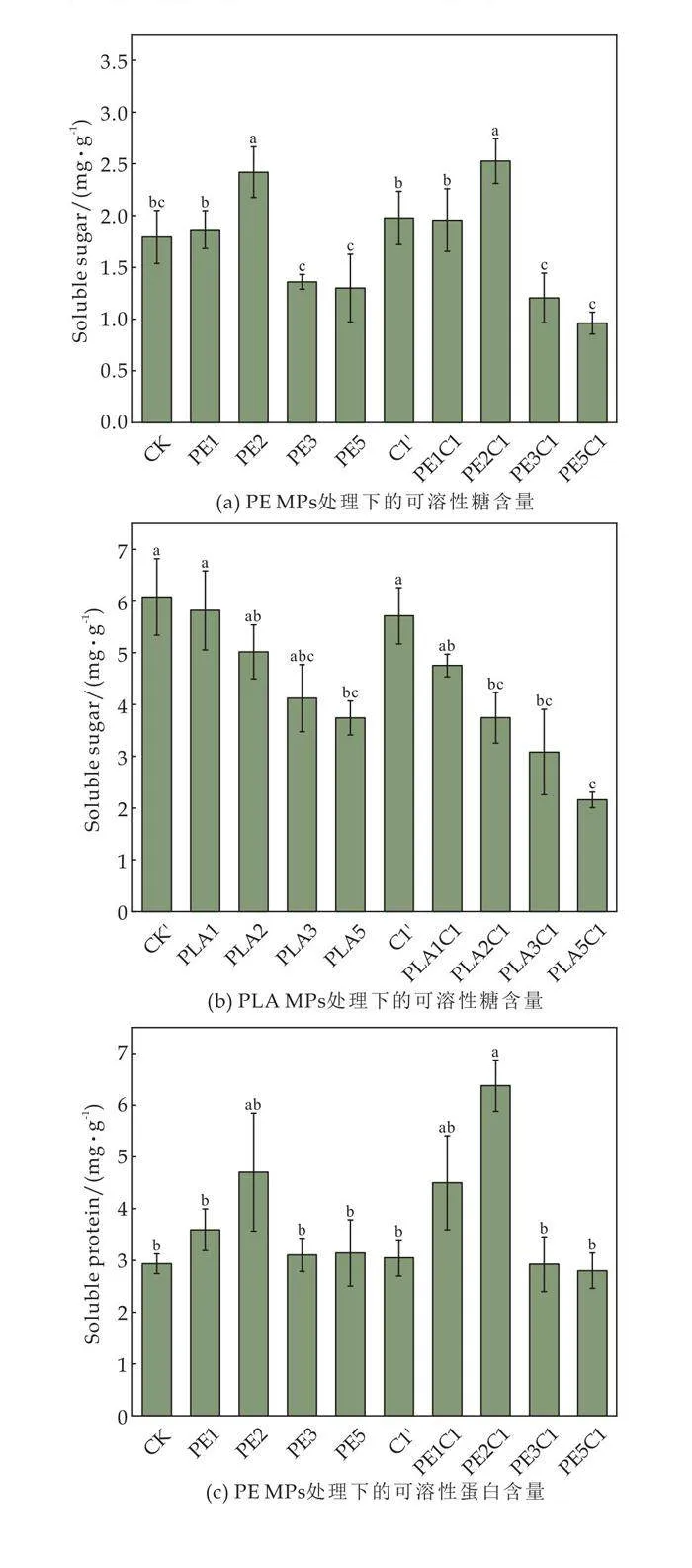
2.5 微塑料和氯氰菊酯农药对可溶性糖和可溶性蛋白的影响
可溶性糖是植物体内重要的营养物质,可以反映出植物光合碳的合成和运输过程.可溶性蛋白能够协助植物细胞平衡渗透压,保护细胞的生命物质和生物膜,从而降低非生物因素对细胞的潜在伤害[19].当受到外界污染物的胁迫时,植物细胞中某些合成蛋白质的基因可能会受阻,从而影响可溶性蛋白质的合成,使其含量降低.可溶性蛋白含量的增加可以增强植物细胞的保水能力,保护植物降低伤害[20].
PE MPs处理组上海青叶片中可溶性糖含量如图4(a)所示.在PE2处理下,上海青叶片中可溶性糖含量比CK组提高了32.29%.在PE5处理下,上海青叶片中可溶性糖含量降低了23.21%.PE2C1处理时,可溶性糖含量最高;PE5C1处理下可溶性糖含量最低.PLA MPs与氯氰菊酯农药处理对上海青叶片可溶性糖含量的影响如图4(b)所示.在PLA5处理下,上海青叶片可溶性糖含量较CK降低了35.56%.PLA5C1处理使上海青叶片可溶性糖含量降到最低,与CK相比降低了59.59%.
如图4(c)所示,与CK相比,PE2处理下的上海青叶片可溶性蛋白含量提高了51.48%,而PE5处理则降低了6.02%.与CK组相比,PE2C1处理的可溶性蛋白含量提高了85.63%,而PE5C1处理的可溶性蛋白含量降低了3.92%.如图4(d)所示,在PLA MPs和氯氰菊酯农药处理下,上海青叶片中可溶性蛋白含量随着PLA MPs添加量的增加而降低.
当受到微塑料胁迫时,作物会保持“内部稳定”的平衡,并产生更多的可溶性糖和可溶性蛋白质来抵御外部胁迫[21].这也解释了PE MPs低添加量(2%)下可溶性蛋白和可溶性糖的增加.随着微塑料添加量的增加,作物的调控系统无法满足内部稳定,从而影响作物正常的代谢活动[22],抑制植物茎部和根部可溶性蛋白的合成和积累[23].同时也影响了作物对可溶性糖的吸收和利用,导致可溶性糖含量降低[24].这也是在PLA MPs作用下可溶性蛋白和可溶性糖呈下降趋势的原因.这也反映出PLA MPs在降解过程中对植物的胁迫大于传统的PE MPs,微塑料与氯氰菊酯农药联合作用对上海青的胁迫作用大于微塑料单独作用.
2.6 PE MPs与PLA MPs老化前后形貌对比
PE MPs与PLA MPs老化前后的形貌对比如图5所示,微塑料老化42 d后,PE MPs表面出现明显的裂痕,形成粗糙且不规则的表面.
PLA MPs表面变得凹凸不平,孔隙结构增多,比表面积增大.当PE MPs和PLA MPs与氯氰菊酯农药复合处理时,PE5C1处理下的微塑料表面撕裂更加严重,PLA5C1处理下的微塑料孔隙结构增多,表面更加粗糙.由此可以推测氯氰菊酯农药的添加可能促进了微塑料的降解过程.已有研究证实,可生物降解的微塑料会产生一种挥发性化合物十二烷醛[25].该挥发性化合物可以通过调节植物激素稳态、代谢、养分获取、植物耐受性和植物与微生物的相互作用来促进或抑制植物生长[26,27].这可能是相同添加量微塑料处理下,PLA MPs对上海青生长的抑制作用大于PE MPs的原因.
3 结论
(1)微塑料与氯氰菊酯农药复合作用时对上海青的抑制效果大于微塑料单独污染.PLA MPs和PE MPs与氯氰菊酯农药复合处理后,上海青叶片中叶绿素含量、抗氧化酶活性、可溶性糖和可溶性蛋白含量均显著降低.高添加量(5%)微塑料与氯氰菊酯农药复合处理对上海青的负面影响大于与低添加量(2%)微塑料复合处理.
(2)在PE MPs处理组,随着PE MPs添加量的增加,PE MPs对上海青表现出“低促高抑”的规律.在PLA MPs处理组,PLA MPs对上海青的抑制作用随着PLA MPs添加量的增加而增强.在相同添加量下,可生物降解的PLA MPs对上海青的抑制效应大于传统PE MPs.因此,可降解微塑料生态环境风险的不确定性需要开展更深入的研究.
参考文献
[1] Da Costa I, Costa L, Zalmon I.Are fishes selecting the trash they eat:Influence of feeding mode and habitat on microplastic uptake in an artificial reef complex (ARC)[J].Science of the Total Environment,2023,904:166 788.
[2] Tang G W, Liu M Y, Zhou Q,et al.Microplastics and polycyclic aromatic hydrocarbons (PAHs) in Xiamen coastal areas:Implications for anthropogenic impacts[J].Science of the Total Environment,2018,634:811-820.
[3] Llorca M,Schirinzi G,Martínez M,et al.Adsorption of perfluoroalkyl substances on microplastics under environmental conditions[J].Environmental Pollution,2018,235:680-691.
[4] Fang S,Yu W S,Li C L,et al.Adsorption behavior of three triazole fungicides on polystyrene microplastics[J].Science of the Total Environment,2019,691:1 119-1 126.
[5] Qi Y L,Yang X M,Pelaez A M,et al.Macro and micro-plastics in soil-plant system:Effects of plastic mulch film residues on wheat (Triticum aestivum) growth[J].Science of the Total Environment,2018,645:1 048-1 056.
[6] Tang L L,Cai H,Ji W,et al.Overexpression of GsZFP1 enhances salt and drought tolerance in transgenic alfalfa (Medicago sativa L.)[J].Plant Physiology and Biochemistry,2013,71:22-30.
[7] 廉宇航,刘维涛,史瑞滢,等.聚乙烯和聚乳酸微塑料对大豆生长和生理生化及代谢的影响[J].中国环境科学,2022,42(6):2 894-2 903.
[8] Wilgenburg M,Werkman E,Gorkom W,et al.Criticism of the use of coomassie brilliant blue G-250 for the quantitative determination of proteins[J].Clinical Chemistry and Laboratory Medicine,1981,19(5):301-304.
[9] Liu Y H,Xiao M L,Shahbaz M,et al.Microplastics in soil can increase nutrient uptake bywheat[J].Journal of Hazardous Materials,2022,438:129 547.
[10] Jiang X F,Chen H,Liao Y C,et al.Ecotoxicity and genotoxicity of polystyrene microplastics on higher plant Vicia faba[J].Environmental Pollution,2019,250:831-838.
[11] Liu S Q,Wang J W,Zhu J H,et al.The joint toxicity of polyethylene microplastic and phenanthrene to wheat seedlings[J].Chemosphere,2021,282:130 967.
[12] De Souza Machado A,Lau C,Till J,et al.Impacts of microplastics on the soil biophysical environment[J].Environmental Science amp; Technology,52(17):9 656-9 665.
[13] Bosker T,Bouwman L,Brun N,et al.Microplastics accumulate on pores in seed capsule and delay germination and root growth of the terrestrial vascular plant Lepidium sativum[J].Chemosphere,2019,226:774-781.
[14] Sun W,Meng Z Y,Li R S,et al.Joint effects of microplastic and dufulin on bioaccumulation,oxidative stress and metabolic profile of the earthworm (Eisenia fetida)[J].Chemosphere,2021,263:128 171.
[15] Alaghabary K,Zhu Z,Shi Q.Influence of silicon supply on chlorophyll content,chlorophyll fluorescence,and antioxidative enzyme activities in tomato plants under salt stress[J].Journal of Plant Nutrition,2005,27(12):2 101-2 115.
[16] Xu S,Zhao R,Sun J,et al.Microplastics change soil properties,plant performance,and bacterial communities in salt-affected soils[J].Journal of Hazardous Materials,2024,471:134 333.
[17] Mu X H,Chen Y L.The physiological response of photosynthesis to nitrogen deficiency[J].Plant Physiology and Biochemistry,2021,158:76-82.
[18] Abbasi S,Moore F,Keshavarzi B.PET-microplastics as a vector for polycyclic aromatic hydrocarbons in a simulated plant rhizosphere zone[J].Environmental Technology amp; Innovation,2021,21:101 370.
[19] Najeeb U,Jilani G,Ali S,et al.Insights into cadmium induced physiological and ultrastructural disorders in Juncus effusus L.and its remediation through exogenous citric acid[J].Journal of Hazardous Materials,2011,186:565-574.
[20] Bu C F,Wang C,Yang Y S,et al.Physiological responses of artificial moss biocrusts to dehydration-rehydration process and heat stress on the Loess Plateau,China[J].Journal of Arid Land,2017,9(3):419-431.
[21] Li Z X,Li R J,Li Q F,et al.Physiological response of cucumber (Cucumis sativus L.) leaves to polystyrene nanoplastics pollution[J].Chemosphere,2020,263:128 171.
[22] Yang M,Huang D Y,Tian Y B,et al.Influences of different source microplastics with different particle sizes and application rates on soil properties and growth of Chinese cabbage(Brassica chinensis L.)[J].Ecotoxicology and Environmental Safety,2021,222:112 480.
[23] Li Z Y,Zeng X L,Sun F H,et al.Physiological analysis and transcriptome profiling reveals the impact of microplastic on melon (Cucumis melo L.) seed germination and seedling growth[J].Journal of Plant Physiology,2023,287:154 039.
[24] Dong Y M,Song Z G,Liu Y,et al.Polystyrene particles combined with dibutyl phthalate cause significant decrease in photosynthesis and red lettuce quality[J].Environmental Pollution,2021,278:116 871.
[25] Qi Y L ,Ossowicki A,Yang X M,et al.Effects of plastic mulch film residues on wheat rhizosphere and soil properties[J].Journal of Hazardous Materials,2020,387:121 711.
[26] Tyagi S,Mulla S,Lee K,et al.VOCs-mediated hormonal signaling and crosstalk with plant growth promoting microbes[J].Critical Reviews in Biotechnology,2018,38:1 277-1 296.
[27] Sharifi R,Ryu C M.Sniffing bacterial volatile compounds for healthier plants[J].Current Opinion in Plant Biology,2018,44:88-97.
【责任编辑:陈 佳】
