血清神经元特异性烯醇化酶、白细胞介素-6、肿瘤坏死因子-α水平评估肺癌患者预后不良的价值
2025-01-24陈杰彭君琴

【摘要】目的 探讨血清神经元特异性烯醇化酶(NSE)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)水平评估肺癌患者预后不良的价值,为临床提供参考。方法 回顾性分析2021年7月至2023年8月仙桃市第一人民医院收治的94例肺癌患者的临床资料。根据随访1年预后情况的不同分为预后不良组(25例,复发、转移、癌症死亡)与预后良好组(69例)。比较两组患者临床资料;分析影响肺癌患者预后不良的独立危险因素;分析NSE、IL-6、TNF-α水平单独及联合检测预测肺癌患者预后不良的价值。结果 预后不良组患者肿瘤TNM分期为Ⅲ~Ⅳ期占比、Karnofsky评分lt;80分占比、NSE、IL-6、TNF-α水平均高于预后良好组,整体分化程度低于预后良好组(均Plt;0.05)。多因素Logistic分析结果显示,肿瘤TNM分期为Ⅲ~Ⅳ期、低分化、Karnofsky评分lt;80分、NSE、IL-6、TNF-α水平升高均是影响肺癌患者预后不良的独立危险因素(均Plt;0.05)。受试者操作特征(ROC)曲线分析结果显示,NSE、IL-6、TNF-α水平单独及联合预测肺癌患者预后不良的曲线下面积(AUC)分别为0.819、0.887、0.852、0.953,灵敏度分别为0.760、0.880、0.840、0.920,特异度分别为0.768、0.913、0.696、0.942(均Plt;0.05)。结论 肿瘤TNM分期为Ⅲ~Ⅳ期、低分化、Karnofsky评分lt;80分、NSE、IL-6、TNF-α水平升高均是影响肺癌患者预后不良的独立危险因素,联合检测NSE、IL-6、TNF-α在肺癌患者预后不良评估中效能较高。
【关键词】神经元特异性烯醇化酶;白细胞介素-6;肿瘤坏死因子-α;肺癌;预后
【中图分类号】R446 【文献标识码】A 【文章编号】2096-2665.2025.03.0013.03
DOI:10.3969/j.issn.2096-2665.2025.03.005
由于肺癌患者早期无明显症状,大部分患者确诊时病情已进展至中晚期,其治疗预后效果较差[1]。因此,探讨影响肺癌患者预后不良的因素,尽早采取措施干预,能一定程度上改善预后。神经元特异性烯醇化酶(NSE)是一种蛋白酶,在肿瘤中表达升高,属于肿瘤标志物[2]。有研究显示,炎症在肿瘤发生、发展中有重要作用,炎症水平升高对其预后有一定预测价值[3]。白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)均为常见炎症指标,表达水平越高表示炎症反应越强[4]。基于此,本研究旨在探讨NSE、IL-6、TNF-α在肺癌患者预后不良评估中的效能。
1 资料与方法
1.1 一般资料 回顾性分析2021年7月至2023年8月仙桃市第一人民医院收治的94例肺癌患者的临床资料。根据随访1年期间预后情况不同分为预后不良组(25例,复发、转移、癌症死亡)与预后良好组(69例)。预后不良组患者中男性15例,女性10例;年龄51~73岁,平均年龄(62.11±8.46)岁;BMI 20~25 kg/m2,平均BMI(22.53±2.31)kg/m2。预后良好组患者中男性36例,女性33例;年龄50~75岁,平均年龄(62.67±8.29)岁;BMI 20~24 kg/m2,平均BMI(22.08±2.16)kg/m2。两组患者一般资料比较,差异均无统计学意义(均Pgt;0.05),组间具有可比性。本研究经仙桃市第一人民医院医学伦理委员会批准。纳入标准:⑴符合肺癌的诊断标准[5],并经病理学检查确诊;⑵年龄≥18岁;⑶临床资料完整。排除标准:⑴合并心、肝等脏器病变者;⑵合并其他恶性肿瘤者;⑶合并严重感染、炎症者;⑷精神状态异常者。
1.2 研究方法 收集两组患者临床资料,包括吸烟史(过去1年内每天吸烟1支及以上)、饮酒史(酒精摄入量≥20 g/d)、糖尿病(空腹血糖≥7.0 mmol/L,餐后2 h血糖≥11.1 mmol/L)、高血压[收缩压≥140 mmHg,舒张压≥90 mmHg(1 mmHg=0.133 kPa)]、肿瘤最大直径(≤5 cm、gt;5 cm)、肿瘤TNM分期[5](Ⅰ~Ⅱ期、Ⅲ~Ⅳ期)、分化程度[5](高分化、中分化、低分化)、Karnofsky评分[6](lt;80分、≥80分)、NSE、IL-6、TNF-α水平。入院24 h内采集两组患者空腹静脉血5 mL,采用离心机离心5 min(转速为4 000 r/min,离心半径为8 cm)取血清,通过电化学发光法检测NSE、IL-6,酶联免疫吸附法检测TNF-α。
1.3 观察指标 ⑴比较两组患者临床资料。⑵分析影响肺癌患者预后不良的独立危险因素。⑶分析NSE、IL-6、TNF-α水平单独及联合预测肺癌患者预后不良的价值。
1.4 统计学分析 采用SPSS 22.0统计学软件进行数据分析。计数资料以[例(%)]表示,采用χ2检验或秩和检验;计量资料以(x)表示,采用t检验;影响因素采用多因素Logistic回归分析;预测价值采用受试者操作特征(ROC)曲线分析。以Plt;0.05为差异有统计学意义。
2 结果
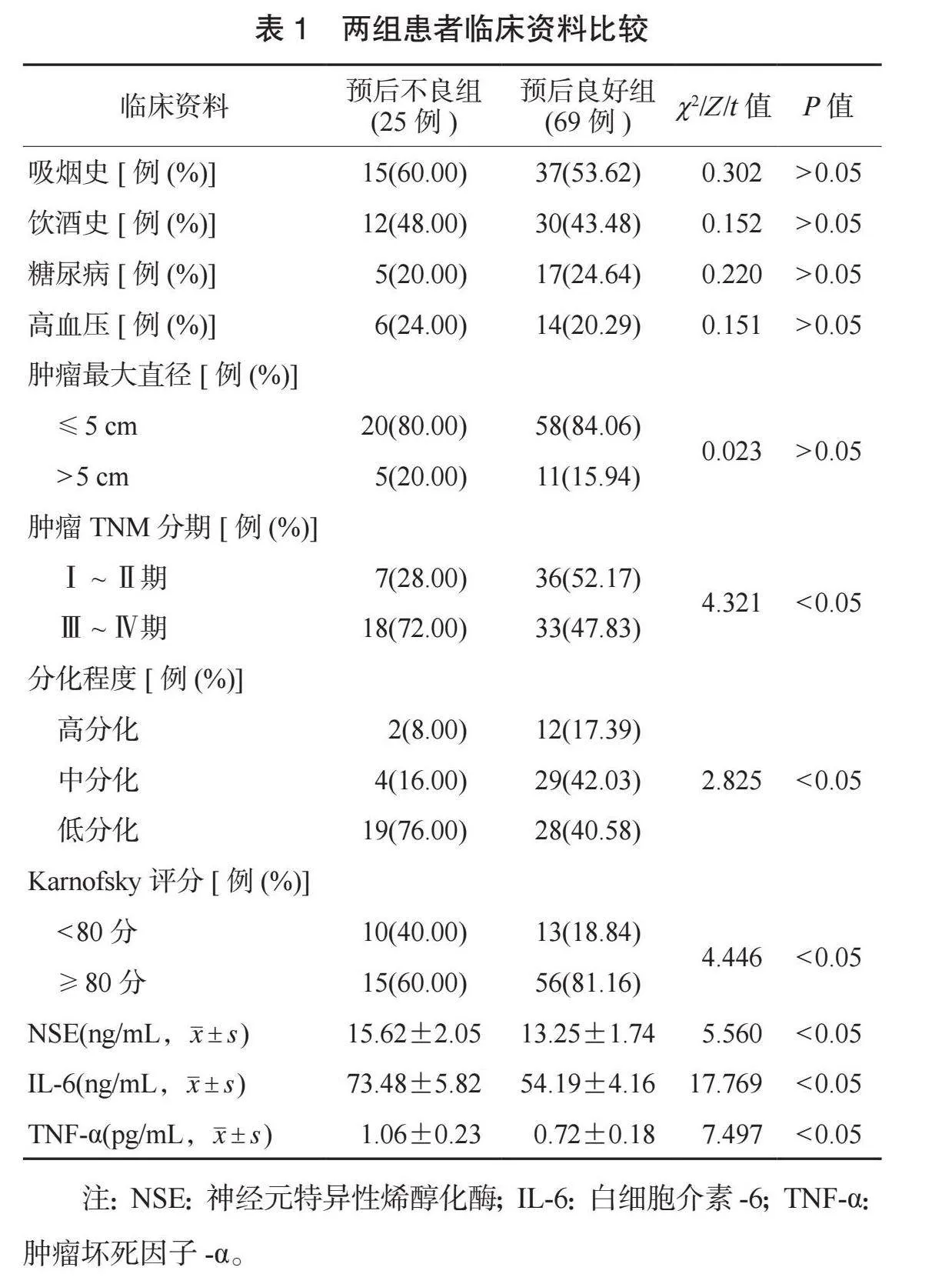
2.1 两组患者临床资料比较 两组患者吸烟史、饮酒史、糖尿病、高血压、肿瘤最大直径比较,差异均无统计学意义(均Pgt;0.05);预后不良组患者肿瘤TNM分期为Ⅲ~Ⅳ期占比、Karnofsky评分lt;80分占比、NSE水平、IL-6水平、TNF-α水平均高于预后良好组,预后不良组患者整体分化程度低于预后良好组,差异均有统计学意义(均Plt;0.05),见表1。
2.2 影响肺癌患者预后不良的多因素Logistic分析 将可能影响肺癌患者预后不良的因素行量化赋值,以肺癌患者是否发生预后不良为因变量(是=1,否=0),以肿瘤TNM分期(Ⅲ~Ⅳ期=1,Ⅰ~Ⅱ期=0)、分化程度(低分化=1,中、高分化=0)、Karnofsky评分(lt;80分=1,≥80分=0)、NSE(连续变量)、IL-6(连续变量)、TNF-α(连续变量)为自变量。多因素Logistic分析结果显示,肿瘤TNM分期为Ⅲ~Ⅳ期、低分化、Karnofsky评分lt;80分、NSE水平升高、IL-6水平升高、TNF-α水平升高均是影响肺癌患者预后不良的独立危险因素(均Plt;0.05),见表2。
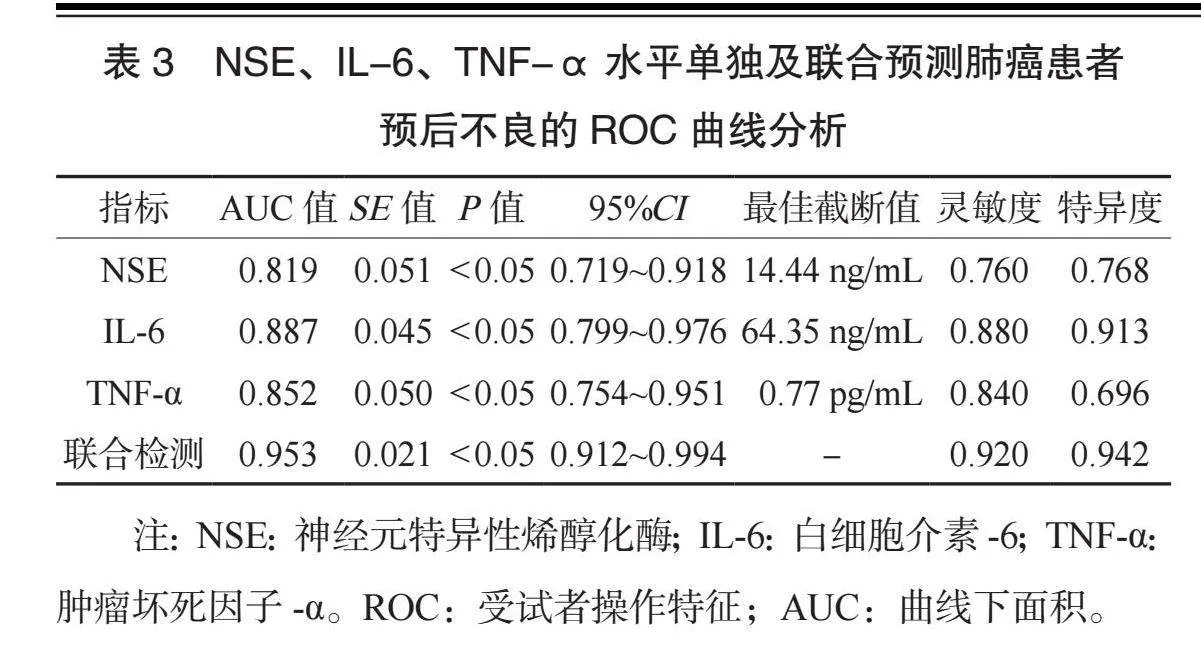
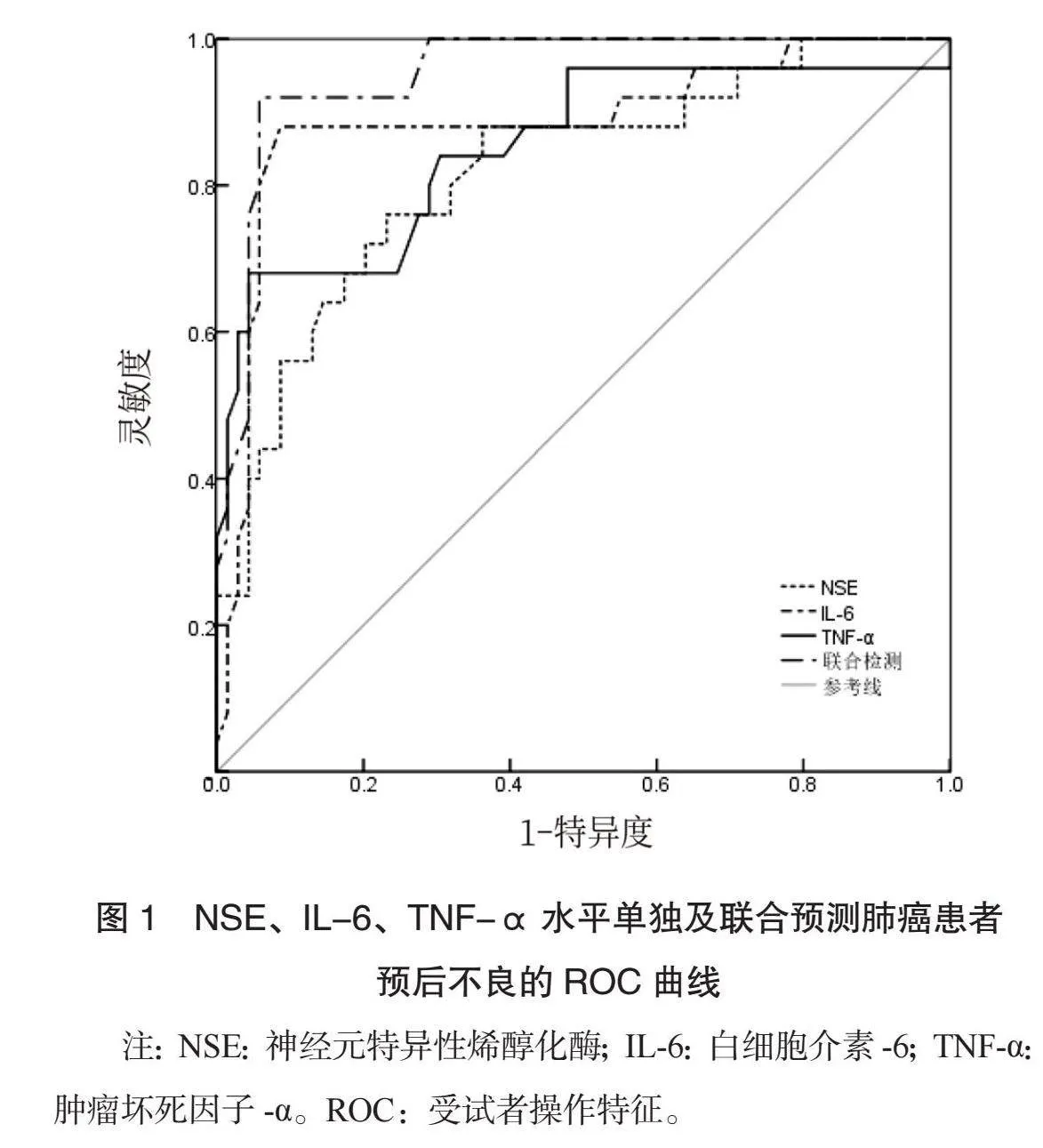
2.3 NSE、IL-6、TNF-α水平单独及联合预测肺癌患者预后不良的ROC曲线分析 ROC曲线分析结果显示,NSE、IL-6、TNF-α水平单独及联合预测肺癌患者预后不良的曲线下面积(AUC)分别为0.819、0.887、0.852、0.953,灵敏度分别为0.760、0.880、0.840、0.920(均Plt;0.05),见表3、图1。
3 讨论
不同分期肺癌患者的治疗方式有所不同,例如中晚期肺癌患者在手术治疗基础上还需联合放疗、化疗等方式,且相较于早期患者,中晚期患者通常预后不佳。基于此,明确影响肺癌患者预后不良的因素,有利于尽早采取干预措施,改善患者预后情况。
本研究结果显示,预后不良组患者肿瘤TNM分期为Ⅲ~Ⅳ期占比、Karnofsky评分lt;80分占比、NSE水平、IL-6水平、TNF-α水平均高于预后良好组,预后不良组患者整体分化程度低于预后良好组;多因素Logistic分析显示,肿瘤TNM分期为Ⅲ~Ⅳ期、低分化、Karnofsky评分lt;80分、NSE、IL-6、TNF-α水平升高均是影响肺癌患者预后不良的独立危险因素,这提示以上因素与肺癌患者预后不良有关。分析原因为,Ⅲ~Ⅳ期患者由于发生淋巴结及远处转移,肿瘤细胞扩散范围更大,手术、放疗等治疗方式无法有效清除所有肿瘤细胞,导致预后不佳[7]。低分化则提示肿瘤恶性程度高,其侵袭性与转移性更强,若无法广泛切除病灶及其周围组织、处理转移淋巴结,可能导致术后复发,影响预后[8]。Karnofsky评分≥80分的患者功能状态更好,通常能够接受更彻底的治疗,预后更好。而NSE水平与临床分期等疾病进展有关,NSE水平越高提示临床分期越高,患者预后也更差[9]。IL-6能够刺激免疫系统激活,诱导C反应蛋白等炎症因子表达;TNF-α来源于巨噬细胞、T淋巴细胞等多种炎症细胞,其水平升高提示机体炎症反应剧烈,易发生预后不良[10]。
本研究ROC曲线分析结果显示,NSE、IL-6、TNF-α单独及联合预测肺癌患者预后不良的AUC分别为0.819、0.887、0.852、0.953,这提示3项指标联合在肺癌患者预后不良中的预测价值更高。分析原因为,NSE在肺癌患者中与病情严重程度有关,NSE水平越高表示病情越严重,预后越差;IL-6、TNF-α均为炎症标志物,水平越高提示炎症反应越强,即使治疗后也存在复发可能,因此,3项指标联合检测的预测效能更好。
综上所述,肿瘤TNM分期为Ⅲ~Ⅳ期、低分化、Karnofsky评分lt;80分、NSE、IL-6、TNF-α水平升高均是影响肺癌患者预后不良的独立危险因素,NSE、IL-6、TNF-α水平联合检测的预测效能更高。
参考文献
姚源山,华青旺,高文.晚期非小细胞肺癌患者免疫治疗的预后相关因素分析[J].实用肿瘤杂志, 2023, 38(3): 239-245.
毕惠娟,方文浩,薛莹,等.肺癌四项血清学指标在肺癌患者中的表达与临床应用价值[J].安徽医学, 2020, 41(5): 540-543.
李四香,李镭,杨茗,等.肺癌患者血常规指标特征分析[J].华西医学, 2020, 35(9): 1060-1067.
李少昆,安生花,郭凤龙,等.肺癌患者血清TNF-α、IL-6与凝血功能的相关性研究[J].实用癌症杂志, 2018, 33(11): 1773-1776.
中华医学会,中华医学会肿瘤学分会,中华医学会杂志社.中华医学会肺癌临床诊疗指南(2018版)[J].中华肿瘤杂志, 2018, 40(12): 935-964.
FRIENDLANDER A H, ETTINGER R L. Karnofsky performance status scale[J]. Spec Care Dentist, 2009, 29(4): 147-148.
张云魁,张荣生,彭胜祖,等.可切除肺癌预后预测模型的构建及生存分析[J].肿瘤研究与临床, 2020, 32(1): 16-21.
张磊,韩京军,杨门,等. ATG2B、TGFBR1在非小细胞肺癌中的表达及预后价值[J].临床和实验医学杂志, 2023, 22(10): 1030-1034.
黄伟,郑继坤,杨燕,等. MSCT参数、CA199、NSE在早期肺癌诊断及预后中的应用[J].河北医药, 2023, 45(4): 500-503.
崔东,许广辉,贾忠伟,等. NLR、VEGF、IL-6、TNF-α水平与非小细胞肺癌预后的相关性[J].现代肿瘤医学, 2019, 27(14): 2514-2518.
