生物胁迫下黄瓜酵母双杂交cDNA文库构建与鉴定
2025-01-24刘东潘春清张艳菊


摘要以黄瓜抗病高代自交系D9320为试验材料,采用Gateway技术构建了黄瓜霜霉病和棒孢叶斑病菌胁迫下黄瓜酵母双杂交cDNA文库。结果表明:酵母文库克隆数为350个,文库滴度为3.5×107CFU/mL,重组率达到100%,插入片段长度在750~2000bp,平均片段长度超过1000bp。文库容量和重组率及插入片段大小均说明霜霉病菌和棒孢叶斑病菌胁迫下黄瓜酵母双杂交cDNA文库构建成功,可用于黄瓜双抗机制互作蛋白的筛选。
关键词黄瓜霜霉病;黄瓜棒孢叶斑病;cDNA文库;酵母双杂交
中图分类号S432.1"文献标识码A
文章编号0517-6611(2025)02-0093-04
doi:10.3969/j.issn.0517-6611.2025.02.021
开放科学(资源服务)标识码(OSID):
ConstructionandIdentificationofCucumberYeastTwo-hybridcDNALibraryUnderBiologicalStress
LIUDong,PANChun-qing,ZHANGYan-ju
(CollegeofPlantProtection,NortheastAgriculturalUniversity,Harbin,Heilongjiang,150030)
AbstractAyeasttwo-hybridcDNAlibraryofcucumberwasconstructedbyGatewaytechnologyunderthestressofPseudoperonosporacubensisandCorynesporacassiicolausingthediseaseresistantinbredlineD9320.Theresultsshowedthatthenumberofyeastlibrarycloneswas350,thetiteroflibrarywas3.5×107CFU/mLandtherateofrecombinationwas100%.Thelengthofallthefragmentswas750-2000bp.Theaveragelengthwasmorethan1000bp.TheyeasttwohybridcDNAlibraryofcucumberunderthestressofPseudoperonosporacubensisandCorynesporacassiicolawasconstructedsuccessfully,whichcouldbeusedforscreeninginteractionproteinsofthedouble-diseaseresistancemechanismincucumber.
KeywordsCucumberdownymildew;Cucumbertargetleafspot;cDNAlibrary;Yeasttwo-hybrid
黄瓜(CucumissativusL.)是重要的蔬菜作物之一,在我国主要以保护地栽培为主。黄瓜霜霉病和棒孢叶斑病是黄瓜生产中的重要病害,传播流行速度快,一旦发生难以控制,严重影响黄瓜产量及品质。化学药剂虽能短期快速控制病害使其发展缓慢,但长期用药必然会造成污染、残留以及病原菌耐药性等问题。因此,选育双抗品种是防治黄瓜病害最安全和高效的方法之一。
常规育种周期长,利用分子生物学技术进行双抗品种的培育可大大缩短育种周期。黄瓜抗霜霉病和棒孢叶斑病双抗分子机制研究还不深入,单一病害的抗性遗传规律研究结果仍不一致。国外学者Abul-Hayja等[1]将棒孢叶斑病抗、感亲本进行杂交,发现1对参与调控黄瓜对棒孢叶斑病的显性抗病基因Cca。国内学者与国外学者研究结果相反,2010 年王惠哲等[2]研究结果显示,黄瓜棒孢叶斑病的抗性并非由显性基因控制,而是由隐性基因调控,感病性状与抗病性状相比,感病性状呈显性且为不完全显性。2015年Wen等[3]利用 D31(抗病亲本)与 D5(感病亲本)杂交获得隐性抗病基因Cca-3。1990年至今,大部分霜霉病抗性遗传规律研究结果显示抗性是由多个基因控制[4-5],少数研究显示抗性是由单一基因控制[6]。
随着黄瓜遗传转化技术体系的建立与优化,使霜霉病和棒孢叶斑病抗病基因的研究不仅仅局限在遗传规律分析及定位,Wang等[7]使用抗、感材料,多时间点接种进行转录组测序分析,发现了146个差异基因,其中包括转录因子、激素、Ca2+代谢通路和防御类基因等多种类型。新鉴定出7个与抗黄瓜棒孢叶斑病相关的miRNAs,在黄瓜植株内过表达CsNAC、CsAPE、Cs4CL 和 CsPAL 能增强黄瓜植株对棒孢叶斑病的抗病性。2017年以来,刘东等[8-12]对黄瓜霜霉病和棒孢叶斑病双抗机制进行品种抗病性、组织病理学观察及分子双抗机理研究。利用转录组测序技术挖掘到了双抗相关基因CsERF004、CsCBS和CsGASA4,过表达CsERF004的株系对黄瓜霜霉病和棒孢叶斑病的抗病性明显增强,CsCBS和CsGASA4能够积极响应2种病原菌的胁迫。目前,已明确CsERF004与黄瓜抗霜霉病和棒孢叶斑病有关,但与其相关的互作蛋白尚不清楚,黄瓜抗霜霉病和棒孢叶斑病双抗反应的调控网络不清晰。
酵母双杂交cDNA文库是研究蛋白互作的方法之一。通过构建酵母双杂交cDNA文库,可以用来筛选目标基因的互作蛋白,对研究基因调控网络将有很大帮助。酵母双杂交技术应用于不同胁迫下的多种作物。在番茄作物中,构建了生物胁迫(叶霉菌侵染)和非生物胁迫(干旱胁迫)下的酵母双杂交cDNA文库[13-14];青枯病菌胁迫下的茄子酵母双杂交文库被构建[15];大丽轮枝菌生物胁迫下和激素非生物胁迫下的棉花酵母双杂交文库被构建等[16]。黄瓜酵母双杂交文库的构建仅见在黄瓜发育性状上[17],缺乏病原菌生物胁迫下的黄瓜酵母双杂交文库的构建。
笔者采用Gateway技术,以黄瓜抗病高代自交系D9320为试验材料,构建霜霉病菌和棒孢叶斑病菌胁迫下的黄瓜酵母双杂交cDNA文库。文库的构建将为解析黄瓜对霜霉病和棒孢叶斑病双抗反应中的调控网络奠定基础,为深入研究黄瓜双抗分子机制及品种培育提供理论依据。
1材料与方法
1.1试验材料
抗病黄瓜高代自交系D9320由东北农业大学园艺园林学院黄瓜课题组提供。黄瓜棒孢叶斑病菌由天津科润黄瓜研究所赠予。
黄瓜霜霉病菌采集自东北农业大学园艺试验站。载体:购自Invitrogen公司的pDONR222及pGADT7-DEST。
1.2试验方法
1.2.1病原菌胁迫处理。
黄瓜材料的准备:播种前先进行种子表面消毒,消毒使用3%次氯酸钠溶液。用准备好的消毒液浸泡黄瓜种子10min进行种子表面消毒。消毒后使用无菌水清洗种子,洗去残留的消毒液,提前准备好装有滤纸的培养皿,将消毒好的种子摆放在培养皿内,加入无菌水保湿。28℃避光催芽1d,0.5cm胚根长出后即可进行播种。播种后将其置于设置好温度及光照(26℃/18℃、16h/8h光周期)的人工气候箱中培养。
孢子悬浮液的配制:①棒孢叶斑病,使用PDA培养基培养黄瓜棒孢叶斑病菌,28℃培养箱内培养7d后,无菌水冲洗培养基表面菌丝,用3层灭菌纱布对冲洗液进行过滤,过滤后在显微镜下将孢子悬浮液浓度调至1×105个孢子/mL。②霉病:用毛刷将采集到的病叶上的孢子囊刷到装有无菌水的烧杯中,将孢子悬浮液浓度调至5×103个孢子囊/mL。
接种处理:待黄瓜植株第1片真叶展平时,采用点滴法将2种配制好的孢子悬浮液交叉点滴各15滴,每滴20L。接种后至少保湿24h。
取材时间:接种12、24、48、72、96h后,使用手术剪剪下第1片真叶,锡纸包裹好样品立即置于液氮中冷冻,冷冻后在-80℃冰箱保存,为后续RNA提取作准备。
1.2.2RNA提取、mRNA分离及纯化。
采用Trizol 法进行黄瓜植物叶片总RNA的提取[18]。mRNA分离的具体操作步骤则按照Invitrogen公司的产品Oligotex mRNA Midi Kit说明书进行分离。mRNA的纯化需要用到糖原、NH4OAC及无水乙醇,所用体积分别为2 L、0.5倍体积和2.5倍体积。mRNA与3种药品混匀,最后通过无水乙醇进行清洗则获得纯化的mRNA。
1.2.3病原菌胁迫下黄瓜cDNA初级文库的构建。
病原菌胁迫下黄瓜cDNA初级文库构建的具体操作按照CloneMiner试剂盒(Invitrogen公司)说明书进行,依次完成cDNA第1链和第2链的合成,cDNA与三框attB1重组接头连接,cDNA分级分离及收集,BP重组反应和电转化大肠杆菌DH10B。最终将电转物移至新的15mL离心管中。培养条件为37℃,225~250r/min培养1h,使用涂布棒将培养的菌液涂布于含有Kan抗性的LB培养基平板上进行库容量的鉴定;剩余培养物按照1∶1的体积加入50%甘油存于-80℃,即为初级文库菌液。
1.2.4病原菌胁迫下黄瓜cDNA次级文库的构建。
提取初级文库的质粒,进行LR重组反应体系的建立。反应体系中包括初级文库质粒、pGADT7-DEST、LRClonaseⅡMix和ddH2O,所用体积分别为1μL(300ng/L)、1μL(300ng/L)、4和14μL;反应条件:25℃,16~20h。将LR重组反应的产物通过电转化法将其转入大肠杆菌DH10B菌株中。最终将电转物移至新的15mL离心管中。培养条件为37℃,225~250r/min培养1h,使用涂布棒将培养的菌液涂布于含有Amp抗性的LB培养基平板上进行库容量的鉴定;剩余培养物按照1∶1的体积加入50%甘油存于-80℃,即为次级文库菌液。
1.2.5初级文库和次级文库的鉴定。
通过计算文库总CFU、重组率和插入片段长度对初级文库和次级文库的质量进行鉴定。将2个文库的菌液分别进行稀释,每个文库取稀释好的100倍菌液50L。使用涂布棒在含有Kan抗性和Amp抗性的LB平板上分别进行涂布。观察平板上的克隆数量,根据如下公式计算文库总CFU。随机选取平板上的克隆,选取24个进行菌落PCR,通过凝胶电泳结果对重组率和插入片段长度进行鉴定。
CFU/mL=平板上的克隆数/50μL×100倍×1×103μL
文库总CFU=CFU/mL×文库菌液总体积(mL)
1.2.6病原菌胁迫下黄瓜酵母双杂交文库构建与鉴定。
次级文库质粒的提取使用诺维赞试剂盒,操作流程参照说明书。将次级文库质粒转入酵母Y187菌株中,完成酵母工作液的制备。使用涂布棒将酵母菌液(1∶10、1∶100、1∶1000、1∶10000稀释液)涂布在SD/-Leu平板上,每个平板涂布100L稀释液。培养条件为30℃培养3~6d,检测转化效率。按照“1.2.5”中的公式进行库容量的计算。随机选取平板上的克隆,选取24个进行菌落PCR,通过凝胶电泳结果对重组率和插入片段长度进行鉴定。
2结果与分析
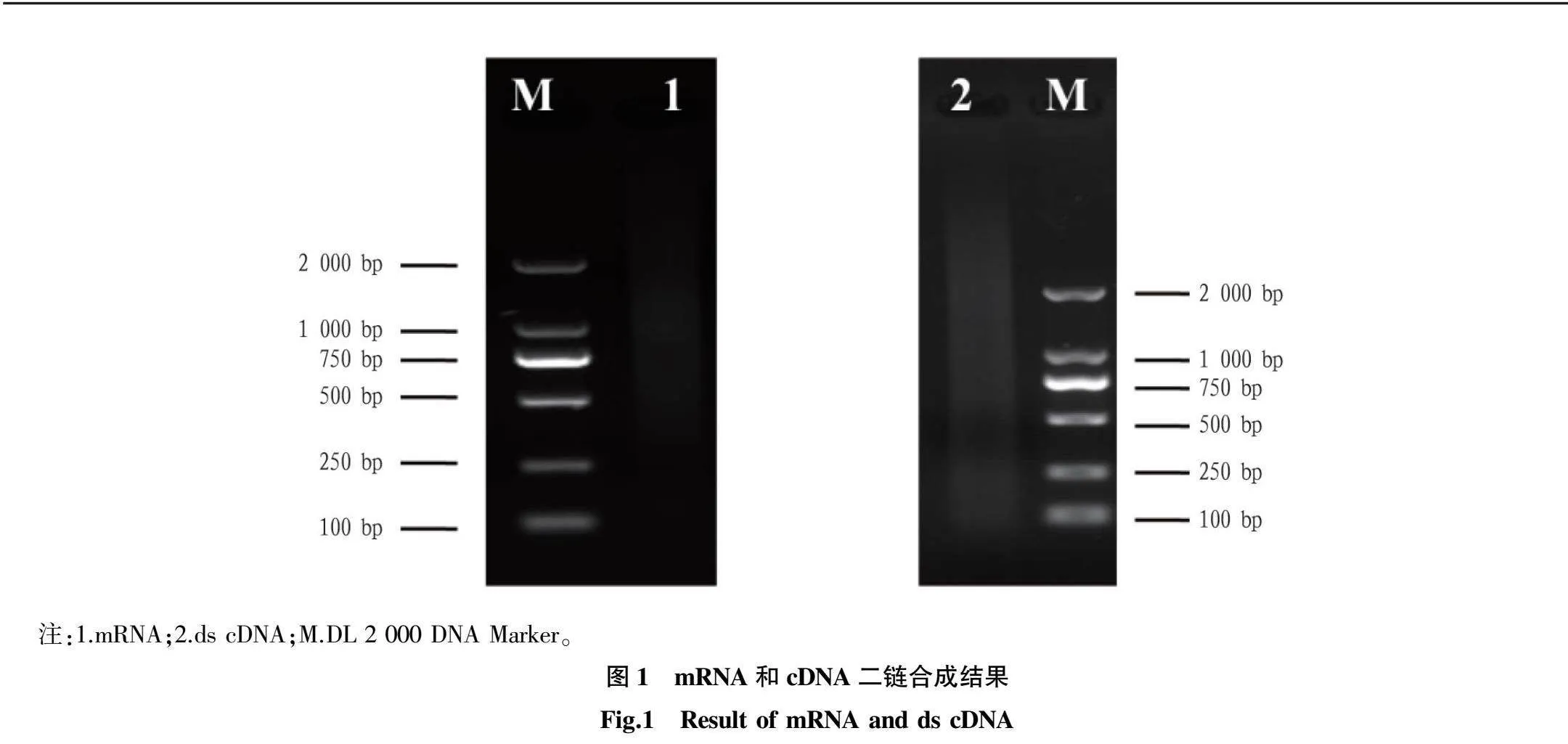
2.1mRNA与dscDNA的检测
黄瓜霜霉病菌和棒孢叶斑病菌胁迫后的12、24、48、72和96h,将黄瓜叶片混合进行RNA的提取并进行mRNA分离。1%琼脂糖凝胶检测mRNA,结果如图1所示,mRNA在250~2000bp弥散均匀,质量好。检测dscDNA显示,弥散区间较大,质量好。通过琼脂糖凝胶电泳检测结果说明dscDNA可以用于后续的黄瓜酵母cDNA文库的构建。
2.2初级文库构建与鉴定
将构建好的初级文库菌液稀释100倍后,使用涂布棒将50L菌液涂布于含有Kan抗性的LB培养基平板上进行库容量的鉴定。如图2所示,在LB平板上共长出了1300个克隆。通过“1.2.5”中的公式进行初级文库库容量的计算,结果为1.04×107CFU。随机挑取24个克隆进行菌落PCR鉴定,每个克隆均有条带,结果显示,重组率达到100%(图2),PCR产物进行琼脂糖凝胶电泳检测后,片段在500~2000bp,平均片段长度大于1000bp,在500~750bp的片段仅1个。根据文库容量和重组率以及插入片段大小均说明构建的初级文库质量较好,可以进行次级文库的构建。
2.3次级文库构建与鉴定
将构建好的次级文库菌液稀释100倍后,使用涂布棒将50L菌液涂布于含有Amp抗性的LB培养基平板上进行库容量的鉴定。如图3所示,在LB平板上共长出了1500个克隆。根据“1.2.5”中的公式计算初级文库容量为1.20×107CFU。随机挑取24个克隆进行菌落PCR,每个克隆均有条带,重组率达到100%(图3)。PCR产物进行琼脂糖凝胶电泳检测后,平均片段长度大于1000bp,无低于500bp的条带。文库容量和重组率及插入片段大小均说明次级文库质量较好,成功构建了次级文库。
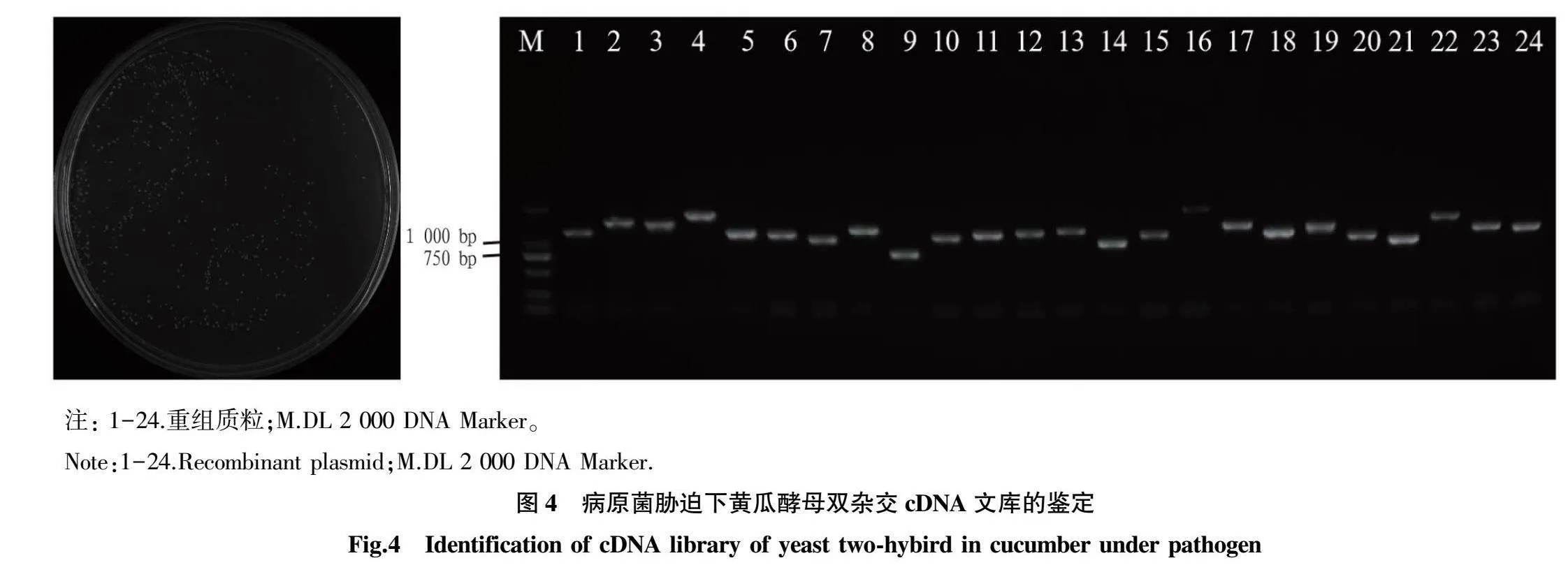
2.4病原菌胁迫下黄瓜酵母cDNA文库鉴定
将构建好的次级文库菌液提取质粒后转化到酵母菌中,酵母菌液进行稀释(1∶10、1∶100、1∶1000、1∶10000稀释液),取10000倍稀释液100L用涂布棒涂布在SD/-Leu平板上,30℃培养3~6d,检测文库滴度。如图4所示,克隆数为350个,根据“1.2.5”中的公式计算文库滴度为3.5×107CFU/mL。随机对24个克隆进行菌落PCR,每个克隆均有条带,重组率达到100%,所有片段长度大于750bp,24个克隆中23个克隆片段大于1000bp。文库容量和重组率及插入片段大小均说明病原菌胁迫下黄瓜酵母双杂交cDNA文库构建成功。
3讨论与结论
黄瓜棒孢叶斑病是由多主棒孢霉死体寄生的病原菌侵染引起的一种真菌病害。黄瓜霜霉病是一种由藻物界卵菌门古巴假霜霉菌活体寄生的病原菌侵染引起的卵菌病害。当环境条件适宜时2种病害发生严重,且流行速度极快。植物在自然条件下会遭受多种病原物的侵染,但其对大多数病原物侵染都会呈现出不同的抗性策略。病原物为了能够成功侵染宿主就会分泌毒素,突破一系列物理屏障,使植物对该病原物表现为感病,正是由于这种病原物与植物之间的相互作用形成了植物的先天免疫系统[19]。
有研究发现,过表达CsERF004能够增强黄瓜对霜霉病和棒孢叶斑病的抗性,同时增加了水杨酸和乙烯的含量,且使CsPR1和CsPR4上调表达[20]。关于ERF转录因子的互作蛋白的研究,有文献显示STK 能够通过磷酸化增强 ERF 的活性,使 ERF 表达,同时增强ERF激活PR蛋白表达的活性。Gu等[21]通过酵母双杂交的试验发现 ERF 转录因子 Pti4 编码蛋白与 STK 类抗病基因 Pto 编码蛋白互作,过表达 Pto 能够使 Pti4 上调表达,同时激活 PR 基因 GluB 和Osm 的表达。Song 等[22]研究结果表明,AtERF7 能够被丝氨酸、苏氨酸蛋白激酶 PKS3 磷酸化。
酵母双杂交cDNA文库是一种很好的挖掘互作蛋白,探究调控网络及解析分子机理的技术手段[23]。黄瓜作物缺乏病原菌胁迫后的酵母双杂交文库的构建,进行文库构建将为黄瓜抗霜霉病与棒孢叶斑病双抗分子机理的研究奠定基础。利用Gateway技术构建酵母双杂交cDNA文库对RNA质量的要求高,但在后续筛选互作蛋白过程中既可以使用Mating法又可以使用共转法,有利于互作蛋白筛选的顺利进行。由于Smart技术后续筛库中只能利用Mating的方法,对于筛库的成功率不敢保证,因此笔者选用Gateway方法进行文库的构建[14]。通过对高代抗病自交系D9320接种黄瓜霜霉病菌和棒孢叶斑病菌后的黄瓜叶片不同时间点进行取材,混合样品进行RNA的提取、mRNA分离。mRNA和ds cDNA电泳结果弥散均匀,质量好。初级文库库容量为1.04×107 CFU,次级文库库容量为1.20×107 CFU,且重组率均达到100%,插入片段均大于1 000 bp。转化酵母菌后,100 μL 10 000倍酵母稀释液克隆数为350个,文库滴度为3.5×107 CFU/mL,重组率达到100%,所有片段长度大于750 bp,24个克隆中23个克隆片段大于1 000 bp。这说明该研究中构建的霜霉病菌和棒孢叶斑病菌胁迫下的黄瓜酵母双杂交cDNA文库质量高。
该研究完成了黄瓜霜霉病菌和棒孢叶斑病菌胁迫下的黄瓜酵母双杂交cDNA文库的构建,下一步将进行互作蛋白的筛选,研究抗病基因调控网络,解析黄瓜抗霜霉病和棒孢叶斑病双抗分子机理,为黄瓜抗病育种提供理论基础。
参考文献
[1]ABUL-HAYJAZ,WILLIAMSPH,PETERSONCE.Inheritanceofresistancetoanthracnoseandtargetleafspotincucumbers[J].Plantdiseasereporter,1978,62(1):43-45.
[2]王惠哲,李淑菊,管炜.黄瓜褐斑病抗源鉴定与抗性遗传分析[J].中国瓜菜,2010,23(1):24-25.
[3]WENCL,MAOAJ,DONGCJ,etal.Finegeneticmappingoftargetleafspotresistancegenecca-3incucumber,CucumissativusL.[J].Theoreticalandappliedgenetics,2015,128(12):2495-2506.
[4]ZHANGSP,LIUMM,MIAOH,etal.ChromosomalmappingandQTLanalysisofresistancetodownymildewinCucumissativus[J].Plantdisease,20197(2):245-251.
[5]WANGYH,VANDENLANGENBERGK,WEHNERTC,etal.QTLmappingfordownymildewresistanceincucumberinbredlineWI7120(PI330628)[J].Theoreticalandappliedgenetics,2016,129(8):1493-1505.
[6]孟攀奇,蔡丽静,张桂华,等.与黄瓜霜霉病抗性相关基因连锁的分子标记研究[J].长江蔬菜,2014(8):12-14.
[7]WANGXY,ZHANGD,CUIN,etal.TranscriptomeandmiRNAanalysesoftheresponsetoCorynesporacassiicolaincucumber[J].Scientificreports,2018,8(1):1-16.
[8]刘东,辛明,周秀艳,等.主要黄瓜种质资源抗病性评价[J].东北农业大学学报,2017,48(3):10-16.
[9]LIUD,QINZW,ZHANGYJ,etal.HistologicalobservationofcucumberinfectedwithCorynesporacassiicola[J].Europeanjournalofplantpathology,2017,149(2):455-466.
[10]LIUD,XINM,ZHOUXY,etal.Expressionandfunctionalanalysisofthetranscriptionfactor-encodinggeneCsERF004incucumberduringPseudoperonosporacubensisandCorynesporacassiicolainfection[J].BMCplantbiology,2017,17(1):1-13.
[11]王奕童.黄瓜CsCBS克隆及抗棒孢叶斑病和霜霉病功能验证[D].哈尔滨:东北农业大学,2018.
[12]秦智伟,于思琦,刘东,等.黄瓜CsGASA4基因克隆及生物信息学分析[J].东北农业大学学报,2018,49(7):19-26.
[13]许向阳,裴童,吴泰茹,等.Cf-19介导的抗番茄叶霉病(Cladosporiumfulvum)免疫应答酵母双杂交cDNA文库构建和鉴定[J].东北农业大学学报,2020,51(5):10-16.
[14]许向阳,裴童,吴泰茹,等.干旱胁迫下“Micro-Tom”番茄酵母双杂交cDNA文库构建和鉴定[J].东北农业大学学报,2020,51(7):20-26.
[15]肖熙鸥,林文秋,李威,等.感染青枯病病原菌R.solanacearum的茄子酵母双杂交文库构建及评价[J].北方园艺,2016(21):102-105.
[16]许艳,李冉,宋健,等.大丽轮枝菌及激素处理后棉花酵母双杂交文库的构建[J].植物保护,20247(2):46-55.
[17]王晖.黄瓜超矮生基因scp-1功能初步分析及酵母双杂交cDNA文库的构建[D].杨凌:西北农林科技大学,2017.
[18]LISN,WANGCH,ZHOUXY,etal.ThecurvatureofcucumberfruitsisassociatedwithspatialvariationinauxinaccumulationandexpressionofaYUCCAbiosynthesisgene[J].Horticultureresearch,2020,7(1):1-12.
[19]BOLLERT,HESY.Innateimmunityinplants:Anarmsracebetweenpatternrecognitionreceptotsinplantsandeffectorsinmicrobialpathogens[J].Science,2009,324(5928):742-744.
[20]刘东.黄瓜霜霉病及棒孢叶斑病双抗性分子机制的研究[D].哈尔滨:东北农业大学,2017.
[21]GUYQ,YANGC,THARAVK,etal.Pti4isinducedbyethyleneandsalicylicacid,anditsproductisphosphorylatedbythePtokinase[J].Theplantcell,2000,12(5):771-786.
[22]SONGCP,AGARWALM,OHTAM,etal.RoleofanArabidopsisAP2/EREBP-typetranscriptionalrepressorinabscisicacidanddroughtstressresponses[J].Theplantcell,2005,17(8):2384-2396.
[23]邱爱连,刘林林,蔡汉阳,等.Gateway技术构建酵母双杂分析用辣椒cDNA文库[J].江西农业大学学报,2010,32(4):791-796.
