斜带石斑鱼源的哈维氏弧菌分离与鉴定
2025-01-24徐露茜顾豪铭许馨兰汪志鲁义善







摘要[目的]为鉴定造成湛江某养殖场斜带石斑鱼大量死亡的病原,对皮肤滋生白色隆起疥疮的患病斜带石斑鱼进行解剖与细菌分离与纯化。[方法]通过生化反应、16SrRNA基因克隆与测序,构建系统进化树鉴定分离纯化获得的优势菌S1。采用OD600和平板活菌计数绘制V.harveyiS1生长曲线,以R2判断其生长曲线的相关性和可信度。[结果]鉴定结果显示S1为哈维氏弧菌,同V.harveyihq-V149聚为一支。药敏试验结果显示,斜带石斑鱼源的哈维氏弧菌S1对诺氟沙星、头孢氨苄、左氧氟沙星、环丙沙星等12种抗生素敏感,对青霉素G、氨曲南、链霉素、头孢唑林、头孢哌酮等12种抗生素不敏感。[结论]哈维氏弧菌S1是造成湛江某养殖场斜带石斑鱼大量死亡的病原,其指数生长时间为5~12h,随后进入平台期。
关键词哈维氏弧菌;16SrRNA;斜带石斑鱼;药敏试验;生长曲线
中图分类号S94"文献标识码A
文章编号0517-6611(2025)02-0071-06
doi:10.3969/j.issn.0517-6611.2025.02.017
开放科学(资源服务)标识码(OSID):
IsolationandIdentificationofVibrioharveyifromEpinepheluscoioides
XULu-xi,GUHao-ming,XUXin-lanetal
(GuangdongOceanUniversity,Zhanjiang,Guangdong524000)
Abstract[Objective]ToidentifythepathogenthatcauseddeathsofEpinepheluscoioidesinafarminZhanjiang,conductedthedissectionofEpinepheluscoioideswithwhiteraisedscabiesonskin,andbacterialisolationandpurification.[Method]Thoughbiochemicalreactions,16SrRNAgenecloningandsequencing,aphylogenetictreewasconstructedtoidentifythedominantstrainS1.ThegrowthcurveofV.harveyiS1wasplottedbyOD600andplateviablecount.AccordingtoR2,itwoulddeterminethecorrelationandreliabilityofitsgrowthcurve.[Result]TheidentificationresultshowedthatS1isoneofVibrioharveyi,thesameasV.harveyihq-V149convergedintoonebranch.ThedrugsensitivitytestresultsshowedthatVibrioharveyiS1wassensitiveto12antibioticssuchasnorfloxacin,cephalexin,levofloxacinandciprofloxacin,butnotto12antibioticssuchaspenicillinG,amtreonam,streptomycin,cefazolinandcefoperazone.[Conclusion]VibrioharveyiS1isthepathogenwhichcauseddeathsofEpinepheluscoioidesinafarminZhanjiang.TheexponentialgrowthtimeofS1is5-12hours,andthenenterstheplateauperiod.
KeywordsVibrioharveyi;16SrRNA;Epinepheluscoioides;Drugsensitivitytest;Growthcurve
斜带石斑鱼(Epinephelus coioides)又称青斑,是鲈形目鮨科下石斑鱼属物种,作为海水养殖代表物种之一,同大黄鱼、金枪鱼等经济物种一样具有高经济价值。人工养殖石斑鱼已有20多年历史[1] ,国内石斑鱼养殖多集中在广东、海南、福建。随着养殖技术的提高和养殖规模的扩大,养殖产量稳步提升,2017年石斑鱼养殖产量超过捕捞产量,其中广东养殖规模最大,到2022年广东地区石斑鱼年产量达到93 024万t,占全球养殖规模的45.57%。然而种质的退化、环境的污染以及超出环境容量的养殖密度导致石斑鱼病害频发,2021年广东水产养殖中有约50%的经济损失由病害造成[2]。
石斑鱼最主要的养殖模式是海水网箱养殖,其次是池塘养殖和工厂化养殖[ 3]。高密度、高污染的养殖过程中出现的富营养化造成水体中细菌群落结构与功能的变化,在海洋中广泛分布的弧菌已经成为海洋养殖的主要病原之一[4] 。部分病原性弧菌能跨物种感染,弧菌中的哈维氏弧菌正是能跨物种感染的病原弧菌之一[5-9]。
哈维氏弧菌能感染鱼类[5,10-11]、虾类[7,12]和贝类[6],甚至能感染海马[13],患病动物源自天津、广东、海南等多地。在石斑鱼上,持续报道患病石斑鱼体内分离出哈维氏弧菌[14-16]。而在斜带石斑鱼上,早在2004年,便有从患病斜带石斑鱼肝脏分离出哈维氏弧菌的报道[17],2021年又有斜带石斑鱼源哈维氏弧菌分离报道[18]。哈维氏弧菌跨物种感染能力之强,地理分布之广,病害泛滥时间之久[19],都证明其作为病原对石斑鱼养殖的负面影响之大。
近期,湛江某养殖场斜带石斑鱼发病,出现鱼体体表发黑、溃烂现象,同时伴有白色隆起疥疮滋生。为研究其病因,笔者对该养殖场发病斜带石斑鱼进行致病菌分离、纯化,观察其形态特征。后通过分子技术和生理生化反应进一步对该分离菌株进行鉴定,确认其中优势株S1为哈维氏弧菌,并根据16SrRNA基因序列多序列比对结果以Neighbor-Joining法构建斜带石斑鱼源哈维氏弧菌S1的系统进化树,确认哈维氏弧菌S1的进化地位。同时绘制哈维氏弧菌S1的生长曲线,检测哈维氏弧菌S1的耐药性。以期为后续对哈维氏弧菌S1的深入研究提供基础,为探寻斜带石斑鱼养殖过程哈维氏弧菌防治提供参考。
1材料与方法
1.1试验材料
于湛江某养殖基地取样3条(5.52±0.20)cm,患病斜带石斑鱼分别标记为Ec1、Ec2、Ec3。一次性涂布棒、16S通用引物、微量细菌生化反应管(购自杭州滨和微生物试剂有限公司)、药敏纸片(购自杭州滨和微生物试剂有限公司)、TSA琼脂培养基、LB琼脂培养基、TCSB琼脂培养基、LB培养基、TSB培养基。
1.2试验方法
1.2.1鱼病诊断。对Ec1、Ec2、Ec3进行目检和剖检,将检查结果与健康斜带石斑鱼进行比较,记录病变组织和组织结构上的病理变化。
根据检查结果对病原进行初步判断。
1.2.2细菌分离与纯化。
对Ec1、Ec2、Ec3体表病灶(Sk)、肝脏(Li)、脾脏(Sp)3个出现病理变化的部位在TSA平板、LB平板、TCSB平板划线接种,接种平板于28℃培养箱中培养18h,观察平板上菌落的大小、颜色和形态并记录,挑取固体培养基上不同区域一定数量的单菌落于LB液体培养基,37℃摇床振荡培养12h。在菌液中添加等体积浓度为40%的灭菌甘油,于-80℃保存。
1.2.316SrRNA基因序列克隆与分析。
以1∶100的比例,将“1.2.2”中分离纯化的菌液接种于400μLLB液体培养基,于37℃振荡培养6h,通过细菌全基因组DNA提取试剂盒提取细菌DNA后对其16SrRNA进行基因克隆、测序与分析,对细菌进行鉴定,引物分别为:27F(AGAGTTTGATCCTGGCTCAG)和1492R(GGTTACCTTGTTACGACTT)。PCR体系为20μL:1μL模板、1μL上游引物、1μL下游引物、7μLddH2O、10μL2×SanTaqPCRMix预混液[生工生物工程(上海)股份有限公司],35个循环。通过1%琼脂糖凝胶电泳检测PCR产物并于紫外光下确认产物大小符合预期,寄送至生工生物工程(广州)股份有限公司进行双向测序,并对测序结果进行分析。
1.2.4生化鉴定。
无菌条件下,取100μLS1菌液在TSA平板上划线涂板,于28"℃下培养12h,取单菌落接种在微量生化反应管中,将微量生化反应管放置28℃培养18~24h,根据杭州滨和微生物试剂有限公司《细菌微量生化反应管说明书》确认S1细菌生化反应结果。通过《伯杰细菌鉴定手册》《常见细菌鉴定手册》对S1生化特性进行鉴定。
1.2.5药敏试验。
在无菌条件下制备10个TSA 平板,每个平板均匀涂布100 μL菌液,等距平贴3张药敏纸片。以3个不同角度测量每个抑菌环直径,最后取3次测量的平均值,长度单位mm,记录在册,整理并以《NCCLS药敏试验标准》和杭州滨和微生物试剂有限公司《抗生素类药敏纸片使用说明书》为标准判断药敏试验结果[12]。
1.2.6细菌生长曲线绘制。
在无菌条件下接种哈维氏弧菌至装有5 mL TSB培养基的试管中,于28 ℃培养12 h;再以1∶100比例接种菌液于装有100 mL TSB培养基的锥形瓶,于28 ℃培养;选择不同时间点(0、0.5、1.5、2.5、3.0、5.0、6.5、8.0、12.0、16.0、20.0和24.0 h),收集菌液,在无菌条件不同稀释倍数下(×105、×107、×109和×1011倍)涂布在TSA平板上,于28 ℃培养箱中培养12 h后计数,有效计数范围为10~200。同时通过分光光度计在波长600 nm条件下测量该时间点的OD 600值,菌液浓度较高时,将菌液稀释至OD600值在0.4~0.6区间再进行测量,测量结果乘稀释倍数,记录在册。
2结果与分析
2.1鱼病诊断结果
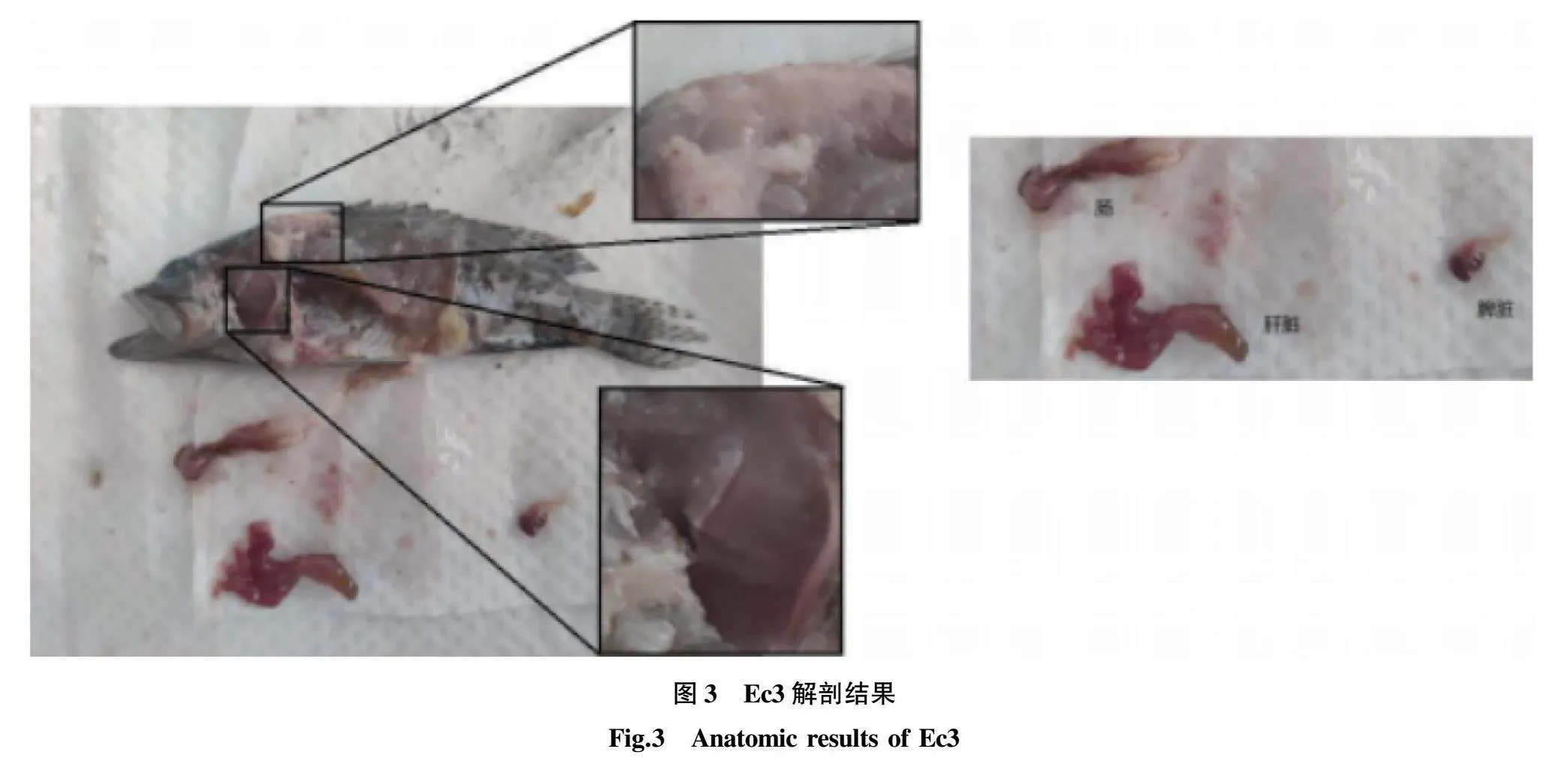
对Ec1、Ec2、Ec33条患病斜带石斑鱼进行目检,发现其均体表变黑,严重溃烂并出现不规则的白色隆起疥疮。Ec1背鳍相对完好,尾鳍开始溃烂,胸部和尾部有充血。Ec2头部和胸部有白色疥疮,尾鳍有溃烂,嘴部充血。Ec3体表出现大量不规则白色疥疮,还出现了淡黄色结节,尾鳍和背鳍完全溃烂。
对Ec1、Ec2、Ec33条患病斜带石斑鱼进行剖检,发现其体内肝脏充血(图1~3)。Ec1肝脏充血肿大,脾脏糜烂消解不见,肠道内部呈黄色,有积水和胀气。Ec2鳃部糜烂呈灰色,肝脏充血,脾脏充血呈熔解态,肠道内部呈黄色。Ec3鳃部糜烂,肝脏充血,脾脏充血,肠道发红,有胀气。
根据目检结果和剖检结果,初步判断,患病斜带石斑鱼是受到细菌感染所致。
2.2细菌分离纯化
对Ec1、Ec2、Ec3体表病灶(Sk)、肝脏(Li)、脾脏(Sp)3个出现病理变化的部位在TSA平板、LB平板、TCSB平板划线接种。其中,LB平板上菌落数量相较TSA平板和TCBS平板上菌落数量明显减少,证明分离出的细菌更需要高营养培养基。TSA培养基对细菌没有筛选作用,且营养丰富,菌落生长数量最高,但形态并无较大差异。划线培养后TCBS琼脂培养基对细菌具有筛选作用,Ec1、Ec2、Ec3体表病灶(Sk)、肝脏(Li)、脾脏(Sp)3个出现病理变化的部位划线接种于TCBS平板上培养后均出现黄色且大小、形态一致的菌落。
挑选其中优势菌落,单菌落接种于400μLLB液体培养基(表1),37℃振荡培养12h后在菌液中添加等体积浓度为40%的灭菌甘油,于-80℃保存。
2.316SrRNA序列分析
将测序结果进行拼接通过Blast进行分析,并通过MEGA7.0进行多序列比对和同源建树,以Neighbor-Joining法构建系统发育进化树。分析显示,S116SrRNA基因序列为1191bp,Blast结果显示该菌株同哈维氏弧菌其他菌株差异较大,与2018年被报道的V.harveyihq-V149聚为一支(图4)。
2.4细菌生化特性
哈维氏弧菌S1的生理生化反应结果显示(表2),阿拉伯糖、鸟氨酸脱羧酶葡萄糖、赖氨酸脱羧酶、精氨酸脱羧酶、甘露醇、蕈糖等反应为阳性,蛋白胨水、精氨酸双水解酶、核糖、肌醇、硫化氢等反应为阴性。同《伯杰细菌鉴定手册》《常见细菌鉴定手册》上哈维氏弧菌的生化特征吻合。
2.5药敏试验结果
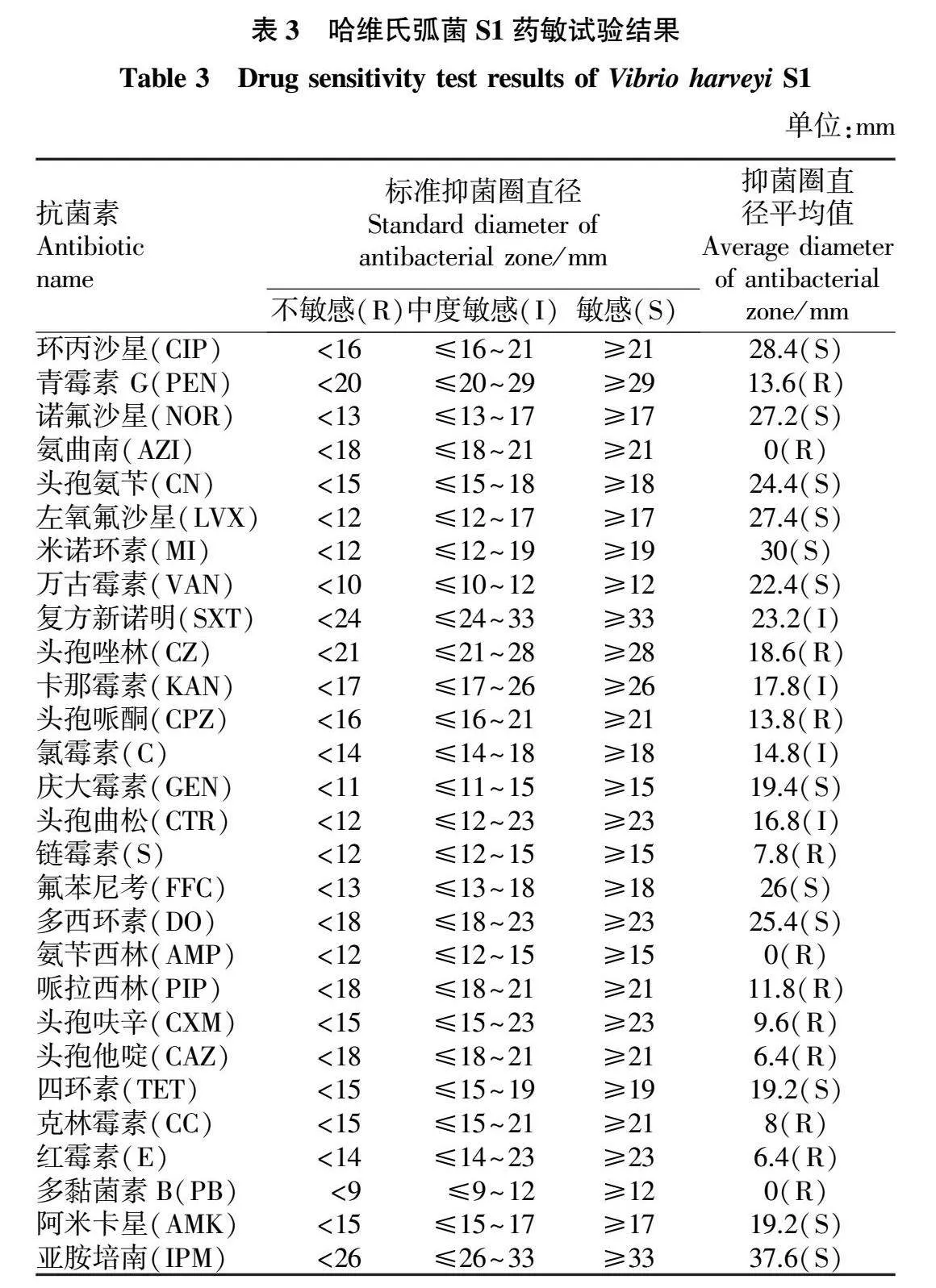
由表3可知,药敏试验结果显示,斜带石斑鱼源哈维氏弧菌对环丙沙星(CIP)、诺氟沙星(NOR)、头孢氨苄(CN)、左氧氟沙星(LVX)、米诺环素(MI)、万古霉素(VAN)、庆大霉素(GEN)、氟苯尼考(FFC)、多西环素(DO)、四环素(TET)、阿米卡星(AMK)、亚胺培南(IPM)敏感,对青霉素G(PEN)、氨曲南(AZI)、头孢唑林(CZ)、头孢哌酮(CPZ)、链霉素(S)、氨苄西林(AMP)、哌拉西林(PIP)、头孢呋辛(CXM)、头孢他啶(CAZ)、克林霉素(CC)、红霉素(E)、多黏菌素B(PB)不敏感。
2.6细菌生长曲线
根据不同时间点分光光度计检测结果和活菌计数结果绘制哈维氏弧菌S1的生长曲线(图5、6),结果显示,哈维氏弧菌S1指数生长时间为5~12h,在该阶段中,哈维氏弧菌S1快速增殖,在12h出现峰值,随后OD600下降后趋于平稳,活菌计数结果与OD600的变化趋势基本吻合。
哈维氏弧菌S1的OD600与培养时间的关系表达式为:
Y1=0.0298200+0.0205400X+0.0247900X2-0.0007134X3(R2=0.9977)
哈维氏弧菌S1的菌落形成数量与培养时间的关系表达式为:
Y2=1387675+387588433X-306607341X2+65425698X3(R2=0.5418)
上述公式R2均大于0.4,表明哈维氏弧菌S1的OD600、菌落形成数量与培养时间具有相关性,但公式中哈维氏弧菌S1的菌落形成数量与培养时间的关系表达式R2lt;0.99,不足以作为直接计算公式预测哈维氏弧菌S1菌落形成数量数值,而哈维氏弧菌S1的OD600与培养时间的关系表达式R2gt;0.99,具有预测意义。
3结论与讨论
对暴发病害的湛江斜带石斑鱼养殖场样品Ec 1、Ec 2、Ec 3进行目检时,其皮肤表面的白色隆起疥疮是最显著特征,因此初步怀疑是诺卡氏菌感染导致鱼体皮肤、肌肉和内脏滋生白色结节[20-24]。但在随后的解剖检查中发现,Ec 1、Ec 2、Ec 3肌肉与内脏均无白色结节,证明并不是诺卡氏菌感染。但Ec 1、Ec 2、Ec 3皮肤病变同常见石斑鱼感染哈维氏弧菌后的症状,如大面积溃烂、暴露肌肉组织[25],都有明显差异。此外Ec 1、Ec 2、Ec 3肝脏都有充血现象,这同半滑舌鳎感染哈维氏弧菌8 - 0635症状一致[26]。肝脏细菌分离纯化后鉴定结果同2021年SBY-G的分离纯化后鉴定结果相同,证明哈维氏弧菌S1感染鱼体体内组织,具有致病力。但脾脏糜烂的症状较少在哈维氏弧菌感染的鱼类身上出现,不排除与感染程度有关,也可能还有其他细菌共感染导致这一症状。
16SrRNA是细菌高度保守的基因,是对细菌进行分类与鉴定的重要参考标准之一,选择这一基因对哈维氏弧菌S1进行分类鉴定。哈维氏弧菌S1的16SrRNA的鉴定结果同2018年被报道的V.harveyihq-V149明确地聚为一支,同其他主要流行的哈维氏弧菌分类地位较远,说明哈维氏弧菌S1感染途径更易追踪,并且对海水养殖中的哈维氏弧菌传播途径的相关研究具有更深意义。
16S rRNA鉴定结果与药敏结果结合,让它的药敏试验更具研究意义[27-28]。与其他哈维氏弧菌药敏试验结果进行比较,其他石斑鱼源哈维氏弧菌毒株敏感的氯霉素,哈维氏弧菌S1对其变成了中度敏感,而其他石斑鱼源哈维氏弧菌毒株不敏感的抗生素,如链霉素,哈维氏弧菌S1依旧不敏感。当然也有其他石斑鱼源哈维氏毒株不敏感的四环素,哈维氏弧菌S1却对其敏感,而从患病泥蚶上分离出的哈维氏弧菌J14等同样对四环素敏感,却与哈维氏弧菌S1同源性并不高。哈维氏弧菌S1在药敏试验中同其他毒株有差异的结果进一步体现了它在传播途径和进化地位上与较多报道的致病哈维氏弧菌的差异性,证明其研究价值。这对研究不同毒株哈维氏弧菌毒力因子差异以及造成的病理现象差异有一定参考价值,而对不同毒株的哈维氏弧菌感染后是否会造成转录水平和蛋白水平的差异化表达的研究[29-30],也是未来需要哈维氏弧菌S1的分离与鉴定作为研究基础的研究之一。
为后续对斜带石斑鱼源的哈维氏弧菌S1研究试验准备,对哈维氏弧菌S1的生长曲线进行绘制,发现哈维氏弧菌S1在5h时OD600进入0.4~0.6范围,随后快速增长,因此哈维氏弧菌S1在5h时进入对数增长期。而在12h后进入平台期,但活菌计数结果显示,16h是菌落形成数量结果最高的时间点。而在16h之后,菌落形成数量有明显下降,但OD600数值稳定,证明此时哈维氏弧菌S1进入衰亡期,TSB液体培养基中总菌数没有明显变化,但活菌数快速减少。哈维氏弧菌S1OD600和菌落形成数量的生长曲线证明,OD600和菌落形成数量并不成线性关系,无法通过时间或者OD600检测结果直接预测菌落形成数量,但时间和OD600检测结果同菌落形成数量仍存在相关性。根据生长曲线绘制结果,可以判断,5~16h是哈维氏弧菌S1的对数生长期,活性强,适宜使用这期间的菌液进行试验。
参考文献
[1]贝维全,古荣锋,贾志军.石斑鱼新型网箱健康养殖技术[J].河北渔业,2010(9):10-11.
[2]徐乐俊,吴反修.2019中国渔业统计年鉴[M].北京:中国农业出版社,2019.
[3]黄进光,谢恩义.云纹石斑鱼工厂化健康育苗技术初探[J].水产养殖,2010,31(4):8-9.
[4]ZHANGYB,ZHANGJX,SUNXL.Advancesininfluenceofseawatereutrophicationonmarinebacteria[J].Actaecologicasinica,2012,32(10):3225-3232.
[5]王保坤,余俊红,李筠,等.花鲈弧菌病病原菌(哈维氏弧菌)的分离与鉴定[J].中国水产科学,2002,9(1):52-55.
[6]滕爽爽,张炯明,张利兵,等.泥蚶致病性哈维氏弧菌的分离与鉴定[J].水产科学,2022,41(4):547-555.
[7]刘迪,房文红,周红霞,等.虾源哈维氏弧菌的致病性与生物学特性比较分析[J].海洋渔业,2017,39(2):197-205.
[8]WANQJ,WULQ,YANGQH,etal.FirstidentificationandpathogenicitystudyofVibrioharveyiisolatedfromdiseasedAmericaneel(Anguillarostrata)cultivatedinfreshwater[J].Aquacultureresearch,2022,53(4):1240-1253.
[9]SHENGM,SHICY,FANC,etal.Isolation,identificationandpathogenicityofVibrioharveyi,thecausalagentofskinulcerdiseaseinjuvenilehybridgroupersEpinephelusfuscoguttatus×Epinepheluslanceolatus[J].Journaloffishdiseases,2017,40(10):1351-1362.
[10]HALDARS,MAHARAJANA,CHATTERJEES,etal.IdentificationofVibrioharveyiasacausativebacteriumforatailrotdiseaseofseabreamSparusauratafromresearchhatcheryinMalta[J].Microbiologicalresearch,2010,165(8):639-648.
[11]孔明慧,黄丽芳,廖国威,等.豹纹鳃棘鲈哈维氏弧菌的分离鉴定与耐药分析[J].仲恺农业工程学院学报,20234(4):16-20.
[12]OTTAVIANID,BACCHIOCCHII,MASINIL,etal.etal.Antimicrobialsusceptibilityofpotentiallypathogenichalophilicvibriosisolatedfromseafood[J].Internationaljournalofantimicrobialagents,20018(2):135-140.
[13]李营,王波,张培玉,等.哈维氏弧菌引起的条纹海马表皮溃疡综合征的研究[J].水产学报,2019,43(5):1298-1307.
[14]王宝珍,葛辉.珍珠龙胆石斑鱼(Epinephelusfuscoguttatus♀×E.lanceolatus♂)幼鱼溃疡病病原分离及鉴定分析[J].渔业研究,2019,41(6):494-501.
[15]LAIXL,WUHC,GUOWJ,etal.Vibrioharveyico-infectedwithCryptocaryonirritanstoorange-spottedgroupersEpinepheluscoioides[J].Fishamp;shellfishimmunology,202139:1-13.
[16]ALIAMATUL-SAMAHAHM,MOHAMADA,AL-SAARIN,etal.DraftgenomesequencedataofVibrioharveyiVH1isolatedfromadiseasedtigergrouper,Epinephelusfuscoguttatus,culturedinMalaysia[J].Datainbrief,2022,44:1-6.
[17]陈献稿,吴淑勤,石存斌,等.斜带石斑鱼病原菌(哈维氏弧菌)的分离与鉴定[J].中国水产科学,2004,11(4):313-317.
[18]裴立硕,朱永龙,毛晴,等.点带石斑鱼致病性哈维氏弧菌的分离鉴定及药敏试验[J].天津农学院学报,20228(4):35-40.
[19]崔婧,范雪亭,刘文竹,等.华南地区海水养殖鱼类主要弧菌病原的分离与鉴定[J].海南大学学报(自然科学版),2014,32(3):244-251.
[20]KINGAS,CASTROJG,DOWGC.NocardiafarcinicalungabscesspresentinginthecontextofadvancedHIVinfection:Spontaneousresolutioninresponsetohighlyactiveantiretroviraltherapyalone[J].Canadianjournalofinfectiousdiseasesandmedicalmicrobiology,2009,20(3):e103-e106.
[21]袁思平,王国良,金珊.养殖鱼类致病诺卡氏菌研究进展[J].微生物学通报,2006,33(2):137-141.
[22]张媛,张媛媛,李振军,等.诺卡氏菌研究进展[J].中国人兽共患病学报,2012,28(6):628-634.
[23]吴迪,阮泽超,王跃斌,等.小黄鱼(Larimichthyspolyactis)鰤鱼诺卡氏菌的分离及鉴定[J].海洋与湖沼,20254(4):1182-1190.
[24]吕丽丽,梅飞,曹守林,等.加州鲈源鰤鱼诺卡氏菌的分离鉴定及致病性[J].微生物学通报,20248(12):4765-4775.
[25]石存斌,胡学峰,李宁求,等.哈维氏弧菌SpGY020601株的鉴定和生物学特性分析[J].水产学报,2004,28(B12):117-123.
[26]吴雅婷,汪笑宇,汤青平,等.半滑舌鳎体表溃疡症细菌性病原的分离鉴定及组织病理学研究[J].中国农业科技导报,20225(6):135-143.
[27]曾德乾,冯娟,徐力文,等.海水养殖鱼哈维弧菌分离株的耐药谱型分析[J].中国水产科学,2015,22(1):129-138.
[28]RANLM,WANGXL,HEXX,etal.GenomicanalysisandchitinasecharacterizationofVibrioharveyiWXL538:Insightintoitsadaptationtothemarineenvironment[J].Frontiersinmicrobiology,20214:1-15.
[29]NAKAYAMAT,ITOE,NOMURAN,etal.ComparisonofVibrioharveyistrainsisolatedfromshrimpfarmsandfromculturecollectionintermsoftoxicityandantibioticresistance[J].FEMSmicrobiologyletters,2006,258(2):194-199.
[30]DENGYQ,XULW,CHENHX,etal.Prevalence,virulencegenes,andantimicrobialresistanceofVibriospeciesisolatedfromdiseasedmarinefishinSouthChina[J].Scientificreports,2020,10(1):1-8.
