微生物菌肥对碱胁迫下新疆野苹果幼苗生理特性的影响
2025-01-20左晓婷王超鹏张杭孙玉芳

摘 要:【目的】通过测定微生物菌剂及碱处理下新疆野苹果幼苗的相关生理指标,明确以地衣芽孢杆菌为主要功能菌的微生物菌肥对碱胁迫下新疆野苹果幼苗生理特性的影响,为提高新疆野苹果幼苗抗逆性提供理论依据。【方法】以盆栽新疆野苹果实生幼苗为试验材料,对盆栽土壤用1∶1 000的复合微生物菌液进行灌溉,1个月之后,对盆栽土壤用NaHCO3∶Na2CO3为1∶1的碱液进行处理,对照为清水灌溉未经碱液处理的盆栽幼苗,设置对照组(CK)、碱胁迫组、碱+菌肥组3个处理,测定并分析不同处理下土壤的pH、电导率以及新疆野苹果幼苗叶片光合色素、光合参数、渗透调节物质以及抗氧化酶活性等生理指标。【结果】结果表明,微生物菌肥通过改变土壤pH、EC,降低细胞膜膜脂过氧化程度,增加新疆野苹果叶片叶绿素的含量、提高类胡萝卜素/总叶绿素的比例、维持气孔导度和胞间CO2浓度,调节渗透调节物质含量等方式,进而减轻碱胁迫对新疆野苹果幼苗的伤害。【结论】微生物菌肥可缓解土壤盐碱度,也可影响碱胁迫下新疆野苹果幼苗生理响应,进而提高新疆野苹果碱胁迫下的生存能力。
关键词:新疆野苹果;微生物菌肥;碱胁迫;生理特性
文章编号:2096-8108(2025)01-0014-07 中图分类号:S661.1中图分类号
文献标识码:A文献标志码
Effects of Microbial Fertilizer on Physiological Characteristics of Malus sieversii under Alkali Stress
ZUO Xiaoting,WANG Chaopeng,ZHANG Hang,SUN Yufang*
(College of Life Sciences, Xinjiang Agricultural University, Urumqi Xinjiang 830052, China)
Abstract:【Objective】The effects of microbial fertilizer with Bacillus licheniformis as the main functional bacteria on the physiological characteristics of Malus sieversii seedlings under alkali stress were determined by measuring the related physiological indexes of Malus sieversii seedlings under microbial agents and alkali treatment, so as to provide theoretical basis for improving the stress resistance of Malus sieversii seedlings. 【Methods】The potted Malus sieversii seedlings were used as experimental materials, and the potted soil was irrigated with 1∶1 000 compound microbial bacteria solution. After one month, the potted soil was treated with NaHCO3∶Na2CO3 as 1∶1 alkali solution. The control group was treated with clear water to irrigate the potted seedlings without alkali solution. The control group (CK), alkali stress group and alkali + bacterial fertilizer group were set up. The pH and conductivity of the soil under different treatments and the photosynthetic pigments, photosynthetic parameters, osmotic adjustment substances and antioxidant enzyme activities of Malus sieversii seedlings were measured and analyzed. 【Results】The findings demonstrated that the application of microbial fertilizer effectively mitigated the detrimental effects of alkali stress on Malus sieversii seedlings. This was achieved through alterations in soil pH and EC, reduction in membrane lipid peroxidation, enhancement of chlorophyll content, elevation of carotenoid to total chlorophyll ratio, maintenance of stomatal conductance and intercellular CO2 concentration, as well as regulation of osmoregulatory substance levels. 【Conclusion】 The application of microbial fertilizer can mitigate soil salinity and modulate the physiological response of Malus sieversii seedlings, thereby enhancing their adaptability to alkali stress.
Keywords:Malus sieversii; microbial fertilizer; alkaline resistance; physiological character
土壤盐碱化是农业可持续生产和生态修复面临的严重问题之一[1]。其中,地表层土壤中含Na2CO3、 NaHCO3等碱性盐的土壤称为碱土,此类土壤的溶液一般呈强碱性(pHgt;8.5),对植物产生的伤害不仅包括盐胁迫造成的离子胁迫、渗透胁迫和氧化胁迫,还包括由HCO-或 CO-3引起的离子胁迫及高 pH胁迫,伤害程度明显重于盐胁迫[2]。因此,在生产中如何降低碱胁迫对植物的伤害,提高植物对碱胁迫的抵抗能力成为影响农业可持续生产和生态修复的重要方面。
微生物在植物生长、发育以及提高抗逆性中具有重要作用[3],随着研究的深入,人们从植物的根际土壤中分离出了假单胞菌、芽孢杆菌等对植物具有促生作用的微生物菌种[4],并以此为基础,开发出了具有多功能的微生物肥料,如放线菌制剂、固氮蓝绿藻肥、丛枝菌根(AM菌根真菌)菌剂、EM菌剂等[5]。不同微生物菌肥功能不同,有的具有固氮、解磷或产生铁载体等作用[6-7],有的具有促长、防病、土壤修复、提高植物抗性等作用[8-9],还有一些复合微生物菌肥兼具以上功能。当前已有关于微生物菌肥提高植物抗盐碱胁迫的研究,其功能菌株主要包括地衣芽孢杆菌、丛枝菌根真菌(AMF)等[10]。研究结果表明,这类微生物菌肥可平衡土壤的酸碱度,促进营养物质吸收[11];同时,可帮助植物通过积累无机离子和合成渗透调节物质,参与调节植物体内渗透平衡,从而降低细胞水势,促进吸水[12];此外,还通过释放促生物质或刺激免疫系统诱导植物的系统抗性,清除活性氧等有害物质,进而调节植物对盐渍环境的适应[13]。
新疆野苹果(Malus sieversii (Ledeb.) Roem.)又名塞威士苹果,是新疆野果林中珍贵的野生植物资源[14]。作为重要的苹果砧木,新疆野苹果已被内地苹果产区引用多年,突出表现为抗旱性、抗寒性较强[15]。于玮玮等[16]研究了新疆野苹果在盐胁迫下的生长指标,认为新疆野苹果具有一定的耐盐性;但吴玉霞、刘兵等[17]通过比较不同苹果品种和新疆野苹果的耐盐性,结果均表明新疆野苹果的耐盐碱性较低。因此,如何提高新疆野苹果的抗盐碱性,成为影响制约新疆野苹果作为砧木利用和发展的重要方面。本试验通过测定经微生物菌肥处理后碱胁迫下新疆野苹果幼苗的相关生理指标,旨在明确微生物菌肥在新疆野苹果抗碱胁迫中的作用,为新疆野苹果在高盐碱土壤上的栽培提供理论依据。
1 材料与方法
1.1 试验材料及处理
试验材料:以种子繁殖的2年生新疆野苹果实生幼苗为试材,实生苗高度为50 cm左右,种植于高25 cm、直径20 cm的圆形花盆中,每盆1株,室外培养。培养基质为新疆地区的棕钙土和蛭石按体积比1∶1混合而成,每盆装入5 kg。经前期测定,土壤的主要营养成分为: Na+ 含量为 0. 039 g·kg-1 DW;K+含量为 0. 011 g·kg-1 DW;Ca2 +含量为 0. 726 g·kg-1 DW;CO2-3含量为 0. 013 g·kg-1 DW。
微生物肥料:主要功能菌种为地衣芽孢杆菌的复合微生物菌剂,生产厂家为新疆柯源丰农业科技服务有限公司。
将新疆野苹果幼苗分为两组,一组正常管理,定期浇水,另一组用1∶1 000的菌液稀释液代替水定期浇灌,其他管理一致。1个月之后,选择大小、高度一致的新疆野苹果幼苗(高度50 cm左右,茎粗0.5 cm)进行以下处理,处理1:前期未经微生物处理的幼苗作为对照;处理2:前期未经微生物处理的幼苗进行碱处理,处理液为含NaHCO3 和Na2CO3(1∶1)的碱液;处理3:前期经微生物处理的幼苗进行碱处理,处理液为含NaHCO3 和Na2CO3(1∶1)的碱液。为避免一次性过高浓度的碱对植物造成伤害,采用逐步提高浓度的方法(分4次依次加入含Na+ 浓度分别为30 mmol·L-1、55 mmol·L-1 、75 mmol·L-1、100 mmol·L-1的碱液)。以上每个处理,分别做3个重复,每个重复5株幼苗(5盆),共计15株幼苗,20 d后,进行相关指标的测定。
1.2 试验方法
1.2.1 样品采集
土壤样品的采集:土壤样品分5次取,处理前取1次样,以后每处理1次,于次日取1次样,共取5次,用以测定土壤pH和电导率的变化,以明确微生物菌肥对土壤pH和电导率的影响。
叶片采集:碱胁迫15 d后,取不同处理下幼苗大小一致的功能叶,每盆植物取5~6片,用蒸馏水清洗干净后,用于丙二醛(MDA)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、可溶性糖、可溶性蛋白脯氨酸(Pro)等指标的测定[18]。
1.2.2 土壤pH和电导率的测定
于每个处理的盆栽中,取2 g土壤,加入5 mL的蒸馏水,放置摇床充分摇匀溶解30 min后取出,用pH计和电导率仪进行测量[18]。
1.2.3 光合色素的测定
采用95%乙醇-分光光度计[9]的方法测量并计算叶片叶绿素a、叶绿素b、类胡萝卜素、总叶绿素以及叶绿素a/b、类胡萝卜素/总叶绿素的比值[19]。
1.2.4 抗氧化酶活性测定
过氧化物酶(POD)活性的测定采用愈疮木酚法[11];超氧化物歧化酶(SOD)的测定采用NBT光化还原法[10];过氧化氢酶(CAT)的测定采用紫外吸收法[18-19]。
1.2.5 渗透调节物质含量测定
可溶性糖含量的测定采用蒽酮比色法[18];可溶性蛋白含量采用考马斯亮蓝法[18];脯氨酸(Pro)含量测定用茚三酮显色法[19]。
1.2.6 丙二醛含量测定
丙二醛(MDA)含量测定采用硫代巴比妥酸显色法[19]。
1.2.7 光合作用特征测定
选择晴天上午11:00-12:00进行光合参数的测定,所用仪器为光合测定仪Li-6400(美国LI-COR公司生产),测定光合参数为净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr) 和胞间CO2浓度(Ci),每盆幼苗分别选取3片相同的功能叶进行测定,重复3次,每3 d测1次,连续测量3次。
1.3 数据处理
采用SPSS.19软件进行数据分析,组间差异显著性通过ANOVA检验分析,相关性分析及绘制作图均采用Origin2021软件。
2 结果与分析
2.1 碱处理下土壤pH和电导率的变化
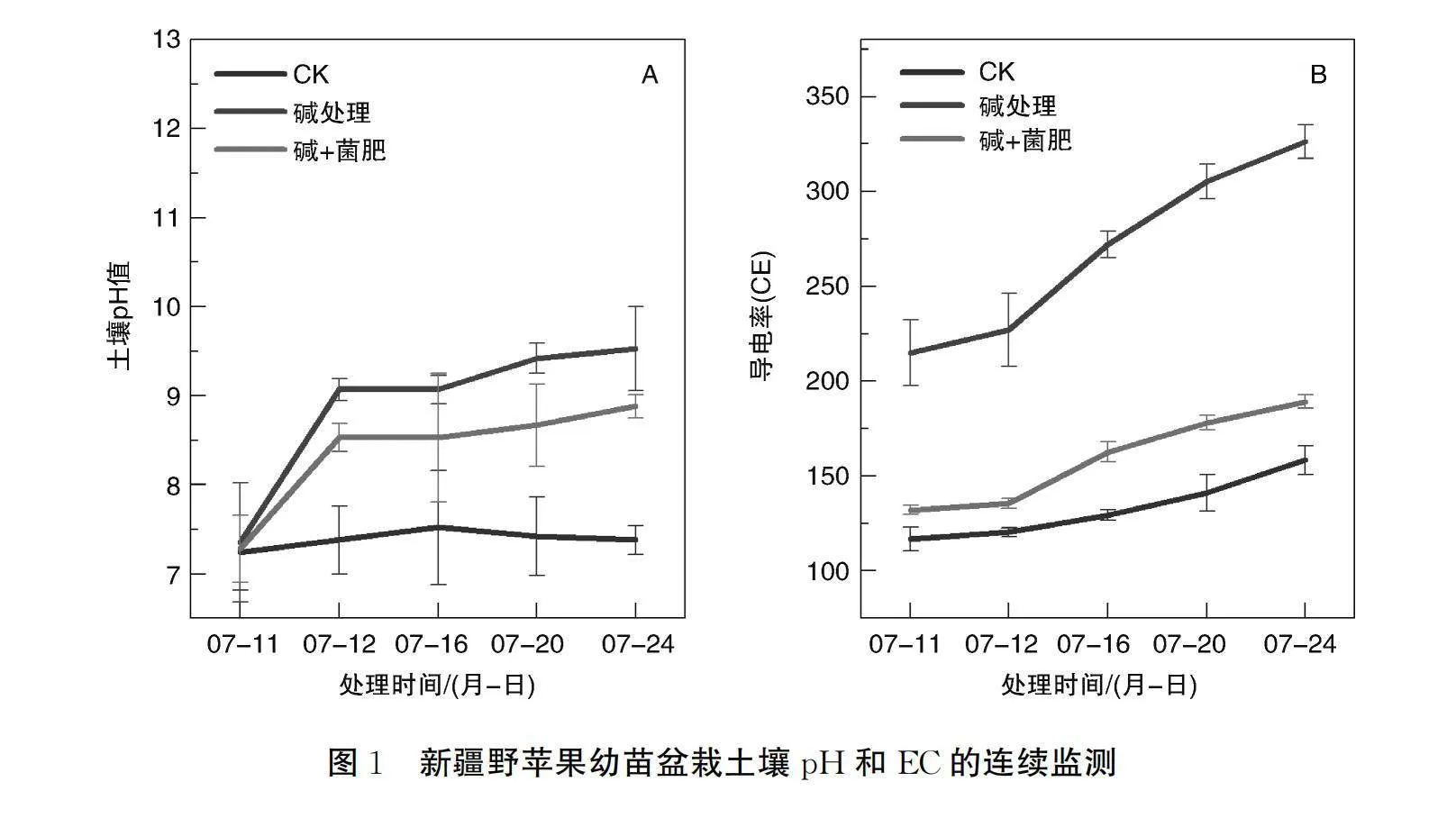
如图1所示,本试验共进行了连续4次碱胁迫处理,处理前盆栽土壤pH为7.2左右,随着碱处理次数的增加,土壤的pH均逐渐升高(见图1-A),但在碱胁迫和菌肥+碱胁迫处理下土壤pH呈现显著差异,碱胁迫下的pH均显著高于菌肥+碱胁迫处理下的pH(P<0.05)。碱胁迫下土壤的pH最后维持在9.5以上,而碱+菌肥处理下土壤pH维持在9.0左右,显著低于碱胁迫处理下的pH(P<0.01)。电导率的变化呈现出和pH相同的趋势(图1B),即随着碱胁迫次数的增加电导率逐渐增强,但是单纯碱胁迫和碱+菌肥处理下表现出差异极显著 (P<0.01),和对照相比,碱胁迫下土壤电导率的上升比例达到51.4%、碱+菌肥处理只上升了16.3%。总体来看,碱胁迫下土壤pH和EC(见图1-B)均显著上升,但微生物菌肥可使其上升幅度显著减小。
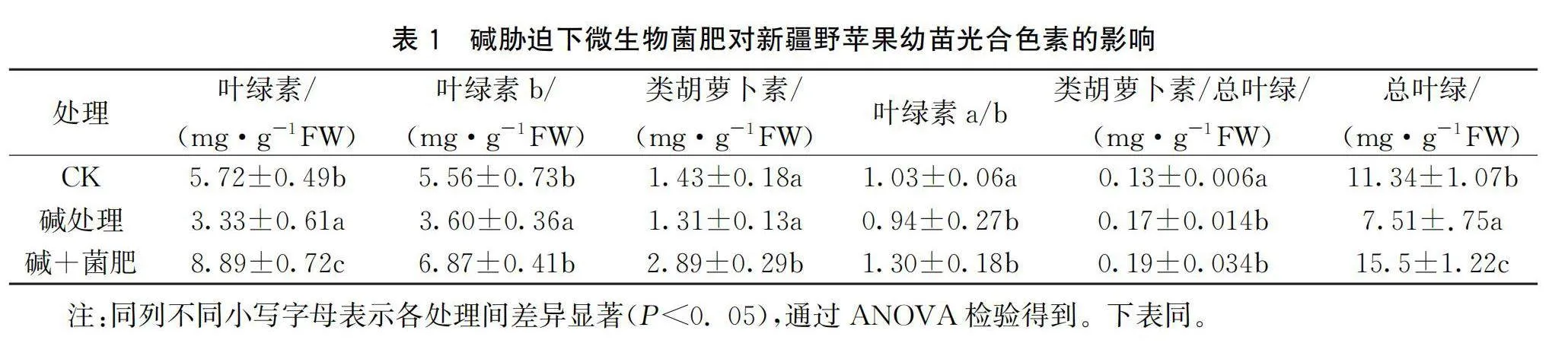
2.2 碱胁迫下微生物菌肥对新疆野苹果叶片光合色素含量的影响
如表1所示,不同处理下,光合色素的含量呈现显著差异 (P<0.05)。碱处理下,叶绿素a,叶绿素b以及总的叶绿素含量均呈现显著下降趋势(见表1)。然而,当加入微生物菌肥后,叶绿素a、叶绿素b以及总的叶绿素含量均显著上升,甚至高于对照(CK)。碱处理对叶绿素a/b比值影响不大,但在微生物菌肥的作用下,叶绿素a/b比值显著升高。此外,碱处理下类胡萝卜素含量维持不变,但由于总叶绿素含量下降,导致类胡萝卜素/总叶绿素中的比值显著上升。微生物菌肥则显著提高类胡萝卜素的含量,且其增加幅度高于总叶绿素的增加幅度,使得类胡萝卜素/总叶绿素的比值显著上升。
2.3 不同土壤处理对新疆野苹果叶片光合作用的影响
如表2所示,碱胁迫显著影响新疆野苹果幼苗的净光合速率,胞间CO2浓度,蒸腾速率以及气孔导度,使其显著下降(见表2)。但是加入微生物菌肥后,其净光合速率则可维持在对照水平。此外,微生物菌肥还提高了胞间CO2浓度,增加了气孔的开度,提高了蒸腾速率,可见微生物菌肥可提高碱胁迫下新疆野苹果幼苗的光合作用,并影响其蒸腾速率。
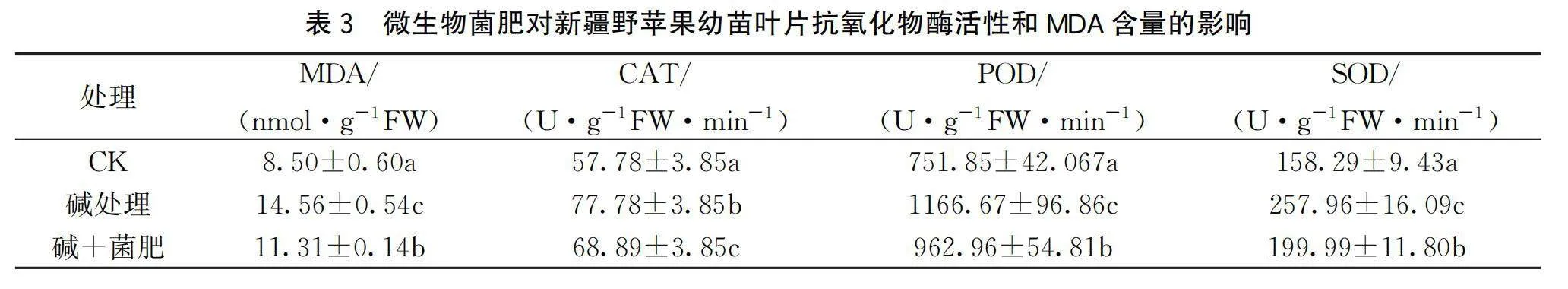
2.4 不同土壤处理下新疆野苹果叶片抗氧化酶活性和MDA含量的变化
如表3所示,和对照相比,碱胁迫和碱+菌肥处理下,新疆野苹果幼苗叶片MDA含量均有所升高,但其含量的上升幅度差异显著。碱胁迫下,叶片MDA的含量高于碱+菌肥处理下的含量。与此同时,其叶片抗氧化酶SOD、POD、CAT的活性也呈现出类似的变化趋势,即和对照相比,在碱胁迫和碱+菌肥处理下,叶片SOD、POD、CAT的活性均有所上升,但是在碱胁迫下其活性高于碱+菌肥处理下的活性。
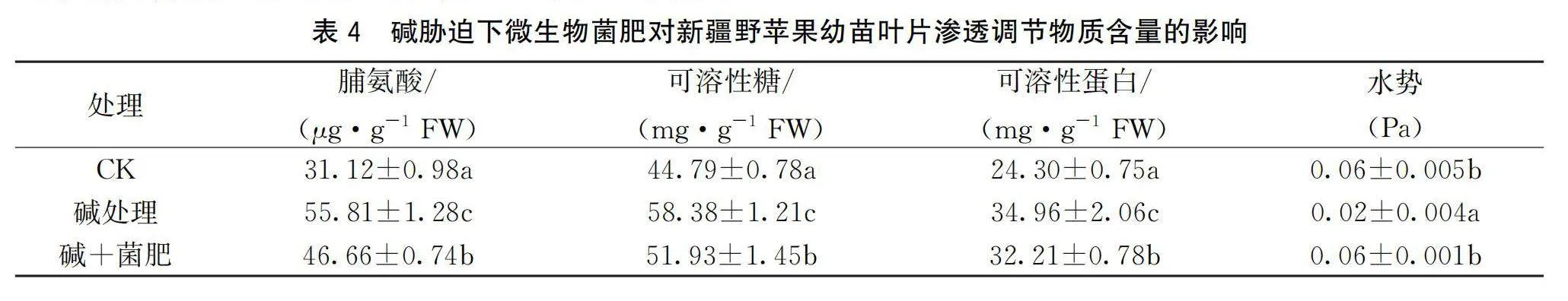
2.5 不同土壤处理下新疆野苹果叶片水势及渗透调节物质含量的变化
如表4所示,和对照相比,碱胁迫处理下使新疆野苹果幼苗的叶片的水势显著下降,而菌肥+碱的处理下则使叶片水势维持在较高水平。分析其渗透调节物质含量发现,碱胁迫和菌肥+碱处理使新疆野苹果幼苗叶片中脯氨酸含量、可溶性糖含量以及可溶性蛋白含量均显著提高,以增强其抵抗渗透胁迫的能力。但升高幅度不同,碱胁迫下,其增加程度略高于菌肥+碱胁迫下,即菌肥+碱处理之下以上3种渗透调节物质的含量均略低于单纯碱胁迫处理下的含量。
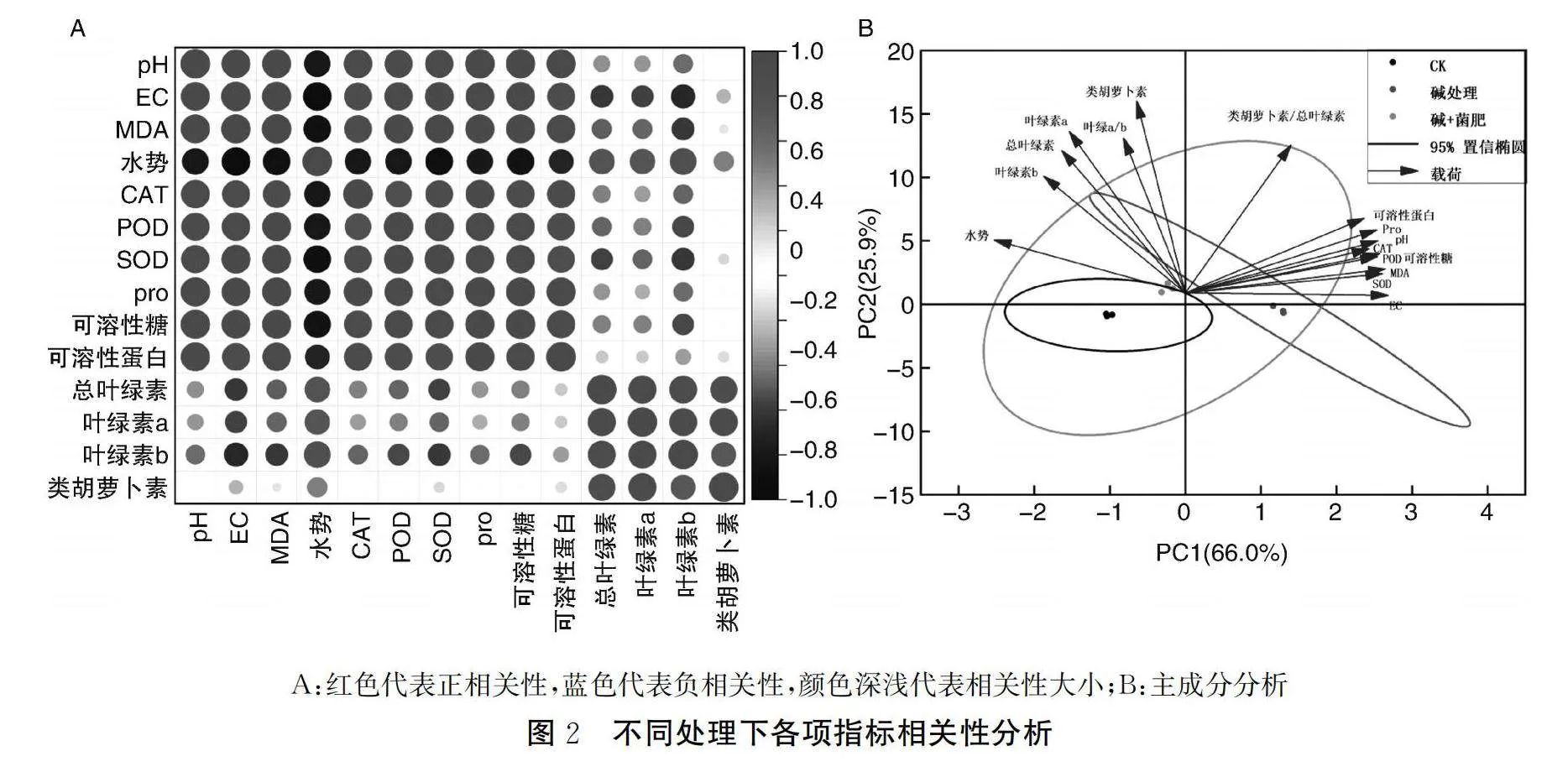
2.6 不同处理土壤pH值、EC与新疆野苹果叶片生理指标的相关性分析
土壤pH值和EC是影响植物生长的重要因素,土壤微生物的使用可降低土壤pH和EC(见图1),不同处理下,土壤pH、EC和新疆野苹果幼苗叶片生理指标呈现不同的相关性。如图2A所示,土壤 pH、EC和幼苗叶片水势、总叶绿素、叶绿素a、叶绿素b及类胡萝卜含量呈显著负相关(Plt;0.05),和CAT、POD、SOD、脯氨酸(Pro)、可溶性糖及可溶性蛋白均呈显著正相关(Plt;0.01)。可见,微生物菌肥降低土壤pH值和EC可能是引起其他生理指标发生变化的主要因素。
不同处理条件下,新疆野苹果幼苗叶片各项生理指标的变化存在差异,对其做主成分分析(见图2B),结果显示:主要有两个主成分PC1和PC2,两者的贡献率分别为66.0% 和25.9%,总计贡献率达到92%。第一主成分中,可溶性蛋白、脯氨酸含量、pH 、EC、抗氧化酶活性及MDA是主要的影响参数,影响幼苗对碱胁迫的抗性;第二主成分中,光合色素含量为主要影响参数,影响植物在不同处理下的光合作用,第一主成分对幼苗抗性的影响大于第二主成分。
3 讨论
3.1 微生物菌肥调节土壤pH值和EC
土壤酸碱度是影响植物生长发育的重要因素,碱胁迫往往伴随着盐分胁迫和高pH值的双重胁迫,对植物造成更严重的损伤。微生物菌肥可改善土壤的理化性质[20],增加土壤有益微生物的数量,有利于提高土壤有机质、营养成分,加速淋盐、抑制返盐,降低土壤的容重和盐分含量,一定程度上还可增加土壤碱解氮含量,降低土壤的pH值[21],从而为植物的生长发育提供了良好的生存空间,促进植物的生长发育。本试验结果显示,相比于单纯的碱胁迫,微生物菌肥显著降低了土壤pH,并使其电导率也显著降低,这与前人研究结果一致[22-23]。可见微生物菌肥的加入改善了土壤理化性质,降低了土壤pH值和电导率,为新疆野苹果幼苗的生长提供了较好的环境,这也可能是碱+菌肥条件下新疆野苹果幼苗相关生理指标的变化较碱胁迫差异显著的原因之一。
3.2 调节碱胁迫下新疆野苹果幼苗的光合作用
光合作用是植物最基本的生命活动之一,逆境中光合作用的大小可作为反应植物抗性的指标之一[24]。已有大量研究证明,碱胁迫使植物叶片光合色素的含量、光合速率、蒸腾作用、气孔导度以及胞间CO2浓度等均显著下降[25]。有研究发现,微生物菌肥在高盐碱条件下,仍然能通过产生IAA和EPS等显著缓解植物的盐碱胁迫,增强植物的光合能力,促进植物在高盐碱条件下的生长[26-27]。本试验结果显示,单纯的碱胁迫下,以上指标也发生相同的变化趋势,但是微生物菌肥可逆转这种变化,使得碱胁迫下新疆野苹果幼苗叶片光合速率维持不变,这和其他相关内容研究报道结果一致。光合速率的大小受多种因素的影响,其中光合色素是影响光合作用的关键因素之一。碱胁迫下微生物菌肥可使光合色素含量显著增加,甚至高于对照水平。此外,类胡萝卜素含量的大小和植物的抗性相关,逆境胁迫下,其含量的升高具有保护光合器官免受伤害[28]。本项研究发现,微生物菌肥可显著提高新疆野苹果幼苗叶片中类胡萝卜素的含量,使类胡萝卜素/总叶绿素的比值显著上升(Plt;0.01),以保护光合器官免受碱胁迫的伤害,进而维持其正常光合速率。此外,微生物菌肥还可以使植物叶片气孔导度和胞间CO2浓度维持在较高水平,这也可能是微生物菌肥可维持其光合速率不变的原因之一,而气孔导度的增加可促进叶片蒸腾速率的增大。
3.3 参与调节碱胁迫下新疆野苹果幼苗渗透平衡
盐碱胁迫下会使植物产生渗透胁迫,导致植物体内水分含量降低。植物可通过积累体内溶质的含量以降低渗透势,提高吸水能力。有机溶质包括可溶性糖、可溶性蛋白和脯氨酸等渗透调节物质的积累是维持植物细胞膨压和增强植物耐盐碱性的途径之一[29]。一些微生物自身具有产脯氨酸的能力,这不仅可诱导植株体内的游离脯氨酸的积累,还可增加植株对渗透胁迫的耐受性[30]。还有一些微生物则可通过诱导植物系统性抗性促进渗透物质的积累,进而帮助植物抵抗盐碱环境下的渗透胁迫[31]。在本研究中,碱胁迫使新疆野苹果幼苗叶片水势显著降低,相应的,其叶片中可溶性糖、可溶性蛋白和脯氨酸含量显著升高,以维持其在碱胁迫下的保水、吸水能力。但和单纯的碱胁迫处理相比,微生物菌肥的使用,可显著提高碱胁迫下叶片的水势,使其维持在对照水平,但可溶性糖、可溶性蛋白和脯氨酸的含量较碱胁迫下降低(Plt;0.05),而高于对照,这与微生物提高渗透调节物质的积累的研究结果不一致。分析以上渗透调节物质与土壤pH值和电导率(EC)的相关性,发现呈显著正相关,因此我们认为,较单纯的碱胁迫相比,碱+菌肥处理下,以上3种渗透调节物质的降低,跟土壤pH值和电导率(EC)的降低有关。有研究表明,微生物聚集在植物根系,代谢产生的有机酸能够使土壤脱盐脱碱,进而降低土壤pH值和电导率(EC),增加土壤蓄水能力[32],维持植物的吸水能力。综上,本研究认为,微生物菌肥可维持碱胁迫下新疆野苹果幼苗叶片水势不变的原因包括两个方面,一是微生物菌肥改善了碱胁迫下土壤的理化性质,降低了碱胁迫的程度,使土壤中的有效水分能更多的被吸收;二是叶片中渗透物质的增加帮助其提高了吸水能力。
3.4 参与调控抗氧化酶活性清除活性氧
丙二醛(MDA)是膜脂过氧化的产物,植物体内活性氧的大量产生会引发膜脂过氧化作用,导致细胞膜系统被破坏。一般来说,植物在盐碱胁迫时,活性氧(ROS)会大量积累,导致膜脂过氧化加剧[33],抗氧化酶活性的增强是降低膜损伤的重要方面。微生物可通过上调植物体内抗氧化酶的活性,以防止过量活性氧导致的膜质损伤[34]。本研究中,碱胁迫下新疆野苹果幼苗中MDA含量显著增加,伴随着膜脂过氧化的加剧,叶片中SOD、POD、CAT等酶活性相应显著升高,以保护细胞膜免受伤害。而相比于单纯的碱胁迫,微生物菌肥可显著降低碱胁迫下MDA含量,说明微生物菌肥可减少细胞内ROS的产生,降低细胞膜脂过氧化程度[34]。然而,不同的是,本试验的发现微生物菌肥并未使SOD、POD、CAT等酶活性显著升高,反而较碱胁迫下降低。分析以上酶活性变化与土壤pH值和电导率(EC)的相关性,发现碱+菌肥处理下新疆野苹果叶片SOD、POD、CAT等酶活性的降低跟土壤pH和电导率(EC)呈显著正相关(Plt;0.01)。因此我们认为,本试验中SOD、POD、CAT等酶活降低的主要原因是微生物菌肥改善了碱胁迫下土壤理化性质,降低了对植物的损伤 ,因此使得其活性较碱胁迫降低。
4 结论
综上,微生物菌肥可提高新疆野苹果的在碱胁迫下的生存能力。首先,可降低土壤的pH值和电导率,从而改善土壤碱过高的性状;其次,可通过提高叶绿素的含量,增加类胡萝卜素的比例,增加气孔导度,维持胞间CO2浓度在较高水平、维持水势、降低膜脂过氧化等方式,进而提高碱胁迫下新疆野苹果幼苗的生存能力。最后,该微生物菌肥降低土壤pH值和EC可能是引起其他生理指标发生变化的主要因素。以上研究内容初步证实微生物菌肥可通过影响新疆野苹果幼苗的生理特性,提高新疆野苹果幼苗在碱胁迫下的生存能力,这为后续其机理的进一步研究提供了一定的基础。
参考文献
[1] 李建国,濮励杰,朱明,等. 土壤盐渍化研究现状及未来研究 热点. 地理学报, 2012, 67(9): 1233-1245.
[2] AHMED M. Physiological effects of salt stress on plant growth[J]. Tikrit journal for agricultural sciences,2022.
[3] BERENDSEN R,CORN M. PIETERSE,BAKKER P. The rhizosphere microbiome and plant health[J]. Trends in Plant Science,2012,17(8):478-486.
[4] 郑立伟,闫洪波,张丽,等.微生物肥料发展及作用机理综述[J].河北省科学院学报, 2020, 37(1): 61-67.
[5] 武杞蔓,张金梅,李玥莹,等.有益微生物菌肥对农作物的作用机制研究进展[J].生物技术通报,2021,37(5):221-230.
[6] 黄铖程,刘景辉,杨彦明. 生物菌肥对盐碱地燕麦生理特性及土壤速效养分的影响. 北方农业学报,2018,46(5): 57-61.
[7] 吕亮雨,段国珍,苏彩风,等.木霉菌微生物菌剂对枸杞生长及土壤性状的影响[J].沈阳农业大学学报,2022,53(4):7-11.
[8] VERBON E, LIBERMAN L. Beneficial microbes affect endogenous mechanisms controlling root development. Trends in Plant Science,2016,21(3): 218-229.
[9] 马原松,黄志璞.微生物肥料的研究进展[J].山东工业技术,2017(11):259-260.
[10] 陈小娟, 刘铠鸣, 宣明刚, 等. 增强作物耐盐胁迫能力的根际促生菌筛选、鉴定及田间应用效果. 南京农业大学学报, 2020, 43(3): 452-459.
[11] UPADHYAY S, SINGH D. Effect of salt-tolerant plant growth-promoting rhizobacteria on wheat plants and soil health in a saline environment. Plant Biology, 2015, 17(1): 288-293.
[12] ZAWOZNIK M, AMENEIROS M, BENAVIDES M, et al. Response to saline stress and aquaporin expression in Azospirillum-inoculated barley seedlings. Applied Microbiology and Biotechnology, 2011, 90(4): 1389-1397.
[13] HASHEM A, ABD ALLAH E, ALQARAWI A, et al. The interaction between arbuscular mycorrhizal fungi and endophytic bacteria enhances plant growth of Acacia gerrardii under salt stress. Frontiers in Microbiology, 2016, 7: 1089.
[14] 张博,刘立强,秦伟,等.新疆野苹果抗寒生理生化机制研究[J].经济林研究,2021,39(4):60-68.
[15] 米尔卡米力·麦麦提,刘忠权,马晓东等.新疆野苹果的生存现状、问题及保护策略[J].广西植物, 2021, 41(12): 2100-2109.
[16] 于玮玮,曹波,龙鸿,等.新疆野苹果幼苗对盐胁迫的生理响应[J].华北农学报, 2016, 31(1): 5-9.
[17] 吴玉霞,马兰,何天明.苹果砧木八棱海棠和新疆野苹果耐盐性的比较[J].北方果树, 2018, (2): 4-7.
[18] 高俊凤,孙群,曹翠玲,等. 植物生理学试验指导[M]. 北京: 高等教育出版社,2006.
[19] 张志良,瞿伟菁,李小方. 植物生理学实验指导4版[M]. 北京: 高等教育出版社,2009.
[20] 逄焕成,李玉义,严慧峻,等.微生物菌剂对盐碱土理化和生物性状影响的研究[J].农业环境科学学报, 2009, 28(5): 5-10.
[21] 吴晓卫.微生物菌肥改良渭北地区盐碱化土壤作用及效果研究[D].西安:西北大学,2015.
[22] 周昕南. AM真菌对向日葵生长及耐盐碱性的影响[D].呼和浩特:内蒙古大学,2019.
[23] 赵丹丹.不同浓度微生物菌剂对番茄土壤理化性质及生长的影响[D].杨凌:西北农林科技大学,2020.
[24] 韩艺,赵继发,蔡璨,等.光捕获叶绿素a/b结合蛋白基因在植物逆境胁迫中的研究进展[J].高师理科学刊, 2023, 43(6): 79-83.
[25] 杨春武,李长有,尹红娟,等.小冰麦(Triticum aestivum-Agropyron intermedium)对盐胁迫和碱胁迫的生理响应[J].作物学报,2007,33(8):7.
[26] ASHRAF M, HASNAIN S, BERGE O, et al. Inoculating wheat seedlings with exopolysaccharide producing bacteria restricts sodium uptake and stimulates plant growth under salt stress. Biology and Fertility of Soils, 2004, 40(3): 157-162.
[27] EGAMBERDIEVA D, WIRTH S, ABD ALLAH E. Plant hormones as key regulators in plant-microbe interactions under salt stress. Plant Microbiome: Stress Response, 2018: 5:165-182.
[28] CAZZONELLI C. Carotenoids in nature: insights from plants and beyond[J]. Funct Plant Biol, 2011, 38(11): 833-847.
[29] 李子英,丛日春,杨庆山,等. 盐碱胁迫对柳树幼苗生长和渗透调节物质含量的影响[J]. 生态学报, 2017, 37(24):8511-8517.
[30] SONG S, LEI Y ,TIAN X, et al.Proline metabolism and cross tolerance to salinity and heat stress in germinating wheat seeds[J].Russian Journal of Plant Physiology, 2005, 52(6): 793- 800.
[31] SZIDERICS A, RASCHE F, TROGNITZ F, et al. Bacterial endophytes contribute to abiotic stress adaptation in pepper plants (Capsicum annuum L.). Canadian Journal of Microbiology, 2007, 53(11): 1195-1202.
[32] 郭玉鸽,申洪涛,李丽华,等.微生物菌肥对不同酸碱度土壤及烤烟生长和致香物质的影响[J].江苏农业科学, 2023, 51(3):54-62.
[33] 冯建灿,张玉洁,杨天柱. 低温胁迫对喜树幼苗SOD活性、MDA和脯氨酸含量的影响[J]. 林业科学研究, 2002(2):197-202.
[34] BROTMAN Y, LANDAU U, CUADROS-INOSTROZA , et al. Trichoderma-plant root colonization: Escaping early plant defense responses and activation of the antioxidant machinery for saline stress tolerance. PLoS Pathogens, 2013, 9(3): e1003221.
