高性能慢性伤口敷料的研究进展
2025-01-12沈佳斌朱怡蓉杨金花覃靖娴韩颜庭


慢性伤口愈合是一个复杂且耗时的过程,容易受到大肠杆菌、金黄色葡萄球菌等微生物的攻击.传统敷料如棉花、纱布等,其屏障作用较差,导致伤口容易被细菌侵入,在愈合过程中其纤维会黏附在新生的肉芽组织上,频繁换药会加剧患者痛苦甚至导致二次创伤,并且对创面愈合无明显促进作用.近十年来,新型创面敷料的相关研究不断涌现,这些敷料可以与伤口相互作用,其中的智能敷料还可以通过内置传感器或智能材料(如刺激响应材料和自修复材料)感知和反应伤口状况或环境变化,赋予伤口敷料智能响应释药的功能,从而有效促进伤口愈合.基于此,综述伤口敷料领域的研究进展,同时总结相关性能表征方法,并简要展望该领域的未来研究方向.
伤口敷料; 伤口愈合; 敷料性能
R318 A 0143-11 02.001
伤口管理一直是全球耗资无数的大问题,伤口敷料的发展越来越受到人们的关注[1-2].敷料在伤口管理中有着至关重要的作用,它不仅能为受伤组织提供必要的物理保护,还直接影响伤口愈合的过程和效果[3].理想的敷料应具有一系列特性,即良好的保湿吸湿性能、有效的抗菌抑菌能力以及良好的顺应性和舒适性[4],且在促进愈合的同时,减轻患者的痛苦和降低伤口感染的风险.
在过去的几十年里,伤口敷料技术经历了从传统的干燥敷料到现代湿润环境敷料的转变.目前,大多数新型伤口敷料在临床上应用广泛,但依然具有局限性.例如,敷料无法随着伤口状况的变化而调整其性能、无法实时检测伤口等.智能伤口敷料的出现为伤口管理提供了一种新的策略,它能够根据伤口微环境的变化做出调整,通过维持伤口床的适宜湿度、温度和pH值等,促进细胞再生和组织修复.此外,除了敷料结构本身的进步以外,智能化还体现在集成了多种先进技术,如生物活性成分的添加、3D打印技术的应用以及包含各种微电子传感器以实现智能监测等.本综述回顾一些用于治疗慢性伤口的功能性伤口敷料以及目前出现的绝大多数智能伤口敷料,并讨论智能伤口敷料的现状、进展、挑战和前景,为伤口管理策略的发展提供最新概述.
1 伤口特性及愈合机制
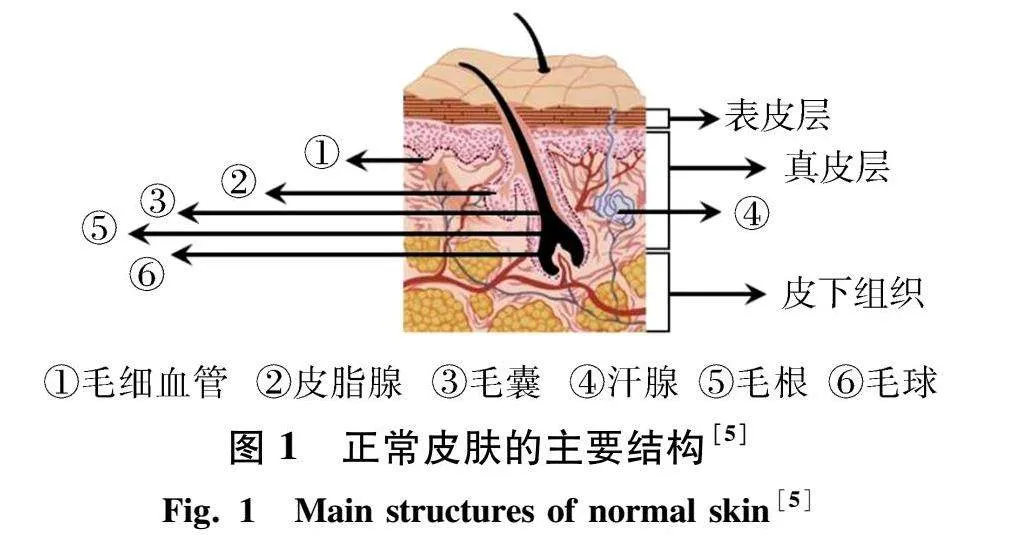
1.1 伤口的分类 图1为正常皮肤的主要结构.
伤口是一种由于物理、化学、热等伤害或生理病态造成的皮肤完整性受损现象[5-6].从愈合过程上看,可分为2种类型:急性伤口和慢性伤口.其中,急性伤口是指由于摩擦、触碰、撞伤、撕裂等原因造成的,并且能够在较短的一段时间内完全愈合的创伤;慢性伤口指在短时间内无法愈合,甚至自身很难愈合的一类创伤,例如烧伤、糖尿病伤口、压疮、静脉溃疡等.慢性伤口的特点是愈合缓慢,持续超过12周,并且经常复发[7].按伤口深浅不同,可分为部分皮层损伤伤口和全层损伤伤口[8-10].部分皮层损伤是指表皮层和真皮层受到破坏,而全层损伤是指表皮层、真皮层乃至皮下组织都受到损伤.不同类型的伤口具有不同的特征,例如伤口的大小、深度、渗出液量等.
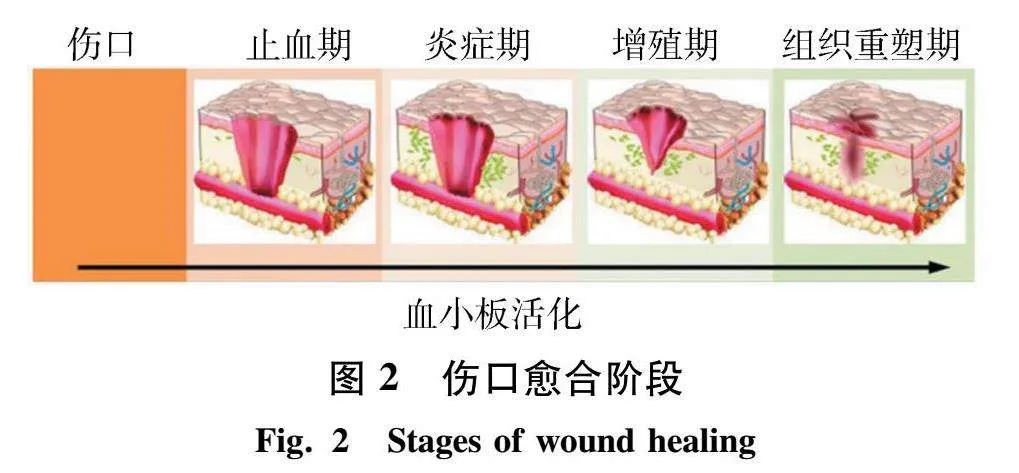
1.2 伤口的愈合机制 伤口愈合是非常复杂的动态过程,包含了实质细胞、细胞外基质、血细胞和可溶性介质之间的相互作用,可以简单概括为4个阶段:止血期、炎症期、增殖期和组织重塑期,如图2所示[11].伤口的愈合受外在和内在因素的影响,分别为自身身体素质和伤口所处的环境因素.现代创伤护理理论认为,伤口处的细胞、酶以及生长因子等无法在干燥环境下产生作用,创面的湿润环境是影响愈合速度的重要外因之一.Winter[12]于1962年在《Nature》杂志发表并提出“湿性愈合环境理论”,经研究首次证明了具有高渗透性和保湿性的创面敷料能加快创面的愈合进程.湿性愈合环境重点在于有利于愈合的微环境,活性成分可进一步软化、溶解和清除创面的坏死组织.
1.3 伤口对敷料的性能要求
理想的伤口敷料[13-14]应该具有以下特点:1) 透气、透湿性能良好;2) 吸收伤口渗液的同时又能保持伤口润湿;3) 生物相容性佳,抗菌、抑菌性能好;4) 良好的顺应性,易更换;5) 舒适性,即适宜的强度、张力和弹性;6) 一定的清创止血功能.伤口渗出液管理是理想敷料的一个基本性能参数,在慢性伤口的情况下,需要根据分泌渗出物的大小、类型、体积和黏度来选择理想的敷料.高度渗出伤口的敷料应具有适当的液体吸收能力,否则液体会通过敷料或在敷料周围泄漏,为细菌的生长和扩散提供理想的环境,从而延缓伤口的愈合过程.
2 敷料性能的表征方法
根据国家医药接触性创面敷料行业标准[15],敷料的性能可从透气性、吸湿性、舒适性、生物相容性、抗菌性以及相关的动物实验、组织学分析来评价.
2.1 水蒸气透过率测试 水蒸气透过率(RWVT)是指在受控湿度和温度下,水分子从皮肤接触部位通过材料至外部环境的材料透过性,其计算公式如下:
RWVT=W0-WtS,
式中:RWVT的单位为g/m2;S代表玻璃瓶口的面积,单位m2;W0代表玻璃瓶中水的起始质量,单位g;Wt代表结束时玻璃瓶中水的质量,单位g.
2.2 吸水性能测试
水凝胶敷料的吸水性能一般通过水凝胶的溶胀率来表示.首先,将水凝胶冷冻干燥至恒质量.然后,将其浸泡于pH=7.4的PBS溶液中,并静置于37 ℃恒温培养箱,至既定时间,取出溶胀的水凝胶,小心地除去其表面的水分,并记录质量.水凝胶的溶胀率(RS)按如下公式计算:
RS=Wt-W0W0×100%,
式中:RS的单位为%;W0代表冻干状态的水凝胶质量,单位g;Wt代表溶胀状态的水凝胶质量,单位g.
2.3 舒适性测试
创面敷料的舒适性是指敷料适应人体形状和运动的能力.当敷料被用于运动部位(如关节)时,能否使其有充分的运动自由度十分重要.“可伸展性”和“永久变形”是舒适度的2个表征指标.通过拉伸试验机测量创面敷料的可伸展性和永久变形来评价其是否具有舒适性.
可伸展性的计算式为
E=Fmaxb,(1)
式中:E为可伸展性,单位N·cm-1;Fmax为拉伸试验机的最大力,单位N;b为样条宽度,单位cm.结果修约到0.1 N·cm-1,并计算各组平均结果.
永久变形指数的计算式为
SP=L2-L1L1×100%,(2)
式中:SP为永久变形指数,L1拉伸前两标记间的距离,L2拉伸后两标记间的距离.结果修约到1%,并计算各组平均结果.
2.4 生物相容性测试
生物材料必须具有良好的生物相容性才能确保临床应用的安全性[16],生物相容性是生物医用材料最重要的考察指标之一.目前,对生物材料生物相容性的评价包括血液相容性评价和组织相容性评价,前者表示材料和血液之间相互适应的程度,后者表示材料与除血液之外其他组织的相互适应程度[17].具体的实验方法包括:细胞毒性实验、血液相容性实验、遗传毒性和致癌实验、显性致死实验、植入实验(皮下植入实验、骨内植入实验)、过敏实验等,其中最常用的是细胞毒性实验[18].
2.5 抗菌性能测试
理想的伤口敷料应具有抗菌抑菌功能,从而促进伤口快速愈合.表征抗菌剂抗菌效果的方法有以下几种:
1) 平板计数法:抗菌剂对细菌进行杀菌处理以后,将细菌稀释到合适的倍数进行平板涂布并对长出的菌落进行计数.通过计算细菌存活率或者致死率来表征抗菌剂抗菌效果.计算公式如下:
细菌存活率=处理组菌落数对照组菌落数×100%,
细菌致死率=(1-处理组菌落数对照组菌落数)×100%.
2) 活/死细胞染色法:对细菌进行活/死染色也是一种常用的表征抗菌效果的方法.抗菌剂对细菌进行处理后,再对细菌进行活/死染色.常见细菌活/死染色试剂盒以PI和SYTO-9为例,即采用红色荧光碘化丙啶(PI)核酸染色和绿色荧光核酸染料(SYTO-9)进行荧光细胞活/死试验,验证所制备的抗菌剂的抗菌性能.PI是一种可对DNA染色的细胞核染色剂,它不能穿透完整细胞膜,但可穿透凋亡晚期细胞和死细胞的破损细胞膜,从而使细胞核染红.SYTO-9是一种能够透过细胞膜的绿色荧光核酸染料,可用于活的和死的真核细胞的RNA和DNA染色.
3) 扫描电镜表征法:抗菌剂对细菌进行处理后,可能会引起细菌形态的变化,如褶皱凹陷或者破损.因此,通过拍摄扫描电镜观察细菌形态也是表征抗菌剂抗菌效果的手段之一.
2.6 动物实验
除了敷料的体外实验,还需要进行动物实验,在动物身上测试各种敷料的性能,以确保它们不会引起人体的刺激和过敏反应,以及验证其对伤口治疗是否具有促愈合作用.动物实验流程如下:
首先,将健康的大鼠麻醉,在其背部建立直径为1.0 cm的全层伤口,作为创伤模型.根据实验需求,将创伤模型鼠随机分为对照组和实验组,各组模型鼠分笼饲养,且每组不少于3只.每日清理伤口、更换敷料,称质量并拍照记录伤口情况.此外,收集敷料治疗2周后的伤口处皮肤组织,并用质量分数为4%的多聚甲醛进行固定.然后,采用Hamp;E染色和Masson染色进行组织学分析,考察伤口内部组织的愈合情况.
3 典型伤口敷料
3.1 传统敷料
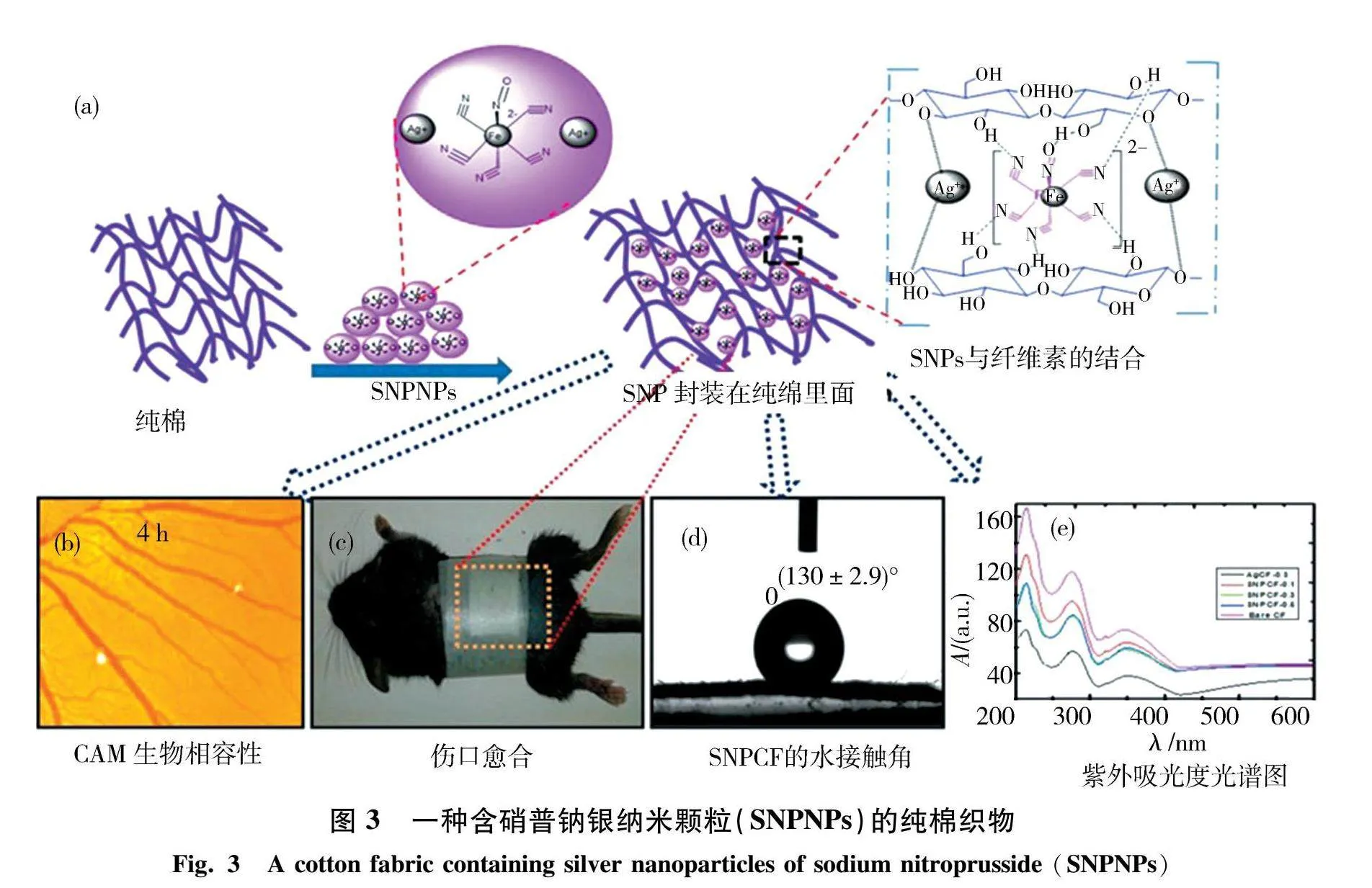
传统敷料通常由棉花、纱布、亚麻布等天然材料加工而制成,结构简单.如今,随着医学技术的发展,薄膜型敷料、水凝胶型敷料、泡沫型敷料等功能型医用敷料纷纷问世,但由于其材料自身的种种限制性以及相对较高的生产及使用成本,棉质敷料依然是医疗机构使用最广泛的医用敷料之一[19].传统敷料历史悠久,具有较好的吸湿性,能有效吸收伤口渗液;透气性良好,有助于伤口的通风与干燥,其在简单伤口(如轻微擦伤、烧伤)的处理上表现出色,成本较低,应用广泛,可在日常家庭医疗中备用.但其功能单一,主要起到覆盖、保护伤口的作用,不能维持伤口的湿度平衡从而易与伤口发生粘连,造成伤口二次创伤[20].对于复杂伤口,如深度烧伤、慢性溃疡等,传统敷料可能无法满足需求.2019年,吴帅等[21]利用化学方法制备了一种可溶止血纱,研究发现,在制备可溶止血纱过程中,纱布浸渍液的硝酸银浓度与其载银含量呈正相关,而银含量与其抗菌性能密切相关,该新型纱布的制备方法可有效克服传统可溶性止血纱不能抗感染的缺点,并且能更好地加速伤口部位的愈合.2021年,Rao等[22]研发了含一种硝普钠银纳米颗粒(SNPNPs)的纯棉织物,如图3所示,实验表明由于硝普钠银复合物的表面改性,这些棉织物保持光惰性并显示出长期的抗菌活性,通过各种分析技术(XRD、FTIR、UV光谱、TGA、TEM、FESEM、EDAX、ICP-OES)进行表征,用纳米颗粒制成的棉敷料显示出的水接触角(113°~130°)比裸棉纱布(60°)更好,并且在革兰氏阴性菌和革兰氏阳性菌存在的情况下表现出更好的抗菌性能,局部应用可促进创面愈合.
3.2 水凝胶敷料
水凝胶是一种由含亲水基团的高分子通过物理或化学交联产生的三维网状结构,按来源可分为天然高分子水凝胶和合成高分子水凝胶[23].合成高分子水凝胶又包括均聚物、共聚物、半互穿网络结构和互穿网络结构水凝胶[24].水凝胶因其结构中存在大量亲水基团而能吸收大量水分,含水量可达到99%.同时,水凝胶优异的生物相容性、可降解性、应激响应性和溶胀率高等性质,在植介入和药物输送方面有巨大的应用潜力.将水凝胶作为医用敷料,在吸收伤口渗出液的同时还能保持环境湿润,能与伤口紧密贴合不粘连,减少细菌接触,不会造成与伤口粘连带来二次创伤[25].此外,水凝胶可以作为药物、蛋白质或细胞的靶向递送载体[26].细胞外基质(ECM)是细胞周围的分子网络,通过促进伤口再上皮化和血管生成,在为伤口愈合创造有利的微环境方面发挥着至关重要的作用[27-28].由于水凝胶在结构上类似于ECM,因此,它们在生物医学科学领域受到了重点关注并具有广泛的应用.随着临床实践中具有挑战性的不愈合伤口的出现以及对有效伤口愈合的需求不断增加,开发出具有多种功能的水凝胶基敷料十分必要[29].伤口类型不同,对水凝胶基敷料的功能需求也不同.对于慢性伤口而言,理想的水凝胶伤口敷料应具有止血、抗菌消炎、抗氧化、降血糖、促进血管生成等功效,以及适宜的粘接性、自愈性和导电性等性能.Wei等[30]使用氧化葡聚糖(ODEX)、抗菌肽修饰的透明质酸(HA-AMP)和富血小板血浆(PRP)制备了一种用于治疗慢性感染伤口的水凝胶敷料.ODEX/HA-AMP水凝胶对大肠杆菌、金黄色葡萄球菌和PA有明显的抑制作用,并能释放生长因子,促进胶原沉积和血管生成,从而加速糖尿病感染创面的修复.
3.3 藻酸盐类敷料
藻酸盐敷料主要由从海藻植物中提取的一种天然藻酸盐合成,其高亲水性、优异的生物相容性和强大的液体吸收能力十分有利于使海藻酸盐成为伤口敷料[31].与伤口接触时,敷料中的藻酸钙中的钙离子会与渗液中的钠离子发生钙钠离子交换,从而在伤口表面形成一层稳定的网状凝胶,有助于血液的凝固.陈锦涛[32]通过对海藻酸钙纤维进行疏水改性,再与45S5生物活性玻璃复合,从而完成藻酸盐与蜂蜜、生物活性玻璃之间的有机结合,赋予藻酸盐敷料新的功效——抗菌、止痛、分泌生长因子,在促进剂的作用下各成分产生协同效果,降低蜂蜜与药物护创时离子损耗的速度,延长有效作用时间,达到慢性复杂伤口的护理要求,并提高了临床效果.
3.4 纳米纤维敷料
纳米纤维具有较高的孔隙率及良好的透气性,使伤口保持理想的湿润状态,又能促进细胞及时进行气体交换,加速伤口愈合.静电纺丝技术促进了纳米纤维的广泛使用,如聚l-乳酸(PLLA)、聚ε-己内酯(PCL)、聚乙二醇(PEG)、壳聚糖、几丁质、纤维素、聚乙烯醇(PVA)等[33],这些材料因其优异的生物相容性和生物降解性可作为药物载体和伤口敷料使用.它们可以携带生长因子、抗生素、消炎药等不同的活性物质,以获得相应的功能[34].
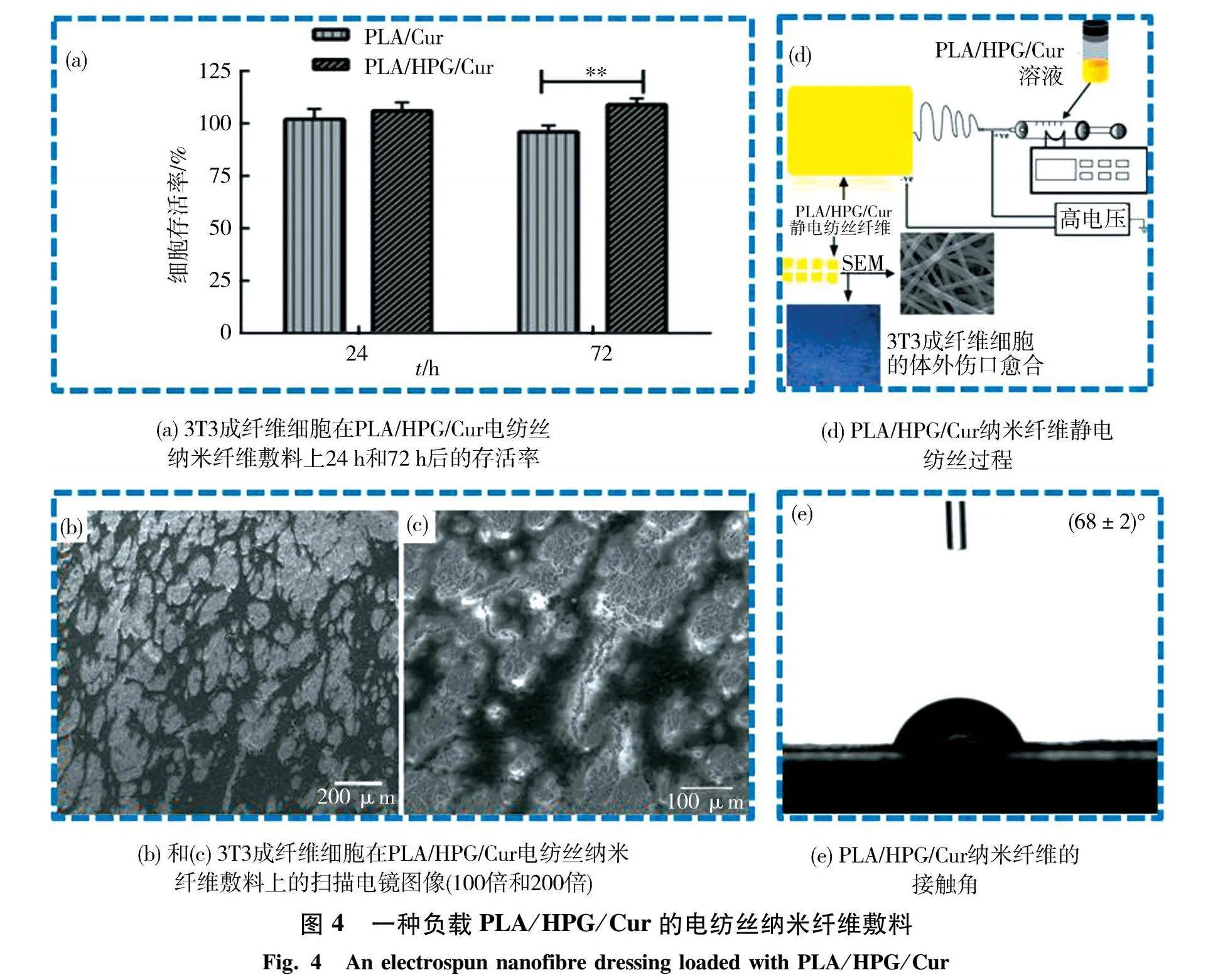
Perumal等[35]通过静电纺丝制备出负载姜黄素(Cur)的聚乳酸PLA纤维和超支化聚甘油(HPG)的电纺丝纳米纤维敷料,如图4所示,姜黄素的抗菌、抗炎和抗氧化性能与HPG的高亲水性和保水能力结合在一起,使得该敷料具有非常高的亲水性、高溶胀性和高药物吸收性,并能促进细胞存活和增殖.这项研究表明,PLA/HPG/Cur静电纺丝纳米纤维支架可用作愈合急性/慢性糖尿病伤口的新型贴片.
3.5 其他新型敷料
泡沫类敷料是指内部具有较多孔洞且具有强吸收能力的物质,其特点是外形可塑性较高,可以满足各类形状的要求,该敷料对伤口渗出物的处理是靠水蒸气的转运和吸收来控制的,常见的原料有天然多糖高聚物、聚氨酯和聚乙烯醇泡沫[36-37].唐文力[38]通过甲苯二异氰酸酯(TDI)和聚乙二醇(PEG)的交联来制得亲水性聚氨酯泡沫敷料,并对形态观测、吸液性、保湿性、凝血率等方面进行了表征测试.该研究以氰酸根与羟基间的扩链反应生成长链的聚氨基甲酸酯大分子(PU)和以长链中的异氰酸酯基团与水反应并分解产生二氧化碳完成发泡2步制得.此法制备所得PU的亲水性得到很大程度的增强,具备更理想的表面孔径分布,更加符合创面敷面的要求.
含银类敷料是银离子和泡沫敷料的复合体,兼具泡沫敷料吸收渗液作用和银离子的抑菌作用.银离子敷料具有以下优点:1)具有广谱抗菌作用,见效快、时间长;2)不易粘附.但该类敷料同时存在一些不足,例如生物安全性也存在较大隐患,人体可吸入银的质量浓度极限为0.01 mg/m3,在该数值以下,银制品才对人体不会产生毒性作用[39-41].
4 智能敷料
智能敷料,也被称为“智能绷带”或“电子敷料”,是一种集监测、治疗与数据传输功能一体的先进医疗材料.它结合了生物医学工程、纳米技术、传感器技术等多个领域的最新成果,旨在提高伤口愈合速度、降低感染风险,并提供实时的健康监测数据.智能敷料的工作原理主要依赖于内嵌的传感器和微型电子设备.这些设备能够监测伤口的温度、湿度、pH值、氧气浓度等关键指标,并通过无线通讯技术将数据发送到手机、电脑或其他医疗设备上[42].此外,一些智能敷料还具有药物释放功能,能够根据伤口状态调整药物的释放速度和剂量.智能敷料可根据其功能和应用场景进行分类,常见的类型包括:
1) 监测型智能敷料:主要用于监测伤口状态,如温度、pH值、血糖值、活性氧浓度等.
2) 治疗型智能敷料:除了监测功能外,还具有药物释放、电刺激等治疗功能.
3) 复合型智能敷料:结合了监测和治疗功能,能够同时提供伤口管理和治疗效果评估.
智能敷料广泛应用于创伤修复、烧伤治疗、慢性伤口管理等领域.在军事医疗、应急救援、老年护理等特殊场景下,智能敷料也能够发挥重要作用.智能敷料的主要优势和特点包括:1)实时监测:能够连续监测伤口状态,及时发现并处理潜在问题.2)个性化治疗:根据伤口状态调整药物释放和治疗方案,提高治疗效果.3)减少感染风险:通过保持伤口环境稳定和优化伤口护理流程,降低感染发生率.4)方便易用:无线通讯技术和可穿戴设备使得智能敷料易于使用和管理.
4.1 pH响应型敷料
Xie等[43]通过1-乙基-3-(3-二甲基氨基丙基)碳二酰胺(EDC)和N-羟基琥珀酰亚胺(NHS)交联,将海藻酸钠(SA)溶液与羧甲基壳聚糖钠盐(CMCS)溶液在不同质量比下制备出效果最优CMCS/SA水凝胶.该水凝胶作为一种新型复合给药系统,具有良好的pH敏感性,在胃肠道和口腔环境pH=7.4时,表现出最好的释药能力,解决了分子间氢键的存在所导致的水凝胶应用限制,是一种非常有前途的给药载体.
Li等[44]制备了一种可自愈注射的多糖水凝胶,由N-羧乙基壳聚糖(N-壳聚糖)、乙二酸二肼(ADH)和透明质酸醛(HA-ALD)原位交联而制成,可用于长期胰岛素释放.酰肼键赋予了其pH响应特性,以此为指令释放胰岛素,可以很好地缩短炎症期,降低血糖水平,显著促进愈合.同时,水凝胶的结构保证了胰岛素的生物活性,在高血糖和酸性微环境的伤口区具有很高的治疗潜力.
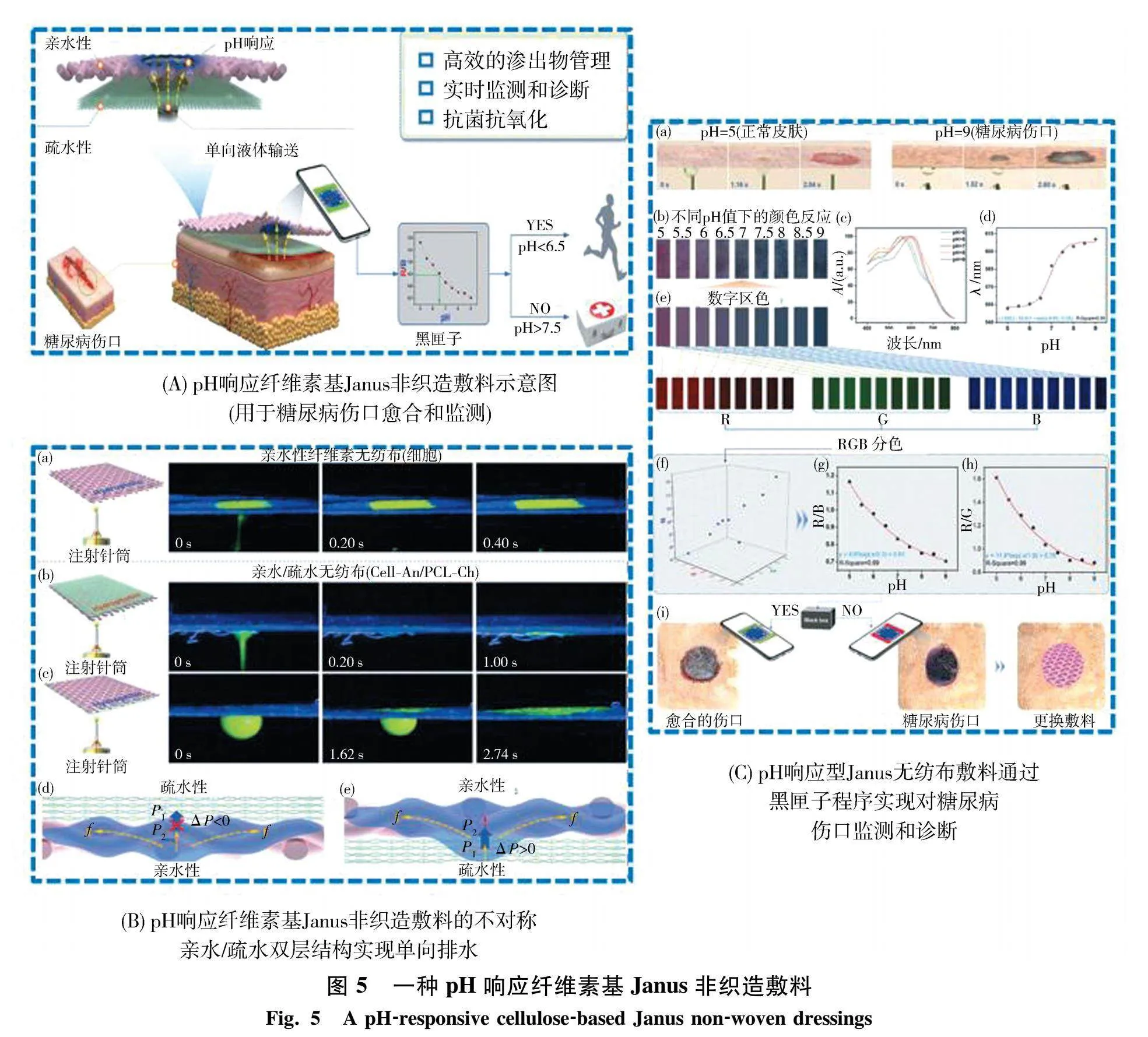
Xu等[45]通过含抗氧化剂和pH敏感组分的亲水性纺丝层(纤维素-花青素,Cell-AN)和含抗菌氯已定(CH)的疏水电纺层(聚已内酯-氯已定,PCL-CH)组成了一种具有单项液体引流能力的pH响应纤维素基Janus非织造敷料.如图5所示,pH响应纤维素基Janus非织造敷料的不对称亲水/疏水双层结构可以从疏水侧到亲水侧实现单向排水,有利于排出淹没伤口多余的渗出物.该敷料进行糖尿病伤口监测和诊断可以通过智能手机中的黑匣子程序实现,使糖尿病创面渗出液的管理、监测更便利,简化糖尿病伤口的医疗护理,并加速糖尿病创面愈合过程,减轻糖尿病患者的医疗负担和痛苦.
4.2 血糖响应型敷料
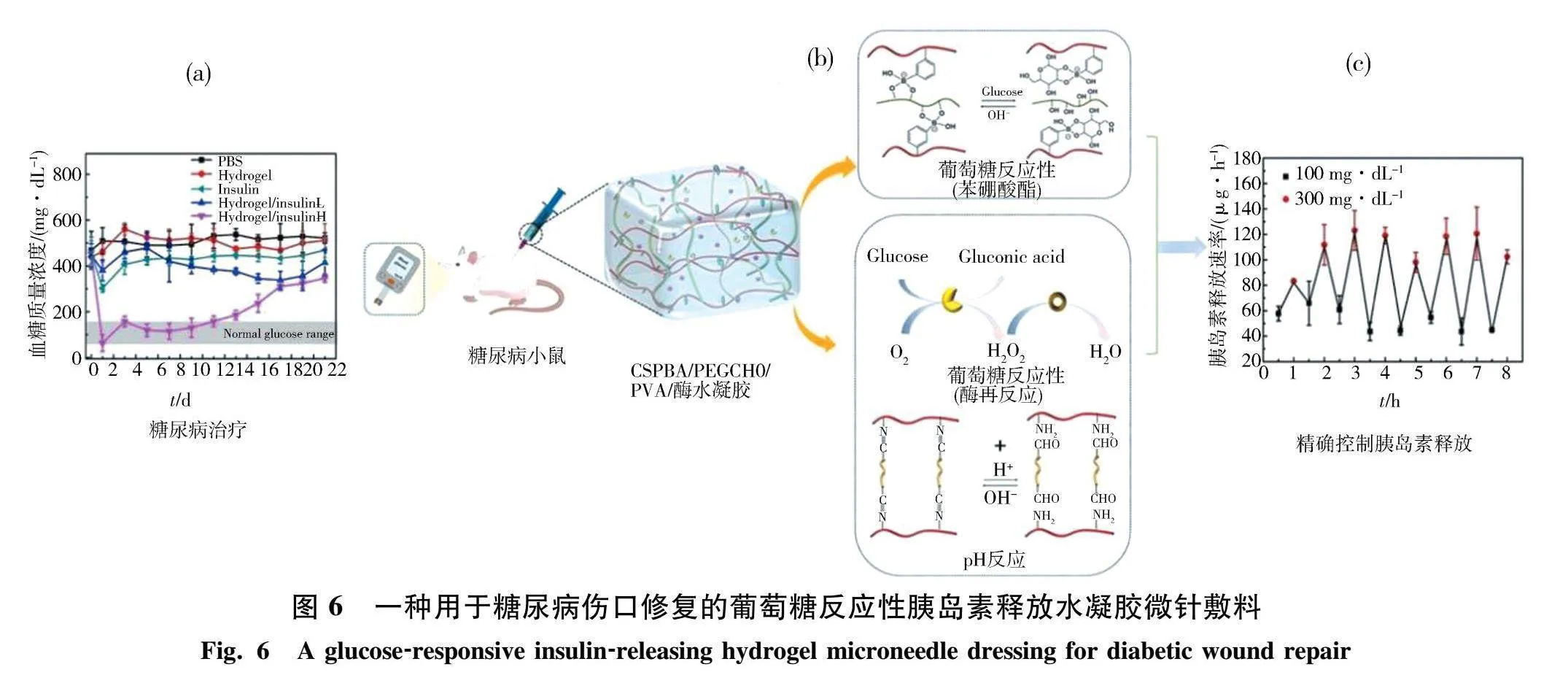
糖尿病作为一种慢性疾病,对于糖尿病病人而言,伤口处血糖水平长期较高,意味着细菌生长更容易,从而激发炎症和破坏细胞,切实的临床需求催生出可对血糖浓度敏感响应的敷料.Zhang等[46]以苯硼酸改性壳聚糖(CSPBA)、甲酰基封端聚乙二醇(PEGCHO)和聚乙烯醇(PVA)为原料,通过苯硼酸酯和亚胺2种动态共价键的交联,掺入GOX和过氧化氢酶(CAT),制备了对葡萄糖敏感性高、反应迅速的注射水凝胶,通过双葡萄糖传感器(GOX和苯硼酸基团)和双葡萄糖反应元件(亚胺和苯硼酸酯)的简单叠加,以实现糖尿病高血糖和血糖动态波动下胰岛素释放的精确控制.
Guo等[47]开发了一种用于糖尿病伤口修复的葡萄糖反应性胰岛素释放水凝胶微针敷料,该水凝胶系统由生物相容性甲基丙烯酸明胶(GelMa)、葡萄糖响应性单体4-(2-丙烯酰胺基乙基氨基甲酰基)-3-氟苯硼酸(AFPBA)和葡萄糖胰岛素(G-insulin)组成,并通过复制PDMS模具开发了基于Gel-AFPBA-ins水凝胶的微针敷料.如图6所示,带有双葡萄糖传感器的壳聚糖基注射水凝胶具有胰岛素调节能力,可避免因血浆胰岛素过高而引起的低血糖,也能在血糖高时释放胰岛素以控制血糖,实现葡萄糖水平动态变化的快速响应.与没有微结构的水凝胶相比,该水凝胶微针敷料具有足够的力学性能、较高的生物相容性、葡萄糖反应性胰岛素释放以及与皮肤的强黏附性等优点,可加速糖尿病伤口的愈合过程,减少炎症反应,促进胶原蛋白在再生组织部位的沉积,可有效治疗糖尿病伤口以及对血糖待定控制.
4.3 温度响应型敷料
温度响应型敷料根据不同的设计原理和应用需求,可以分为多种类型.例如:热敏型水胶体敷料:黏性或凝胶状态会随温度改变;相变材料敷料:在特定温度下发生液固态的转变,从而控制热量;药物释放型敷料:结合温度敏感的载体,控制释放药物和局部治疗等.
Zhang等[48]借助天然脂肪酸相变材料开发了一种温度响应的纤维水凝胶,他们通过静电纺丝和紫外交联制备了类似细胞外基质的甲基丙烯酸甲酯明胶(GelMA)纳米纤维水凝胶,然后将脂肪酸/阿司匹林(ASP)包裹在聚多巴胺(PDA)中,通过加成反应制备了GelMA-PDA-ASP纳米纤维水凝胶.该水凝胶在40 ℃下可以更快地释放ASP,并且在40 ℃和25 ℃之间的加热和冷却循环中实现了对药物释放的控制,解决了普通敷料缺乏响应性基团、药物仅靠物理释放易出现释放速度不均匀等问题.
慢性伤口需要长期和反复更换敷料,在换药过程中给患者带来难以忍受的疼痛和继发性损伤,导致伤口愈合十分困难.因此,制备出一种易于更换的敷料很有必要.Huang等[49]制备了一种快速温度响应、自粘和可拆卸的纳米纤维伤口敷料PGSGS.该敷料由纯天然材料组成,具有良好的生物相容性.外层聚乳酸起到整体机械支撑的作用,中间SSAD与GS交联层起到连接作用,SSAD的黏液有很强的组织黏附性,易于在体内生物降解,能黏附在伤口表面,对伤口进行处理.GS能有效抑制出血,抗菌和促进伤口愈合,溶解后与伤口表面接触时具有良好的生物降解性.该敷料在高温下(25 ℃以上,一般为室温),分子链活跃,官能团较多.PGSGS伤口敷料与皮肤组织表面之间具有高粘接强度,而在低温(低于8 ℃)下,敷料内部分子链排列,表面官能团暴露较少,黏附力减小,可以轻易与伤口分离,达到自粘和可拆卸的功能,从而减少换药过程中可能出现的痛苦和伤害.
4.4 ROS响应型敷料
活性氧(ROS)是指在生物体内与氧代谢有关的、含氧自由基和易形成自由基的过氧化物的总称.Paula等[50]将硫酮(TK)加入聚酰胺中,通过静电纺丝以聚ε-己内酯(如PCL)作为结构聚合物,制备了一种可ROS响应的纤维PATKs.利用TK易与ROS反应的特性,该材料暴露于氧化环境时会被快速地降解,克服了PCL自身因降解缓慢而无法应用于短期生物医学(如伤口敷料)的阻碍.同时,PATKs膜具有一定的ROS清除功能和细胞相容性,可以成为优异的伤口敷料材料.
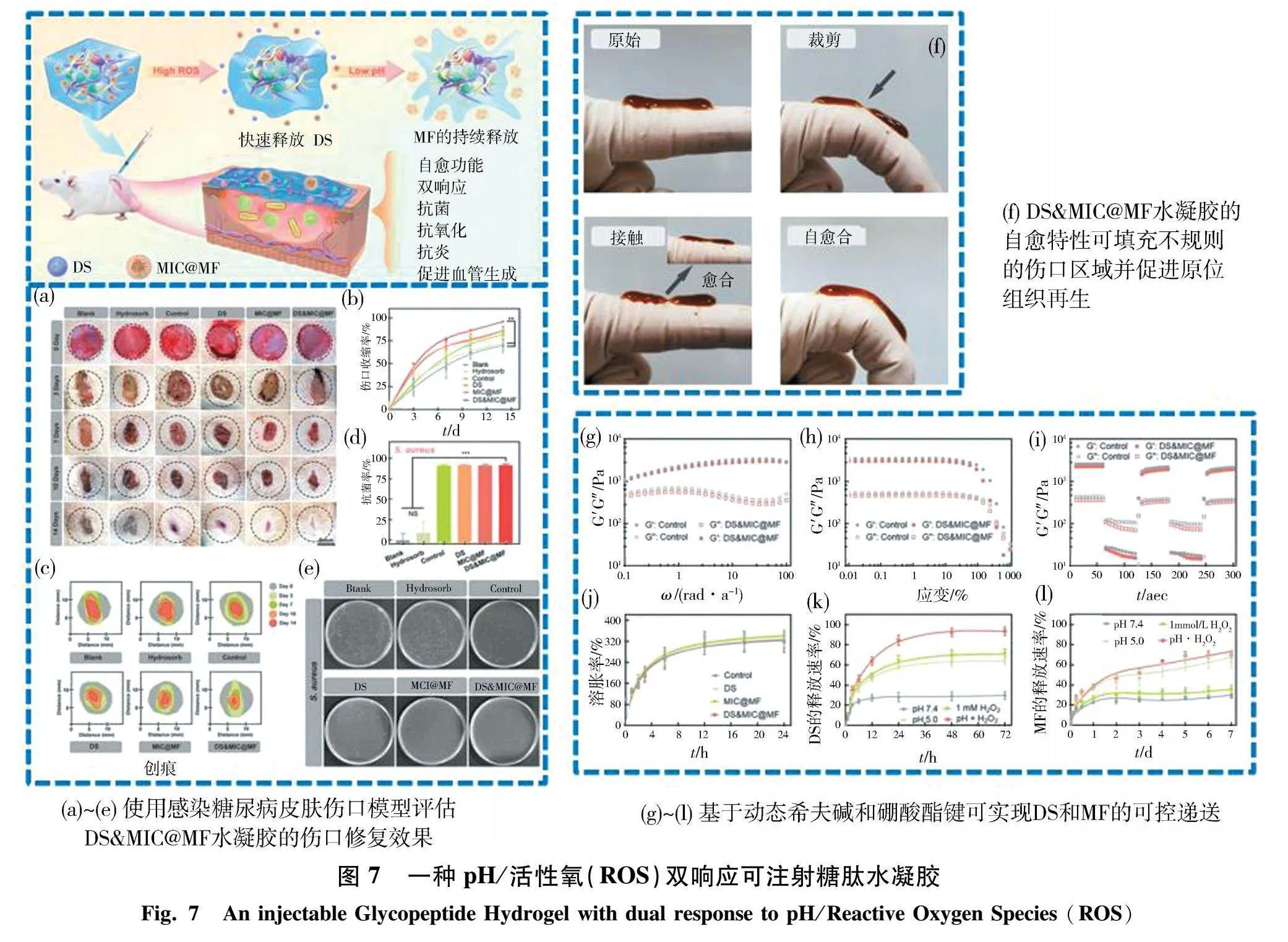
如图7所示,Wu等[51]构建了一种基于苯硼酸接枝氧化葡聚糖和咖啡酸接枝ε-聚赖氨酸的pH/ROS双响应注射糖肽水凝胶,且将能促进血管生成的芒果苷(MF)封装至pH响应胶束(MIC)中,与具有抗炎活性的双氯芬酸钠(DS)一并嵌入水凝胶中.硼酸酯键对ROS高度敏感,在H+浓度低的条件下与PBA进行选择性反应,而在ROS含量高的酸性环境中,亚胺键和硼酸酯键被破坏,使药物释放,以实现DS和MF的可控递送.如此多功能化的水凝胶,避免了由ROS过量产生而导致的伤口部位促氧化剂/抗氧化剂失衡的问题,具备抗感染、抗氧化和抗炎作用,与皮肤再生所需的良好环境相匹配.
5 总结与展望
随着全球医疗保健市场不断扩大和人们对健康管理的需求日益增长,智能敷料的市场前景十分广阔.预计未来几年内,智能敷料市场将保持高速增长态势,并逐渐成为医疗领域的重要创新方向.智能敷料在医疗领域的应用实例丰富多样.例如,在糖尿病足溃疡治疗中,智能敷料能够实时监测溃疡部位的温度、湿度和pH值,结合医生的治疗方案,促进伤口愈合.在烧伤治疗中,智能敷料能够减轻患者疼痛,减少感染风险,提高治疗效果.在术后伤口管理中,智能敷料能够实时监控伤口愈合情况,预防并发症的发生.
未来智能敷料的发展趋势可能包括以下几个方面:
1) 多功能集成:将更多功能(如疼痛管理,体温、pH、血糖调节等)集成到单一敷料中;
2) 敷料在pH、温度、活性氧等方面的监测精度有待提高;
3) 可穿戴设备与物联网融合:实现与其他医疗设备和系统的无缝连接和数据共享;
4) 生物材料创新:研发具有更好生物相容性和降解性的新型生物材料,提高敷料的安全性和有效性.
参考文献
[1] FAROKHI M, MOTTAGHITALAB F, FATAHI Y, et al. Overview of silk fibroin use in wound dressings[J]. Trends in Biotechnology,2018,36(9):907-922.
[2] KIM H S, SUN X Y, LEE J H, et al. Advanced drug delivery systems and artificial skin grafts for skin wound healing[J]. Advanced Drug Delivery Reviews,2019,146:209-239.
[3] DERAKHSHANDEH H, KASHAF S S, AGHABAGLOU F, et al. Smart bandages: the future of wound care[J]. Trends in Biotechnology,2018,36(12):1259-1274.
[4] ZHONG Y J, XIAO H N, SEIDI F, et al. Natural polymer-based antimicrobial hydrogels without synthetic antibiotics as wound dressings[J]. Biomacromolecules,2020,21(8):2983-3006.
[5] 邱玉宇. 多层复合创伤敷料的结构构建及其对伤口愈合机制的研究[D]. 无锡:江南大学,2019.
[6] 朱婕. 生物可降解水凝胶基复合敷料的制备及性能研究[D]. 上海:东华大学,2019.
[7] MISHRA A, KUSHARE A, GUPTA M N, et al. Advanced dressings for chronic wound management[J]. ACS Applied Bio Materials,2024,7(5):2660-2676.
[8] LKR E, ONCUL O, KARAGOZ H, et al. Comparison of silver-coated dressing (ActicoatTM), chlorhexidine acetate 0.5% (Bactigrass), and fusidic acid 2% (Fucidin) for topical antibacterial effect in methicillin-resistant staphylococci-contaminated, full-skin thickness rat burn wounds[J]. Burns,2005,31(7):874-877.
[9] ROH D H, KANG S Y, KIM J Y, et al. Wound healing effect of silk fibroin/alginate-blended sponge in full thickness skin defect of rat[J]. Journal of Materials Science Materials in Medicine,2006,17(6):547-552.
[10] BROUSSARD K C, POWERS J G. Wound dressings: selecting the most appropriate type[J]. American Journal of Clinical Dermatology,2013,14(6):449-459.
[11] LIN P H, SERMERSHEIM M, LI H C, et al. Zinc in wound healing modulation[J]. Nutrients,2017,10(1):16.
[12] WINTER G D. Formation of the scab and the rate of epithelization of superficial wounds in the skin of the young domestic pig[J]. Nature,1962,193:293-294.
[13] FONDER M A, MAMELAK A J, LAZARUS G S, et al. Occlusive wound dressings in emergency medicine and acute care[J]. Emergency Medicine Clinics of North America,2007,25(1):235-242.
[14] WANG X F, ZHONG B, LOU Z, et al. The advancement of intelligent dressings for monitoring chronic wound infections[J]. Chemical Engineering Journal,2024,484:149643.
[15] 国家食品药品监督管理局. 接触性创面敷料试验方法:YY/T 0471.1~0471.6[S]. 北京:中国标准出版社,2004.
[16] WILLIAMS D F. On the mechanisms of biocompatibility[J]. Biomaterials,2008,29(20):2941-2953.
[17] VAN DEN BEUCKEN J J J P, WALBOOMERS X F, VOS M R J, et al. Cyto- and histocompatibility of multilayered DNA-coatings on titanium[J]. Journal of Biomedical Materials Research Part A,2006,77(1):202-211.
[18] 李瑞,王青山. 生物材料生物相容性的评价方法和发展趋势[J]. 中国组织工程研究与临床康复,2011,15(29):5471-5474.
[19] 顾雅楠,桑胜南,张玮. 浅谈棉质医用敷料的研究现状[J]. 中国纤检,2022,8(7):106-107.
[20] TUNCEL U, TURAN A, BAYRAKTAR M A, et al. Clinical experience with the use of gauze-based negative pressure wound therapy[J]. Wounds: a Compendium of Clinical Research and Practice,2012,24(8):227-233.
[21] 吴帅,刘哲,邝荣康,等. 抗菌型可溶性止血纱布的制备及性能研究[J]. 科技风,2019(23):272-273.
[22] RAO B R, KUMAR R, HAQUE S, et al. Ag2[Fe(CN)5NO]-fabricated hydrophobic cotton as a potential wound healing dressing: an in vivo approach[J]. ACS Applied Materials amp; Interfaces,2021,13(9):10689-10704.
[23] 杨旭. 抗菌型聚乙烯醇基水凝胶材料的制备及其性能研究[D]. 合肥:中国科学技术大学,2020.
[24] 鲁手涛,周扬,徐海荣,等. 天然高分子材料水凝胶在伤口敷料中的应用[J]. 工程塑料应用,2020,48(2):139-142.
[25] LAS HERAS K, IGARTUA M, SANTOS-VIZCAINO E, et al. Chronic wounds: current status, available strategies and emerging therapeutic solutions[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society,2020,328:532-550.
[26] KASS L E, NGUYEN J. Nanocarrier-hydrogel composite delivery systems for precision drug release[J]. Wiley Interdisciplinary Reviews Nanomedicine and Nanobiotechnology,2022,14(2):e1756.
[27] LIU W S, GAO R, YANG C F, et al. ECM-mimetic immunomodulatory hydrogel for methicillin-resistant staphylococcus aureus-infected chronic skin wound healing[J]. Science Advances,2022,8(27):eabn7006.
[28] GRAA M F P, MIGUEL S P, CABRAL C S D, et al. Hyaluronic acid: based wound dressings: a review[J]. Carbohydrate Polymers,2020,241:116364.
[29] ZHANG W, LIU L L, CHENG H, et al. Hydrogel-based dressings designed to facilitate wound healing[J]. Materials Advances,2024,5(4):1364-1394.
[30] WEI S K, XU P C, YAO Z X, et al. A composite hydrogel with co-delivery of antimicrobial peptides and platelet-rich plasma to enhance healing of infected wounds in diabetes[J]. Acta Biomaterialia,2021,124:205-218.
[31] VARAPRASAD K, JAYARAMUDU T, KANIKIREDDY V, et al. Alginate-based composite materials for wound dressing application: a mini review[J]. Carbohydrate Polymers,2020,236:116025.
[32] 陈锦涛. 45S5生物活性玻璃/藻酸盐创面修复敷料的制备及性能研究[J]. 广东化工,2019,46(13):36-37.
[33] AMBEKAR R S, KANDASUBRAMANIAN B. Advancements in nanofibers for wound dressing: a review[J]. European Polymer Journal,2019,117:304-336.
[34] DONG Y P, ZHENG Y Q, ZHANG K Y, et al. Electrospun nanofibrous materials for wound healing[J]. Advanced Fiber Materials,2020,2(4):212-227.
[35] PERUMAL G, PAPPURU S, CHAKRABORTY D, et al. Synthesis and characterization of curcumin loaded PLA: hyperbranched polyglycerol electrospun blend for wound dressing applications[J]. Materials Science and Engineering C,2017,76:1196-1204.
[36] ESKANDARINIA A, MOROWVAT M H, NIKNEZHAD S V, et al. A photocrosslinkable and hemostatic bilayer wound dressing based on gelatin methacrylate hydrogel and polyvinyl alcohol foam for skin regeneration[J]. International Journal of Biological Macromolecules,2024,266:131231.
[37] DING Y Y, SUN Z, SHI R W, et al. Integrated endotoxin adsorption and antibacterial properties of cationic polyurethane foams for wound healing[J]. ACS Applied Materials amp; Interfaces,2019,11(3):2860-2869.
[38] 唐文力. 改进的可注射原位形成共价交联透明质酸水凝胶的合成和表征/聚氨酯泡沫敷料的制备和表征[D]. 海口:海南大学,2017.
[39] PANG Q, ZHENG X W, LUO Y, et al. A photo-cleavable polyprodrug-loaded wound dressing with UV-responsive antibacterial property[J]. Journal of Materials Chemistry B,2017,5(45):8975-8982.
[40] EL-SHANSHORY A A, CHEN W M, EL-HAMSHARY H A, et al. Antibacterial ciprofloxacin hydrochloride incorporated PVA/regenerated silk fibroin nanofibers composite for wound dressing applications[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society,2015,213:e8-e9.
[41] YE S, JIANG L, WU J M, et al. Flexible amoxicillin-grafted bacterial cellulose sponges for wound dressing: in vitro and in vivo evaluation[J]. ACS Applied Materials amp; Interfaces,2018,10(6):5862-5870.
[42] CHEN C S, ZENG F, XIAO X, et al. Three-dimensionally printed silk-sericin-based hydrogel scaffold: a promising visualized dressing material for real-time monitoring of wounds[J]. ACS Applied Materials amp; Interfaces,2018,10(40):33879-33890.
[43] XIE C X, TIAN T C, YU S T, et al. pH-sensitive hydrogel based on carboxymethyl chitosan/sodium alginate and its application for drug delivery[J]. Journal of Applied Polymer Science,2019,136(1):46911.
[44] LI Z H, ZHAO Y, LIU H, et al. pH-responsive hydrogel loaded with insulin as a bioactive dressing for enhancing diabetic wound healing[J]. Materials amp; Design,2021,210:110104.
[45] XU Z, FAN J L, TIAN W G, et al. Cellulose-based pH-responsive Janus dressing with unidirectional moisture drainage for exudate management and diabetic wounds healing[J]. Advanced Functional Materials,2024,34(3):2307449.
[46] ZHANG J Y, CHEN F J, YU D L, et al. Chitosan-based injectable hydrogels with dual glucose sensors for precise control of insulin release and diabetes mellitus therapy[J]. International Journal of Pharmaceutics,2023,643:123246.
[47] GUO Z Y, LIU H Y, SHI Z K, et al. Responsive hydrogel-based microneedle dressing for diabetic wound healing[J]. Journal of Materials Chemistry B,2022,10(18):3501-3511.
[48] ZHANG K Y, LV H J, ZHENG Y Q, et al. Nanofibrous hydrogels embedded with phase-change materials: temperature-responsive dressings for accelerating skin wound healing[J]. Composites Communications,2021,25:100752.
[49] HUANG Z, AN H, GUO H T, et al. An asymmetric natural nanofiber with rapid temperature responsive detachability inspired by Andrias davidianus for full-thickness skin wound healing[J]. Advanced Fiber Materials,2024,6(2):473-488.
[50] PAULA C T B, SARAIVA S, PEREIRA P, et al. ROS-responsive electrospun poly(amide thioketal) mats for wound dressing applications[J]. Polymer,2024,294:126697.
[51] WU Y, WANG Y, LONG L Y, et al. A spatiotemporal release platform based on pH/ROS stimuli-responsive hydrogel in wound repairing[J]. Journal of Controlled Release,2022,341:147-165.
Progress in Research on High-Performance Chronic Wound Dressings
SHEN Jiabin1, ZHU Yirong1, YANG Jinhua1, QIN Jingxian1, HAN Yanting2
(1. State Key Laboratory of Polymer Materials Engineering, Polymer Research Institute of Sichuan University, Chengdu 610065, Sichuan;
2. Medicine and Engineering Interdisciplinary Research Laboratory of Nursing amp; Materials, West China School of Nursing, West China
Hospital, Chengdu 610041, Sichuan)
Chronic wound healing is a complex and time-consuming process that is susceptible to attack by microorganisms such as Escherichia coli and Staphylococcus aureus. Traditional dressings, such as cotton and gauze, have a poor barrier effect, resulting in wounds that are easily invaded by bacteria, and their fibers adhere to the nascent granulation tissue during the healing process, and frequent dressing changes can exacerbate the patients pain or even lead to secondary trauma, and do not significantly contribute to wound healing. In the past decade, research on new wound dressings has been emerging, and these dressings can interact with wounds, and smart dressings can also sense and respond to wound conditions or environmental changes through built-in sensors or smart materials (e.g., stimulus-responsive materials and self-repairing materials), which can give wound dressings the function of releasing drugs in response to the wounds, and thus effectively promote wound healing. Based on this, this paper reviews the research progress in the field of wound dressings, summarizes the relevant characterization methods, and briefly outlines the future research direction in this field.
wound dressing; wound healing; dressing properties
(编辑 余 毅)
