篮状菌属次级代谢产物结构及活性的研究进展
2024-12-31安婷谭慧郭蓉马晓丽文怀秀





摘要:内生真菌的次级代谢产物是近年天然产物的研究热点。篮状菌属(Talaromyces sp.)是一种重要的内生真菌,是青霉属(Penicillium)的有性型属菌种。Talaromyces sp.属分布广泛,其次级代谢产物包括生物碱类、多肽类、酯类和聚酮类等,其中一些具有抑菌、抗炎和抗肿瘤等活性。Talaromyces sp.属广泛应用于食品和农业的生产,并在害虫的生物防治中也具有重要作用。因此,Talaromyces sp.属在医药、食品和农业等方面具有重要的研究价值和应用潜力。本文共收录了338种篮状菌属的次级代谢产物,包括38种生物碱、116种酯类、47种异香豆素类、69种聚酮类、16种醌类和52种甾体类及萜类化合物,这些数据能够为以后Talaromyces sp.属的研究提供一定的参考价值,为医学、农业和环境等方面做出贡献。
关键词:篮状菌属;次级代谢产物;化学结构;生物活性
中图分类号:R932 文献标志码:A
Research progress on the structure and activity of secondary metabolites of Talaromyces sp.
An Ting1,2, Tan Hui1,2, Guo Rong1, Ma Xiaoli1, and Wen Huaixiu1
(1 Key Laboratory of Tibetan Medicine Research, Northwest Institute of Plateau Biology, Chinese Academy of" Sciences/Qinghai Provincial Key Laboratory of Tibetan Medicine Research, Xining 810008; 2 University of Chinese Academy of Sciences, Beijing 100049)
Abstract The secondary metabolites of endophytic fungi have been the focus of natural product research in recent years. Talaromyces sp. is an important endophytic fungus, a sexual species of Penicillium. Talaromyces sp. is widely distributed, and its secondary metabolites include alkaloids, peptides, esters, and polyketides, some of which have diverse biological activities, such as antibacterial, anti-inflammatory, and antitumor activities. Talaromyces sp. is widely used in food and agricultural production and also plays an important role in the biological control of pests. Therefore, Talaromyces sp. has important research value and application potential in medicine, food, and agriculture. In this paper, 338 secondary metabolites of cyanobacterium were reviewed, including 38 alkaloids, 116 esters, 47 isocoumarins, 69 polyketides, 16 quinones, 52 steroids, and terpenoids. The data in this paper could provide some reference value for future research on Talaromyces sp. and its contributions to medicine, agriculture, and the environment.
Key words Talaromyces sp.; Secondary metabolites; Chemical structure; Biological activity
1 篮状菌属简介
篮状菌(Talaromyces sp.)是青霉属(Penicillium)的有性型属菌种[1],该属是在1955年由Benjamin[2]命名建立的,可以用于分类一些青霉属菌种的异形体。篮状菌名字主要来源于希腊语中的“篮子(basket)”,描述了其由子囊孢子形成的结构,即裸子囊[3]。Talaromyces sp. 属分布广泛,可从土壤、植物、海绵和食物中分离得到[1,4]。篮状菌 (Talaromyces sp.)的次级代谢物包括生物碱类、多肽类、酯类、聚酮类和萜类等,其中一些化合物具有抗炎、抗肿瘤和抗菌等生物活性[1,4-6],例如一些异香豆素类基于其抗炎和α-糖苷酶抑制特性,能够治疗阿尔兹海默症等疾病[7]。Talaromyces sp.属中的部分菌株耐热,部分可以合成糖类、制备手性构建块和生物转化的酶,在害虫的生物防治中也具有重要作用;并且有的菌株还可广泛应用于食品和农业生产[5,8],例如T. pinophilus strain EMOO 13-3能够降解农业废物[9]。Talaromyces sp.属中的T. marneffei具有致病性,会引发塔尔芳香菌病,这是一种被忽视的热带病,并且艾滋病患者更容易感染T. marneffei真菌,而目前全球极度缺乏对于这种疾病的诊断和治疗方法,主要的治疗手段是使用抗真菌药物,包括两性霉素(AmB)、依曲康唑、伏立康唑和泊沙康唑,所以研究T. marneffei的生长生物学和宿主-病原体相互作用机制是非常重要的,以提高对易感人群的诊断和治疗[10]。
2 篮状菌属的化学成分及活性研究
2.1 生物碱类
生物碱类是篮状菌属真菌中主要的次级代谢产物,其结构复杂多样,以含氮杂环类衍生物为主,生物碱还具有抗菌、抗肿瘤等丰富的生物活性[4,11-12]。下面将按活性进行分类阐述,共总结了38种化合物(图1~2)。
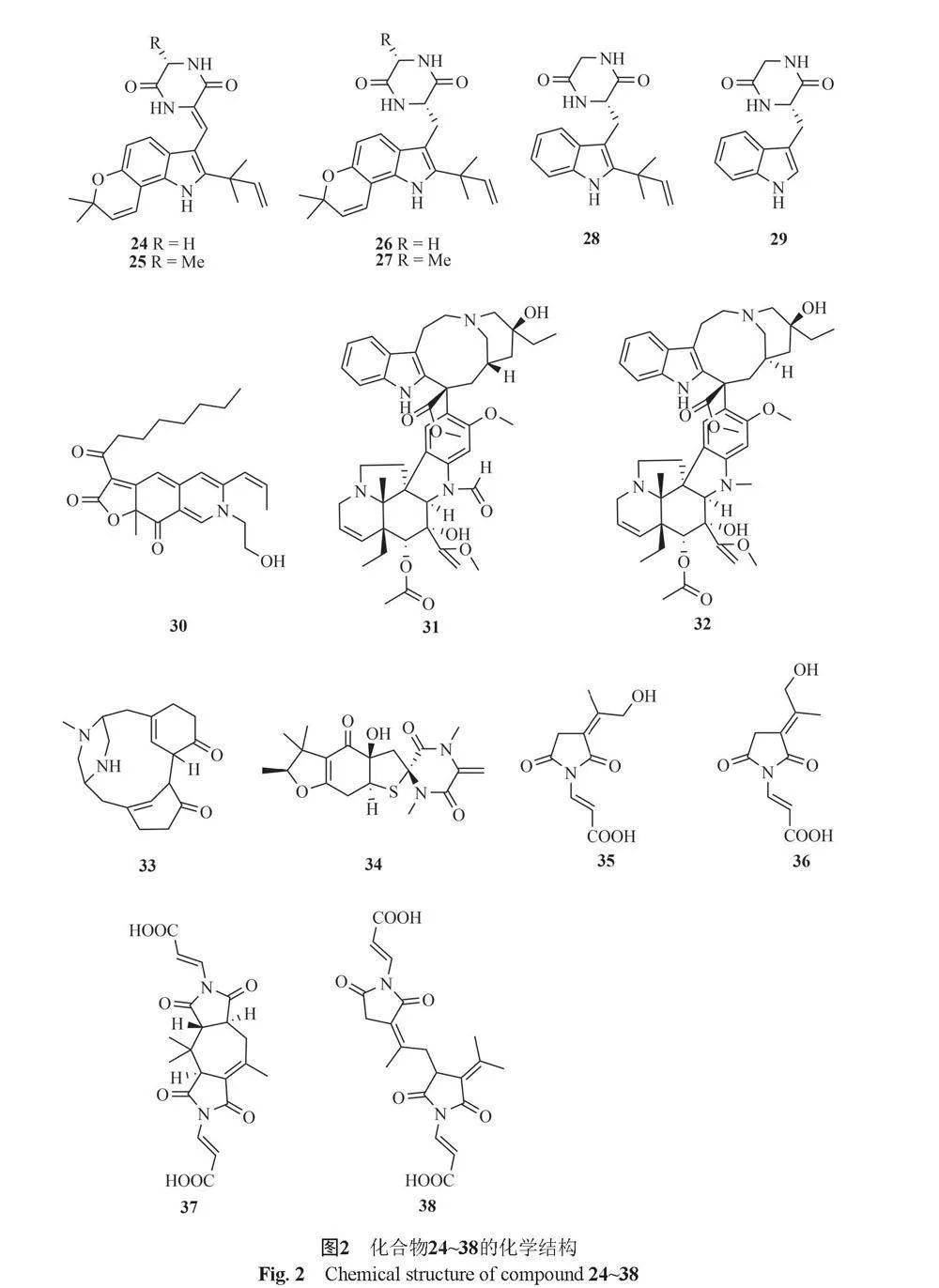
Suzuki等[13]从内生真菌T. convolutus中分离出的4种新化合物talaroconvolutins A~D(1~4)和已知化合物ZG-1494R(5),其中化合物2、3和5对烟曲霉、黑曲霉、白念珠菌和新型隐球菌有抑制作用。Miao等[14]的研究表明,从狼毒属植物内生真菌T. verruculosus中分离得到的1种吲哚类生物碱化合物(6),该化合物对细菌和真菌都具有体外抑菌活性。Yang等[15]从藻类内生真菌Talaromyces sp. cf-16的发酵液中分离得到2种新的天然生物碱2-[(S)-hydroxy(phenyl)methyl]-3-methylquinazolin-4(3H)-one(7)和2-[(R)-hydroxy(phenyl)methyl]-3-methylquinazolin-4(3H)-one(8),以及7种已知化合物roquefortine C(9)、Z-roquefortine C(10)、 viridicatol(11)、penitrem A(12)、penijanthine A(13)、paspaline(14)和3-deoxo-4b-deoxypaxilline(15),其中化合物10、11、12和13对金黄色葡萄球菌有抑制作用。Chen等[16]从红树林内生真菌Talaromyces sp. HZ-YX1中获得了化合物talaramide A(16),该化合物对分枝杆菌蛋白激酶G活性的抑制作用。
Ngokpol等[17]从海洋真菌T. minioluteus(Penicillium minioluteum)中分离出7种化合物,包括4种新的倍半萜烯类生物碱minioluteumides A~D(17~20)和3种已知化合物purpuride(21), berkedrimane B(22)和purpuride B(23),其中化合物17、20和22对HepG2癌细胞具有较弱的细胞毒活性。
Chu等[18]从嗜热真菌T. thermophilus YM 1-3中分离出的2个异戊烯基化吲哚类生物碱talathermophilins A和B(24和25),这些化合物具有杀线虫活性。
Guo等[19]从嗜热真菌T. thermophilus YM 3-4中获得了6种吲哚类生物碱,talathermophilins A~E(24~28)和cyclo(glycyltryptophyl)(29)。Frisvad等[20]从真菌T. atroroseus中分离得到化合物PP-R(30)。Palem等[21]从内生真菌T. radicus中分离得到vincristine(31)和vinblastine(32)。Vinale等[22]从草莓树(Arbutus unedo)的内生真菌T. pinophilus中分离得到herquline B(33)。Zhang等[23]从南海沉积物样品中分离出的1种海洋真菌T. mangshanicus BTBU20211089中鉴定出5个新化合物,即talaromanloid A(34)、10-hydroxy-8-demethyltalaromydine(35)、11-hydroxy-8-demethyltalaromydine(36)、ditalaromylectones A和B(37和38)。
2.2 酯类
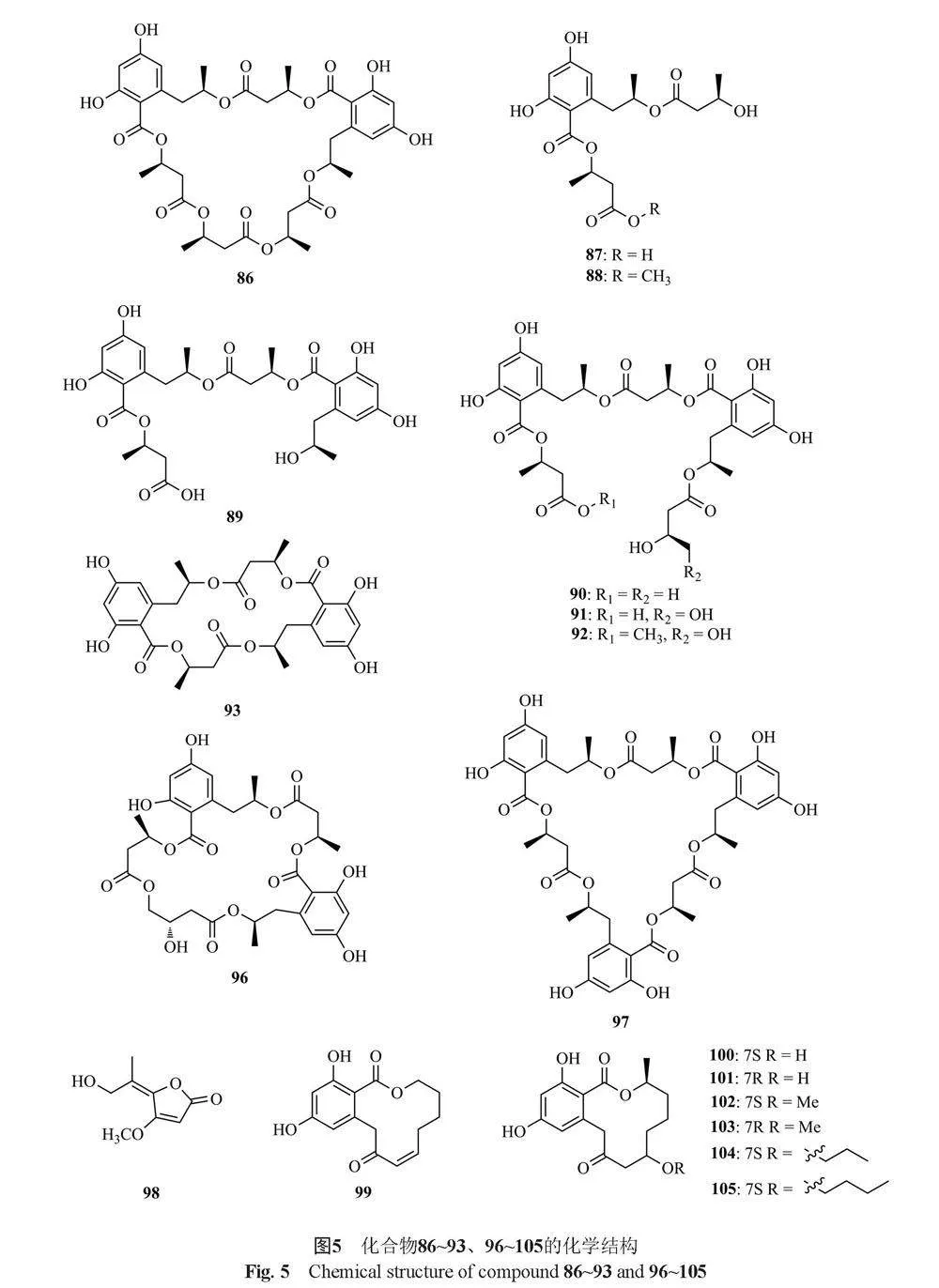
酯类是由氧酸与醇或苯酚等羟基化合物反应生成的化合物,篮状菌属的次生代谢物中主要含有酯类化合物,包括大环内酯类、聚酯类、芳香族内酯类和苯酞类等,有的酯类具有细胞毒活性[4,11-12]。下面将按活性进行分类阐述,共总结了116种化合物(图3~8)。
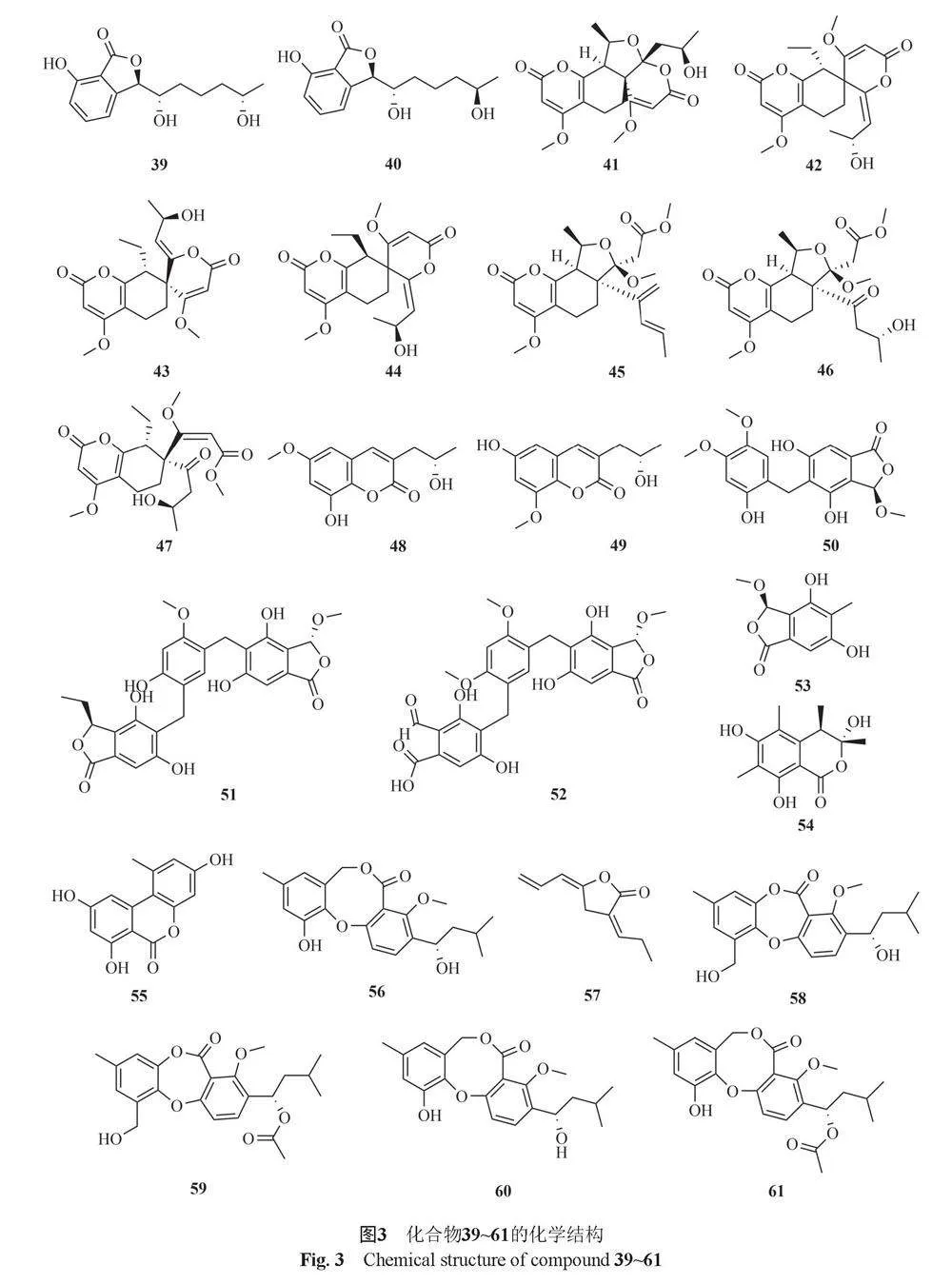
Huang等[24]从尖藻共生真菌T. amestolkiae种分离出2种新化合物amestolkins A和B(39和40),它们对BV-2小胶质细胞具有抗炎作用。Li等[25]从内生真菌T. adpressus中分离得到了7个新型α-吡喃酮加合物talarolactones A~G(41~47),化合物45和46对NO产物具有显著的抑制活性,IC50分别为(2.3±0.1)和(3.7±0.3) μmol/L 。
He等[26]从湿地土源真菌T. flavus BYD07-13中分离得到两个新的香豆素talacoumarins A和B(48和49),这两种化合物具有抗Aβ42聚集、细胞毒活性和抗菌活性。Zhai等[27]从青葱(Allium fistulosum L.)的内生真菌T. pinophilus AF-02中分离得到3种新的酞类衍生物talaromycolides A~C(50~52)和5种已知化合物rubralide C(53)、sclerotinin A(54)、alternariol(55)、penicillide(56)和berkedienolactone(57),其中化合物50对产气荚膜梭菌和枯草芽胞杆菌具有抑制活性,化合物51对巨型芽胞杆菌和大肠埃希菌具有抑菌活性,化合物52对产气荚膜假单胞菌具有抑制活性。Cai等[28]从红树林内生真菌T. stipitatus SK-4的发酵产物中分离得到talaromyone A(58)、talaromyone B(59)、penicillide(60)、purpactin A(61)和tenellicacid A(62),其中化合物59对枯草芽胞杆菌具有较好的抑制活性。Pandit等[29]从T. purpureogenus CFRM-02中分离得到pentalsamonin(63),该化合物对枯草芽胞杆菌、金黄色葡萄球菌和大肠埃希菌等具有抑制活性。Lv等[30]从红树林源真菌T. WHUF0362中分离得到5个新的depsidone衍生物talaronins A~E(64~68),其中化合物68对幽门螺杆菌具有较强的抑菌活性,最小抑菌浓度(MIC)在2.42~36.04 μmol/L之间。
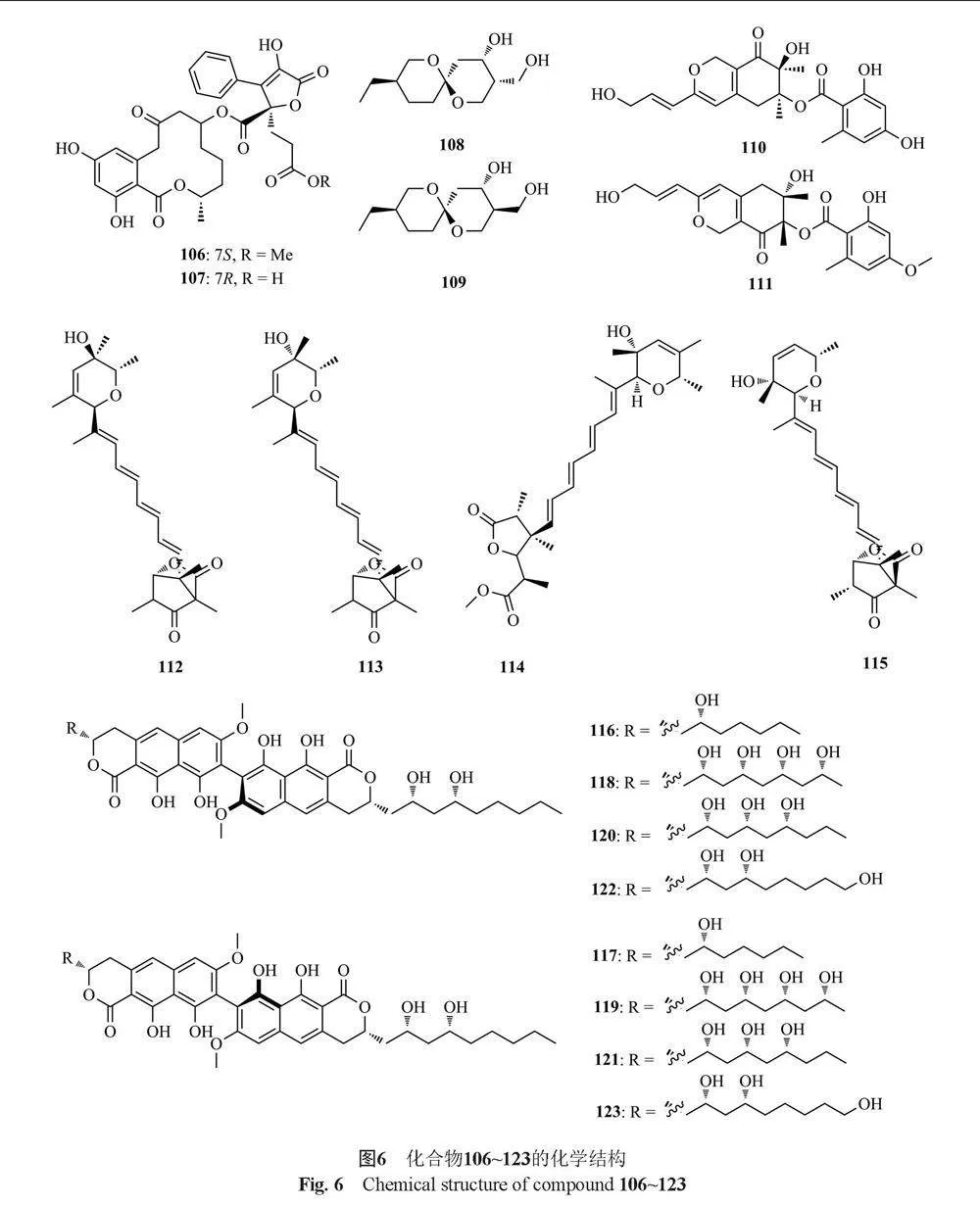
Dethoup等[31]从内生真菌T. bacillisporus中分离得到2种新的低聚苯乙酮二聚体bacillisporins D和 E(69和70)以及已知化合物duclauxin(71),化合物71对3种人肿瘤细胞系MCF-7, NCI-H-460和SF-268具有抑制作用,而化合物70具有较弱的抑制活性。Dong等[32]从T. wortmannii中分离得到4种新的22元大环内酯wortmannilactones A~D(71~74),这些化合物对HCT-5, HCT115和A-549等人类癌细胞具有抑制活性。Li等[33]从红树林内生真菌T. flavus中分离到4种新的去甲半萜过氧化物talaperoxides A~D(75~78)和1个已知类似物steperoxidde B(79),其中化合物76、78和79对人癌细胞具有细胞毒性。Kumar等[34]从内生真菌Talaromyces sp.中分离得到1种新的内酯(3S, 4aR, 7S)-7,8-dihydroxy-3-methyl-3,4,10,5,6,7-hexahydro-1H-isochromen-1-one(80),该化合物对一系列人类癌细胞系(HCT-116, A-549, HEP-1, THP-1和PC-3)具有细胞毒性,能诱导HL-60细胞凋亡。2014年,He等[35]从湿地土壤源性真菌T. flavus BYD07-13的发酵产物中分离到6个新的聚酯talapolyesters A~F(81~86)和11个已知聚酯15G256v(87)、15G256v-me(88)、15G256π(89)、15G256β-2(90)、15G256α-2(91)、15G256α-2-me(92)、15G256ι(93)、15G256β(94)、15G256α(95)、15G256α-1(96)和15G256ω(97),其中化合物93、94、95、96和97对HL-60、SMMC-7721、A-549、MCF-7和SW480肿瘤细胞都具有细胞毒性。Nonaka等[36]从Talaromyces sp. FKA-65中分离得到1个新的青霉素酸衍生物coculnol(98),该化合物对A/PR/8/34(H1N1)有抑制作用,IC50值为283 μg/mL,对MDCK细胞有弱细胞毒性,IC50值为781 μg/mL。Küppers等[37]从地中海海绵Axinella cannabina分离出来的T. rugulosus中得到了9种内酯类衍生物,包括7种(3S)-间苯二酚衍生物,(3S)-cis-resorcylide(99)、(3S,7S)-7-hydroxyresorcylide(100)、(3S,7R)-7-hydroxyresorcylide(101)、(3S,7S)-7-methoxy-resorcylide(102)、(3S,7R)-7-methoxy-resorcylide(103)、(3S,7S)-7-O-n-Butylresorcylide(104)、(3S,7R)-7-O-n-Butylresorcylide(105);2种丁烯内酯二聚体talarodilactones A和B(106和107),这2种化合物对L5178Y小鼠淋巴瘤细胞系具有较强的细胞毒性,IC50值分别为3.9和1.3 µmol/L。Yuan等[38]从内生真菌Talaromyces sp. MH551540中分离得到talaromycin A(108)和clearanol A(109),它们对MDA-MB-231细胞具有选择性细胞毒性。
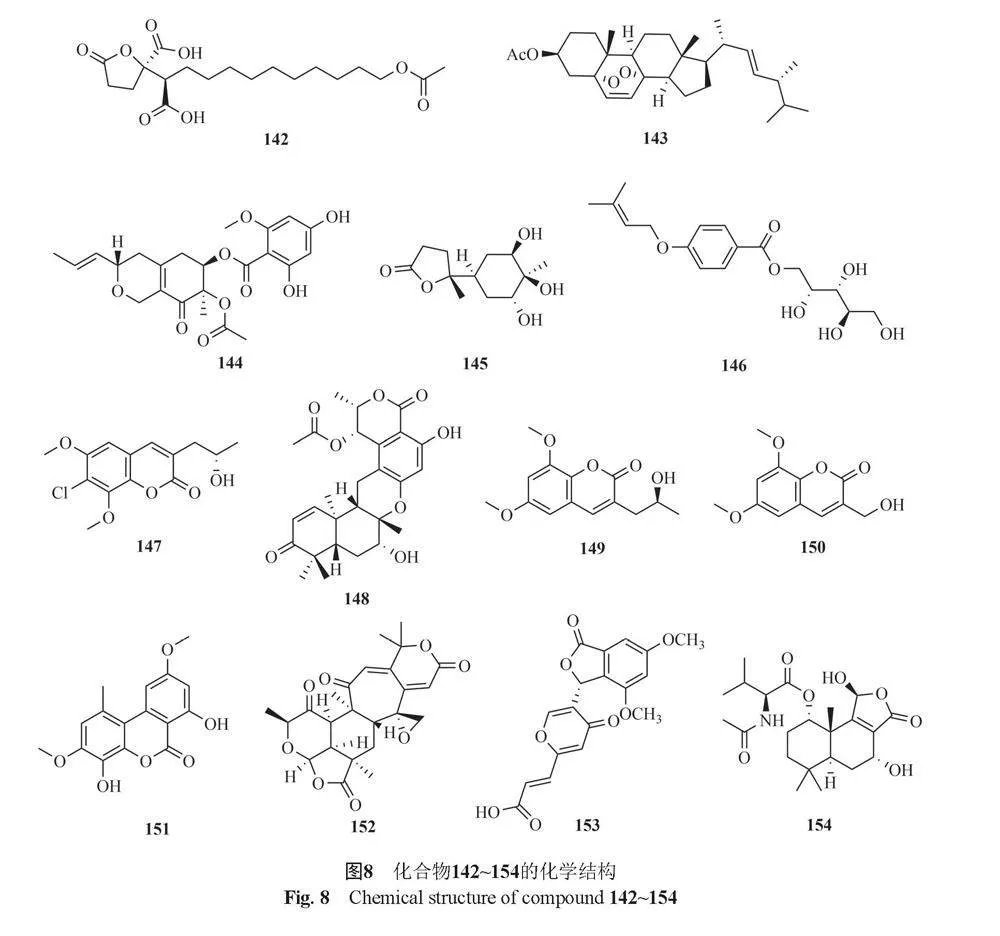
Kimura等[39]从Talaromyces sp.培养物中分离到2个新的氮唑啉类化合物Kasanosins A和B(110和111),它们能够选择性地抑制真核DNA聚合酶b和k的活性,化合物110的抑制作用强于化合物111。Dong等[40]从土壤真菌T. wortmannii中分离得到4种新的四烯内酯wortmannilactones E~H(112~115),这4种化合物对组织蛋白酶B具有抑制剂活性。Kawaguchi等[41]从T. pinophilus FKI-3864发酵液中分离得到dinapinones AB1和AB2(116和117)、dinapinones AC1和AC2(118和119)、dinapinones AD1和AD2(120和121)、dinapinones AE1和AE2(122和123),其中化合物117对完整哺乳动物细胞合成三酰甘油具有较强的抑制作用。Kaifuchi等[42]从真菌Talaromyces sp. FKI-6713中分离得到1种新的乌克里酯类似物ukulactone C(124),该化合物对NADH-富马酸还原酶具有抑制活性。Ding等[43]从真菌T. wortmannii LGT-4 中分离得到secovironolide(125)、 wortmannin(126)、11-desacetoxywortmannin-17β-ol(127)、11-desacetoxywortmannin(128)和deacetylisowortmin(129),其中化合物126和127对单胺氧化酶具有微弱的抑制作用。Zhao等[44]从雷公藤内生真菌T. wortmannii LGT-4培养物中分离得到wortmannines F和G(130和131),具有较强的磷酸肌醇-3-激酶-α(PI3K-α)抑制活性。
Tomikawa等[45]从Talaromyces sp. 3656-A1种分离得到一种新的化合物rasfonin(132)。Wang等[46]在Azole类抗真菌抗生素增效剂筛选过程中,从Talaromyces sp. FKI-0076B中分离得到另一种邻苯二甲酸酯类化合物vermistatin(133)。Dethoup等[47]从T. thailandiasis中分离得到2种vermistatin的类似物penisimplicisin(134)和hydroxydihydrovermistati(135)。Li等[48]从云南红豆杉(Taxus yunnanensis)内生真菌Talaromyces sp. T1BF中分离得到3个氮唑啉类化合物,其中1个为新化合物kasanosin C(136),还有2个已知化合物entonaemin A(137)和(+)-mitorubrin(138)。Frisvad等[20]从真菌T. atroroseus中分离得到化合物glauconic acid(139)。He等[49]从湿地土源真菌T. flavus BYD07-13中分离得到2个新的聚酯talapolyesters G 和H(140和141)。Kumla等[50]从真菌T. trachyspermus(KUFA0021)中分离得到2个新的化合物spiculisporic acid E(142)和3-acetyl ergosterol 5,8-endoperoxide(143)。Fu等[51]从红树林植物Acanthus ilicifolius叶片中提取的T. wortmannii LGT-4中分离得到deacetylisowortmins A和B(129和144)。Yang等[52]从内生真菌T. marneffei的培养物种分离得到talaromarnine A 和B(145和146)。El-Elimat等[53]从T. amestolkiae中分离得到2种新的化合物7-chloropestalasin A(147)和entthailandolide B(148),4种已知化合物pestalasin A(149)、 3-hydroxymethyl-6,8-dimethoxycoumarin(150)、graphislactone A(151)和berkeleyacetal C(152)。Ningsih等[54]从土壤真菌T. thailandensis PSU-SPSF05中分离得到1个新的vermistatin衍生物talarostatin(153)。Yang等[55]从海洋真菌T. minioluteus CS-113中分离得到1个新的drimane倍半萜内酯11-hydroxyminioluteumide B(154)。
2.3 异香豆素类
异香豆素是一类特殊含氧杂环类化合物,具有苯环和α-吡酮环的结构,具有多种生物活性[11,56]。下面将按活性进行分类阐述,共总结了47种化合物(图9~10)。
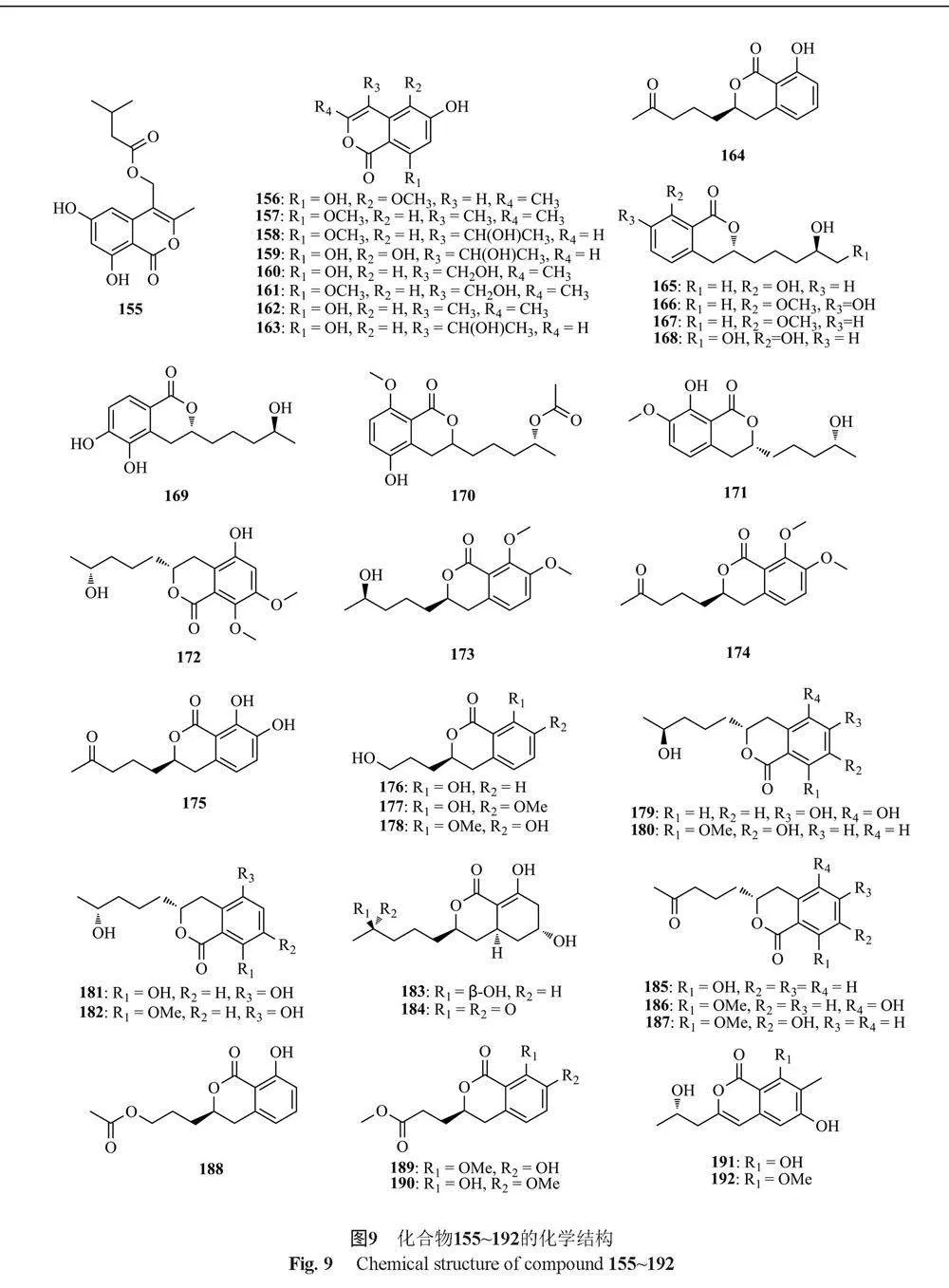
Chen等[57]从红树林内生真菌T. amestolkiae YX1中分离得到6个新的异香豆素(155~158和168~169)和9个已知的异香豆素类似物(159~167),其中化合物156、160、162、164具有抑制α-葡萄糖苷酶活性,IC50值分别为89.4、17.2、36.4和38.1 μmol/L。Cai等[58]从红树衍生真菌T. flavus(Eurotiales: Trichocomaceae)TGGP35中分离得到6个新的异香豆素衍生物talaromarins A~F(170~175)和17个已知的类似物(176~192),这些化合物均无抑菌和抗植物病原菌活性,但化合物175~180、186~188和190~191具有抗氧化活性,化合物169、187、190和192对α-葡萄糖苷酶表现出较强的抑制活性。
Miao等[14]从狼毒(Stellera chamaejasme L.)根际真菌T. verruculosus种分离得到1种二氢异香豆素(-)-8-hydroxy-3-(4-hydroxypentyl)-3,4-dihydroisocoumarin(193),该化合物对金黄色葡萄球菌(Staphylococcus aureus)和大肠埃希菌(Escherichia coli)具有显著的抑菌活性。
Dethoup等[47]从T. thailandiasis中分离得到2种异香豆素类化合物thailandolides A和B(194和195),以及含有thailandolides B的芳香片段的O-甲基化衍生物3-Methyl-6-hydroxy-8-methoxy-3,4-dihydroisocoumarin(196)。Küppers等[37]从地中海海绵Axinella cannabina分离出来的T. rugulosus中得到了2种新的二氢异香豆素talumarin A(197)和化合物(198),以及1种已知的类似物aspergillumarin A(199)。El-Elimat等[53]从T. samestolkiae中分离得到1种新的二氢异香豆素4-hydroxyaspergillumarin A(200)和2种已知的二氢异香豆素aspergillumarins A and B(199和201)。
2.4 聚酮类
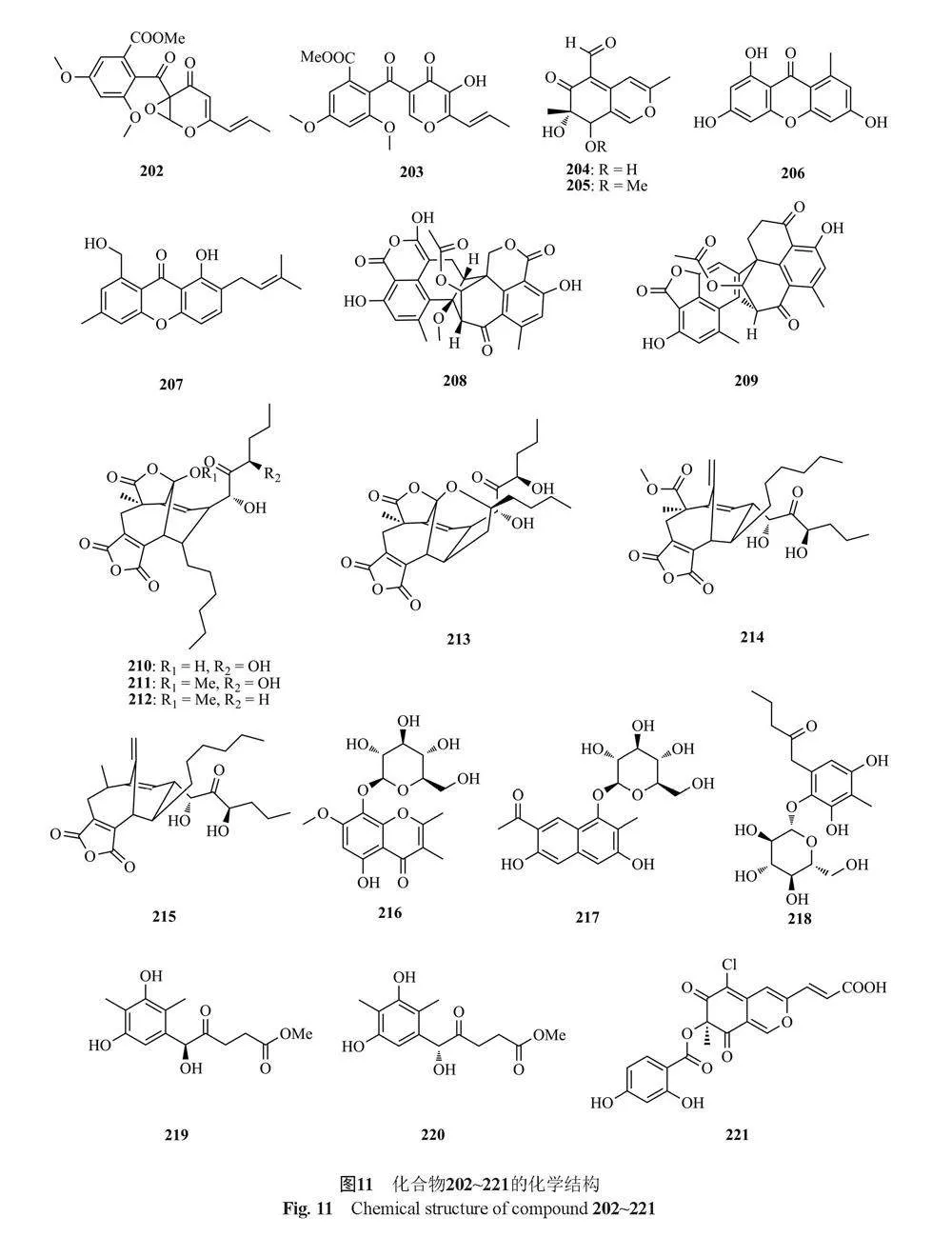
聚酮类化合物是一类结构多样、来源广泛、种类繁多的一类天然产物。聚酮类化合物是由短链的酰基单元经聚酮合酶(polyketide synthase , PKS)催化一系列Claisen缩合反应生成的[11,59]。下面将按活性进行分类阐述,共总结了69种化合物(图11~14):
Komai等[60]从T. flavus IFM52668中分离得到1个新的funicone衍生物9,14-epoxy-11-deoxyfunicone(202)和1个已知化合物funicone(203),其中化合物202对黑曲霉(Aspergillus. niger)的抑制作用较弱,化合物203对人致病性丝状真菌烟曲霉(Aspergillus fumigatus)具有典型的抑制作用。Liu等[61]从Kandelia candel的内生真菌Talaromyces sp. ZH-154中分离得到2个新的聚酮7-epiaustdiol(204)和8-O-methylepiaustdiol(205),以及1个已知的氧杂蒽酮norlichexanthone(206),其中化合物204对铜绿假单胞菌具有显著的抑制活性,MIC值为6.25 µg/mL。Wu等[62]从海洋真菌Talaromyces sp. LF458的培养液和菌丝体中分离得到3个新的化合物talaroxanthenone(207)、talaromycesoneA和B(208和209),其中化合物207和208具有抗菌活性,化合物207对乙酰胆碱酯酶(AchE)和磷酸二酯酶(PDE-4B2)有抑制作用,IC50值分别为1.61和
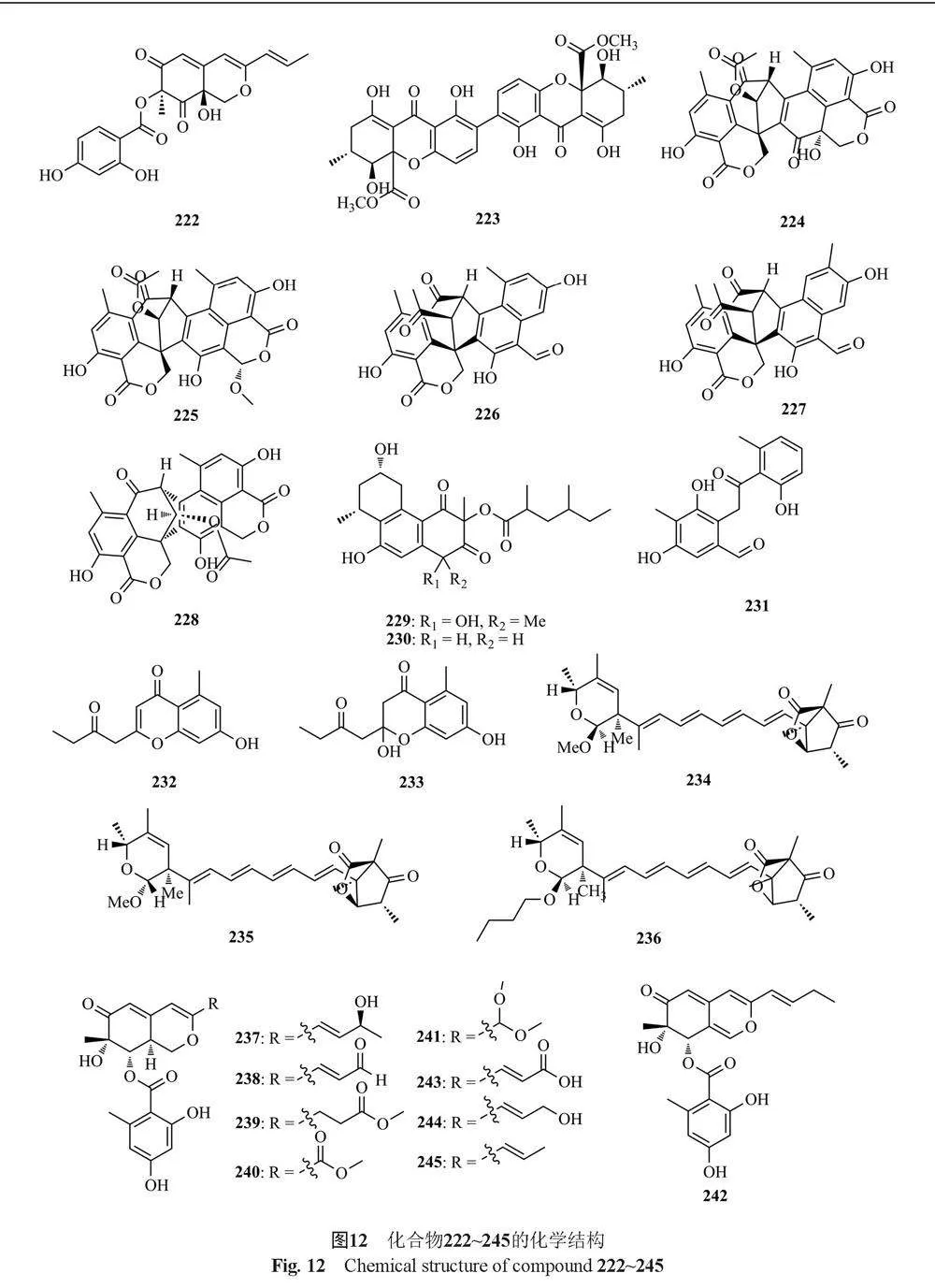
7.25 μmol/L。Zhao等[63]从南极海绵源真菌Talaromyces sp. HDN1820200中分离到6个新的非甾体衍生物talarodrides A~F(210~215),其中化合物210和211对奇异变形杆菌(Proteus mirabilis)和副溶血性弧菌(Vibrio parahemolyticus)有选择性的抑制作用,MIC值为3.13~12.5 μmol/L。Yang等[55]从海洋真菌T. minioluteus CS-113中分离得到3个新的葡萄糖苷类聚酮talaminiosides A~C(216~218),一对外消旋芳香聚酮(±)-talaminone A(219~220), 2个新的氮唑酮类聚酮(+)-5-chloromitorubrinic acid(221)和7-epi-purpurquinone C(222),其中化合物216~218对交替稻瘟病菌QDAU-26、gloeosporioides QDAU-22、asiarium QDAU-27和F. graminearum QDAU-4具有抑制活性,MIC值在4~32 μmol/L之间,化合物222对上述真菌具有较强的抑制活性,MIC值为1~4 μmol/L。
Liu等[61]从Kandelia candel的内生真菌Talaromyces sp. ZH-154中分离得到1个已知的氧杂蒽酮secalonic acid A(223),该化合物对KB和KBv200细胞株具有细胞毒活性,IC50值分别为0.63和1.05 μmol/L。Zang等[64]从真菌T. stipitatus中分离到5个新的聚酮衍生的寡酚烯酮二聚体9a-epi-bacillisporin E(224)和 bacillisporins F~H(225~227),以及1个已知化合物bacillisporin A(228),其中化合物227对HeLa细胞具有抑制活性和适度的细胞毒性。
Matsunaga等[65]从Talaromyces sp.的培养液中分离到2个新的三环多酮化合物vanitaracin A和B(229和230),以及其他3个新化合物3,5-dihydroxy-2-(2-(2-hydroxy-6-methylphenyl)-2-oxoethyl)-4-methylbenzaldehyde(231), 7-hydroxy-5-methyl-2-(2-oxobutyl)-4H-chromen-4-one(232)和2,7-dihydroxy-5-methyl-2-(2-oxobutyl)chroman-4-one(233),其中化合物229具有较强的抗HBV活性,IC50值为10.5 μmol/L。Liu等[66]从T. wortmanninii中分离得到3个新的聚酮wortmannilactones I1~I3(234~236),这些化合物对NADH-富马酸还原酶具有选择性抑制活性,这些化合物对NFRD的IC50值分别为8.8、11和13 μmol/L。Ren等[64]从盐碱地来源的内生真菌T. aculeatus中获得了6个新的聚酮类化合物talaraculones A~F(237~242)和5个已知类似物pinazaphilone B, pinophilin, sch 725680,(-)-mitorubrin, 和(-)-mitorubrinol(243~247),其中化合物237和238对α-葡萄糖苷酶的抑制活性强于阳性对照阿卡波糖(IC50 = 101.5 μmol/L),IC50值分别为78.6和22.9 μmol/L。Silva等[67]从亚马逊内生真菌T. stipitatus DgCr2 2.1b中分离得到1个新的paecillin D(248),以及5种已知的聚酮类化合物secalonic acid A(249)、blennolide G(250)、versixanthone A(251)、 penicillixanthone A(252)和paecillin B(253),其中化合物248和251对酵母有活性,MIC值分别为15.6和31.3 µmol/L。
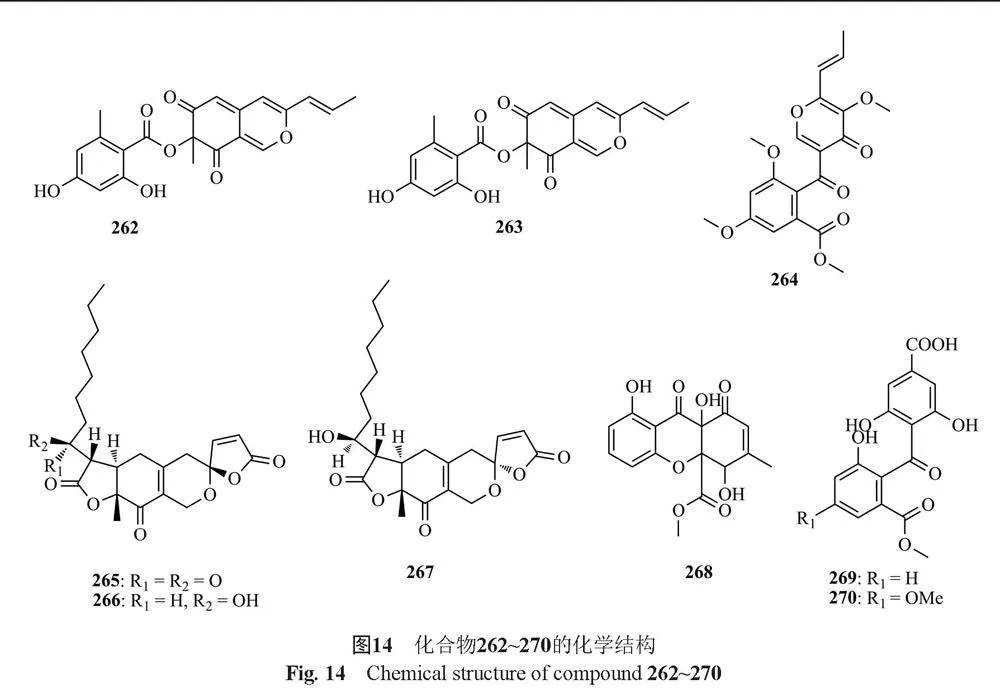
Arai等[68]从T. flavus FKI-0076中分离得到1个新的聚酮类化合物actofunicone(254)和1个已知化合物deoxyfunicone(255)。Koolen等[69]从亚马逊热带雨林药用植物杜鹃(Duguetia stelechantha)的内生真菌Talaromyces sp.中分离得到1个新的山酮二聚体talaroxanthone(256)。Bara等[70]从T. wortmanii中分离得到1个新的wortmannin衍生物wortmannin B(257),2个已知的wortmannin衍生物amino adduct 3a(258)和wortmannin-diol(VIII)(259),以及2个已知化合物wortmannin(260)和wortmin(261)。Frisvad等[20]从真菌T. atroroseus中分离得到化合物Monascorubramine(262)和Monascorubrin(263)。Vinale等[22]从草莓树(Arbutus unedo)的内生真菌T. pinophilus中分离得到3-O-methylfunicone(264)。Cao等[71]从海洋真菌Talaromyces sp. CX11中鉴定出3个新的螺旋环多酮类化合物talaromyacins A~C(265~267)。Lv等[30]从红树林源真菌T. WHUF0362中分离得到3个新的xanthone衍生物talaronins F~H(268~270)。
2.5 醌类
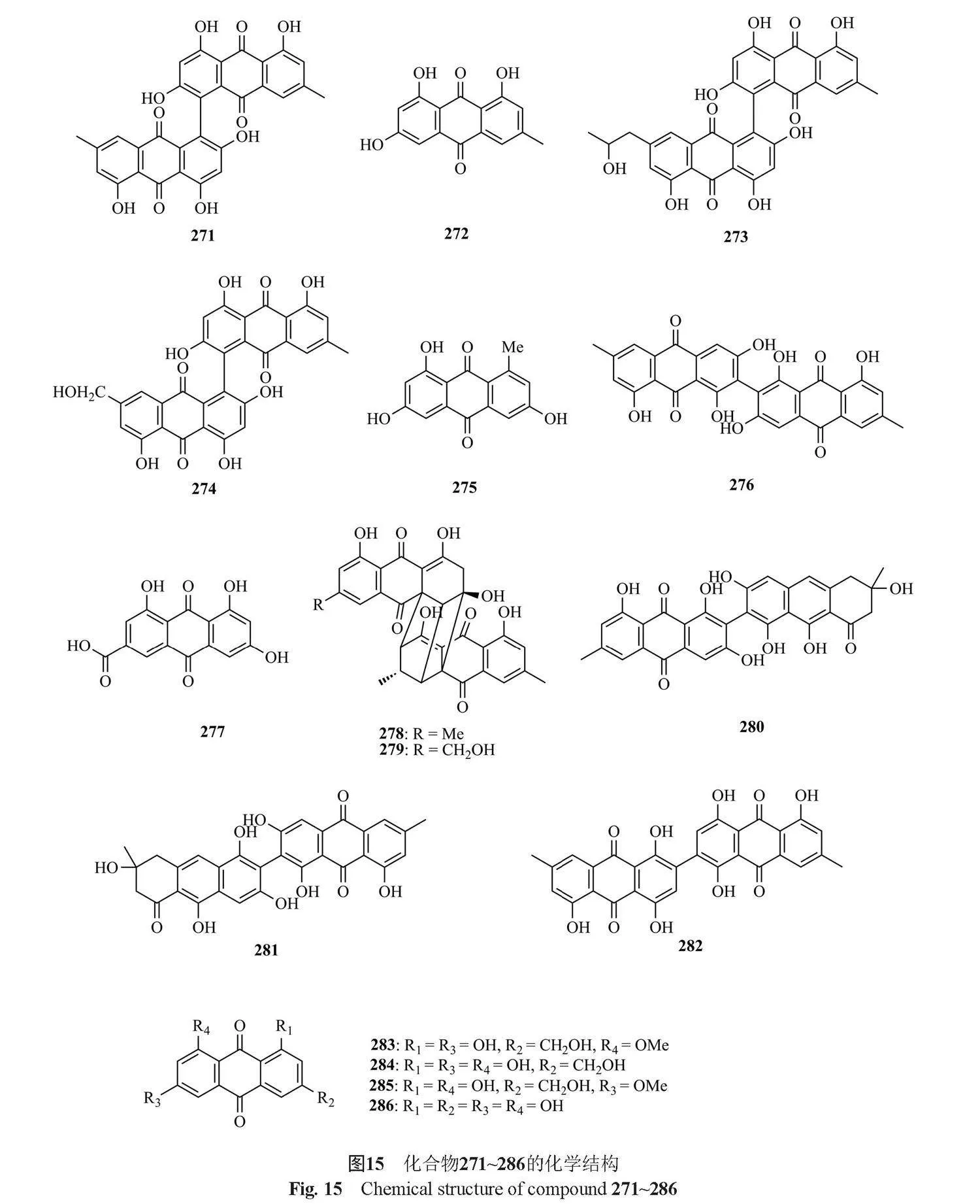
醌类化合物是一类重要的天然产物和药物,主要分布于植物、真菌和细菌中,是细胞呼吸和光合作用电子传递链中的重要组成部分,具有保肝 、 抗炎、 抗菌等生物活性[12,72-74]。下面将按活性进行分类阐述,共总结了16种化合物(图15)。
Liu等[61]从Kandelia candel的内生真菌Talaromyces sp. ZH-154中分离得到2个蒽醌化合物skyrin(271)和emodin(272),这两个化合物具有中等的细胞毒活性,化合物272的生物活性高于化合物271,化合物271对KB和KBv200细胞株的IC50值分别为20.38和16.06μmol/L,化合物272对KB和KBv200细胞株的IC50值分别为12.43和15.72 μmol/L。Xie等[75]从内生真菌Talaromyces sp.固态发酵提取物中分离到1个新的不对称二聚体蒽醌3-demethyl-3-(2-hydroxypropyl)-skyrin(273),以及5个已知化合物skyrin(271)、oxyskyrin(274)、emodin(272)和 1,3,6-trihydroxy-8-methylanthraquinone(275),其中化合物271、273和274对MCF-7细胞系具有中等的细胞毒活性。
Bara等[70]从T. wortmanii中分离得到1个新的蒽醌类化合物biemodin(276)和5个已知的化合物emodic acid(277)、skyrin(271)、oxyskyrin(274)和rugulosins A and B(278和279),其中276对革兰阳性菌,特别是对MRSA也有很强的活性。同年,Bara等[76]又从该菌中分离得到2种新的蒽醌类化合物talaromannins A 和 B(280和281),这两种化合物在金黄色葡萄球菌的可比浓度范围内显示中等MIC,MIC值为4~8 μg/mL,其中化合物280代表最活跃的同源物。
Noinart等[77]从海绵提取的真菌T. stipitatus KUFA 0207中分离得到了1个新的双蒽醌衍生物2,20-bis-(7-methyl-1,4,5-trihydroxy-anthracene-9,10-dione)(282)和5个已知化合物emodin(272)、 questinol(283)、citreorosein(284)、" fallacinol(285)和rheoemodin(286),其中化合物283和284具有显著的抗肥胖活性,它们分别降低了gt;60%和gt;90%的染色脂质,IC50值分别为0.95和0.17 μmol/L。
2.6 甾体类和萜类
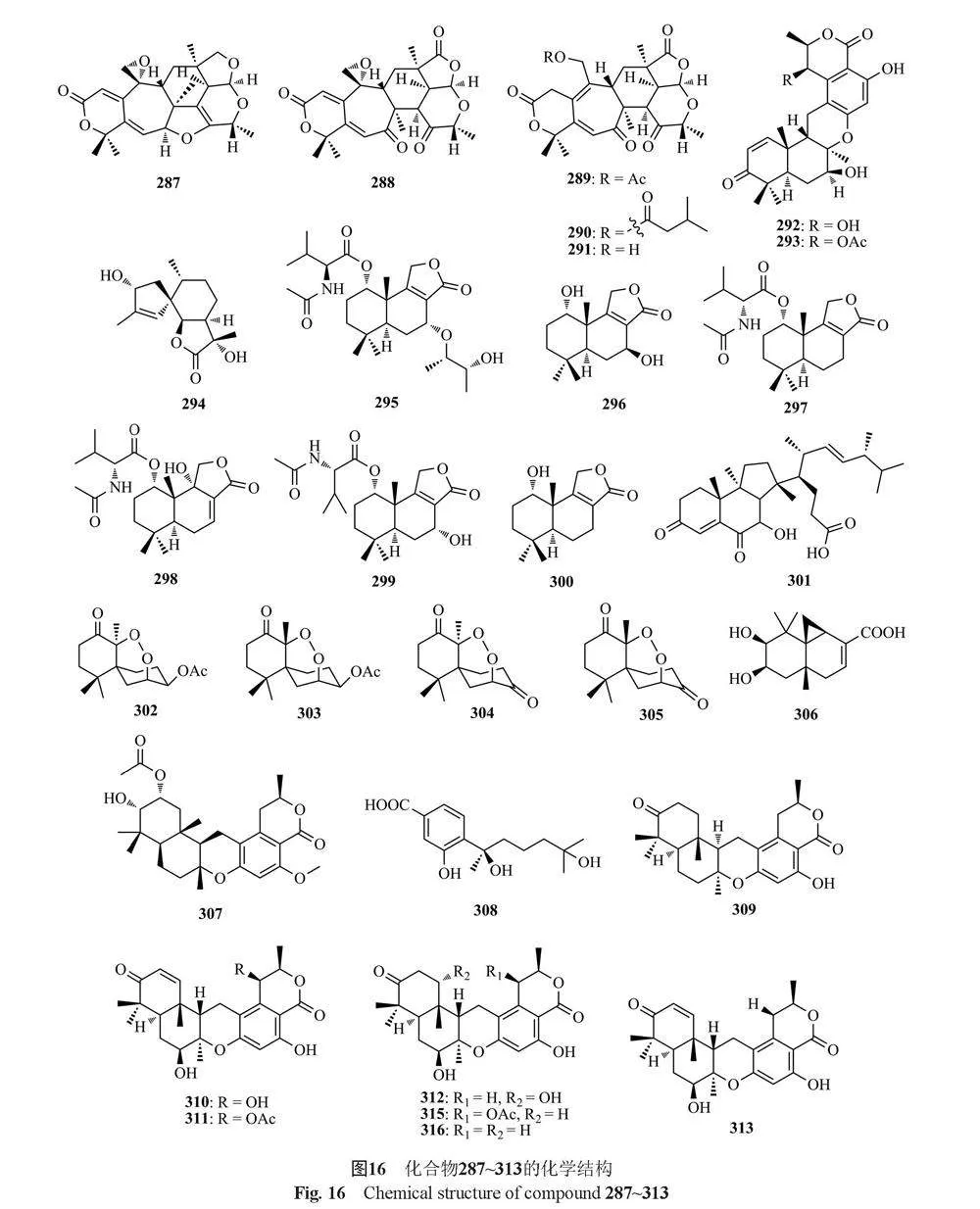
甾体类和萜类化合物广泛存在于自然界中。甾体类化合物具有环戊烷骈多氢菲的环系结构,具有抗炎、抗毒和抗休克等生物活性[78]。萜类化合物是以异戊二烯为基本单位的一类化合物,主要来源于动植物,具有抗肿瘤和抗氧化等生物活性[79]。下面将按活性进行分类阐述,共总结了52种化合物(图16~18)。
Chen等[80]从红树林内生真菌T. amestolkiae YX1分离得到4个杂萜amestolkolides A~D(287~290),以及3个已知化合物purpurogenolide E(291)、chrodrimanin B(292)和chrodrimanin A(293),其中化合物288有较强的体外抗炎活性,IC50值为(1.6±0.1) μmol/L。Chen等[81]从T. minioluteus发酵液中获得了1种新的螺旋体烷倍半萜talaminoid A(294)和两种驱动型倍半萜talaminoids B和C(295和296),以及4种已知化合物purpuride、berkedrimanes B 、minioluteumide B 和1α-hydroxyconfertifolin(297~300),化合物294、297和298对LPS诱导的BV-2细胞产生NO有显著抑制作用,IC50值在4.97~7.81 μmol/L之间,此外,它们对促炎细胞因子如TNF-α、IL-6具有显著的抑制活性。Zhang等[82]从海南三亚亚龙湾土壤真菌T. adpressus中分离得到了1个甾体类化合物talasterone A(301),这是1种罕见的6/6/5三环13(14→8)abo -8,14-二麦角甾体,该化合物具有显著的抗炎活性,在RAW264.7细胞中对LPS刺激的炎症表现出明显的抑制作用,IC50值为(8.73±0.66) μmol/L,化合物301可以通过抑制NF-κB通路来减少促炎细胞因子的产生。
Li等[33]从红树林内生真菌T. flavus的发酵产物中分离出4种新的倍半萜过氧化物talaperoxid A~D(302~305),其中化合物303和305对人癌细胞MCF-7、MDA-MB-435、HepG2、HeLa和PC-3具有细胞毒性,IC50值在0.70~2.78 μmol/L之间。Wang等[83]从T. purpureogenus的发酵产物中分离到新的二萜类化合物roussoellol C(306),该化合物对MCF-7癌细胞有抑制作用,IC50值为6.5 μmol/L。Hong等[84]从海洋源真菌Talaromyces sp. HM6-1-1中分离到一个新的美萜类化合物taladrimanin A(307),该化合物对MGC803和MKN28胃癌细胞具有抗肿瘤活性,对金黄色葡萄球菌6538P表现出选择性抗菌活性,对副溶血性弧菌和大肠埃希菌表现出较低的抗菌活性。
聂影影等[85]从1株来自普哥滨珊瑚的内生真菌Talaromyces sp.中分离得到1个没药烷型倍半萜(R)-()-hydroxysydonic acid(308),该化合物对白色假丝酵母Canidia albicans和耐甲氧基青霉素的金黄色葡萄球菌methicillin-resistant Staphylococcus aureus(MRSA)具有一定的抑制作用,MIC值分别为0.075和0.2 mmol/L,
对副溶血弧菌Vibrio parahemolyticus的抑制活性较弱,在0.2 mmol/L浓度下的抑制率为17%。
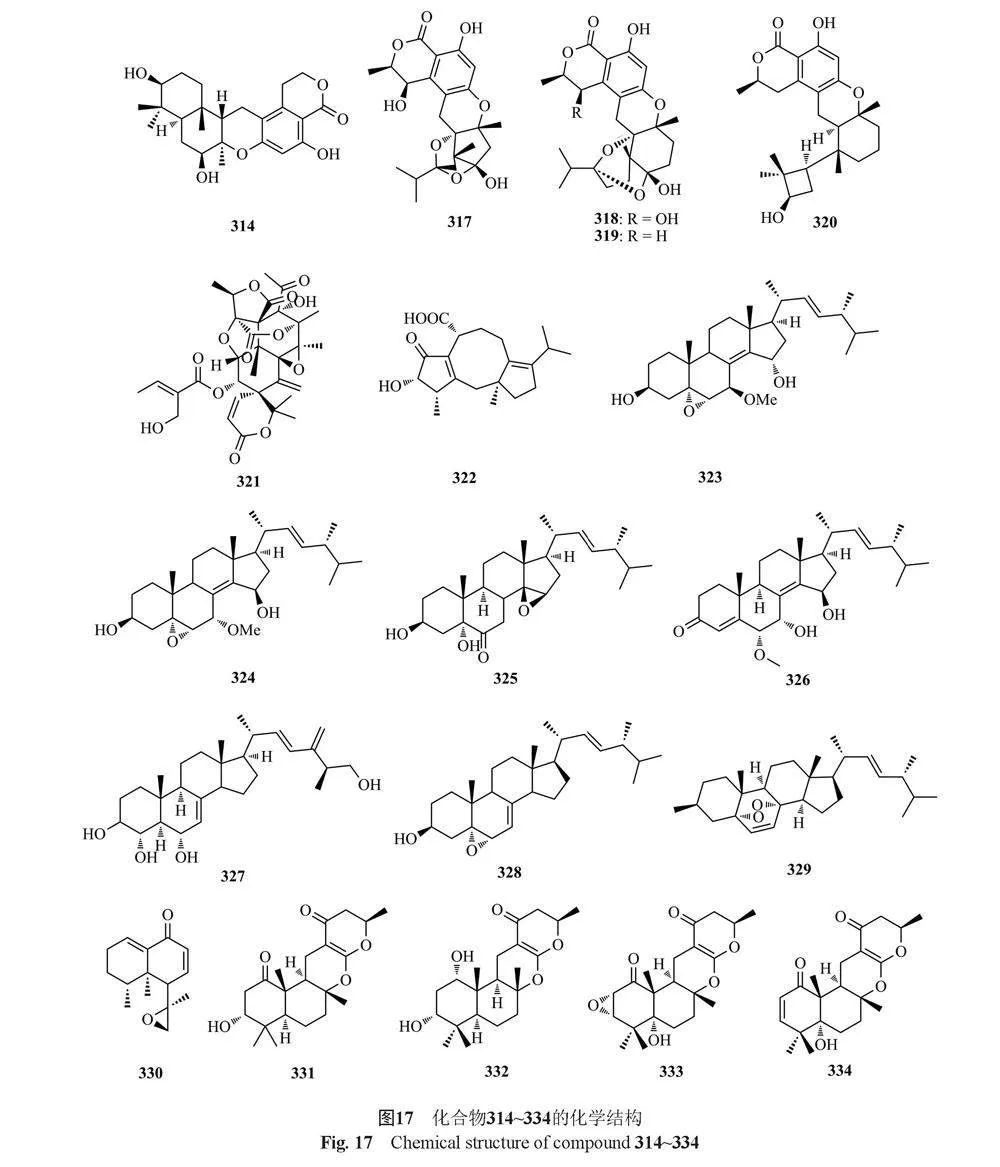
Hayashi等[86]从Talaromyces sp. YO-2菌株中分离出1个新的杂萜类化合物chrodrimanin C(309)以及已知化合物chrodrimanins A和B(310和311),其中化合物311具有杀虫活性。同年,Hayashi等[87]又从同一菌株中分离到4个新的杂萜类化合物chrodrimanins D~G(312~315)和1个已知化合物chrodrimanin H(316),其中化合物312、313和314对蚕具有杀虫活性。Cao等[88]从海洋真菌Talaromyces sp. CX11中分离得到talaromyolides A~D(317~320)和talaromytin(321),其中化合物320对伪狂犬病毒(PRV)具有较强的抗病毒活性,CC50值为3.35 μmol/L。Zhao等[89]从丹参内生真菌T. pinophilus中分离得到1个新的fusicoccane二萜pinophicin A(322)。Zhang等[90]从长柄参内生真菌T. stipitatus中分离得到5个新的甾醇衍生物(22E,24R)-7α-methoxy-5α,6α-epoxyergosta-8(14),22-diene-3β,15β-diol(323), (22E,24R)-5α,6α-epoxyergosta-8(14), 22-diene-3β,7β,15α-triol(324), (22E,24R)-3β,5α-dihydroxy-14β,15β-epoxyergosta-7,22-diene-6-one(325), (22E,24R)-6α-methoxy-7α,15β-dihydroxyergosta-4,8(14),22-triene-3-one(326)和(25S)-ergosta-7,24(28)-diene-3β,4α,6α,26-tetraol(327),这些化合物的抗增殖作用主要是通过诱导细胞凋亡介导的。
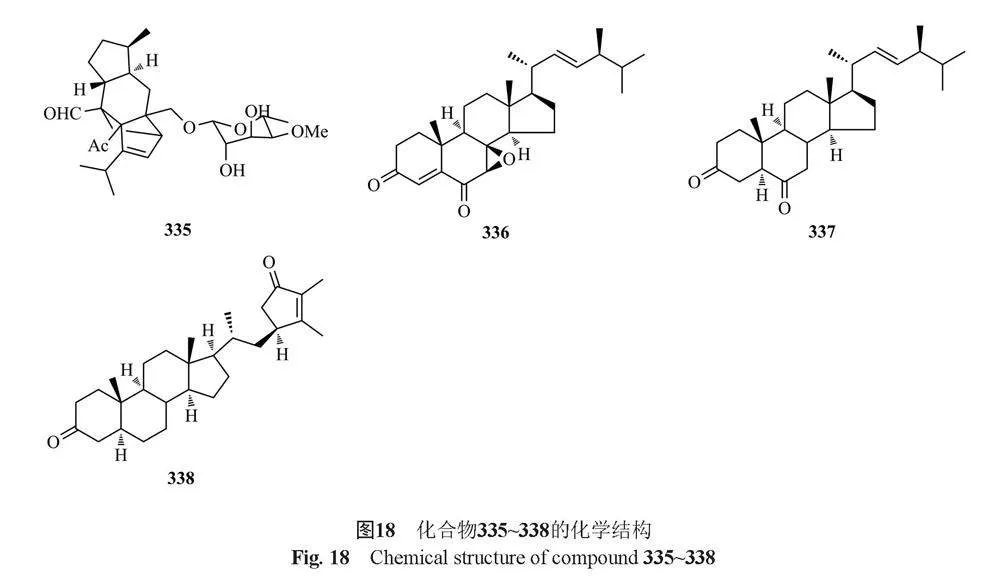
Li等[91]从云南红豆杉(Taxus yunnanensis)内生真菌Talaromyces sp. T1BF中分离得到1个已知的甾体类化合物α,6α-环氧-24(R)-甲基胆甾-7,22-二烯-3β(328)。Kumla等[50]从真菌T. trachyspermus(KUFA0021)中分离得到1个新的甾体类化合物3-acetyl ergosterol 5,8-endoperoxide(329)。He等[92]从湿地土壤真菌T. flavus BYD07-13中分离得到1种新的nardosinane型倍半萜类化合物talaflavuterpenoid A(330)。Kaur等[93]从药用植物水飞蓟[Silybum marianum (L.)Gaertn.]的内生真菌T. minioluteus(G413)中分离鉴定了4个萜类化合物talarolutins A~D(331~334)。Dewapriya等[94]从澳大利亚海洋被膜相关真菌Talaromyces sp.(CMB TU011)中分离得到1个二萜sordarin(335)。Noinart等[77]从海绵提取的真菌T. stipitatus KUFA 0207中分离得到了1个新化合物talarosterone(336)和1个已知的甾体类化合物cyathisteron(337)。Zhang等[95]从海洋源真菌T. stollii HBU-115的水稻培养物中获得了一个新的睡茄内酯talasteroid(338)。
3 总结与展望
篮状菌属真菌来源广泛、种类繁多,次级代谢产物丰富,在医药、食品和农业等方面具有重要的研究价值和应用潜力。本文对2000—2023年已报道的Talaromyces属次级代谢产物及生物活性进行了综述,为后续的研究提供一定的参考基础,共收录了338种化合物,包括38种生物碱、116种酯类、47种异香豆素类、79种聚酮类、16种醌类和52种甾体类及萜类化合物。数据表现出了Talaromyces属次级代谢产物的化学多样性和生物活性多样性,如抗炎、抗肿瘤、抑菌或抑制α-葡萄糖苷酶、富马酸NADH还原酶等活性。篮状菌属的次级代谢产物已经具有一定的发展,例如从Talaromyces属中分离得到异香豆素类化合物表现出抗乙酰胆碱酶的活性并能够治疗阿尔兹海默症,而甾体类和萜类化合物表现出显著的生物活性多样性,且该类别抗炎活性比较高[8]。然而目前还没有成功研发出可以应用在临床上的药物,并且对于菌株分离、真菌培养、化合物分离的科学技术和方法还需要不断地优化,以研究出具有药用价值的药物,为医学、农业和环境等方面做出贡献。
参 考 文 献
翟明明. 两种特色共生菌次生代谢产物研究[D]. 兰州: 兰州大学, 2016.
Benjamin C R. Ascocarps of Aspergillus and Penicillium[J]. Mycologia, 1955, 47(5): 669-687.
Pitt J. Penicillium: Penicillium and Talaromyces: introduction[M/OL]//Batt C A, Tortorello M L. eds. Encyclopedia of food microbiology (second edition), Academic Press. 2014. doi: 10.1016/B978-0-12-384730-0.00248-2.
Lan D H, Wu B. Chemistry and bioactivities of secondary metabolites from the genus Talaromyces[J]. Chem Biodivers, 2020, 17(8): 2000229.
Zhai M M, Li J, Jiang C X, et al. The bioactive secondary metabolites from Talaromyces species[J]. Natur Prod amp; Bioprosp, 2016, 6(1): 1-24.
Nicoletti R, Salvatore M, Andolfi A. Secondary metabolites of mangrove-associated strains of Talaromyces[J]. Mar Drugs, 2018, 16(1): 12.
Noor A O, Almasri D M, Bagalagel A A, et al. Naturally occurring isocoumarins derivatives from endophytic fungi: Sources, isolation, structural characterization, biosynthesis, and biological activities[J]. Molecules, 2020, 25(2): 395.
Nicoletti R, Bellavita R, Falanga A. The outstanding chemodiversity of marine-derived Talaromyces[J]. Biomolecules, 2023, 13(7): 1021.
El-Naggar N E, Haroun S A, Oweis E A, et al. Identification of newly isolated Talaromyces pinophilus and statistical optimization of β-glucosidase production under solid-state fermentation[J]. Prep Biochem Biotech, 2015, 45(7): 712-729.
Wang F, Han R H, Chen S. An overlooked and underrated endemic mycosis-talaromycosis and the pathogenic fungus Talaromyces marneffei[J]. Clin Microbiol rev, 2023, 36(1): e0005122.
Lei L R, Gong" L Q, Jin M Y, et al. Research advances in the structures and biological activities of secondary metabolites from Talaromyces[J]. Front Microbiol, 2022, 13: 984801.
陈仲巍, 林凤娇, 陈彬彬, 等. 篮状菌属微生物次级代谢产物研究进展[J]. 生物资源, 2022, 44(4): 362-369.
Suzuki S, Hosoe T, Nozawa K, et al. Antifungal substances against pathogenic fungi, talaroconvolutins, from Talaromyces convolutus[J]. J Nat Prod, 2000, 63(6): 768-772.
Miao F, Yang R, Chen D D, et al. Isolation, identification and antimicrobial activities of two secondary metabolites of Talaromyces verruculosus[J]. Molecules, 2012, 17(12): 14091-14098.
Yang H B, Li F, Ji N Y. Alkaloids from an algicolous strain of Talaromyces sp.[J]. Chin J Oceanol Limn, 2016, 34(02): 367-371.
Chen S H, He L Q, Chen D N, et al. Talaramide A, an unusual alkaloid from the mangrove endophytic fungus Talaromyces sp.(HZ-YX1)as an inhibitor of mycobacterial PknG[J]. New J Chem, 2017, 41(11): 4273-4276.
Ngokpol S, Suwakulsiri W, Sureram S, et al. Drimane Sesquiterpene-Conjugated Amino Acids from a Marine Isolate of the Fungus Talaromyces minioluteus(Penicillium Minioluteum)[J]. Mar Drugs, 2015, 13(6): 3567-3580.
Chu Y S, Niu X M, Wang Y L, et al. Isolation of putative biosynthetic intermediates of prenylated indole alkaloids from a thermophilic fungus Talaromyces thermophilus[J]. Org Lett, 2010, 12(19): 4356-4359.
Guo J P, Tan J L, Wang Y L, et al. Isolation of talathermophilins from the thermophilic fungus Talaromyces thermophilus YM3-4[J]. J Nat Prod, 2011, 74(10): 2278-2281.
Frisvad J C, Yilmaz N, Thrane U, et al. Talaromyces atroroseus, a new species efficiently producing industrially relevant red pigments[J]. PLoS One, 2013, 8(12): e84102.
Palem P P, Kuriakose G C, Jayabaskaran C. An endophytic fungus, Talaromyces radicus, isolated from Catharanthus roseus, produces vincristine and vinblastine, which induce apoptotic cell death[J]. PLoS One, 2015, 10(12): e0144476.
Vinale F, Nicoletti R, Lacatena F, et al. Secondary metabolites from the endophytic fungus Talaromyces pinophilus[J]. Nat Prod Res, 2017, 31(15): 1778-1785.
Zhang K, Zhang X, Lin R, et al. New secondary metabolites from the marine-derived fungus Talaromyces mangshanicus BTBU20211089[J]. Mar Drugs, 2022, 20(2): 79.
Huang L J, Li X A, Jin M Y, et al. Two previously undescribed phthalides from Talaromyces amestolkiae, a symbiotic fungus of Syngnathus acus[J]. J Asian Nat Prod Res, 2023, 25(2): 147-155.
Li Q, Zheng M J, Li F L, et al. Talarolactones A-G, α-pyrone dimers with anti-inflammatory activities from Talaromyces adpressus, and their biosynthetic pathways[J]. Org Lett, 2023, 25(10): 1616-1621.
He J W, Qin D P, Gao H, et al. Two new coumarins from Talaromyces flavus[J]. Molecules, 2014, 19(12): 20880-20887.
Zhai M M, Niu H T, Li J, et al. Talaromycolides A-C, novel phenyl-substituted phthalides isolated from the green Chinese onion-derived fungus Talaromyces pinophilus AF-02[J]. J Agric Food Chem, 2015, 63(43): 9558-9564.
Cai R L, Chen S H, Long Y H, et al. Depsidones from Talaromyces stipitatus SK-4, an endophytic fungus of the mangrove plant Acanthus ilicifolius[J]. Phytochem Lett, 2017, 20: 196-199.
Pandit S G, Puttananjaih M H, Harohally N V, et al. Functional attributes of a new molecule-2-hydroxymethyl-benzoic acid 2'-hydroxy-tetradecyl ester isolated from Talaromyces purpureogenus CFRM02[J]. Food Chem, 2018, 255: 89-96.
Lv H W, Su H B, Xue Y X, et al. Polyketides with potential bioactivities from the mangrove-derived fungus Talaromyces sp. WHUF0362[J]. Mar Life Sci Tech, 2023, 5(2): 232-241.
Dethoup T, Manoch L, Kijjoa A, et al. Bacillisporins D and E, new oxyphenalenone dimers from Talaromyces bacillisporus[J]. Planta Med, 2006, 72(10): 957-960.
Dong Y S, Yang J S, Zhang H, et al. Wortmannilactones A-D, 22-membered triene macrolides from Talaromyces wortmannii[J]. J Nat Prod, 2006, 69(1): 128-130.
Li H X, Huang H B, Shao C L, et al. Cytotoxic norsesquiterpene peroxides from the endophytic fungus Talaromyces flavus isolated from the mangrove plant Sonneratia apetala[J]. J Nat Prod, 2011, 74(5): 1230-1235.
Kumar M, Qadri M, Sharma P R, et al. Tubulin inhibitors from an endophytic fungus isolated from Cedrus deodara[J]. J Nat Prod, 2013, 76(2): 194-199.
He J W, Mu Z Q, Gao H, et al. New polyesters from Talaromyces flavus[J]. Tetrahedron, 2014, 70(29): 4425-4430.
Nonaka K, Chiba T, Suga T, et al. Coculnol, a new penicillic acid produced by a coculture of Fusarium solani FKI-6853 and Talaromyces sp. FKA-65[J]. J Antibiot, 2015, 68(8): 530-532.
Küppers L, Ebrahim W, El-Neketi M, et al. Lactones from the sponge-derived fungus Talaromyces rugulosus[J]. Mar Drugs, 2017, 15(11): 359.
Yuan W H, Teng M T, Sun S S, et al. Active metabolites from endolichenic fungus Talaromyces sp.[J]. Chem Biodivers, 2018, 15(11): e1800371.
Kimura T, Nishida M, Kuramochi K, et al. Novel azaphilones, kasanosins A and B, which are specific inhibitors of eukaryotic DNA polymerases beta and lambda from Talaromyces sp.[J]. Bioorg Med Chem, 2008, 16(8): 4594-4599.
Dong Y S, Lin J, Lu X H, et al. Cathepsin B inhibitory tetraene lactones from the fungus Talaromyces wortmannii [J]. Helv Chim Acta, 2009, 92(3): 567-574.
Kawaguchi M, Uchida R, Ohte S, et al. New dinapinone derivatives, potent inhibitors of triacylglycerol synthesis in mammalian cells, produced by Talaromyces pinophilus FKI-3864[J]. J Antibiot, 2013, 66(3): 179-189.
Kaifuchi S, Mori M, Nonaka K, et al. Ukulactone C, a new NADH-fumarate reductase inhibitor produced by Talaromyces sp. FKI-6713[J]. J Gen Appl Microbiol, 2015, 61(2): 57-62.
Ding H E, Yang Z D, Sheng L, et al. Secovironolide, a novel furanosteroid scaffold with a five-membered B ring from the endophytic fungus Talaromyces wortmannii LGT-4[J]. Tetrahedron Lett, 2015, 56(48): 6754-6757.
Zhao J W, Yang Z D, Zhou S Y, et al. Wortmannine F and G, two new pyranones from Talaromyces wortmannii LGT-4, the endophytic fungus of Tripterygium wilfordii[J]. Phytochem Lett, 2019, 29: 115-118.
Tomikawa T, Shin-Ya K, Furihata K, et al. Rasfonin, a new apoptosis inducer in ras-dependent cells from Talaromyces sp.[J]. J Antibiot, 2000, 53(8): 848-850.
王海燕, 荒井雅吉, 供田洋, 等. 微生物来源的Azole类抗真菌活性增强剂——FKI-0076A、B和C的研究[J]. 中国抗生素杂志, 2001, 26(2): 89-93.
Dethoup T, Manoch L, Kijjoa A, et al. Merodrimanes and other constituents from Talaromyces thailandiasis[J]. J Nat Prod, 2007, 70(7): 1200-1202.
Li L Q, Yang Y G, Zeng Y, et al. A new azaphilone, kasanosin C, from an endophytic Talaromyces sp. T1BF[J]. Molecules, 2010, 15(6): 3993-3997.
He J W, Gao H, Liu X Z, et al. Two new polyesters from wetland soil-derived fungus Talaromyces flavus[J]. China J Chin Mater Med, 2015, 40(17): 3347-3351.
Kumla D, Dethoup T, Buttachon S, et al. Spiculisporic acid E, a new spiculisporic acid derivative and ergosterol derivatives from the marine-sponge associated fungus Talaromyces trachyspermus(KUFA 0021)[J]. Nat Prod Commun, 2014, 9(8): 1147-1150.
Fu G C, Yang Z D, Zhou S Y, et al. Two new compounds, deacetylisowortmins A and B, isolated from an endophytic Fungus, Talaromyces wortmannii LGT-4[J]. Nat Prod Res, 2016, 30(14): 1623-1627.
Yang Z D, Zhang X D, Yang X, et al. A norbisabolane and an arabitol benzoate from Talaromyces marneffei, an endophytic fungus of Epilobium angustifolium[J]. Fitoterapia, 2021, 153: 104948.
El-Elimat T, Figueroa M, Raja H A, et al. Coumarins, dihydroisocoumarins, a dibenzo-α-pyrone, a meroterpenoid, and a merodrimane from Talaromyces amestolkiae[J]. Tetrahedron Lett, 2021, 72: 153067.
Ningsih B N S, Rukachaisirikul V, Phongpaichit S, et al. Talarostatin, a vermistatin derivative from the soil-derived fungus Talaromyces thailandensis PSU-SPSF059[J]. Nat Prod Res, 2023: 1-8.
Yang S Q, Song Q, Li X M, et al. Antimicrobial polyketides and sesquiterpene lactones from the deep-sea cold-seep-derived fungus Talaromyces minioluteus CS-113 triggered by the histone deacetylase inhibitor SAHA[J]. Org Biomol Chem, 2023, 21(12): 2575-2585.
安雪婵. DMSO与SOCl2介导下4-甲硫基异香豆素骨架构建的新方法[D]. 天津: 天津大学, 2022.
Chen S H, Liu Y Y, Liu Z M, et al. Isocoumarins and benzofurans from the mangrove endophytic fungus Talaromyces amestolkiae possess α-glucosidase inhibitory and antibacterial activities[J]. RSC Adv, 2016, 6(31): 26412-26420.
Cai J, Zhu X C, Zeng W N, et al. Talaromarins A-F: Six new isocoumarins from mangrove-derived fungus Talaromyces flavus TGGP35[J]. Mar Drugs, 2022, 20(6): 361.
庞子萱, 吴季恒, 严豪, 等. 聚酮类化合物研究进展[J]. 食品与发酵工业, 2022, 48(6): 316-326.
Komai S, Hosoe T, Itabashi T, et al. In A new funicone derivative isolated from Talaromyces flavus IFM52668. Mycotoxin, 2004, 54(1): 15-19.
Liu F, Cai X L, Yang H, et al. The bioactive metabolites of the mangrove endophytic fungus Talaromyces sp. ZH-154 isolated from Kandelia candel(L.)Druce[J]. Planta Med, 2010, 76(2): 185-189.
Wu B, Ohlendorf B, Oesker V, et al. Acetylcholinesterase inhibitors from a marine fungus Talaromyces sp. strain LF458[J]. Mar Biol, 2015, 17(1): 110-119.
Zhao Y, Sun C X, Huang L Y, et al. Talarodrides A~F, nonadrides from the antarctic sponge-derived fungus Talaromyces sp. HDN1820200[J]. J Nat Prod, 2021, 84(12): 3011-3019.
Zang Y, Genta-Jouve G, Escargueil A E, et al. Antimicrobial oligophenalenone dimers from the soil fungus Talaromyces stipitatus[J]. J Nat Prod, 2016, 79(12): 2991-2996.
Matsunaga H, Kamisuki S, Kaneko M, et al. Isolation and structure of vanitaracin A, a novel anti-hepatitis B virus compound from Talaromyces sp.[J]. Bioorg Med Chem Lett, 2015, 25(19): 4325-4328.
Liu W C, Yang F, Zhang R, et al. Production of polyketides with anthelmintic activity by the fungus Talaromyces wortmannii using one strain-many compounds(OSMAC)method[J]. Phytochem Lett, 2016, 18: 157-161.
Silva P, Souza M, Bianco E, et al. Antifungal polyketides and other compounds from amazonian endophytic Talaromyces fungi[J]. J Braz Chem Soc, 2017, 29(3): 622-630.
Arai M, Tomoda H, Okuda T, et al. Funicone-related compounds, potentiators of antifungal miconazole activity, produced by Talaromyces flavus FKI-0076[J]. J Antibiot, 2002, 55(2): 172-180.
Koolen H H F, Menezes L S, Souza M P, et al. Talaroxanthone, a novel xanthone dimer from the endophytic fungus Talaromyces sp. associated with Duguetia stelechantha(Diels)R. E. Fries[J]. J Braz Chem Soc, 2013, 24: 880-883.
Bara R, Aly A H, Pretsch A, et al. Antibiotically active metabolites from Talaromyces wortmannii, an endophyte of Aloe vera[J]. J Antibiot, 2013, 66(8): 491-493.
Cao X, Ge Y C, Lan D H, et al. Spirocyclic polyketides from the marine fungus Talaromyces sp. CX11[J]. Fitoterapia, 2023, 164: 105359.
Kumagai Y, Nakajima H, Midorikawa K, et al. Inhibition of nitric oxide formation by neuronal nitric oxide synthase by quinones: Nitric oxide synthase as a quinone reductase[J]. Chem Res Toxicol, 1998, 11(6): 608-613.
王馨瑶. 可见光诱导醌类化合物无金属苄基化反应研究[D]. 大连: 大连理工大学, 2023.
胡观明. 蒽醌类化合物的合成及对肿瘤细胞的细胞毒活性的研究[D]. 兰州: 兰州大学, 2014.
Xie X S, Fang X W, Huang R, et al. A new dimeric anthraquinone from endophytic Talaromyces sp. YE3016[J]. Nat Prod Res, 2016, 30(15): 1706-1711.
Bara R, Zerfass I, Aly A H, et al. Atropisomeric dihydroanthracenones as inhibitors of multiresistant Staphylococcus aureus[J]. J Med Chem, 2013, 56(8): 3257-3272.
Noinart J, Buttachon S, Dethoup T, et al. A new ergosterol analog, a new bis-anthraquinone and anti-obesity activity of anthraquinones from the marine sponge-associated fungus Talaromyces stipitatus KUFA 0207[J]. Mar Drugs, 2017, 15(5): 139.
顾云兰. 甾类及相关化合物的结构与生物活性关系研究[D]. 苏州: 苏州大学, 2006.
王岩. 优化甲羟戊酸途径提高萜类化合物在大肠埃希菌中的生物合成[D]. 苏州: 苏州大学, 2022.
Chen S H, Ding M, Liu W Y, et al. Anti-inflammatory meroterpenoids from the mangrove endophytic fungus Talaromyces amestolkiae YX1[J]. Phytochemistry, 2018, 146: 8-15.
Chen C M, Sun W G, Liu X R, et al. Anti-inflammatory spiroaxane and drimane sesquiterpenoids from Talaromyces minioluteus(Penicillium minioluteum)[J]. Bioorg Med Chem, 2019, 91: 103166.
Zhang M, Li Q, Li S J, et al. An unprecedented ergostane with a 6/6/5 tricyclic 13(14→8)abeo-8,14-seco skeleton from Talaromyces adpressus[J]. Bioorg Chem, 2022, 127: 105943.
Wang W J, Wan X, Liu J J, et al. Two new terpenoids from Talaromyces purpurogenus[J]. Mar Drugs, 2018, 16(5): 150.
Hong X, Guan X Q, Lai Q L, et al. Characterization of a bioactive meroterpenoid isolated from the marine-derived fungus Talaromyces sp.[J]. Appl. Microbiol, 2022, 106(8): 2927-2935.
聂影影, 刘亚月, 杨文聪, 等. 来自普哥滨珊瑚的一株Talaromyces sp.真菌的活性次生代谢产物[J]. 菌物学报, 2019, 38(4): 585-593.
Hayashi H, Oka Y, Kai K, et al. A new meroterpenoid, chrodrimanin C, from YO-2 of Talaromyces sp.[J]. Biosci Biotech Bioch, 2012, 76(4): 745-748.
Hayashi H, Oka Y, Kai K, et al. New chrodrimanin congeners, chrodrimanins D-H, from YO-2 of Talaromyces sp.[J]. Biosci Biotech Bioch, 2012, 76(9): 1765-1768.
Cao X, Shi Y T, Wu X D, et al. Talaromyolides A-D and talaromytin: Polycyclic meroterpenoids from the fungus Talaromyces sp. CX11[J]. Org Lett, 2019, 21(16): 6539-6542.
Zhao W T, Shi X, Xian P J, et al. A new fusicoccane diterpene and a new polyene from the plant endophytic fungus Talaromyces pinophilus and their antimicrobial activities[J]. Nat Prod Res, 2021, 35(1): 124-130.
Zhang M, Deng Y F, Liu F, et al. Five undescribed steroids from Talaromyces stipitatus and their cytotoxic activities against hepatoma cell lines[J]. Phytochemistry, 2021, 189: 112816.
李良群, 杨艳光, 曾英, 等. 云南红豆杉内生真菌Talaromyces sp.T1BF的化学成分研究[J]. 广西植物, 2011, 31(5): 699-701.
He J W, Liang H X, Gao H, et al. Talaflavuterpenoid A, a new nardosinane-type sesquiterpene from Talaromyces flavus[J]." J Asian Nat Prod Res, 2014, 16(10): 1029-1034.
Kaur A, Raja H A, Swenson D C, et al. Talarolutins A-D: Meroterpenoids from an endophytic fungal isolate of Talaromyces minioluteus[J]. Phytochemistry, 2016, 126: 4-10.
Dewapriya P, Prasad P, Damodar R, et al. Talarolide A, a cyclic heptapeptide hydroxamate from an Australian marine tunicate-associated fungus, Talaromyces sp.(CMB-TU011)[J]. Org Lett, 2017, 19(8): 2046-2049.
Zhang Y H, Zhao Y J, Qi L, et al. Talasteroid, a new withanolide from the marine-derived fungus Talaromyces stollii[J]. Nat Prod Res, 2023, 37(19): 3283-3289.
文章编号:1001-8689(2024)09-0961-25
收稿日期:2023-11-07
基金项目:青海省自然科学基金面上项目(No. 2023-ZJ-927M)
作者简介:安婷,女,生于1998年,硕士,主要研究中藏药药效物质基础及质量标准化,E-mail: anting@nwipb.cas.cn
*通信作者,E-mail: whx@nwipb.cas.cn
