单核细胞增生李斯特菌感染患者的临床特征分析
2024-12-31张敬霞 李刚 陈素明 蔡珍 杜鸿 黄彬 张鞠玲
摘要:目的 分析单核细胞增生李斯特菌(Listeria monocytogenes, LM)感染患者的病原学特点及临床特征,找到影响预后的因素,为临床早期诊治提供依据。方法 通过电子病例系统查询北京、宁夏、苏州和广州等地区5家医院2011—2023年间临床分离的无菌体液和组织以及宫颈分泌物和耳道分泌物鉴定为LM患者的病例信息,并收集其菌株,回顾性分析LM病原学特点及感染者临床特征,探讨导致患者死亡的危险因素。结果 共纳入68例患者病例,LM的感染以50岁以上的中老年患者居多(51.47%);感染部位以血流感染为主(51.85%),主要临床表现为发热;其次是颅内感染(24.0%),主要临床表现为发热、头晕、头痛、意识模糊和感染性休克等,整体死亡率达到23.53%。存活组C反应蛋白(CRP)[58.77(5.1~183) mg/L vs 89.08(12.4~272.7) mg/L,P=0.027]和降钙素原(PCT)[2.88(0.04~55.50) ng/L vs 12.35(0.19~38.56) ng/L,P=0.020]均明显低于死亡组。早期抗生素的选择对患者的生存率具有显著影响(P=0.008)。结论 LM感染死亡率较高,年龄分布以中老年患者为主,感染部位以血流感染和颅内感染为主,不同的感染部位具有不同的临床表现,以发热最为常见。CRP和PCT的升高程度与患者的生存率呈负相关。青霉素、氨苄西林、复方磺胺甲恶唑、红霉素、美罗培南对LM都具有很高的体外抑菌,但复方磺胺甲恶唑不适用于孕妇和新生儿,尽早使用有效灭活LM的抗生素,对提高患者生存率极其重要。
关键词:单核细胞增生李斯特菌;病原学特点;临床特征;抗生素
中图分类号:R978 文献标志码:A
Analysis of clinical characteristics of patients with Listeria monocytogenes infection
Zhang Jingxia1, Li Gang2, Chen Suming3, Cai Zhen1, Du Hong4, Huang Bin5, and Zhang Juling3
(1 Department of Clinical Laboratory, Aviation General Hospital, Beijing 100020; 2 Center of Medical Laboratory, The General Hospital of Ningxia Medical University, Ningxia 750004; 3 Department of Clinical Laboratory, the Fifth Medical Center of Chinese PLA General Hospital, Beijing 100039; 4 Department of Microbiology, the Second Affiliated Hospital Soochow University, Suzhou 215000;"5 Center of Medical Laboratory, First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080)
Abstract Objective To analyze the pathogenic characteristics and clinical characteristics of patients infected by (Listeria monocytogenes, LM), find the factors that affect the prognosis, and provide a basis for early clinical diagnosis and treatment. Methods The case information of patients identified as LM from clinical isolation of sterile body fluids and tissues, cervical secretions and ear canal secretions from 5 hospitals in Beijing, Ningxia, Suzhou and Guangzhou from 2011 to 2023 was queried through an electronic medical records system. Their strains were collected, retrospectively analyzed for pathogenic and clinical characteristics, and explored as risk factors leading to patient death. Results A total of 62 patient cases that infected LM were mainly middle-aged and elderly patients who were over the age of 50 years old, accounting for 51.47%. The infection site was mainly a blood flow infection (51.85%); the main clinical manifestation was fever, followed by intracranial infection (24.0%), manifested as fever, dizziness, headache, confusion, septic shock, etc. The overall mortality rate reached 23.53%. Survival group C-reactive protein (CRP) [58.77 (5.1~183) mg/L vs. 89.08 (12.4~272.7) mg/L, P=0.027] and procalcitonin (PCT) [2.88 (0.04~55.50) ng/L"vs 12.35 (0.19~38.56) ng/L,P=0.020] were significantly lower than the death group. The choice of early antibiotic had a significant effect on the survival rate of patients (P=0.008). Conclusion The mortality rate from LM infection was higher. The age distribution was mainly middle-aged and elderly patients. The most common infection sites were blood flow infection and intracranial infection. Different infection sites had different clinical manifestations; fever was the most common manifestation. There was a negative correlation between the degree of increase in CRP and PCT and the survival rate of patients. Penicillin, ampicillin, trimethoprim/sulfamethoxazole, erythromycin, and meropenem all had high in vitro antibacterial effects on LM, but trimethoprim/sulfamethoxazole was not suitable for pregnant women and neonates. The early use of antibiotics that effectively inactivated LM was extremely important to improve the survival rate of patients.
Key words Listeria monocytogenes; Pathogenic characteristics; Clinical features; Antimicrobial
单核细胞增生李斯特菌LM(Listeria monocytogenes, LM)是一种人畜共患病的病原菌,也是重要的食源性病原菌,在高盐、低温、高温和酸或碱(pH值4.4~9.4)环境中均可生存,可以通过污染的食物感染人类引起李斯特菌病,临床感染的报道持续上升[1-3]。在2015—2018年间美国平均每10万人有0.3人感染LM,死亡率为21.0%[4]。中国大陆从2011—2017年,报道了562例LM侵袭性和非侵袭性感染病例,其中有231名围产期患者,最终导致23名孕妇流产,47名新生儿死亡,围产期死亡率为32.68%,非围产期死亡率为23.78%[5]。李斯特菌病的临床表现包括腹泻、败血症、脑膜炎、流产、早产、死胎以及新生儿感染,死亡率高达20%~40%[6],因此LM被欧盟确认为是导致患者住院和死亡的最严重的食源性病原菌[7]。由于LM是一种胞内感染菌,通常的体液免疫及经验治疗无效,早期诊断及针对性治疗至关重要。本研究回顾性分析来自5家医院的68例李斯特菌病患者的病例,分析其病原学特点、基本特征、临床表现、实验室检查、抗生素使用情况以及患者预后,为临床的诊治提供参考依据。
1 对象与方法
1.1 研究对象
通过医院LIS系统查询2011年1月—2023年12月就诊于北京、宁夏、苏州和广州等地区5家医院的李斯特菌病患者病例信息,收集从患者血液、脑脊液、胸腹水、引流液(胸腔和腹腔)、胎盘组织、分泌物(宫颈分泌物和耳道分泌物)分离出的LM菌株,本研究剔除没有感染症状(如:发热、腹泻、流产、早产等)的患者及同一患者反复出现的阳性标本。
1.2 收集资料
收集李斯特菌病患者的菌株及病例详细信息,包括性别、年龄、基础疾病、临床表现、体温、实验室检查[C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、白细胞计数(WBC)、中性粒细胞百分数(N%)、单核细胞计数(MONO)]、标本来源、抗生素使用情况及患者预后。
1.3 标本的培养、鉴定及药敏
根据临床实验室的常规操作程序,将有LM感染症状患者分离的血液、脑脊液、胸腹水和引流液标本经过全自动血培养系统(BacT/Alert 3D;法国Bio-Merieux)培养报阳后,转种于含5%羊血的胰酶大豆琼脂平板,放置37 ℃,5% CO2温箱中进行纯培养;分泌物、胎膜组织接种于血平板,放置37 ℃,5% CO2温箱中孵育16~20 h。使用Vitek全自动微生物鉴定系统进行鉴定,阳性菌株进行纯培养并冻存。本研究最终使用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS,德国Bruker)将菌株鉴定到菌种水平(评分大于2.0)作为筛选菌株标准。药敏试验选择纸片扩散法(KB法),抗生素包括青霉素、氨苄西林、复方磺胺甲恶唑、红霉素和美罗培南,根据EUCAST(欧洲药敏试验联合委员会)标准判定结果。质控菌株为大肠埃希菌ATCC25922,金黄色葡萄球菌ATCC25923,购于国家卫生健康委员会临检中心。
1.4 统计学分析
使用SPSS22.0进行统计学分析,符合正态分布的计数资料用平均值±标准差(x±s)表示,并使用独立样本t检验进行比较;非参数数据用中位数(最小值,最大值)表示,并使用Mann-Whitney检验进行比较;计数资料采用频数(%)表示,并使用χ2检验进行比较。Plt;0.05时认为差异具有统计学意义。
2 结果
2.1 病例来源及分布
本研究中68例患者包括宁夏27例、北京27例、广州8例、苏州6例。在2017年和2019年分别为13例和12例,LM感染在任何季节均有发生。
2.2 菌株来源
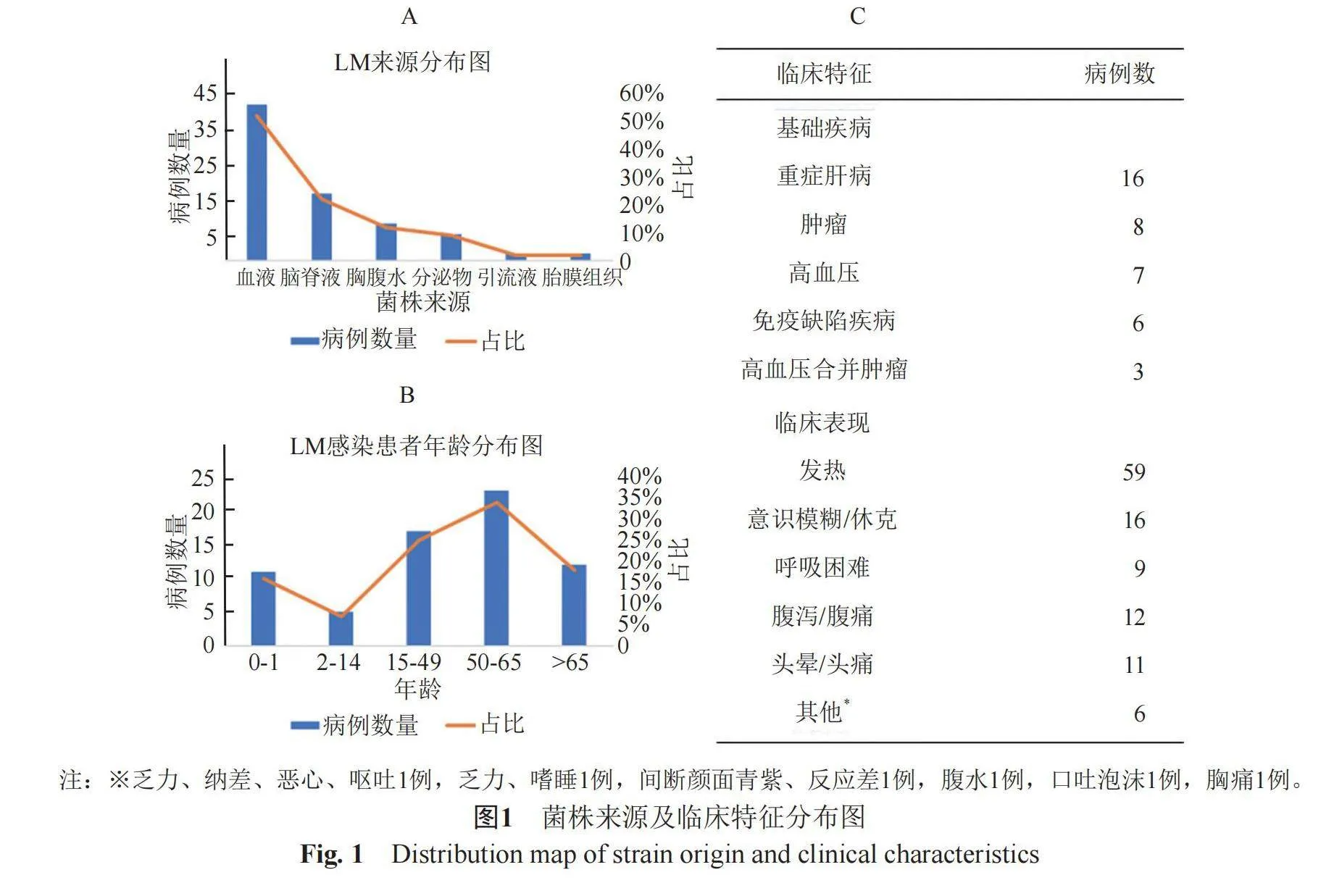
分离来自临床感染患者的68株LM,标本分别来自于血液42例(51.85%)、脑脊液18例(22.22%)、胸腹水8例(9.88%)、分泌物4例(4.94%)、引流液和胎膜组织各2例(2.47%),其中有5例患者在脑脊液和血液中同时培养出LM,3例患者在血液和胸腹水中同时培养出LM,1例在胸水和腹水、1例在血液和分泌物、1例在血液、脑脊液和引流液中分别培养出LM(图1A)。
2.3 LM感染患者的临床特征
2.3.1 一般特征
本研究的68例LM感染患者均为散发病例,包括男性26例(38.24%),女性42例(61.76%),其中9例(13.24%)为新生儿,6例(8.82%)为孕妇。患者年龄分布从新生儿到94岁,其中0~1岁有11例(16.18%)、2~14岁有5例(7.35%)、15~49岁有17例(25.0%)、50~65岁有23例(33.82%)、65岁以上患者有12例(17.65%),提示50岁以上中老年患者占51.47%(图1 B)。40(58.82%)名患者有不同程度的基础疾病,最常见的有:重症肝病16例(40%)、肿瘤8例(20%)、高血压7例(17.5%)、免疫缺陷性疾病6例(15%),高血压合并肿瘤3例(7.5%)(图1C)。
2.3.2 临床表现
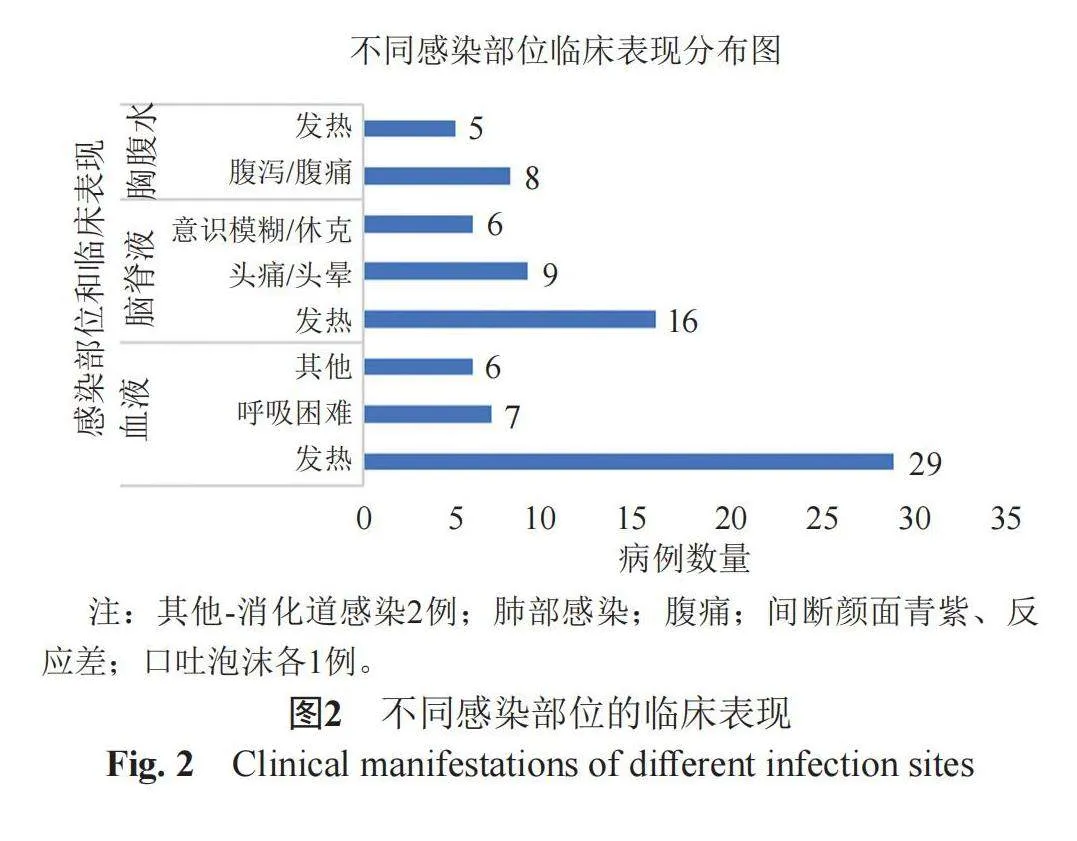
68例LM感染患者中59位患者表现为发热,体温在37.0 ℃到42.0 ℃之间,16位患者表现出意识模糊和感染性休克的症状,9位患者表现为呼吸困难,12位患者有腹泻和腹痛症状,11位患者表现为头晕或头痛(图1C)。9例新生儿患者均表现为呼吸困难和发热,6名孕妇均有发热和腹痛症状,而有2例患者仅表现为腹痛和腹泻。不同的感染部位具有不同的临床表现,其中血流感染患者主要的临床表现为发热(69.05%),其次为呼吸困难(16.67%),颅内感染患者主要临床表现也是发热(51.61%),其次是头痛头晕和意识模糊、感染性休克的神经系统症状(48.39%),胸腹腔感染患者主要临床表现为腹泻和腹痛(61.54%),其次为发热(38.46%)(图2)。
2.3.3 实验室检查
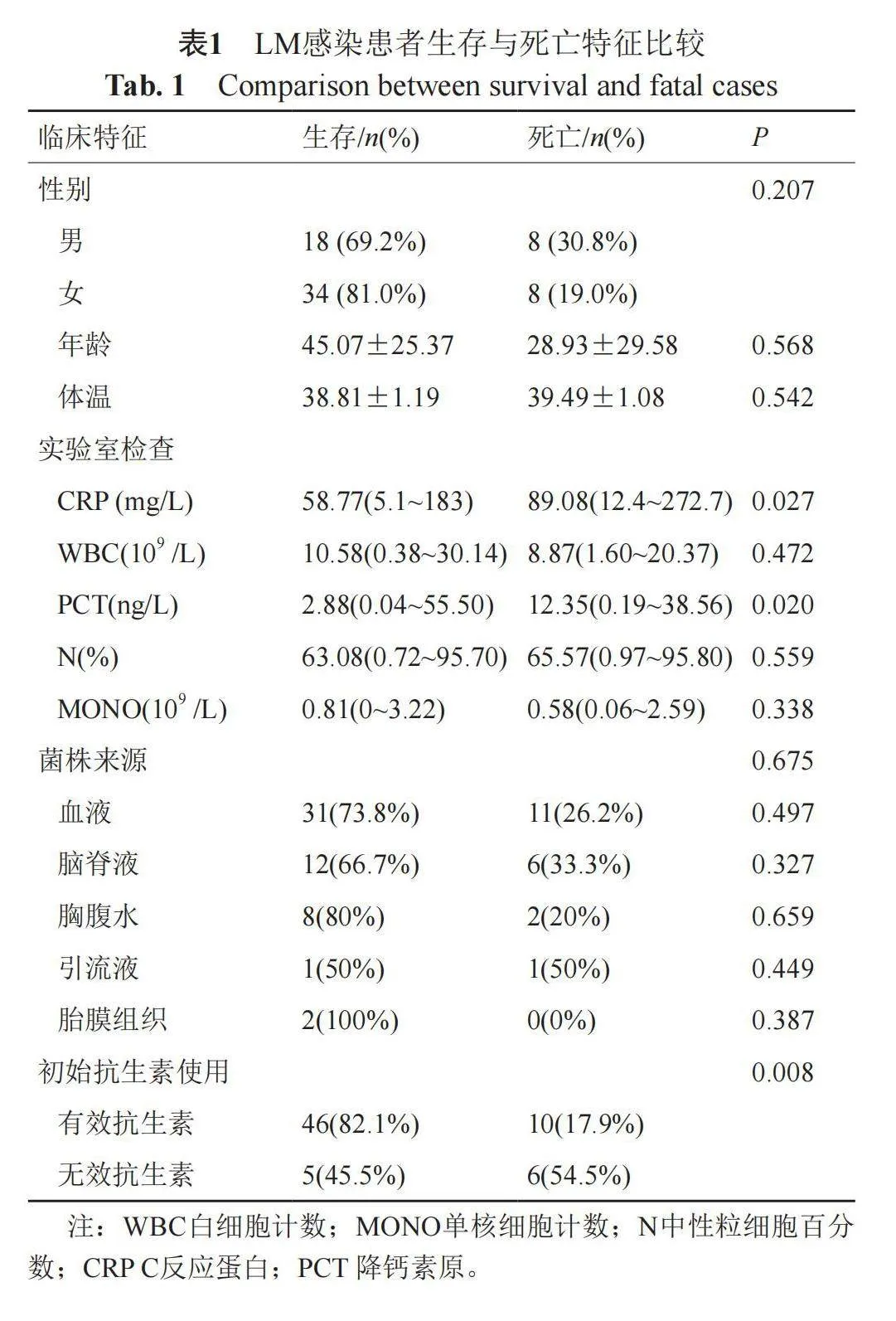
实验室常用的感染指标包括WBC、PCT和CRP,本研究中生存患者CRP的中位数为58.77(5.1~183 mg/L),死亡患者CRP中位数为89.08(12.4~272.7 mg/L)经Mann-Whitney检验统计分析后发现二者对生存与死亡具有显著的统计学差异(P=0.027)。生存患者PCT的中位数为2.88(0.04~55.50 ng/L),死亡患者PCT的中位数为12.35(0.19~38.56 ng/L),经Mann-Whitney检验统计分析后发现二者对生存与死亡也具有显著的统计学差异(P=0.020)。 生存患者白细胞计数中位数10.58 (0.38~30.14) vs 8.87(1.60~20.37)死亡患者(P=0.472);生存患者中性粒细胞百分数中位数为63.08 (0.72~95.70) vs 65.57 (0.97~95.80)死亡患者(P=0.559);生存患者单核细胞计数中位数为0.81(0~3.22) vs 0.58(0.06~2.59)死亡患者(P=0.338); 因此白细胞计数、中性粒细胞百分数和单核细胞计数对患者的生存与死亡都不具有统计学差异(表1)。
2.3.4 患者预后
本研究中68例LM感染病例,52例存活,16例死亡,病死率23.53%。性别在生存与死亡之间差异无统计学意义(P=0.207);生存患者平均年龄为(45.07±25.37)岁,死亡患者平均年龄为(28.39±29.58)岁,经独立样本t检验比较年龄对生存与死亡差异无统计学意义(P=0.568),生存患者平均体温为(38.81±1.19)℃,死亡患者平均体温为(39.49±1.08)℃,经独立样本t检验比较体温对生存与死亡差异无统计学意义(P=0.542)(表1)。16例死亡患者病例中,其中50岁以上患者占比较高,为9例(56.25%),肿瘤患者5例(31.25%),本研究中有6例为孕妇感染病例,其中4例孕周为lt;20周,预后均为稽留流产;另外2例孕周为gt;37周,均顺利生产,所产两例新生儿均为LM感染病例,6例孕妇病例和所产两例新生儿预后均为存活。
2.3.5 药敏结果及初始抗生素使用对预后的影响
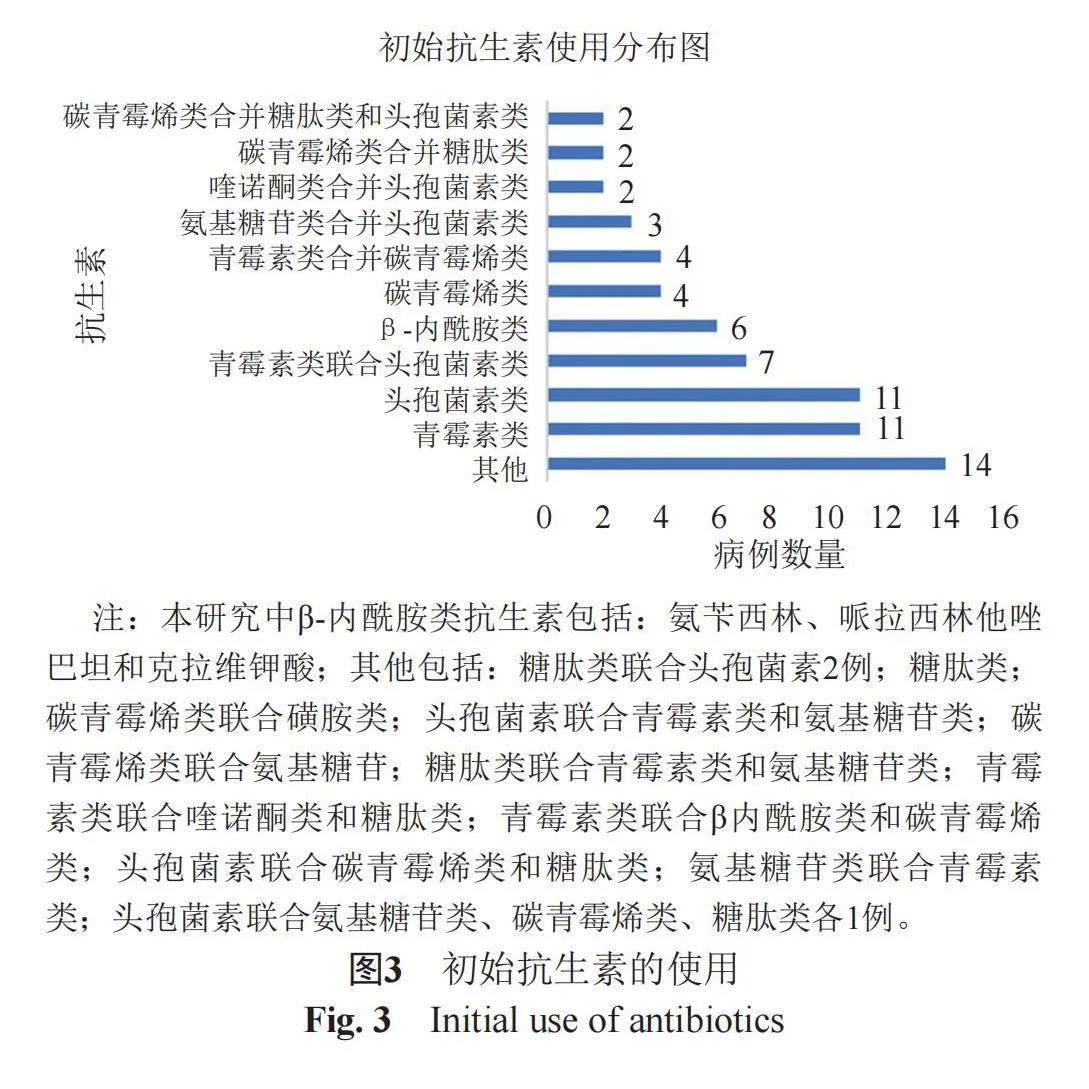
本研究所有菌株均对青霉素和氨苄西林100%敏感,对美罗培南的耐药率为6.45%,红霉素的耐药率为17.74%,对于复方磺胺甲恶唑的耐药率为27.42%。本研究中患者初始使用的抗生素主要包括青霉素类、糖肽类、β-内酰胺类(头孢菌素除外)、磺胺类、喹诺酮类、氨基糖苷类和头孢菌素类。经验用药主要以青霉素类(16.67%)和头孢菌素类(16.67%)抗生素为主(图3)。由于LM对头孢菌素类抗生素天然耐药[10],因此本研究将初始为单独使用头孢类抗生素进行治疗的患者归为使用了无效抗生素治疗组,其他患者归为使用了有效抗生素治疗组。将使用有效抗生素的病例数和使用无效抗生素的病例数进行χ2检验发现二者差异具有统计学意义(P=0.008)。本研究发现有6名免疫缺陷患者,在LM感染前一直使用激素治疗,在发生LM感染后,即使早期使用了有效抗生素治疗,最终也导致6名患者死亡。11例单独使用青霉素类抗生素治疗的患者中,9(81.82%)例存活,存活患者年龄分布为4~94岁、50岁以上患者为5例(55.56%)。2例(18.18%)死亡患者其中1例为患有慢性肾衰的52岁女性,最终放弃治疗。另外1例为患有肝癌的42岁男性,预后为死亡。
3 讨论
LM在自然界中广泛存在,可以在水,土壤,人和动物的粪便中生存,也可以存在于蔬菜、水果和海鲜等食品中,LM主要通过污染的食物传播给人类[8-9]。
研究表明免疫缺陷性疾病、肾移植、肿瘤等免疫力低下人群更容易感染LM。LM容易侵犯神经系统并导致高死亡率和持久的神经系统后遗症[10]。孕妇感染LM后,如果得不到及时治疗,则增加LM通过胎盘导致胎儿感染的风险,最终会导致稽留流产或早产[11]。在其他国家已有许多关于LM感染暴发的报道,但是在中国主要是散发病例,并且大多数都以病例报道的形式出现[12-14],这可能是由于缺乏系统的监察工作。因此,本研究回顾性分析来自5家医院经临床诊断为李斯特菌病的68名患者的病例信息,分析他们的临床特征、实验室数据、抗生素的敏感性、抗生素治疗以及预后,为临床诊治提供参考依据。本文报道了北京、广州、宁夏和苏州地区5家医院李斯特菌病的临床特征。
本研究显示李斯特菌病在任何季节均可发生,这与以往报道的LM感染好发于春季和夏季[15]不符,这可能与地理位置不同或LM对环境具有较强的抵抗力有关[3,5]。本研究中女性感染LM的比例较高,这与中国许多省市的情况相似[15]。50岁以上的中老年人是LM感染的主要群体,可能与其抵抗力下降和饮食习惯相关[6,14]。通常,免疫力低下的人群是侵袭性李斯特菌病的易感人群,因此许多侵袭性李斯特菌病的患者都具有不同程度的基础疾病[14],其中重症肝病、肿瘤、免疫缺陷性疾病等基础疾病有重要影响。
研究发现患者最常见的临床表现是发热(86.76%),与之前报道的发烧率(88.6%)基本持平[16]。结果提示李斯特菌病患者的临床表现差异很大,有发热、呼吸困难、咳嗽、胃肠道和中枢神经系统受累的症状,这都与常见的细菌感染症状相似。 此外,大多数患者都接受了基础疾病的治疗,从而使李斯特菌病的诊断更加困难。由于在怀孕期间感染LM会导致流产、早产、死胎等严重后果[7],因此,应及早对于出现任何感染症状尤其是流感样或者胃肠道症状的孕妇进行血培养。9例在宫内感染LM的新生儿病例均表现出了呼吸困难的临床症状,这与之前的报道结果一致[17]。北京协和医院的一项研究报道了44.7%的李斯特菌病患者存在胃肠道感染症状[17],远高于本研究30.88%出现恶心、呕吐、腹痛、腹泻的患者,这可能与患者的感染部位不同有关。基础疾病也是LM感染的影响因素,与本研究中常见基础疾病为重症肝病不同,比利时的一项研究表明,最常见的是免疫缺陷性疾病、肿瘤和心血管疾病[18],而美国的另外一项研究显示最常见的基础疾病是免疫缺陷性疾病、肿瘤和糖尿病[17],
这是由于本研究的5家医院有4家为传染病医院,以肝病患者为主,另外一家医院的重点科室为神经外科,以颅内感染患者为主,但重症造成的免疫力低下是LM感染的危险因素。
本研究发现李斯特菌病患者的实验室特征与常见细菌感染相似,外周血的WBC、CRP、PCT在大多数都会升高,这与之前的研究结果一致[20-21],这表明在临床诊断中存在漏诊和误诊的可能。我们观察到存活组C反应蛋白(CRP)和降钙素原(PCT)均明显低于死亡组,这表明CRP和PCT的升高程度与患者的生存率呈负相关。这与近期深圳的一项研究结果相契合[22]。
抗生素作为影响预后的关键因素,是患者治疗的重要组成部分,本研究显示LM对EUCAST给出的具有折点的5种抗生素都具有很高的体外抑菌活性。但复方磺胺甲恶唑会使游离胆红素升高从而增加胎儿和新生儿核黄疸的风险,因此复方磺胺甲恶唑不适用于孕妇和新生儿。本研究中9例新生儿均在联合使用美罗培南或青霉素后好转。氨苄西林或青霉素,单独使用或与氨基糖苷类抗生素联合使用是治疗李斯特菌病的首选治疗方案[23]。有研究提示氨苄西林可作为儿童李斯特菌病的首选药物[24]。在本研究中有11例首选单独使用氨苄西林或青霉素经验性治疗,最终有9例生存。中国的一项研究显示,144株LM菌株对氨苄西林,青霉素和美罗培南均敏感[25],
本研究中4例首选碳青霉烯类治疗的患者预后均为存活。尽管LM在体外对多种抗生素敏感,但是它对头孢菌素天然耐药[12,26],导致10例首选头孢菌素治疗的患者中,6例死亡,4例更换有效抗生素后存活。因此,早期使用有效的抗生素可以显著提高患者的生存率。
总之,早期诊断和治疗可以显著改善患者预后,微生物培养是诊断的“金标准”[27]。对于有发热、呕吐、腹泻、精神症状改变的患者,应尽早进行无菌部位的病原菌培养。在中国对李斯特菌病的一项病原学调查发现,18%的患者从可疑的食物、砧板、冰箱或厨房水槽感染了LM[28],本研究追踪到一例孕妇感染前饮用了冰箱内的牛奶。因此应加强食品安全管理和安全知识普及教育,减少LM的传播。临床在诊治中也应做好流行病学调查工作,并及时辅助检查,尽早使用覆盖LM的抗生素,提高患者生存率。
参 考 文 献
Cantey J B, Lee J H. Biomarkers for the diagnosis of neonatal sepsis[J]. Clin Perinatol, 2021, 48(2): 215-227.
Azari S, Johnson L J, Webb A, et al. Hofbauer cells spread Listeria monocytogenes among placental cells and undergo pro-inflammatory reprogramming while retaining production of tolerogenic factors[J]. mBio, 2021, (12): e0184921.
Radoshevich L, Cossart P. Listeria monocytogenes: towards a complete picture of its physiology and pathogenesis[J]. Nat Rev Microbiol , 2018, 16(1): 32-46.
Tack D M, Marder E P, Griffin P M, et al. Preliminary incidence and trends of infections with pathogens transmitted commonly through food-foodborne diseases active surveillance network, 10 U.S. sites, 2015-2018[J]. MMWR Morb Mortal Wkly, 2019, 6(8): 369-373.
Fan Z L, Xie J, Li Y, et al. Listeriosis in mainland China: A systematic review[J]. Int J Infect Dis, 2019, 8(1): 17-24.
Muñoz-Gallego I, Candela Ganoza G, Chaves F, et al. Listeria monocytogenes bacteraemia over an 11-year period: Clinical and epidemiologic characteristics in the south area of Madrid[J]. Infect , 2017, 75(3): 276-278.
McLauchlin J, Amar C F L, Grant K A. Neonatal cross-infection due to Listeria monocytogenes[J]. Epidemiol Infect, 2022, (150): 1-31.
Li C, Zeng H, Ding X, et al. Perinatal listeriosis patients treated at a maternity hospital in Beijing, China, from 2013-2018[J]. BMC Infect Dis, 2020, 20(1): 601.
Charlier C, Disson O, Lecuit M. Maternal-neonatal listeriosis[J]. Virulence, 2020, 11(1): 391-397.
Levin S N, Lyons J L. Infections of the nervous system[J]. Am J Med, 2018, 131(1): 25-32.
Kuang L, Lai Y, Gong Y. Analysis of listeriosis infection cases during pregnancy among 70 131 deliveries[J]. J Obstet Gynaecol Res. 2022, 48(1): 66-72.
Zhang X, Niu Y, Liu Y, et al. Isolation and characterization of clinical Listeria monocytogenes in Beijing, China, 2014-2016[J]. Front Microbiol, 2019, 10: 981.
Luo L, Chen X, Payne M, et al. Case report: Whole genome sequencing based investigation of maternal-neonatal listeriosis in Sichuan, China[J]. BMC Infect Dis, 2019, 19(1): 893.
Li N, Huang H Q, Zhang G S, et al. Encephalitis caused by Listeria monocytogenes in a healthy adult male in China: A case report[J]. Medicine, 2019, 98(25): e16145
Chen S, Meng F, Sun X, et al. Epidemiology of human listeriosis in China during 2008-2017[J]. Foodborne Pathog Dis, 2020, (17): 119-125.
Lee C Y, Tsai H C, Kunin C M, et al. Emergence of sporadic non-clustered cases of hospital-associated listeriosis among immunocompromised adults in southern Taiwan, China from 1992 to 2013: effect of precipitating immunosuppressive agents[J]. BMC Infect Dis, 2014, 14: 145.
Wang H, Ghanem K G, Wang P, et al. Listeriosis at a tertiary care hospital in Beijing, China: High prevalence of nonclustered healthcare-associated cases among adult patients[J]. Clin Infect Dis, 2013, 56(5): 666-676.
Maertens D N C, Devleesschauwer B, Maertens D N A, et al. Comorbidities and factors associated with central nervous system infections and death in non-perinatal listeriosis: A clinical case series[J]. BMC Infect Dis, 2016, 16: 256.
Centers for Disease Control and Prevention (CDC). Vital signs: Listeria illnesses, deaths, and outbreaks-United States, 2009-2011[J]. MMWR Morb Mortal Wkly Rep, 2013, 62(22): 448-452.
Charlier C, Perrodeau E, Leclercq A. Clinical features and prognostic factors of listeriosis: the MONALISA national prospective cohort study[J]. Lancet Infect Dis, 2017, (17): 510-519.
Arslan F, Meynet E, Sunbul M, et al. The clinical features, diagnosis, treatment, and prognosis of neuroinvasive listeriosis: A multinational study[J]. Eur J Clin Microbiol Infect Dis, 2015, 34(6): 1213-1221.
蒋钟吉, 许智坤, 吴劲松, 等. 深圳单核细胞增生李斯特菌感染10例临床分析[J]. 中国抗生素杂志, 2022, 47(11): 1202-1206.
Yu W, Huang Y, Ying C, et al. Analysis of genetic diversity and antibiotic options for clinical Listeria monocytogenes infections in China[J]. Open Forum Infect Dis, 2021, 8(6): b177.
周瑾思, 华春珍, 王高良, 等. 儿童单核细胞增生性李斯特菌侵袭性感染22例分析[J]. 中国抗生素杂志, 2020, 45 (11): 1166-1170.
Lu B, Yang J, Gao C, et al. Listeriosis cases and genetic diversity of their L. monocytogenes isolates in China, 2008-2019[J]. Front Cell Infect Microbiol, 2021, 11: 608352.
Fischer M A, Wamp S, Fruth A, et al. Population structure-guided profiling of antibiotic resistance patterns in clinical Listeria monocytogenes isolates from Germany identifies pbpB3 alleles associated with low levels of cephalosporin resistance[J]. Emerg Microbes Infect, 2020, 9(1): 1804-1813.
Huang Y T, Kuo Y W, Lee M R. Clinical and molecular epidemiology of human listeriosis in Taiwan, China[J]. Int J Infect Dis, 2021, (104): 718-724.
Li W, Bai L, Ma X, et al. Sentinel listeriosis surveillance in selected hospitals, China, 2013-2017[J]. Emerg Infect Dis, 2019, 25(12): 2274-2277.
