红象草花青素提取工艺优化及其抗氧化活性研究
2024-12-31林平冬高龙陈鑫珠



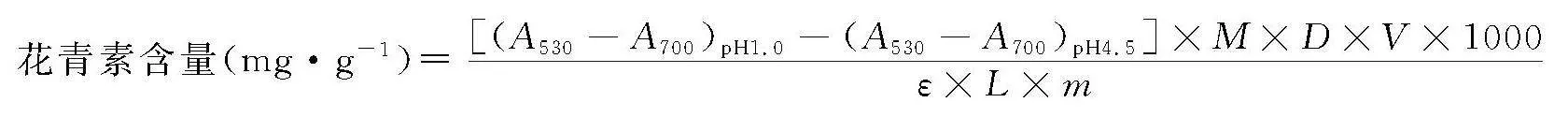

摘要:以红象草(Pennisetum purpureum Schumab)为原材料,花青素含量为响应值,在单因素试验的基础上,选择乙醇浓度、液料比和提取时间3个因素作为自变量,基于Box-Behnken设计3因素3水平的响应面优化试验,确定红象草花青素的最佳提取工艺,并测定其抗氧化能力。结果表明:红象草花青素的最佳提取工艺条件为乙醇浓度49%,提取时间30 min,液料比49∶1,在此条件下提取得到的花青素含量为2.09 mg·g-1,相对于理论值误差为1.8%。红象草花青素对羟自由基、DPPH自由基的清除率最高分别为121.3%和97.5%,对ABTS+自由基的总抗氧化能力最高可达2.6 mmol·g-1,具有较强的抗氧化活性。本研究可为红象草花青素的提取及其加工利用提供可靠的理论依据和重要的技术支持。
关键词:红象草;花青素;工艺优化;抗氧化活性
中图分类号:S543""" 文献标识码:A""""" 文章编号:1007-0435(2024)12-3988-09
收稿日期:2024-04-15;修回日期:2024-06-04
基金项目:国家自然科学基金项目(32302791);福建省人民政府中国农业科学院农业高质量发展超越“5511”协同创新工程项目(XTCXGC2021012,XTCXGC2021019)资助
作者简介:
#林平冬(1990-),女,汉族,福建莆田人,博士,助理研究员,主要从事植物有效成分提取及其生物活性研究,E-mail:lpd7911@163.com;#高龙(1997-),男,汉族,新疆伊犁人,硕士研究生,主要从事动物营养与饲料科学研究,E-mail:1194746853@qq.com;*通信作者Author for correspondence,E-mail:010622051@163.com
Optimization of Anthocyanins Extraction Process of Red Elephant
Grass and Study on its Antioxidant Activity
LIN Ping-dong1#, GAO Long1,2#, CHEN Xin-zhu1*
(1. Institute of Animal Husbandry and Veterinary Medicine/Fujian Key Laboratory of Animal Genetics and Breeding, Fujian
Academy of Agricultural Sciences, Fuzhou, Fujian Province 350013, China; 2. College of Animal Sciences (College of Bee
Science), Fujian Agriculture and Forestry University, Fuzhou, Fujian Province 350002, China)
Abstract:Using red elephant grass (Pennisetum purpureum Schumab) as the raw material and anthocyanin content as the response value. Based on a single factor test,three independent variables including ethanol concentration,liquid-material ratio,and extraction time were selected to design a response surface optimization experiment with three factors and three levels using Box-Behnken methodology to optimize the extraction process of anthocyanins from red elephant grass and assess its antioxidant capacity. The results indicated that the optimal conditions for anthocyanin extraction from red elephant grass were a 49% ethanol concentration,an extraction time of 30 minutes,and a liquid-solid ratio of 49∶1. Under these conditions,the extracted anthocyanin content was 2.09 mg·g-1,with only a slight deviation of 1.8% from the theoretical value. The maximum scavenging rates of anthocyanins from red elephant grass on hydroxyl radical and DPPH radical were found to be 121.3% and 97.5%,respectively. While the maximum total antioxidant capacity against ABTS+radical reached up to 2.6 mmol·g-1,demonstrating significant antioxidant activity. This study can offer a reliable theoretical foundation and important technical support for the extraction and processing of anthocyanins from red elephant grass.
Key words:Pennisetum purpureum Schumab;Anthocyanin;Process optimization;Antioxidant activity
红象草(Pennisetum purpureum Schumab)为多年生禾本科狼尾草属(Pennisetum),茎叶为紫红色,所以又叫紫狼尾草、紫象草。红象草易栽培、产量高,且营养丰富、适口性好,可直接饲喂,也可调制成干草或制作青贮饲料,是适合食草畜禽的优质牧草品种[1-4]。花青素是广泛存在于所有深红色、紫色或蓝色植物中的一种水溶性黄酮类色素,是赋予植物颜色的主要物质之一。红象草茎叶中因含有大量花青素而呈现紫红色。除了着色作用,花青素还具有广泛的生物学活性,包括抗炎和抗氧化特性[5-7]。目前,花青素的提取方法主要是有机溶剂萃取法、微波辅助提取法、超声波辅助提取法、超临界二氧化碳萃取法和酶分解提取法等,其中以超声波、微波辅助提取应用最为广泛[8]。黄凌辉等[9-10]在水浴提取的基础上,通过改进、优化提取装置来达到提高花青素提取率的目的。焦文静等[11]对超声提取红象草花青素的工艺进行优化,提取得到的花青素含量为1.96 mg·g-1。刘赛格等[12]采用95%酸性丙酮,在料液比1∶110、提取温度55℃、提取时间60 min的条件下,从紫象草中提取得到含量为5.06 mg·g-1的低聚体原花青素B2,并测得该花青素对羟自由基有较好的清除能力。目前对红象草花青素提取工艺及其生物学功能的研究仍较少,红象草花青素的工业化生产及应用尚缺乏更多科学的理论与技术参考。本研究采用超声波辅助法提取红象草花青素,通过单因素试验和响应面优化试验,筛选红象草花青素的最佳提取工艺条件,建立合理的提取方案,以期为从红象草中提取花青素提供重要的技术支持;通过测定红象草花青素对羟自由基、DPPH自由基和ABTS+自由基的清除能力,评价其体外抗氧化活性,可为象草资源开发和拓展利用提供详实的理论依据。
1" 材料与方法
1.1" 材料与试剂
红象草(2~2.5 m高度采集叶片):由福建省农业科学院试验种植基地提供。
乙醇、甲醇、甲酸、盐酸、乙酸、氯化钾、醋酸钠(均为分析纯):国药集团化学试剂有限公司;矢车菊色素标准品(色谱纯):北京索莱宝科技有限公司;过氧化氢溶液(H2O2,3%):上海泽叶生物科技有限公司;水杨酸(分析纯):上海麦克林生化科技股份有限公司;硫酸亚铁(90%):上海麦克林生化科技股份有限公司;L-抗坏血酸(VC,99.99%):上海麦克林生化科技股份有限公司;1,1-二苯基-2-苦基肼(DPPH):上海泽叶生物科技有限公司;总抗氧化能力检测试剂盒(ABTS法):上海碧云天生物技术有限公司。
1.2" 仪器与设备
Master-E UV超纯水机:上海和泰仪器有限公司;TU-1810紫外可见分光光度计:北京普析通用有限公司;LYOQUEST-55实验室冻干机:阿自倍尔泰事达机电设备(上海)有限公司;060ST超声波清洗机:广州锂阁科技有限公司;GM-0.33Ⅱ隔膜真空泵:天津市津腾实验设备有限公司;EClassical 3200高效液相色谱仪:大连依利特分析仪器有限公司;SynergyH1 M多功能酶标仪:美国Biotek。
1.3" 红象草花青素提取方法
采用超声波辅助提取法:准确称取1.000 g红象草冻干粉,加入50 mL 50%的酸性乙醇溶液(1%盐酸酸化处理,pH=2),于超声功率480 W,温度50℃的条件下提取30 min,过滤,离心,取上清液减压浓缩,用酸性乙醇定容至50 mL,即得红象草花青素提取液。重复3次平行试验,结果取平均值。
1.4" 花青素含量测定方法
取1 mL红象草花青素提取液于5 mL容量瓶中,分别用pH值1.0的氯化钾缓冲溶液和pH值 4.5的乙酸钠缓冲溶液定容。以蒸馏水为空白,采用紫外分光光度计分别在波长530 nm和700 nm处测定溶液的吸光度,按照Fuleki公式计算花青素含量[13]。
花青素含量(mg·g-1)=[(A530-A700)pH1.0-(A530-A700)pH4.5]×M×D×V×1000ε×L×m
其中,A530为待测溶液在530 nm处的吸光度;A700为待测溶液在700 nm处的吸光度;M为矢车菊素3-O-葡萄糖苷的摩尔质量,449.2 g·mol-1;D为稀释因子,20;V为提取液体积,mL;ε为摩尔消光系数,26 900 L·(mol·cm)-1;L为光程,1 cm;m为样品质量,g。
1.5" 红象草花青素提取单因素试验
固定乙醇浓度(50%)、提取温度(50℃)、液料比(50∶1)、提取时间(30 min),考察超声功率(250,360,480 W)对花青素提取量的影响;固定超声功率(480 W)、提取温度(50℃)、液料比(50∶1)、提取时间(30 min),考察乙醇浓度(40%,50%,60%,70%,80%)对花青素提取量的影响;固定超声功率(480 W)、乙醇浓度(50%)、提取温度(50℃)、提取时间(30 min),考察液料比(20∶1,30∶1,40∶1,50∶1,60∶1)对花青素提取量的影响;固定超声功率(480 W)、乙醇浓度(50%)、提取温度(50℃)、液料比(50∶1),考察提取时间(10,20,30,40,50 min)对花青素提取量的影响。
1.6" 响应面法优化红象草花青素提取工艺
根据单因素试验结果,选择乙醇浓度(A)、液料比(B)、提取时间(C)3个因素,每个因素设置3个水平,以红象草花青素提取量为响应值,采用响应面法中的Box-Behnken(BBD)进行优化试验设计,试验因素与水平见表1。
1.7" 红象草花青素提取结果验证
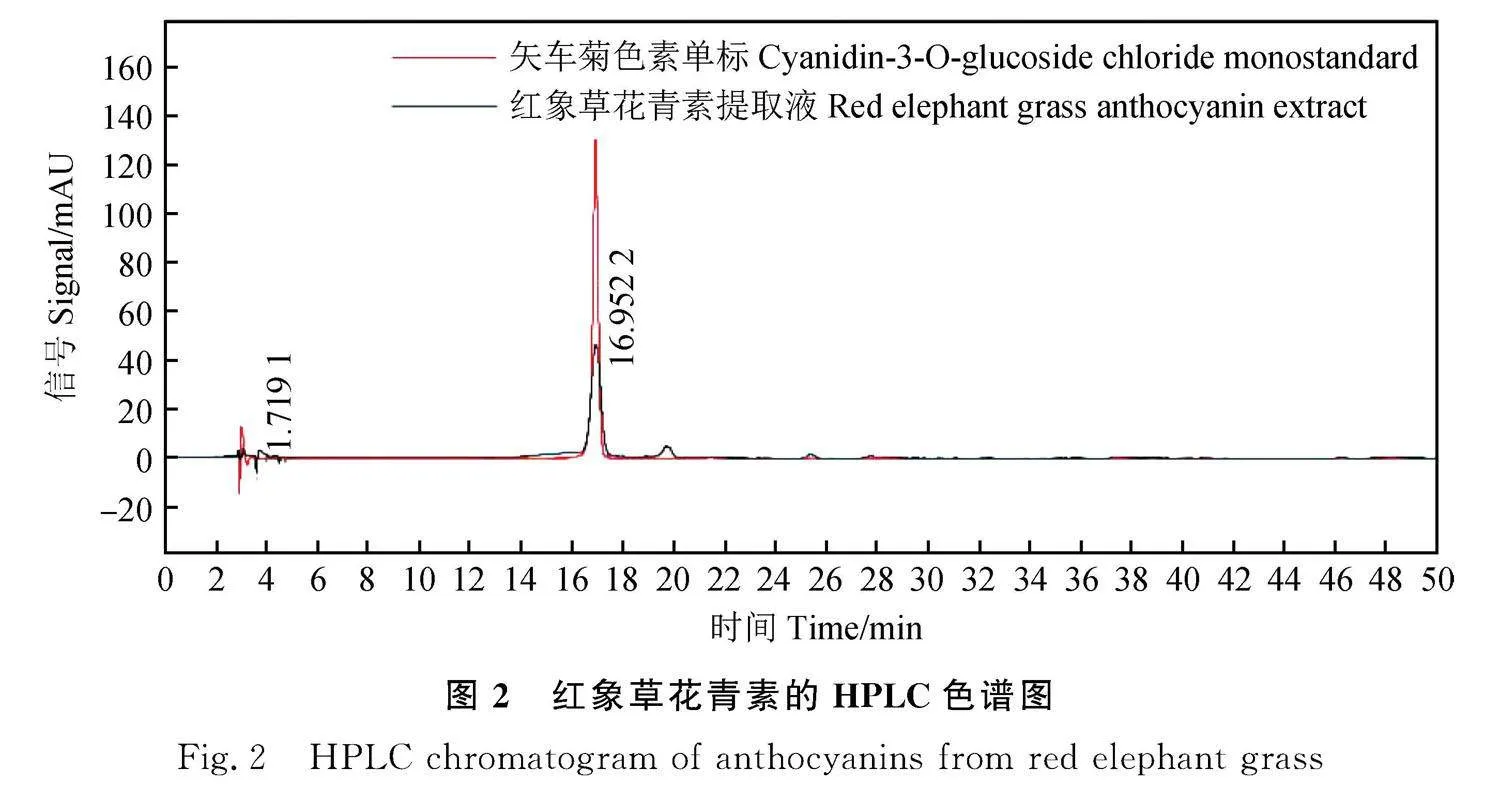
采用优化后的最佳提取工艺条件提取红象草花青素,并按1.4项下方法测定花青素含量,通过HPLC对在该条件下提取得到的红象草花青素进行定性和定量分析。
色谱条件:Agilent ZORBAXSB-C18柱(5 μm×4.6 mm×250 mm)。流动相A为1%甲酸水溶液,流动相B为1%甲酸乙腈溶液。洗脱程序:0 min,A/B=92/8(v/v);5 min,A/B=82/18(v/v);15 min,A/B=70/30(v/v);30 min,A/B=20/80(v/v);50 min,A/B=92/8(v/v)。流速为0.8 mL·min-1;柱温为35℃;进样量为20 μL;检测波长为530 nm。
1.8" 体外抗氧化试验
1.8.1" 红象草花青素对羟自由基清除率的测定" 分别吸取不同浓度的样品(0.2,0.4,0.6,0.8,1.0 mg·mL-1)各200 μL于刻度试管中,依次加入6.0 mmol·L-1的硫酸亚铁溶液和6.0 mmol·L-1的过氧化氢溶液各200 μL,摇匀后静置10 min;再加入 6.0 mmol·L-1的水杨酸-乙醇溶液200 μL,加入蒸馏水定容至1 mL,37℃水浴15 min后于酶标仪510 nm处测定吸光度Ai;用蒸馏水代替水杨酸-乙醇溶液和过氧化氢溶液,同法测定吸光度Aj作为对照组;用蒸馏水代替样品,同法测定吸光度A0作为空白组;用不同浓度的VC溶液作为阳性对照。样品对羟自由基的清除率计算公式:
羟自由基清除率=[1-(Ai-Aj)/A0]×100%。
1.8.2" 红象草花青素对DPPH自由基清除率的测定" 分别吸取不同浓度的样品(0.2,0.4,0.6,0.8,1.0 mg·mL-1)各300 μL于试管中,加入2.0 mmol·L-1的DPPH-乙醇溶液300 μL,暗处放置20 min后于酶标仪517 nm处测定吸光度A样;用无水乙醇代替DPPH,同法测定吸光度A对作为对照组;用水代替样品,同法测定吸光度A空作为空白组;用不同浓度的VC溶液作为阳性对照。样品对DPPH自由基的清除率计算公式:DPPH自由基清除率
[1-(A样-A空/A空]×100%
1.8.3" 红象草花青素对ABTS+自由基总抗氧化能力的测定" 使用等体积ABTS溶液和氧化剂溶液配制ABTS工作母液,室温避光存放12~16 h待用。根据待测定样品的数量(含标准曲线),用80%乙醇将ABTS工作母液稀释35~55倍(A734为(0.70±0.05),对应的A405在1.40左右)。用样品配制溶液把10 mmol·L-1 Trolox标准溶液稀释成0.15,0.3,0.6,0.9,1.2,1.5 mmol·L-1。在96孔板的每个孔中加入200 μL ABTS工作液,空白对照孔内加入10 μL蒸馏水或PBS等适当溶液;标准曲线检测孔内加入10 μL各浓度的Trolox标准溶液;样品检测孔内加入10 μL各浓度样品,轻轻混匀;室温孵育2~6 min后测定A734。根据标准曲线计算出样品的总抗氧化能力,结果以Trolox等效抗氧化能力(TEAC)来表示,单位为mmol·g-1
1.9" 数据统计分析
所得数据为3次平行试验的平均值,结果以均数±标准差(x±s)表示,采用Design-Expert 10.0.4软件进行响应面试验的优化设计及结果分析,采用SPSS 26.0软件对数据进行统计分析,采用GraphPad Prism 9软件绘图。
2" 结果与分析
2.1" 单因素试验结果
2.1.1" 超声功率对红象草花青素提取量的影响" 由表2可知,提取液中的花青素含量随超声功率的增大而增加,但增加幅度无明显差异,说明超声功率可能不是红象草花青素提取的显著影响因素,故选择花青素含量相对最高对应的超声功率480 W作为后续响应面优化试验中的提取条件之一。
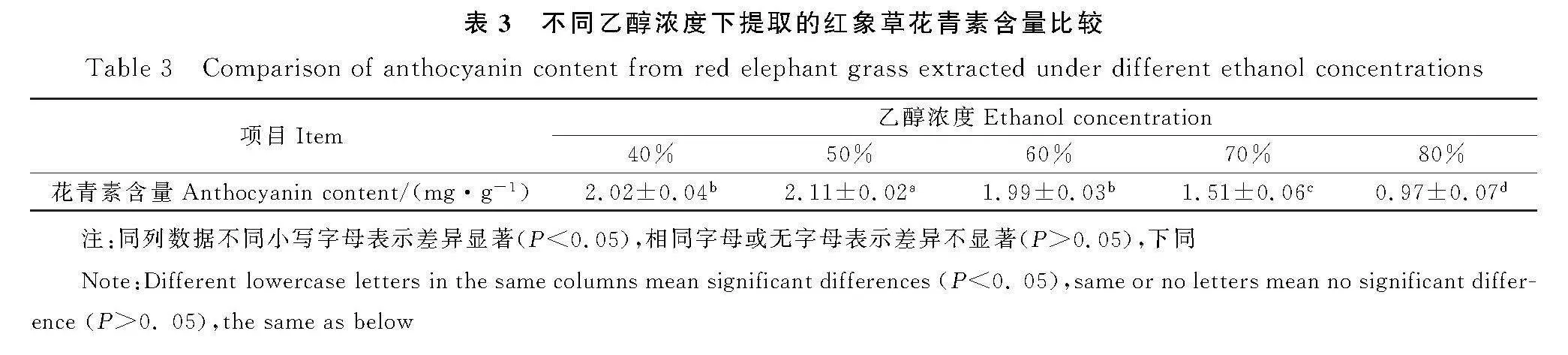
2.1.2" 乙醇浓度对红象草花青素提取量的影响" 由表3可知,一定范围内,随着乙醇浓度的增大,提取液中的花青素含量随之先增高后降低,其中乙醇浓度为50%时的花青素含量最高,且与其他组相比差异显著(P<0.05);乙醇浓度为40%和60%时的花青素含量无明显差异,但均显著高于乙醇浓度为70%和80%的。故选择40%,50%,60%作为后续响应面优化试验中的乙醇浓度考察水平。
2.1.3" 液料比对红象草花青素提取量的影响" 由表4可知,液料比越大,提取液中的花青素含量越高,并在液料比为50∶1时达到峰值,继续增大液料比,花青素含量有所下降。根据组间差异性,选择40∶1,50∶1,60∶1作为后续响应面优化试验中的液料比考察水平。
2.1.4" 提取时间对红象草花青素提取量的影响" 由表5可知,提取时间越长,提取液中的花青素含量越高,提取时间为20,30,40 min时的花青素含量均明显高于10 min的(P<0.05);提取时间为50 min时,花青素含量较20~40 min时明显降低(P<0.05)。因此选择20,30,40 min作为后续响应面优化试验中提取时间的考察水平。
2.2" 响应面优化试验结果及分析
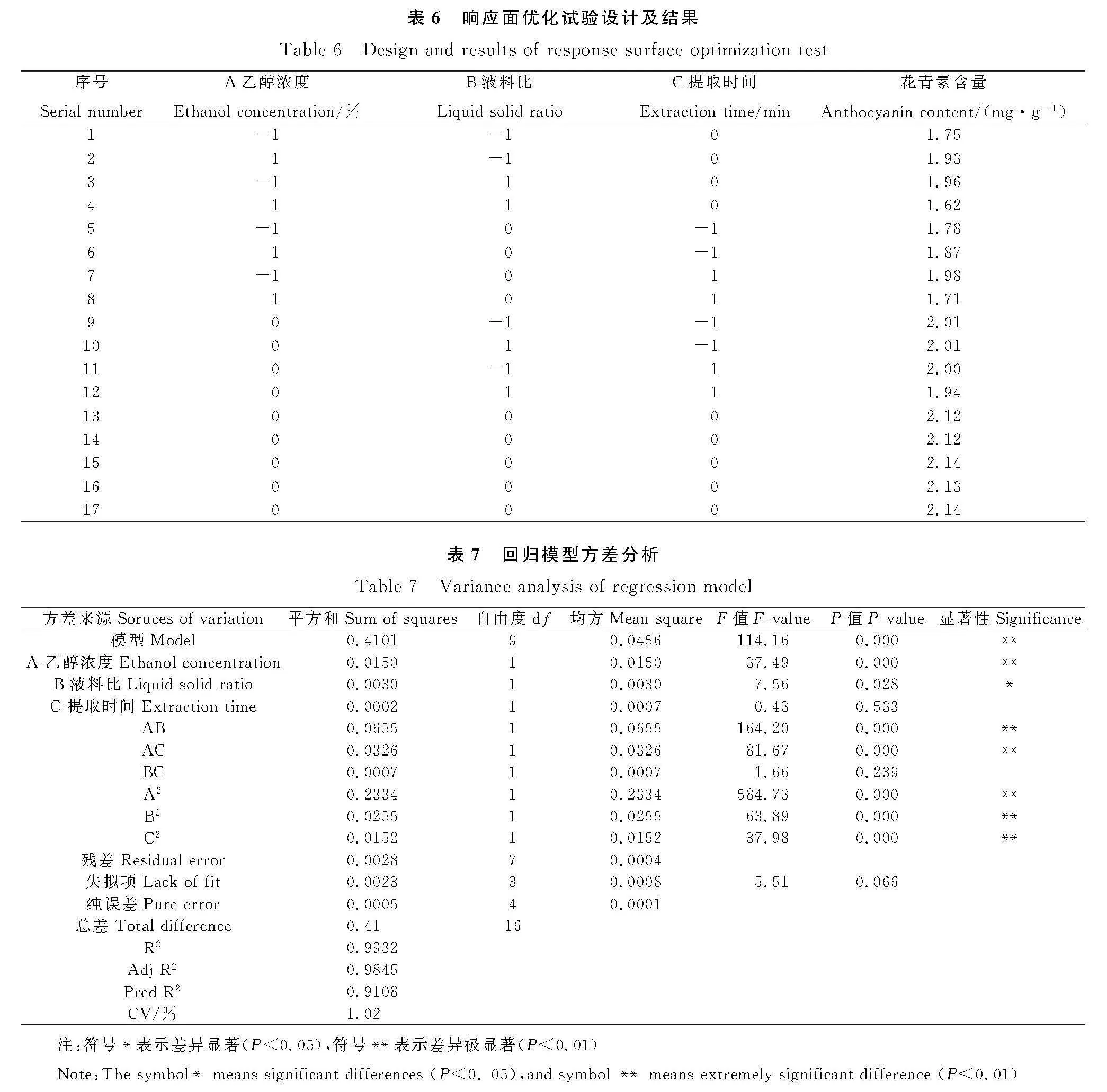
2.2.1" 响应面设计与结果" 以花青素含量为响应值,通过Design-Expert10.0.4软件对待考察的3因素3水平进行响应面优化设计,具体试验结果见表6。对表6中的数据进行拟合,建立回归模型,得到二次多项回归方程:花青素含量Y=2.130-0.043A-0.019B-4.596C-0.130AB-0.090AC-0.013BC-0.240A2-0.078B2-0.060C2。
2.2.2" 回归模型方差分析" 由表7可知,回归模型的P值小于0.0001,达到极显著水平,失拟项不显著,变异系数为1.02%(lt;10%),说明非试验因素对结果影响不大,回归模型具有较好的试验稳定性。模型线性相关系数R2为99.32%,与校正决定系数Adj-R2的98.45%接近,说明该方程拟合度较好,有充分的准确性和通用性,能充分体现乙醇浓度、液料比、提取时间3个因素对花青素提取量的影响。从该表可以看出,一次项A、B,交互项AB、AC和二次项A2、B2、C2对花青素提取量的影响极显著,交互项BC和一次项C的影响不显著。再通过参照F值大小也可得出这3个因素对花青素提取量的影响程度大小顺序为:A(乙醇浓度)gt; B(液料比)gt; C(提取时间)。
2.2.3" 响应面中各因素交互作用分析" 根据回归模型所作的各因素两两交互作用的等高线图与曲面图如图1所示。
当提取时间不变时:从图1(a)可以看出,乙醇浓度与料液比的等高线图呈椭圆状,说明这两项因素之间的交互影响较强;结合图1(b)三维曲面的倾斜度可知,乙醇浓度对花青素提取量的影响大于料液比。随着乙醇浓度的增大,花青素含量呈先升高后降低的趋势;在乙醇浓度较低的情况下,随着液料比的增大,提取得到的花青素含量逐渐增高;当乙醇浓度在较高水平时,提取得到的花青素含量随着液料比的增大而降低。
当液料比不变时,从图1(c)可以看出,乙醇浓度与提取时间的等高线图也呈椭圆状,即这两项因素之间也有较强的交互影响;结合图1(d)三维曲面的倾斜度可知,乙醇浓度对花青素提取量的影响大于提取时间。随着乙醇浓度的增大,花青素含量呈先升高后降低的趋势;低乙醇浓度下,提取时间越长,花青素含量越高;高乙醇浓度下,提取时间越长,花青素含量越低。
当乙醇浓度不变时,从图1(e)可以看出,液料比与提取时间的等高线图近圆形,说明这两项因素之间的交互影响较弱;从图1(f)可以看出,提取得到的花青素含量存在极大点,当提取时间从20 min增加至30 min时,花青素含量提高,当提取时间继续增加时,花青素含量下降,该极点出现在提取时间为30 min条件下。
2.3" 最佳提取工艺确定及提取结果验证
经软件分析优化,可得红象草花青素的最佳提取工艺参数为乙醇浓度为49.19%,液料比为49.39∶1,提取时间30.29 min,花青素含量理论值为2.13 mg·g-1。考虑到实际操作方便,将提取条件调整为乙醇浓度49%,提取时间为30 min,液料比49∶1。在此条件下提取得到的提取物经HPLC分析确定为花青素(如图2所示),并测得花青素含量为2.09 mg·g-1,误差值为1.8%。
2.4" 红象草花青素的抗氧化能力分析
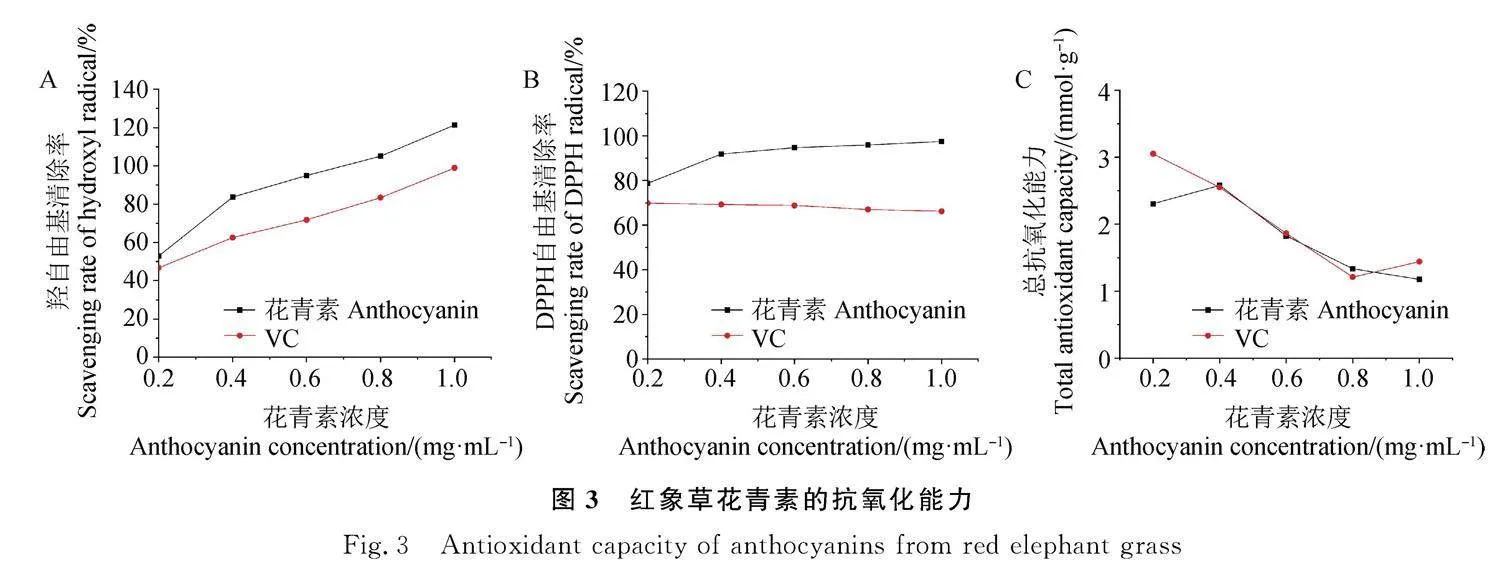
如图3A所示,随着浓度的增高,红象草花青素对羟自由基的清除率逐渐增大,在浓度0.2~1.0 mg·mL-1范围内,红象草花青素对羟自由基的清除率最高可达121.3%,且高于同等浓度下的VC对羟自由基的清除率。如图3B所示,在浓度0.2~0.4 mg·mL-1内,红象草花青素对DPPH自由基的清除率随浓度的增高而增大,之后花青素浓度继续增大,DPPH清除率保持在90%以上,均高于同等浓度下的VC对DPPH自由基的清除率。如图3C所示,在浓度0.2~1.0 mg·mL-1范围内,红象草花青素对ABTS+自由基的总抗氧化能力随花青素浓度的增高呈先升后降的趋势,并与VC相当,当花青素浓度为0.4 mg·mL-1时,总抗氧化能力最高,为2.6 mmol·g-1。
3" 讨论
花青素作为植物中广泛存在的且具有着色、抗氧化作用的生物活性物质,具有较高的研究与应用价值。目前对于红象草的研究主要集中于其作为草食动物饲料的营养价值或青贮方面[14-15],而关于红象草所含花青素的研究极少,研究红象草花青素提取有利于象草资源的深入挖掘和拓展利用。
植物中的花青素通常以糖基化和酰化形成花色苷的形式存在,自然游离条件下分子稳定性较差,易受pH值、温度、光照、金属离子等环境因素的影响而发生降解、褪色甚至丧失生理活性等变化[16-18]。为保持花青素的稳定性,其提取或加工环境一般要求pH值保持酸性且温度不超过50℃[19]。超声波辅助提取是一种利用超声的空化效应加速植物成分溶出进入提取溶剂的提取技术,具有提取时间短、温度低、效率高等特点,适用于热不稳定活性物质的提取[20-22]。因此本研究以酸化乙醇为提取溶剂,采用超声波辅助法从红象草中提取花青素。
本研究中,红象草花青素提取含量主要与超声功率、乙醇浓度、液料比、提取时间等因素有关。单因素试验考察结果表明,花青素提取含量作为响应值受乙醇浓度、液料比、提取时间的影响较为明显,因素水平越高,响应值越大。但响应值与影响因素两者之间并非完全的线性关系,各因素达到一定水平后,花青素含量不再增高或反而降低。如在张潇等[23]研究紫甘蓝(Brassica oleracea L.)花青素的提取工艺中,料液比、乙醇体积分数、超声时间等参数均存在一个使花青素提取量达到峰值的因素水平,本研究试验结果也呈现该趋势。原因可能如下:过高浓度的乙醇溶液会促使红象草中其他醇溶性杂质和亲脂性强的成分溶出,使得花青素含量降低;而随着液料比的增加,细胞内外渗透压升高,使花青素充分向周围溶剂释放,但当液料比继续增大,被提取成分溶出达到饱和,醇溶性杂质溶出增多,质量传递速度变慢,溶剂粘度增大,超声空化效应减弱,提取率则下降;另外,提取时间过久增加了自由基等氧化物质的产生,花青素被消耗而含量降低[24-26]。根据单因素试验结果,本研究最终筛出3个主要因素进行响应面试验设计,建立回归模型,分析各因素对花青素含量的两两交互作用。试验结果表明,乙醇浓度对花青素提取含量的影响最大,液料比次之,提取时间的影响最小。陈雪等[27]采用超声辅助乙醇提取葡萄皮渣中的花青素时得出乙醇体积分数对葡萄皮渣花青素提取效果的影响最大,其次是料液比和提取时间,这与本研究试验结果相似。
花青素具有酚羟基结构,能够与羟自由基、DPPH自由基等氧化物结合并将其清除,从而发挥抗氧化作用;ABTS在适当的氧化剂作用下氧化成绿色的ABTS+,在抗氧化物存在时ABTS+的产生会被抑制[28-29]。因此,通过测定花青素对自由基的清除能力可评估其抗氧化活性。如OLDZKI R等[30]通过测定葡萄果皮中花青素对DPPH和ABTS+自由基的清除能力和对FRAP的还原力,表明了葡萄果皮花青素具有较强的抗氧化活性。马孟佳[31]等分别测定了蓝莓、紫薯、紫甘蓝、黑豆花青素对羟自由基、DPPH自由基、ABTS+自由基的清除率,比较了这些植物中花青素的抗氧化活性强弱。本研究以VC为阳性对照,探究不同浓度红象草花青素对自由基的清除能力,发现红象草花青素对羟自由基、DPPH自由基以及ABTS+自由基均有较好的清除和抑制作用,其自由基清除能力与VC相当或更高,表明红象草花青素抗氧化活性显著,故本试验制备的红象草花青素提取物具备开发成为天然抗氧化饲料添加剂的潜力。
4" 结论
本研究采用超声波辅助提取法从红象草中提取花青素成分,并通过响应面法对提取工艺进行优化,结果表明,红象草花青素最佳提取工艺条件为:乙醇浓度49%,提取时间30 min,液料比49∶1;验证试验结果表明,红象草花青素提取含量为2.09 mg·g-1,与模型预测的理论值相符,提取工艺优化合理可行;自由基清除实验结果表明,红象草花青素对羟自由基、DPPH及ABTS+自由基有较好的清除能力,说明红象草花青素具有较强的体外抗氧化活性。红象草的资源优势和特性使其发挥了较大的养殖效益和生态效益,对红象草含有的丰富的生物活性物质加以利用能够进一步提高其经济价值,红象草花青素提取工艺及其活性研究可为象草资源的深层次开发奠定基础。
参考文献
[1]" 陆云华,汤洪波,邹怀波,等. 台湾甜象草、红象草和皇竹草营养成分和无机元素的分析[J]. 浙江农业科学,2011(2):418-419
[2]" 陈钟佃,黄勤楼,黄秀声,等. 闽引红象草栽培技术[J]. 福建农业科技,2013(4):54-55
[3]" 陈钟佃,黄秀声,黄勤楼,等. 红象草花青素饮料及其制备方法:中国,CN103040062B[P]. 2014-06-25
[4]" 陈鑫珠,李文杨,刘远,等. 红象草绿汁发酵液微生物组成及其对菌糠发酵品质的影响[J]. 福建农业学报,2018,33(6):644-648
[5]" 沈媛. 樱桃果实营养成分和花青素的研究[D]. 南京:南京林业大学,2014:41-45
[6]" MERECZ-SADOWSKA A,SITAREK P,KOWALCZYK T,et al. Food Anthocyanins:Malvidin and its glycosides as promising antioxidant and anti-Inflammatory agents with potential health benefits[J]. Nutrients,2023,15(13):3016
[7]" LIU J Q,ZHOU H B,SONG L,et al. Anthocyanins:promising natural products with diverse pharmacological activities[J]. Molecules,2021,26(13):3807
[8]" 张媛雯,赵琳,郑天翔,等. 原花青素提取及分离纯化方法的研究进展[J]. 食品工业,2023,44 (4):263-266
[9]" 黄凌辉,蔡锦森,蔡锦胜. 红象草提取花青素装置及其采用该装置提取花青素的方法:中国,CN113289375A[P]. 2021-08-24
[10]黄凌辉,蔡锦森,蔡锦胜. 红象草提取花青素装置:CN217015395U[P]. 2022-07-22
[11]焦文静,林洁荣,叶健军,等. 响应面分析法优化紫象草花青素提取工艺[J]. 黑龙江畜牧兽医,2015(19):11-15,20,294
[12]刘赛格,冉思蛟,倪海花,等. 紫象草原花青素提取物的制备条件优化和体外抗氧化活性研究[J]. 动物营养学报,2022,34(11):7443-7454
[13]FULEKI T,FRANCIS F J. Quantitative methods for anthocyanins. 4. determination of individual anthocyanins in cranberry and cranberry products[J]. Journal of Food Science,1968,33(5):471-478
[14]李茂,字学娟,侯冠彧,等. 体外产气法评价5种热带禾本科牧草营养价值[J]. 草地学报,2013,21(5):1028-1032
[15]武齐丰,陈晨,黄沁骄,等. 纤维素酶和乳酸菌对杂交象草青贮结构性碳水化合物影响[J]. 草地学报,2024,32 (7):2314-2322
[16]ALAPPAT B,ALAPPAT J. Anthocyanin pigments:beyond aesthetics[J]. Molecules,2020,25(23):5500
[17]ECHEGARAY N,MUNEKATA P E S,GULLN P,et al. Recent advances in food products fortification with anthocyanins[J]. Critical Reviews in Food Science and Nutrition,2022,62(6):1553-1567
[18]崔海鹏,郭健龙,王大全,等. 花青素加工稳定性及其研究进展[J]. 食品与发酵工业,2024,50(13):388-397
[19]李冠臻. pH和温度对紫苏花青素稳定性的影响[J]. 辽宁农业科学,2018(1):84-85
[20]李小东,王钰,效碧亮,等. 花青素的提取方法及应用研究进展[J]. 应用化工,2020,49 (2):449-451,457
[21]THILAKARATHNA W P D W,RUPASINGHE H P V. Optimization of the extraction of proanthocyanidins from grape seeds using ultrasonication-assisted aqueous ethanol and evaluation of anti-steatosis activity in vitro[J]. Molecules,2022,27(4):1363
[22]RANJHA M A N,IRFAN S,LORENZO J M,et al. Sonication,a potential technique for extraction ofphytoconstituents:a systematic review[J]. Processes,2021,9(8):1406
[23]张潇,周海旭,高晗,等. 紫甘蓝中花青素提取工艺及其抗氧化研究[J]. 河南科技学院学报(自然科学版),2024,52(3):62-68
[24]葛艳琳. 山葡萄皮花青素超声波辅助提取及抗氧化活性研究[J]. 食品研究与开发,2018,39(10):48-55
[25]许丹丹,王晓君,陈宇. 多指标综合评分法优化金银花枝叶的提取工艺研究[J]. 浙江中医杂志,2020,55(7):541-542
[26]程海涛,申献双. 超声波-协同溶液水力空化提取马齿苋中原花青素工艺优化[J]. 饲料研究,2020,43(1):65-69
[27]陈雪,耿延,李雯婷,等. 葡萄皮渣花青素提取工艺研究[J]. 农产品加工,2024(6):34-37
[28]王海歌,鲍梦圆,徐心雨,等. 植物食材花青素结构特性及对其功效机制研究进展[J]. 中国食品添加剂,2024,35(2):299-307
[29]李煦,白雪晴,刘长霞,等. 天然花青素的抗氧化机制及功能活性研究进展[J]. 食品安全质量检测学报,2021,12(20):8163-8171
[30]OLDZKI R,LUTOSAWSKI K,NOWICKA P,et al. Non-commercial grapevines hybrids fruits as a novel food of high antioxidant activity[J]. Foods,2022,11(15):2216
[31]马孟佳,赵娟,陈鹏飞,等. 4种不同来源花青素的稳定性及抗氧化性比较[J]. 食品研究与开发,2024,45(4):31-39,67
(责任编辑" 刘婷婷)
