PSMD6在肝细胞癌中的异常高表达及临床价值
2024-12-31莫伟嘉唐宇星宋畅黄庆玲赵春艳罗嘉嫄蒋洪棉陈罡吴华裕



摘要:目的" 评估PSMD6在肝细胞癌(HCC)患者组织中的表达情况,并探究其潜在临床价值。方法" 基于Gene Expression Omnibus(GEO)、Metabric、TCGA-GTEx、ArrayExpress、Sequence Read Archive(SRA)数据库,综合分析全球多中心、多平台的PSMD6基因表达谱,探究PSMD6的mRNA在HCC中的过表达趋势。同时,使用The Human Protein Atlas组织芯片库展示PSMD6在HCC组织中蛋白表达情况。绘制KM曲线,分析PSMD6在HCC中的预后预测价值。结果" PSMD6蛋白表达的阳性染色信号定位于HCC细胞的细胞浆和核膜中,表达强度中等,染色度中等。HCC中PSMD6高表达(P<0.01),结果未发生偏倚。SROC的AUC为0.75(0.71,0.79),敏感性为0.64,特异性为0.74,提示PSMD6具有中度鉴别HCC的能力。生存分析显示,PSMD6高表达的患者面临着更高的生存风险(HR=1.4,P=0.043)。结论" PSMD6在HCC中异常高表达,可作为HCC筛查和治疗潜在靶点。
关键词:PSMD6;肝细胞癌;上皮-间叶细胞转化
中图分类号:R735.7" " " " " " " " " " " " " " " " " "文献标识码:A" " " " " nbsp; " " " " " " " " " "DOI:10.3969/j.issn.1006-1959.2024.18.001
文章编号:1006-1959(2024)18-0001-05
Abstract:Objective" To evaluate the expression of PSMD6 in patients with hepatocellular carcinoma (HCC), and explore its potential clinical value.Methods" Based on Gene Expression Omnibus (GEO), Metabric, TCGA-GTEx, ArrayExpress, Sequence Read Archive (SRA) databases, the global multi-center and multi-platform PSMD6 gene expression profiles were comprehensively analyzed to explore the overexpression trend of PSMD6 mRNA in HCC. At the same time, the Human Protein Atlas tissue microarray library was used to show the protein expression of PSMD6 in HCC tissues. KM curve was drawn to analyze the prognostic value of PSMD6 in HCC.Results" The positive staining signal of PSMD6 protein expression was located in the cytoplasm and nuclear membrane of HCC cells, with moderate expression intensity and moderate staining degree. PSMD6 was highly expressed in HCC (Plt;0.01), and the results were not biased. The AUC of SROC was 0.75 (0.71, 0.79), the sensitivity was 0.64, and the specificity was 0.74, suggesting that PSMD6 had a moderate ability to identify HCC. Survival analysis showed that patients with high expression of PSMD6 with a higher survival risk (HR=1.4, P=0.043).Conclusion" PSMD6 is abnormally highly expressed in HCC, which can be used as a potential target for HCC screening and treatment.
Key words:PSMD6;Hepatocellular carcinoma;Epithelial-mesenchymal cell transformation
肝细胞癌(hepatocellular carcinoma, HCC)是肝癌最主要的组织学亚型,占原发性肝癌的90%[1]。根据癌症研究报告显示[2],肝癌的生存率为倒数前3位(21%),已经成为威胁人类健康的主要危险因素之一。手术切除、肝移植和经皮穿刺是早期肝癌患者可能治愈的有效治疗方法。而其中最有效的移植疗法因其在移植后极高的复发率和转移率导致患者预后情况并不理想。肝癌趋势因国家而异,我国过去占全球肝癌负担的一半以上[3]。更严峻的是,肝癌起病隐匿,早期并无明显不适,大多数肝癌患者确诊时已到中晚期,失去了手术治疗的最佳时机[4,5]。因此,HCC早期精准诊断和靶向治疗尤为重要,亟需探明一种有效的生物标志物辅助临床医师进行肿瘤的早期筛查、诊断、治疗评估、复发和预后预测[6]。泛素蛋白酶体系统(UPS)是调节细胞内蛋白质降解不可或缺的机制,可影响人类抗原加工、信号转导和细胞周期调控[7]。由于肿瘤细胞迅速增长繁殖,蛋白质无序代谢也随之加剧,呈现极其混杂的细胞环境[8]。蛋白酶体可与高混杂性的底物选择性相结合,精确接受来自泛素链修饰的蛋白质并进行破坏[9]。26S蛋白酶体中非ATP酶(PSMD)共有14个亚型,被证明有助于受损、错误折叠、异常和外来蛋白质的降解[10]。当下已有研究探明部分PSMD家族成员在HCC中呈过表达趋势,独特的分子机制使其具有成为HCC生物标志物的潜力。PSMD1在HCC中可能通过诱导p53蛋白降解来调节细胞生长促进癌症的发生发展[11,12]。也有学者发现[13],PSMD11可能通过与ATP7A、DLAT和PDHA1的复杂相互作用来调节HCC的发育。而高水平的PSMD13有助于维持肝癌癌细胞的活性并促进其上皮-间叶细胞转化(EMT)过程,与肿瘤的增殖特征和基因组不稳定性相关联[14]。但是部分PSMD家族成员还未有研究表明其和肿瘤形成是否有关,如Rpn7(PSMD6别称)具有独特的作用,敲低后破坏了DNA稳定性并导致细胞凋亡[15],但是否和肿瘤形成有关还有待挖掘。因此,本研究深入探究PSMD6在全球HCC肝组织及健康肝组织样本中的mRNA和蛋白质表达水平,旨在确认PSMD6在HCC早期诊断及临床预后的价值,现报道如下。
1材料与方法
1.1数据获取" 通过Gene Expression Omnibus(GEO)、Metabric、TCGA-GTEx、ArrayExpress、Sequence Read Archive(SRA)等高通量数据库获取全球多平台HCC RNA-seq数据集。纳入标准:人体组织,而非细胞系;同时包含癌和对照的癌旁或正常肝组织,样本数≥3;表达数据及临床信息完整;患者术前未接受化疗、放疗等任何辅助治疗;数据类型为miRNA或mRNA表达谱。对所得数据集分别进行log2对数转换并合并处理后移除批次效应批,将相对表达值转换为log2(x+1)标度后用“limma-voom”程序包进行移除。
1.2 PSMD6在HCC中的表达分析及临床价值" 基于The Human Protein Atlas(THPA)数据库探究PSMD6蛋白表达情况。通过使用免疫组织化学和质谱分析技术探讨表征细胞和组织中的蛋白质表达和定位,以此挖掘PSMD6基因和蛋白质的表达模式、潜在分子机制以及与HCC的关联性。利用标准化处理并移除批次效应的全球HCC mRNA表达矩阵,基于Stata v12.0软件合并PSMD6表达水平的标准化平均差(standardized mean difference, SMD),计算灵敏度和特异度。SMD数值为0.10~0.34、0.35~0.64、0.65~1.19、≥1.20时分别代表低等、中等、高等及显著差异。绘制总受试者工作特征曲线(SROC),AUC数值大小反映PSMD6在HCC中差异表达敏感性和特异性,AUC数值为0.50~0.70、0.71~0.90、>0.90时分别代表低度、中度、高度差异表达。相应进行Begg和Eggr偏倚检验,判别标准化效应量和方差及误差之间的关系概率。最后,利用Kaplan Meier Plotter平台整合预后数据,通过KM生存曲线分析PSMD6表达对HCC患者预后的影响。
2结果
2.1 PSMD6蛋白在HCC组织中表达水平及定位" PSMD6蛋白在正常肝细胞中呈阴性表达,而在HCC细胞中有表达增加的趋势。差异表达的阳性染色信号定位于HCC细胞的细胞浆和核膜中,表达强度中等,染色度中等,见图1。
2.2 PSMD6 mRNA在HCC中表达水平及鉴别潜力" 本研究综合分析来自全球多中心的39个基因芯片及高通量测序数据集,对比研究3394例HCC肝组织及3016例健康肝组织中PSMD6的表达情况,结果显示HCC中PSMD6高表达[SMD为0.31(0.12,0.50),P<0.01](图2A);经Begg和Eggr偏倚检验,发现其均未发生偏倚(图2B、图2C)。明显异质性来源为GSE128274-GPL18573、GSE33294-GPL10999、GSE55048-GPL9115和GSE67764-GPL17077,可能是数据样本过少导致(图2D)。PSMD6具有中度鉴别HCC的能力,结果得到SROC及敏感特异性检验数据验证:AUC为0.75(0.71,0.79),敏感性为0.64,特异性为0.74(图2E、图2F)。
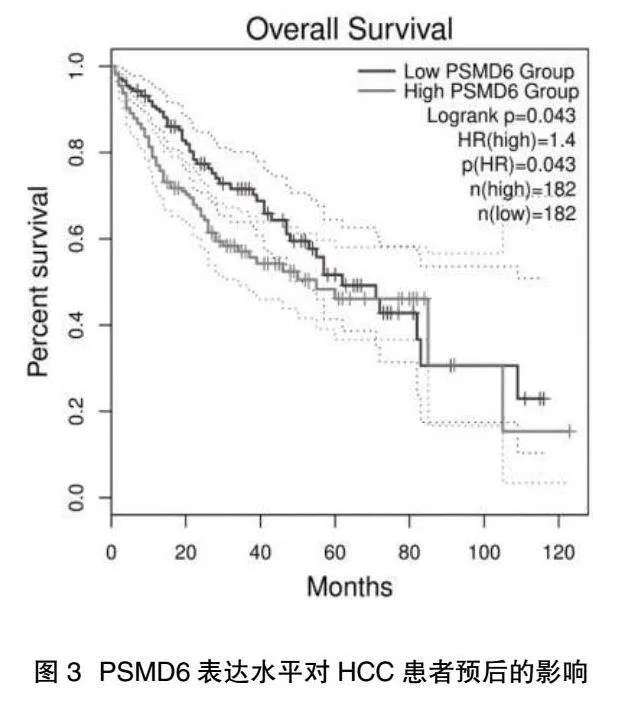
2.3 PSMD6表达水平对HCC患者预后的影响" 本研究进一步评估PSMD6对HCC患者预后的潜在影响,以中位表达值划分PSMD6高表达和低表达,分析其表达情况对HCC患者的影响,结果显示6年内PSMD6高表达的患者面临更高的生存风险和更差的预后(HR=1.4,P=0.043),见图3。
3讨论
HCC是一种高侵袭性的原发性恶性肝肿瘤,加强早期监测筛查可提高生存获益,但临床上超过60%的诊断阶段已处于晚期,预后较差[16,17]。HCC的早期筛查诊断和监测治疗依赖于可靠、方便的血清生物标志物,但迄今为止仅有甲胎蛋白(AFP)广泛应用于临床实践[18]。随着基因测序技术及分子病理学的发展,亟需更多前瞻性研究探明更加可靠的分子标志物以弥补AFP在敏感性和特异性上的缺陷。蛋白酶体通过快速单向催化生物反应控制多种细胞的生物活性[19]。最近对秀丽隐杆线虫种系作为蛋白酶体模型的研究发现,Rpn7的下调可导致蛋白酶体蛋白水解活性功能障碍及细胞周期缺陷[20]。为契合肿瘤细胞极高蛋白代谢及极短的细胞分裂周期特性,26S蛋白酶体中的非ATP酶家族可能也相应呈现高表达趋势。当下已有学者对PSMD家族和各类癌症之间的潜在联系进行探索,但是关于PSMD6促进HCC发生的证据尚不足。据此,本研究整合分析全球多中心多平台HCC高通量测序数据集,从蛋白和mRNA两个方面的表达水平分析PSMD6对HCC的鉴别潜力,并进一步挖掘其和HCC患者生存风险之间的关联。
本研究依托全球3394例HCC及3016例正常肝组织样本基因芯片及测序数据集,排除因人种、地域差异带来的误差,使结果更具有说服力及普适性。并从mRNA层面验证了PSMD6在HCC中呈高表达趋势(P<0.01),且具有中度敏感性和高度特异性,结果未发生偏倚。对结果产生影响的异质性来源为样本量极少的4个数据集,带来的误差权重可忽略不计。此外,基于THPA所得蛋白表达情况显示,PSMD6中度表达于HCC细胞浆及核膜。最后,生存分析提示,PSMD6高表达患者面临更高的生存风险和更差的预后。综合结果提示PSMD6在HCC中呈现异常高表达趋势,可能参与HCC发生发展进程,且预示着HCC患者更差的生存预后。
综上所述,PSMD6高表达可能和HCC的发生发展相关,可作为HCC筛查治疗的潜在靶点。同时本研究具有一定局限性:仅针对PSMD6在HCC中的异常高表达通过计算病理学展开研究,但其具体分子机制及真实临床有效性需深入研究。
参考文献:
[1]Chakraborty E,Sarkar D.Emerging Therapies for Hepatocellular Carcinoma (HCC)[J].Cancers (Basel),2022,14(11):2798.
[2]Siegel RL,Miller KD,Wagle NS,et al.Cancer statistics,2023[J].CA Cancer J Clin,2023,73(1):17-48.
[3]Shi JF,Cao M,Wang Y,et al.Is it possible to halve the incidence of liver cancer in China by 2050?[J].Int J Cancer,2021,148(5):1051-1065.
[4]Zhou H,Song T.Conversion therapy and maintenance therapy for primary hepatocellular carcinoma[J].Biosci Trends,2021,15(3):155-160.
[5]Raja A,Haq F.Molecular classification of hepatocellular carcinoma:prognostic importance and clinical applications[J].J Cancer Res Clin Oncol,2022,148(1):15-29.
[6]Gao YX,Yang TW,Yin JM,et al.Progress and prospects of biomarkers in primary liver cancer (Review)[J].Int J Oncol,2020,57(1):54-66.
[7]Li X,Li X,Hu Y,et al.PSMD8 can serve as potential biomarker and therapeutic target of the PSMD family in ovarian cancer:based on bioinformatics analysis and in vitro validation[J].BMC Cancer,2023,23(1):573.
[8]Devoy A,Soane T,Welchman R,et al.The ubiquitin-proteasome system and cancer[J].Essays Biochem,2005,41:187-203.
[9]Bard JAM,Goodall EA,Greene ER,et al.Structure and Function of the 26S Proteasome[J].Annu Rev Biochem,2018,87:697-724.
[10]Xuan DTM,Wu CC,Kao TJ,et al.Prognostic and immune infiltration signatures of proteasome 26S subunit,non-ATPase (PSMD) family genes in breast cancer patients[J].Aging (Albany NY),2021,13(22):24882-24913.
[11]Okumura T,Ikeda K,Ujihira T,et al.Proteasome 26S subunit PSMD1 regulates breast cancer cell growth through p53 protein degradation[J].J Biochem,2018,163(1):19-29.
[12]Rubio AJ,Bencomo-Alvarez AE,Young JE,et al.26S Proteasome Non-ATPase Regulatory Subunits 1 (PSMD1) and 3 (PSMD3) as Putative Targets for Cancer Prognosis and Therapy[J].Cells,2021,10(9):2390.
[13]Zhang C,Xu T,Ji K,et al.An integrative analysis reveals the prognostic value and potential functions of PSMD11 in hepatocellular carcinoma[J].Mol Carcinog,2023,62(9):1355-1368.
[14]Huang W,Mei J,Liu YJ,et al.An Analysis Regarding the Association Between Proteasome (PSM) and Hepatocellular Carcinoma (HCC)[J].J Hepatocell Carcinoma,2023,10:497-515.
[15]Tsolou A,Nelson G,Trachana V,et al.The 19S proteasome subunit Rpn7 stabilizes DNA damage foci upon genotoxic insult[J].IUBMB Life,2012,64(5):432-442.
[16]Lv J,Zhang S,Wu H,et al.Deubiquitinase PSMD14 enhances hepatocellular carcinoma growth and metastasis by stabilizing GRB2[J].Cancer Lett,2020,469:22-34.
[17]Liu F,Lou K,Zhao X,et al.miR-214 regulates papillary thyroid carcinoma cell proliferation and metastasis by targeting PSMD10[J].Int J Mol Med,2018,42(6):3027-3036.
[18]Schlosser S,Tümen D,Volz B,et al.HCC biomarkers - state of the old and outlook to future promising biomarkers and their potential in everyday clinical practice[J].Front Oncol,2022,12:1016952.
[19]Tanaka K.The proteasome:overview of structure and functions[J].Proc Jpn Acad Ser B Phys Biol Sci,2009,85(1):12-36.
[20]Fernando LM,Quesada-Candela C,Murray M,et al.Proteasomal subunit depletions differentially affect germline integrity in C.elegans[J].Front Cell Dev Biol,2022,10:901320.
收稿日期:2023-09-10;修回日期:2023-09-27
编辑/杜帆
基金项目:1.广西自然科学基金项目(编号:2020GXNSFAA238027);2.广西壮族自治区卫生健康委员会科研课题(编号:Z20190594);" " 3.南宁市第一人民医院2023年度科研启动基金项目(编号:YN2023002)
作者简介:莫伟嘉(1985.6-),男,广西梧州人,博士,主治医师,主要从事分子病理学研究
通讯作者:吴华裕(1984.8-),男,广东湛江人,博士,讲师,主要从事肿瘤发生发展分子机制研究
