医疗器械临床试验项目启动前风险管理策略研究
2024-12-31王倩郭晋敏

【摘要】目的探讨医疗器械临床试验项目启动前风险管理策略,以提高专业科室临床试验能力。方法基于机构规定的试验前流程,识别项目启动前各环节38项风险要素,对风险事件的影响程度和发生可能性进行评估及赋值,确定风险等级,并制订分级管控策略。结果针对中高风险事件、中风险事件、中低风险事件实施风险管控策略后,专业科室项目启动前风险评估由中风险降为低风险。结论通过构建项目启动前风险管理体系,使试验前各环节风险最小化,提升了专业科室临床试验质量。
【关键词】医疗器械临床试验;风险管理; 项目启动前管理;试验质量
中图分类号:R197.39文献标识码:A
Research on Risk Management Strategy before the Start-up of Medical Device Clinical Trial Project/WANG Qian, GUO Jinmin.//Chinese Health Quality Management,2024,31(10):91-95
AbstractObjectiveTo explore the risk management strategy before the start-up of medical device clinical trial project, so as to enhance the clinical trial ability of professional departments. MethodsBased on the pre-test process specified by the organization, 38 risk factors in all processes were identified, the influence degree and occurrence possibility of risk events were evaluated and assigned, the risk level was determined, and the hierarchical management and control strategies were formulated. ResultsAfter the implementation of risk management and control strategies for medium-high risk events, medium-risk events, and medium-low risk events, the overall risk assessment before the start-up of the professional departments project was reduced from medium risk to low risk. Conclusion Constructing the risk management system before project start-up can minimize the risk of each link before the test and improve the quality of clinical trial in professional departments.
Key wordsMedical Device Clinical Trial; Risk Management; Management before Project Start-Up; Test Quality
First-author's addressThe 960th Hospital of the PLA Joint Logistics Support Force,Jinan,Shandong,250031,China
医疗器械临床试验是指在符合条件的医疗器械临床试验机构中,对拟申请注册的医疗器械(含体外诊断试剂)在正常使用条件下的安全性和有效性进行确认的过程[1]。在此过程中,面临各种可预期和不可预期的风险,如产品本身风险、系统风险等[2]。项目启动是临床试验实施的准入关,应从人员、设备、环境、项目等各方面做好风险防控,才能保障临床试验顺利实施[3-4]。医疗器械临床试验机构通常会制订从立项至启动的试验前流程和制度体系,但专业科室普遍对试验前工作重视程度不高,规范管理意识不强[5-6],由于科室对项目启动前缺乏有效管理,因此存在较多不确定性风险。
风险管理是将项目风险减至最低的管理过程,包括对风险的识别、分析、评估和应变策略等[7-8]。风险管理已广泛应用于医学领域,但医疗器械临床试验中专业科室对风险的评估研究较少。某医疗机构骨科从2010年开始承接医疗器械临床试验,并于2018年8月成功备案为医疗器械临床试验专业科室。本研究以该专业科室临床试验项目启动前管理作为切入点,引入风险管理理念,分析医疗器械临床试验项目启动前管理中各环节的风险点,制订针对性策略,以期减少风险事件发生,加强专业科室项目启动前规范化管理。
1项目启动前风险评估
1.1 成立风险管理小组
成立医疗器械临床试验风险管理小组。由机构办主任担任组长,小组成员包含机构办秘书、机构办质控员、主要研究者、研究者(参与不少于3个项目)、专业科室质控员、专业科室秘书(兼科室资料管理员)。风险管理小组负责识别风险要素,为风险要素的影响程度和发生可能性赋分,制订风险管理策略,并对风险管控效果进行评价。
1.2 识别风险要素
该医疗机构基于《医疗器械临床试验运行管理制度和流程》《医疗器械临床试验启动会标准操作规程》《机构立项审核的标准操作规程》等规定的试验前流程,参照《医疗器械临床试验质量管理规范》[1]、“医疗器械临床试验现场检查要点及判定原则” [9],结合国家及各省局现场检查问题通告[10-12]、本机构质控发现的问题等,由风险管理小组成员系统梳理项目启动前的风险事件,识别风险要素。
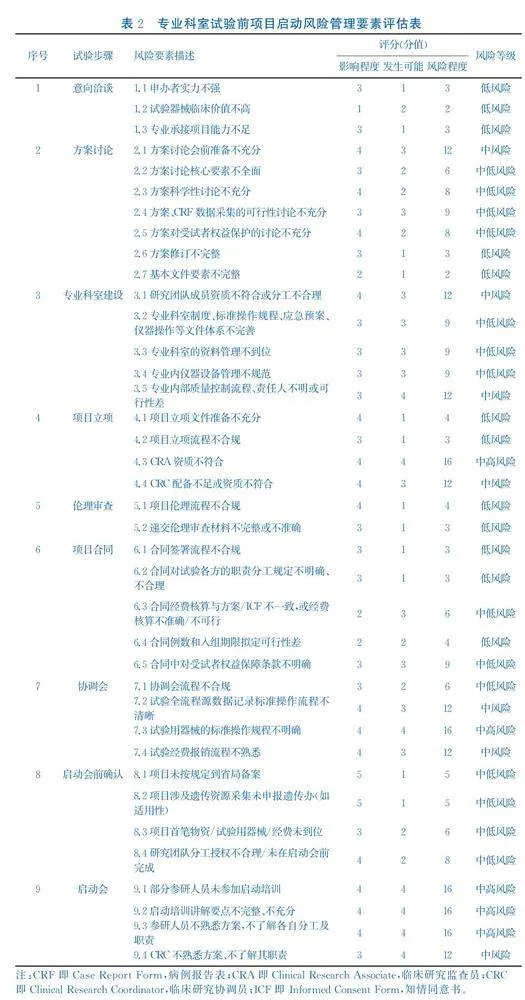
从项目启动前的各环节遴选潜在的风险要素,确定38项,分别为:意向洽谈(3项)、方案讨论(7项)、专业科室建设(5项)、项目立项(4项)、伦理审查(2项)、项目合同(5项)、协调会(4项)、启动前确认(4项)、启动会(4项)。
1.3制订风险评估标准
采用定性分析方法,对风险事件的影响程度和发生可能性进行评估[13]。风险影响等级根据风险对试验质量和受试者权益造成的影响程度,设定5级;风险发生可能性也设定5级,赋值标准见表1。
利用风险评估矩阵表对风险的影响程度和发生可能性进行二维计算,确定各风险要素风险等级[14]。低风险(分值lt;5分),属于可承担风险,无需增加额外控制措施;中低风险(5分≤分值lt;10分),对潜在风险予以关注,必要时定期监测;中风险(10分≤分值lt;15分),对潜在风险予以关注及定期监测,必要时追加风险防控措施;中高风险(15分≤分值lt;20分),需制订规避或转移的风险防控措施,且优先安排实施;高风险(分值≥20分),需立即制订针对性风险措施,并建立风险发生应急预案。
1.4确定风险等级
根据评估标准和风险等级划分,对38项风险要素进行评估,结果(表2)显示:高风险0项;中高风险5项(13.16%);中风险7项(18.42%);中低风险14项(36.84%);低风险12项(31.58%)。经判定,该专业科室项目启动前风险整体评估为中风险。
2风险管控策略
根据启动前各要素的风险等级,针对中高风险、中风险和中低风险事件,制订预防或控制措施。
2.1中高风险事件
制订规避或转移的风险措施,且优先实施。具体如下:
2.1.1" 建立项目启动会管理机制" " " 构建项目启动会从筹备到组织实施再到效果评价的全周期管理流程,主要包括会前准备(明确人员分工、培训要素、试验记录内容和器械管理等操作规程)、培训模式和考核机制。人员培训是启动会重要内容之一。培训内容包含试验相关标准操作规程和人员岗位职责的专题培训,以及入排标准、源数据采集记录、不良事件、器械缺陷的处理及报告等。除申办者和主要研究者进行试验方案及药品临床试验管理规范内容的培训外,机构质控员还需对研究团队进行项目质控要点培训。培训模式不局限于理论授课,还可采取情景模拟、答疑互动等多种形式,以提高培训效果。培训结束后,由机构人员组织现场考核,评估研究团队对培训要点的掌握情况,考核不通过者,持续进行培训,直至全员通过。
2.1.2建立试验用器械管理与使用标准操作规程" "针对各项目试验用器械的流通环节,建立从接收、存储、发放、使用、回收、维修校验等全流程管理的标准操作规程,确保试验用器械质量;建立试验用器械培训体系,必要时采用学习曲线,确保器械规范操作,最大程度降低试验操作风险;建立试验用器械质量控制标准、不良事件监控以及应急预案,确保器械使用安全、有效。机构办建立器械标准管理要素[15],由申办者提供基本要求,研究者从专业角度细化,机构办进行完善。
2.1.3建立CRA考核准入制度 CRA考核准入制度设置为百分制,考核内容包括专业知识(60分)、面谈考评(30分)、既往参研项目情况(10分)。考核及格者(≥60分)方能备案。无工作经验者即使考核通过,仍需申办者配备资深CRA在项目初期从旁协助。
2.2中风险事件
定期监测潜在风险,必要时采取风险防范措施。将风险主题列入本年度工作计划。具体措施如下:
2.2.1建立协调会管理机制" " " "协调会管理内容包括落实会前文件准备、会议各方协调事项、文件的修改跟踪和成文发布。协调会是机构针对试验记录、试验用器械管理以及财务报销三大环节进行模拟演练以及操作标准确认的环节,最终须通过文件发布将标准推广至各岗位职责人员。作为试验实施的操作部门,专业科室需配合做好协调会论证工作,从实践性、可行性、科学性等方面提出专业意见。文件终版经主要研究者、申办方和机构办三方确认后发布,并在启动会上进行培训,确保研究人员明确相关操作和流程。
2.2.2强化专业科室建设" " " 重视研究团队培养,尤其是专业秘书、研究者和研究护士骨干,通过药品临床试验管理规范专题培训、院外参观学习交流等,打造专业研究团队。强化研究团队成员对风险的预估、评价与管控意识,严格落实专业内部质控,将风险管理融入临床试验专业建设理念中。
2.2.3 建立CRC准入及定期考评制度" " "由机构办建立CRC考核准入制度、年度考评制度及定期培训制度,专业科室配合做好CRC管理,要求试验开展期间CRC及时到岗,增强CRC对研究团队及科室的归属感,确保临床试验质量的可靠性和规范性,尽量避免CRC频繁更换。
2.3中低风险事件
对潜在风险予以关注,必要时定期监测。将风险主题列入下一年度工作计划。具体措施如下:
2.3.1多方参与方案讨论" " "研究者作为制订试验方案的主体之一, 应掌握与临床试验相关的法律法规和专业知识,积极参加器械临床试验方案设计相关培训,与业内同仁进行交流讨论,提高对方案科学性、可行性及伦理性的考量能力。此外,进行方案讨论时,除申办者、研究者、统计学专家外,还可邀请经验丰富的机构办人员共同参与,这有助于完善试验方案细节,提升设计质量,减少实施过程中质量问题的发生[16]。
2.3.2启动会前各环节确认" " " 组织专业质控员参加医疗器械法规、医疗器械临床试验现场检查核查等培训,了解项目启动前的法规要求、现场检查常见的问题等,以提高对风险的辨识度、敏锐度。此外,质控员要及时进行启动前质控,确保项目启动前各环节均符合法规和本机构制度文件要求。
2.3.3完善制度文件体系" " "由主要研究者指定专人负责审核科室制度文件,根据法规要求,按标准操作规程修订文件,并定期更新,以满足临床试验实际需求。通过组织科室内部培训,加强团队成员对相关管理制度和标准操作规程的熟悉度和依从性,确保资料和仪器设备管理符合要求,也可制订相应的奖惩措施以提高相关人员的责任心。
2.3.4加强合同条款审核" " "机构提供医疗器械临床试验合同模板,申办方可在此基础上进行拟定。经费核算方面,需明确受试者补助的核算标准,重点审核合同约定和试验方案的一致性,必要时可签署补充条款。
3效果评价
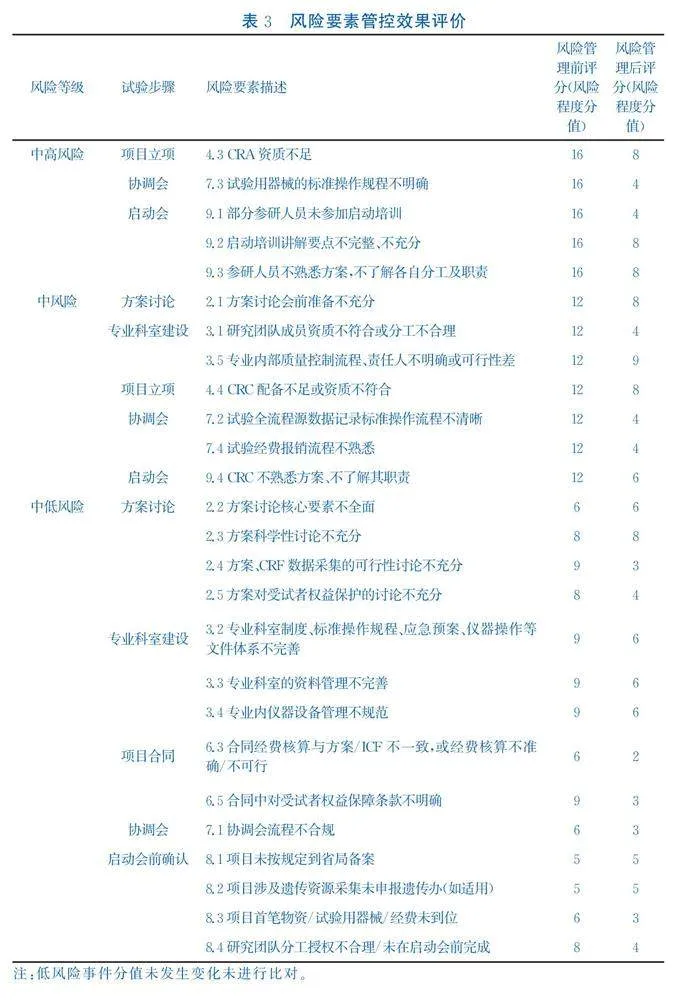
风险管控策略实施一年后,风险管理小组进行了新一轮风险评估。通过上述防范措施,中高风险事件的5个风险要素风险等级降至中低风险或低风险;中风险事件的7个风险要素风险等级降至中低风险或低风险;中低风险事件中,14个要素中71.4%风险程度赋值降低,50%要素的风险程度降至低风险。风险要素管控效果见表3。专业科室项目启动前风险整体评估降为低风险,含中低风险14项(36.84%)、低风险24项(63.16%),风险管控效果明显。
4讨论
本研究聚焦医疗器械临床试验启动前各环节,利用风险管理理念对风险要素进行识别、分析与评价,根据风险等级制订风险管控策略,落实并跟踪评估,持续优化改进,最终形成了医疗器械项目启动前的风险管理体系,实现了项目启动前规范化管理。风险管理可将临床试验风险事件由事后控制转变为事前预防、事中监管,有效保障了试验质量和受试者权益。程毅等[17]总结医疗器械临床试验全流程中存在的问题,结合实际制订了降低风险的具体措施,但未提供风险评价标准。本研究对风险进行量化评估,确定风险等级以及风险防范措施的优先顺序,可执行性更强。
本研究在实施过程中发现,伦理审查中的风险要素识别还不够全面,缺少项目伦理审查要素和知情同意审查要素。例如,该机构某专业科室承接的医疗器械临床试验,启动后才发现知情同意书中受试者随访计划和试验方案中描述不一致;某项可能涉及特殊人群(昏迷患者)的器械临床试验,入组时才发现试验方案未明确该类人群是否可以参加该项临床试验。医疗器械临床试验方案设计不同于药物临床试验,临床评价较多为主观指标,且通常无法达到双盲状态,方案设计比药物临床试验难度大,伦理审核过程中,需在受试者知情同意的前提下,充分考虑受试者的受益风险[2,17]。因此建议:一是风险管理小组纳入1名~2名经验丰富的伦理委员,重点梳理项目启动前伦理审查相关风险要素;二是对伦理委员加强专业审查能力培训。伦理委员可联合统计学专家在临床试验启动前期阶段介入试验方案,制订和运行管理流程优化过程,以提高伦理审查效率和质量[18]。同时,伦理审查过程中,还需加强生物样本采集利用的风险评估和受试者隐私泄露的风险评估,对于器械使用的风险需要重视动物试验、探索性预试验和同类产品临床研究结果的对比分析,对于发生的不良事件/严重不良事件应重点讨论;对于存在学习曲线的医疗器械,需要研究者在试验开展前通过模拟操作或动物试验熟悉器械操作,完成学习曲线后再进行试验,以确保临床试验操作规范[19]。
本研究实施过程还发现,风险评估主要围绕试验流程的系统性风险,并没有纳入对器械自身的风险和器械使用的风险[19-20]。对此,需细化或增加相关风险要素,制订相应的处理措施,并监督落实;定期完善风险管理要素评估表,持续优化风险管控策略。
参考文献
[1]国家药品监督管理局,国家卫生健康委.关于发布《医疗器械临床试验质量管理规范》的公告:2022年第28号[EB/OL]. (2022-03-31)[2024-03-31].https://www.nmpa.gov.cn/xxgk/fgwj/xzhgfxwj/2 0220331144903101.html.
[2]王 健,冯巧巧,刘珊珊.医疗器械临床试验风险管理思考与建议[J].中国药事,2024,38(3):292-297.
[3]赵同香,马丽萍,庞 华,等.医疗器械临床试验立项审查环节质量分析及防范策略[J].中国卫生质量管理,2024,31(2):76-79.
[4]吴建元,蔡君龙,陈 博,等.医疗器械临床试验方案设计要点探讨[J].医疗卫生装备,2020,41(2):65-69,86.
[5]潘辛梅,李明红,谢江川,等.医疗器械临床试验中发现的问题及改进措施[J].医疗卫生装备,2021,42(6):75-78,83.
[6]李文适,陈文华,李 强,等.国内医疗器械临床试验现状的分析[J].中国临床药理学杂志,2019,35(19):2448-2451.
[7]程晓华,余路易,白 薇,等.基于风险管理策略的药物临床试验质量管理[J].医药导报,2022,41(4):584-587.
[8]王永芳,宋梅宁,李博洋.基于风险的临床试验质量管理[J].中国临床药理学与治疗学,2020,25(10):1195-1200.
[9]药监局综合司.关于印发医疗器械临床试验检查要点及判定原则的通知:药监综械注〔2018〕45号[EB/OL]. (2018-11-28)[2024-03-31].https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjylqx/20181128 142501830.html.
[10]食品药品监管总局. 关于开展医疗器械临床试验监督抽查工作的通告:2016年第98号[EB/OL]. (2016-06-08)[2024-03-31].https://www.nmpa.gov.cn/xx gk/ggtg/ylqxggtg/ylqxqtggtg/201606081848 01181.html.
[11]李 佳,梁新华,王 琪,等.从监督抽查结果解析医疗器械临床试验准备阶段的常见问题[J].中国新药与临床杂志,2021,40(12):822-826.
[12]张正付,王佳楠.医疗器械临床试验数据真实性和完整性的监督检查[J].中国临床药理学与治疗学,2019,24(10):1081-1084.
[13]汶 柯,柴 栋,王 瑾,等. 基于风险的药物临床试验机构文档规范化管理探讨[J]. 中国新药杂志,2018,27(24):2916-2921.
[14]刘红艳,董黎娜.基于风险的医疗器械临床试验实施的规范化管理[J].医疗装备,2024,37(5):55-59.
[15]陈 博,吴建元,胡汉宁,等.临床试验用医疗器械管理模式的探讨[J].中国医疗器械杂志,2020,44(1):88-91.
[16]谭 琴,李庆娜,肖梦丽,等.从质量控制角度探讨中药新药临床试验设计中的问题与解决措施[J].中国新药杂志,2024,33(8):805-809.
[17]程 毅,李丽华,布格拉·米吉提,等.基于风险的医疗器械临床试验伦理审查和质量管理[J].中国医学伦理学,2021,34(3):314-318,327.
[18]李红英,蒋 辉,贺 苗,等.伦理再前置提高临床试验伦理审查效率和质量的研究[J].中国医学伦理学,2021,34(11):1436-1441.
[19]杨千粟,白 楠,曹 江,等.医疗器械临床试验开展前的风险评估[J].中国医学伦理学,2023,36 (8):834-839.
[20]朱丹丹,夏慧琳,王学军,等.内蒙古某三甲医院临床试验医疗器械使用安全现状分析[J].中国卫生质量管理,2023,30(2):81-84.
通信作者:
郭晋敏:中国人民解放军联勤保障部队第九六〇医院临床药学科副主任药师
E-mail:gjm90h@126.com
收稿日期:2024-03-29
修回日期:2024-06-14
责任编辑:黄海凤
