基于转录组学解析苗期高粱对干旱胁迫的生理代谢响应
2024-12-31江佰阳白文斌

关键词: 高粱; 干旱胁迫; 生理代谢; 转录组分析
干旱是限制作物生产力的重要非生物因素之一[1],严重制约农业可持续发展。干旱胁迫可以使植物叶片干枯萎缩、降低相对含水量、增加活性氧自由基和丙二醛含量,进而发生膜脂过氧化,导致植物氧化损伤甚至死亡[2];同时也会改变植物对营养物质的利用,对植物体内养分含量产生影响[3]。为了应对干旱,作物会对基因表达进行重新编程,进而调节许多生理生化过程,这些变化不仅发生得快,而且根据组织类型、发育阶段和应激条件而具有特异性[4]。高粱是我国北方干旱和半干旱地区的主要农作物之一[ 5 ],具有较高的水分利用效率和较强的抗旱性,其生长易受干旱影响,且不同品种间的抗旱性差异较大[6]。以往研究显示,苗期是作物群体建成的关键时期[7],苗期的干旱胁迫对高粱的产量和成熟度都会产生影响。目前,高粱抗旱相关研究多集中在干旱胁迫处理前后其形态结构及生理指标的变化[8],其抗旱分子机制研究起步较晚[9]。探究干旱条件下高粱的基因表达模式,分析抗旱代谢途径,对加快高粱抗旱品种选育、促进干旱地区高粱生产具有重要作用。
转录组测序在研究作物不同环境条件下、不同生长发育阶段的基因表达模式方面具有明显优势[10],利用其解释抗旱过程内在基因变化规律和机制已经成为作物抗旱机制研究的有效手段,在玉米[11−12]、小麦[13−15]、水稻[16−19]、谷子[20−24]等作物的抗旱性研究中得到广泛应用,大量与干旱响应相关的基因和代谢途径被发现。玉米幼苗耐旱性较强的主要原因是渗透调节和细胞壁相关基因的差异表达[25],光合作用―天线蛋白、光合生物的固碳作用、卟啉和叶绿素代谢、精氨酸和脯氨酸代谢、脂肪酸降解、磷酸肌醇信号等途径可能是其抵御干旱胁迫的主要代谢途径[26];谷子干旱胁迫后的差异表达基因主要富集在氨基酸生物合成、蔗糖代谢和光合作用等代谢通路中[27],编码蛋白激酶、磷酸酶、信号转导组分、转录因子、功能蛋白等基因的表达发生了较明显的变化[24],SiSLC、SiFBA5 和 SiBT4 对谷子的抗旱性可能起到负调控作用[26];水稻抗旱的主要转录因子[28]为碱性亮氨酸拉链(bZIP)、NAC、DREB/CBFs、Znf (Zincfinger) 蛋白、MYB 和 HSP 转录因子等;小麦的主要抗旱基因[29]包括转录因子类基因、LEA 蛋白基因、信号转导相关基因、代谢调节相关基因、氧化调控相关基因等。近年来,为了更好地理解高粱干旱胁迫响应的分子机理,提高高粱的耐旱性,利用转录组测序技术对高粱抗旱的分子机制也进行了初步探讨。Abdelghany 等[30]选择了4 个抗旱性不同的高粱材料开展转录组分析,发现在干旱胁迫前期,敏感性和耐旱性材料的胁迫响应差异基因以及不同材料之间耐旱差异基因中,上调基因数目均大于下调基因数目。王玉斌等[4]对2 个抗旱性不同的高粱材料在24 h 内的6 个时间点进行了转录组分析,表明次生代谢物生物合成中的苯丙素生物合成和渗透保护中的氰基氨基酸代谢可能是高粱耐旱性的主要代谢通路。何欢[31]对PEG 处理6 h 后的高粱幼根和幼叶进行转录组分析,在根和叶中分别得到8256 和4214个差异表达基因,基于KEGG 的富集分析表明,高粱根和叶对干旱胁迫的敏感度不同,差异基因富集的通路也不相同,根中差异表达基因富集的通路为谷胱甘肽代谢和类固醇激素生物合成,叶中富集的通路为植物激素转导和MARK 植物信号。此外,在对甜高粱的研究中发现,植物激素信号转导(planthormone signal transduction)、氨基糖和核苷酸糖代谢(amino sugar and nucleotide sugar metabolism)、酪氨酸代谢(tyrosine metabolism) 与甜高粱响应干旱胁迫具有良好的相关性[32];可溶性糖在甜高粱幼苗抵御干旱胁迫中发挥重要作用,甜高粱通过激活与干旱胁迫相关的蛋白表达和与碳水化合物相关的基因表达而增强渗透调节能力来响应干旱胁迫[33]。转录组测序技术虽然在筛选抗旱性不同高粱材料的差异表达基因、分析抗旱代谢通路、鉴定高粱响应干旱胁迫应答基因及特性方面有一定的研究基础,但是关于高粱干旱胁迫后生理代谢与转录组的相关性分析较少。本研究以高粱为试验材料,结合不同高粱材料苗期干旱—复水后的生存情况,选择存活率高的材料进行生理指标检测、氮磷钾含量测定及转录组测序分析,通过基因的差异表达分析、GO 功能注释和Pathway 分析等,挖掘抗旱相关基因,分析差异表达基因参与的代谢途径,解析高粱在干旱条件下的分子应答机制,为高粱抗旱育种提供理论指导与技术支撑,为高产栽培提供更多的遗传资源。
1 材料与方法
1.1 试验材料及抗旱材料鉴选
前期采用反复干旱法对50 份苗期抗旱性不同的高粱材料进行抗旱性鉴定,以全部存活为筛选标准,获得苗期抗旱性强的高粱材料1 份(TX-625B),对其开展生理指标检测、养分含量及转录组测序研究。
1.2 抗旱生理指标检测
1.2.1 胁迫处理和样品采集 试验采用水培方式,种子消毒后摆放在培养皿中,加蒸馏水,在昼/夜温度为28℃/20℃、光照14 h 条件下培养;待长至三叶一心,用滤纸吸干培养皿中水分,根据前期预试验,加入20 mL 浓度为25% 的PEG-6000 溶液对其进行干旱胁迫处理;分别剪取胁迫处理0、12、24 h的幼苗叶片进行生理指标检测和氮磷钾含量的测定,每个处理3 次重复。
1.2.2 抗氧化物酶活性和丙二醛活性的测定 采用南京建成生物试剂盒测定样品的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶活性(CAT)和丙二醛的含量(MDA)。
1.2.3 氮、磷、钾含量测定 将叶片105℃ 杀青,70℃ 烘至恒重称取生物量。用全自动凯氏蒸氮仪测定植株N 含量;用1∶3 浓HClO4 和浓HNO3 消煮,钒钼黄法紫外分光光度计测定全P,火焰光度计测定全K。
1.3 抗旱转录组测序
1.3.1 转录组样品 分别取25% 的PEG-6000 溶液胁迫处理0、12、24 h 的植株叶片进行转录组测序。
为保证试验的准确性,每个处理多植株混合取样,分别提取RNA,每个样品设3 次生物学重复,转录组样品设3 个比较组,分别为0 h vs 12 h、0 h vs 24 h、12 h vs 24 h。
1.3.2 总RNA 的提取及测序数据分析 采用Trizol(Invitroge) 试剂提取样品的总RNA。利用琼脂糖凝胶电泳、Nano Drop N、Agilent 2100 Bioanalyzer检测RNA 样品的降解度、纯度、浓度以及样品的完整度。转录组测序由派森诺生物科技有限公司完成。测序后数据经过过滤、比对后,以FPKM (fragmentsper kilobase of transcriptper million fragments mapped)≥1 为标准筛选有效表达基因。根据基因在不同胁迫时间下的表达量进行差异表达分析、差异表达基因功能注释和功能富集分析,挖掘参与高粱干旱胁迫的关键基因及其调控途径。
1.3.3 差异表达基因的筛选 通过将样品数据进行两两比较从而筛选差异表达基因,采用D E S e q对基因表达进行差异分析, 在分析过程中将foldchange≥2 且FDRgt;0.01 作为筛选标准。差异倍数(fold change) 表示两个样品间表达量的比值。错误发现率(1 discovery rate,FDR) 是通过对差异显著性P 值(P-value) 进行校正得到的。采用了公认的Benjamini Hochberg 校正方法对原有假设检验得到的显著性P 值(P-value) 进行校正,最终以FDR 作为差异表达基因筛选的关键指标。
1.3.4 差异表达基因GO 和KEGG 富集分析 将差异表达基因GO (Gene Ontology,http://www.geneontologyorg/,基因本体论) 数据库进行比对,进行基因功能富集分析。分析时利用GO term 注释的差异基因对每个term 的基因列表和基因数目进行计算,通过超几何分布方法计算P-value,Plt;0.05 被认为是显著富集,找出与整个基因组背景相比,差异基因显著富集的GO term,从而确定差异基因行使的主要生物学功能。
将差异表达基因与KEGG (kyoto encyclopedia ofgenes and genomes,http://www.genome.jp/kegg/,京都基因和基因组百科全书) 数据库进行比对,以KEGG数据库中Pathway 为单位进行显著性富集分析。应用超几何检验,找出与参考基因组背景相比,在差异表达基因中显著性富集的Pathway。以P-value 为筛选标准,Plt;0.05 表示差异基因在该Pathway 中富集显著,找出与DEGs 显著相关的代谢通路。
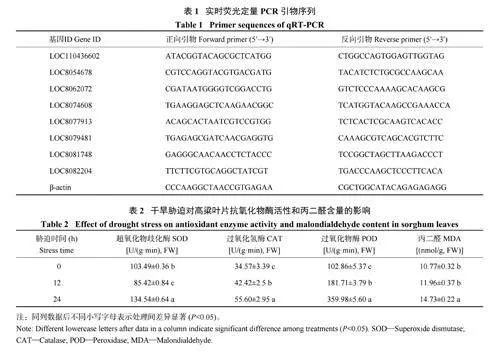
1.3.5 实时荧光定量PCR 验证 为了验证转录组测序差异表达基因表达趋势的准确性,从测序获得的差异表达基因中随机选取8 个进行qRT-PCR 分析,对测序结果的可靠性进行验证。qRT-PCR 验证由南京派诺森科技有限公司完成,运用Primer 5.0 软件设计引物(表1) 并合成,以β-Actin 为内参基因,每次试验设置3 次生物学重复和3 次技术重复。采用2−△△ct 方法分析数据,计算基因的相对表达量。
2 结果与分析
2.1 不同胁迫时间对高粱幼苗叶片抗氧化酶活性和丙二醛含量的影响
不同干旱胁迫时长对高粱幼苗的生理指标产生了影响,叶片的抗氧化酶活性和丙二醛含量均有不同程度的改变(表2)。干旱胁迫24 h 之内,随着胁迫时间的延长,CAT 和POD 的活性呈现逐渐升高的趋势,SOD 活性呈现先降低再升高的趋势,最终均保持了较高的SOD、POD 和CAT 活性;MDA 含量随着胁迫时间的延长逐渐升高,但其升高幅度较小。过氧化物酶和过氧化氢酶均具有较强的清除自由基能力,可以及时清除体内过量的活性氧和过氧化氢,降低外界胁迫对植物造成的损伤,其含量的迅速增加与材料本身的抗旱性正相关,抗旱材料可以通过调节叶片的保护性酶活性来抵御干旱;活性氧代谢产物MDA 在叶片中的积累量较小,该材料具有较强的抗旱性。
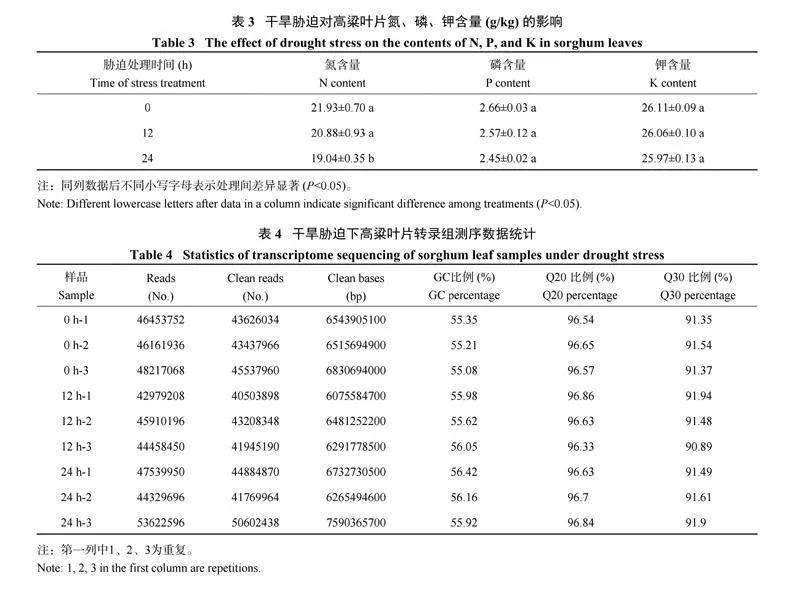
2.2 不同胁迫时间对高粱幼苗叶片氮、磷、钾含量的影响
干旱胁迫降低了高粱幼苗叶片氮、磷、钾的含量(表3),但3 种元素含量降低的程度不同。与对照(0 h) 相比,胁迫12 h 时叶片内氮、磷、钾含量均未发生显著变化,胁迫24 h 时,氮含量显著低于对照0 h,磷、钾含量变化不显著。说明短期的干旱胁迫会影响叶片氮、磷和钾含量, 其中对氮含量影响较为明显。
2.3 转录组测序数据质量分析及与参考基因组比对结果统计
通过转录组测序, 0、12、24 h 3 个不同胁迫时间9 个样本共得到54G 的数据量,每个样本的数据量均为6G。运用数据质量控制程序对转录组测序结果进行分析(表4),把过滤后的数据映射到参考基因组数据中,得到41769964~50602438 条cleanreads 数据,Q30 碱基的分布比例为91.35%~91.94%,G、C (鸟嘌呤和胞嘧啶) 含量在55.08%~56.42%,样本的各项指标数据说明高粱叶片测序数据质量良好,准确率较高,有利于后续的数据分析。
2.4 高粱叶片干旱胁迫的差异表达基因筛选
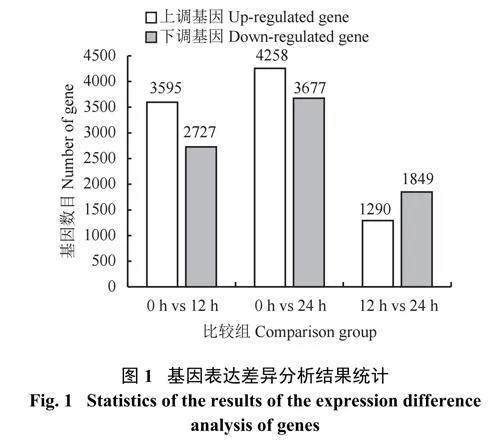
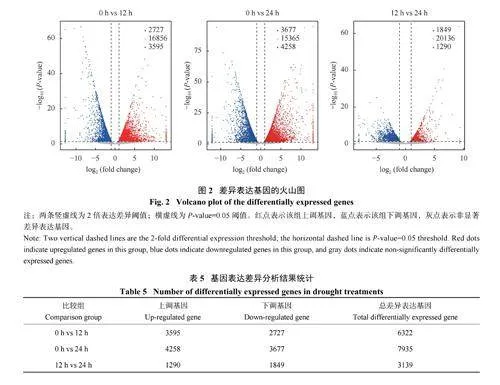
对0、12、24 h 3 个胁迫时间的转录样本信息分别进行两两对比分析,共得到17396 个差异表达基因(图1、图2 ), 包括8 2 5 3 个上调表达基因和9143 个下调表达基因(表5)。3 个比较组0 h vs12 h、0 h vs 24 h、12 h vs 24 h 分别得到6322、7935、3139 个差异表达基因,其中上调表达的基因数量分别为3595、4258、1290 个;下调表达的基因数量分别为2727、3677、1849 个。干旱胁迫24 h 内差异表达基因数目迅速增加,且上调表达的基因数目较多,表明持续的干旱胁迫引起了高粱叶片基因表达的变化,胁迫时间越长调控过程越复杂,更多特定的信号传导机制被激活,更多特异性差异表达基因参与到表达调控中来;在高粱抵御干旱胁迫的过程中上调表达基因和下调表达基因均发挥了重要作用。
2.5 抗旱相关差异表达基因的功能分析
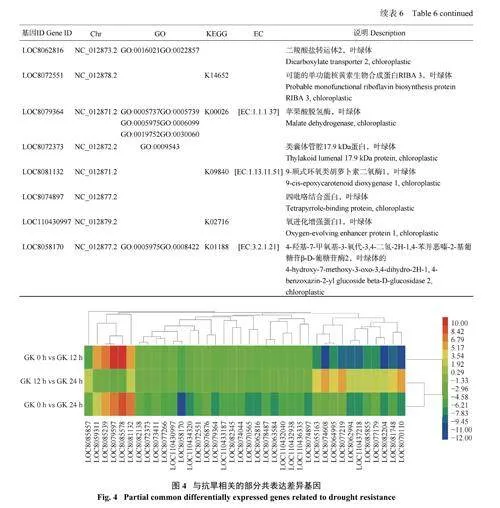
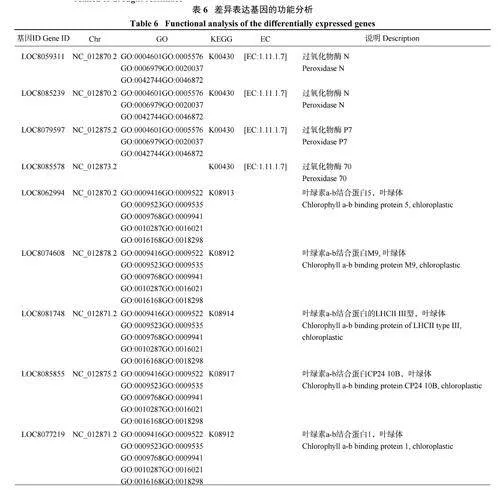
干旱胁迫条件下,高粱的耐旱性强弱在很大程度上取决于抗旱材料自身的差异表达基因。分析不同干旱胁迫时段幼苗的基因表达变化(图3) 发现,3 个比较组中有985 个基因是不同干旱胁迫时间下所共有的,这些基因可以作为高粱响应干旱胁迫的核心差异表达基因。对985 个差异表达基因进行聚类分析,从中选择152 个差异表达最显著的重叠基因,结合对苗期高粱抗旱基因功能的综合分析,筛选到在高粱苗期抗旱分子应答中起着关键作用的几类基因:过氧化物酶基因4 个,叶绿素a-b 结合蛋白基因8 个,光系统蛋白基因7 个,与叶绿体相关的其他酶和蛋白基因19 个(表6、图4)。
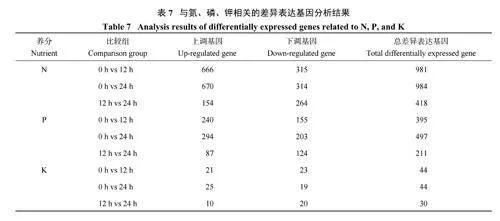
2.6 干旱胁迫下与氮、磷、钾相关差异表达基因分析
干旱胁迫会影响植物体内氮、磷、钾含量,对不同干旱胁迫时间幼苗的基因表达变化进行分析发现,0 h vs 12 h、0 h vs 24 h、12 h vs 24 h 与氮相关的差异表达基因分别为981、984、418 个,其中上调表达的基因数分别为666、670、154 个,下调表达的基因数分别为315、314、264 个;与磷相关的差异表达基因分别为395、497、211 个,其中上调表达的基因数分别为240、294、87 个,下调表达的基因数分别为155、203、124 个;与钾相关的差异表达基因分别为44、44、30 个,其中上调表达的基因数分别为21、25、10 个,下调表达的基因数分别为23、19、20 个(表7)。胁迫24 h 与胁迫12 h 相比,3 种元素的差异表达基因数目均减少,且上调表达基因数目减少,下调表达基因数目增加,说明在没有外部营养物质摄入的情况下,持续的干旱胁迫引起叶片氮、磷、钾基因表达的变化。
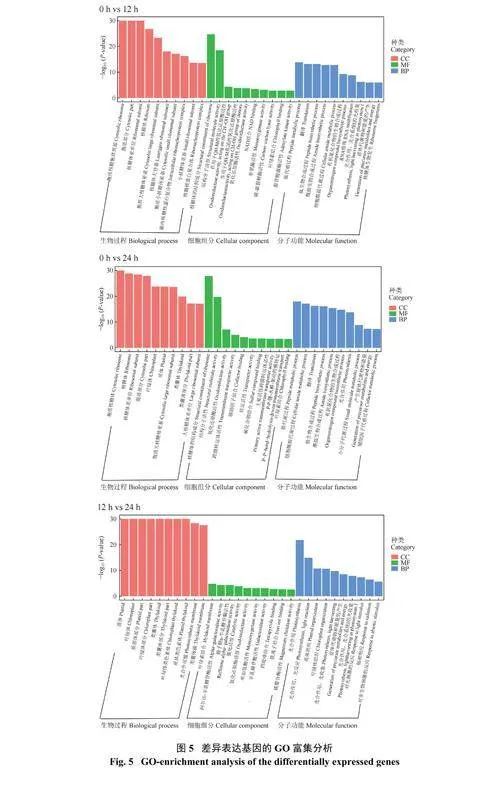
2.7 差异表达基因的GO 分析
对差异表达基因进行GO 分析,3 个比较组共获得12185 个GO 注释条目,注释到的差异表达基因分为生物过程(BP)、分子功能(MF) 和细胞组分(CC) 3 个方面(图5)。与对照相比,不同胁迫时间节点在这3 个方面均存在较大差异,其中注释到生物过程(占比60%) 和分子功能(占比29%) 中的差异表达基因较多,注释到细胞组分中(占比11%) 的最少。注释到生物过程中的差异表达基因主要富集在物质的转运、细胞过程、代谢过程等途径中;与分子功能相关的差异表达基因主要富集在结合、催化活性等方面,包括结构分子活性和核糖体活性等;注释到细胞组分中的以细胞器(包括叶绿体、质体、类囊体等)、细胞成分等富集的差异表达基因数目较多。
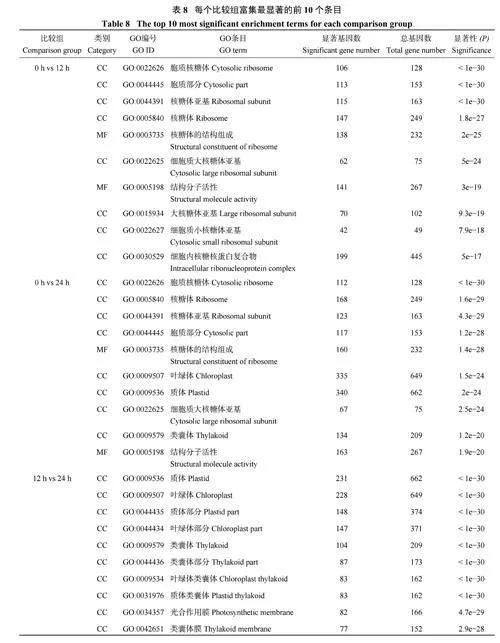
对每个比较组富集最显著的前10 个GO 条目进行分析(表8),随着胁迫时间的延长,3 个比较组在细胞组分中富集的差异表达基因越来越多。0 h vs12 h 和0 h vs 24 h 富集前10 的条目包括细胞组分和分子功能两个方面,0 h vs 12 h 富集前10 的途径主要包括3 类:1) 胞质核糖体,包括核糖体的结构组成、核糖体大小亚基;2) 结构分子活性;3) 细胞内核糖核蛋白复合物。0 h vs 24 h 富集前10 的途径主要包括:1) 胞质核糖体,包括核糖体的结构组成、核糖体大小亚基;2) 结构分子活性;3) 叶绿体、质体、类囊体。12 h vs 24 h 富集最显著的途径均为细胞组分,其中较多的差异基因富集到叶绿体、类囊体和光合作用途径中,可分为两类:1) 叶绿体、质体、类囊体;2) 光合作用膜。将3 个比较组富集前10 的条目进行比较发现,随着胁迫时间的深入,其富集的主要途径由核糖体和结构分子活性转变为叶绿体和光合作用膜,干旱胁迫下光合作用途径可能是调节植物耐旱性的重要原因。
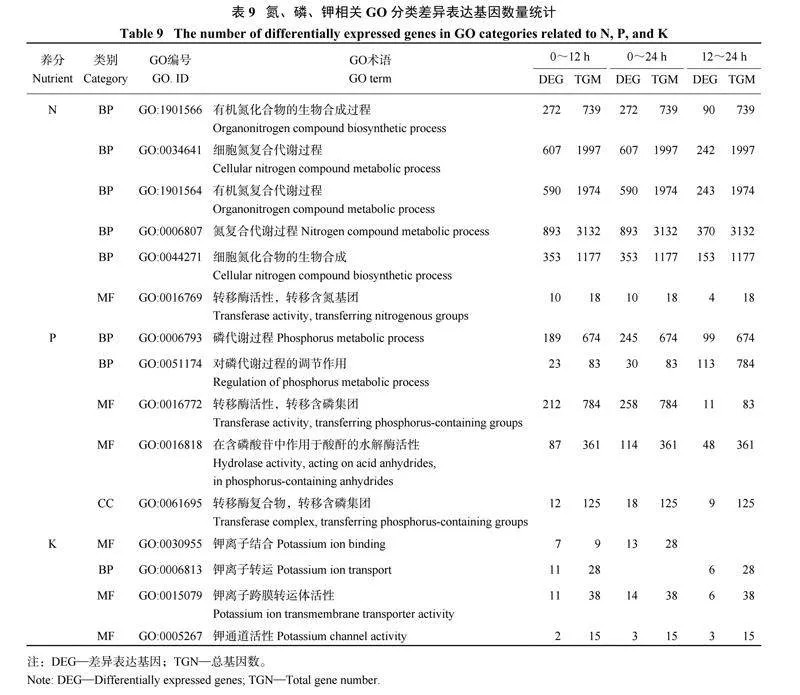
对与氮、磷、钾相关的差异表达基因进行GO分析(表9) 显示,与氮相关的差异表达基因共注释到33 个GO 条目中,分别注释到生物过程(21 条) 和分子功能(12 条) 两个方面,注释到生物过程中的差异基因数目较多,主要富集在有机氮化合物的生物合成过程、细胞氮复合代谢过程、有机氮复合代谢过程、氮复合代谢过程、细胞氮化合物的生物合成工艺等途径中,与分子功能相关的差异表达基因数目很少,主要富集在酶活方面,包括磷酸转移酶活性、水解酶活性等;与磷相关的差异表达基因富集到8 条GO 途径中,分别注释到生物过程(4 条)、分子功能(3 条) 和细胞组分(1 条) 3 个方面,注释到生物过程中的差异表达基因主要富集在磷代谢过程途径中,与分子功能相关的差异表达基因主要富集在转移酶活性(转移含磷集团)、作用于酸酐的水解酶活性方面,注释到细胞组分的主要富集在转移酶复合物方面;与钾相关的差异表达基因注释到包括生物过程(7 条) 和分子功能(6 条) 在内的13 条GO 途径中,但每条途径中注释到的差异表达基因数目很少,注释到生物过程的主要为钾离子转运,注释到分子功能的主要为钾离子结合和钾离子跨膜转运体活性。
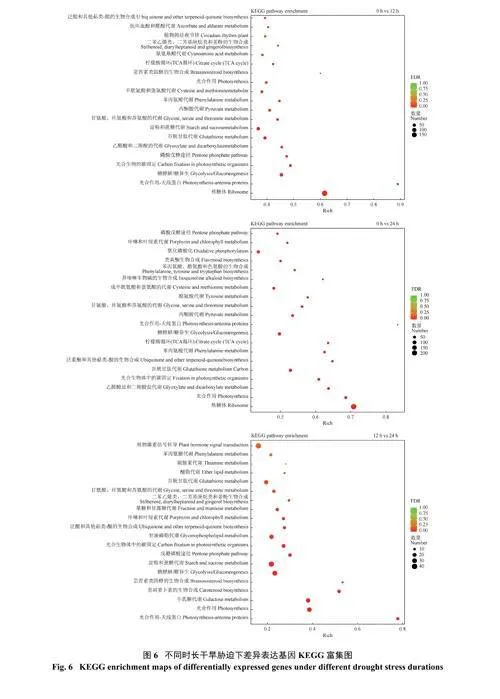
2.8 KEGG 通路富集分析
通过KEGG 富集分析(图6) 发现,3 个比较组0 h vs 12 h、0 h vs 24 h、12 h vs 24 h 分别鉴定到122、126 和115 条代谢通路,主要以氨基酸代谢(amino acid metabolism)、光合作用(photosynthesis)、磷酸戊糖途径(pentose phosphatepathway)、糖酵解/糖异生(glycolysis /gluconeogenesis) 为主。干旱胁迫对高粱的氨基酸代谢、次生代谢产物生物合成、糖类和脂类代谢均有较大的影响。对每个比较组富集最显著的前20 代谢通路进行分析发现,3 个比较组均在氨基酸和肽代谢(amino acid metabolism)、光合作用(photosynthesis) 和糖代谢(glycometabolism) 途径具有显著富集。3 个比较组中均富集最显著的氨基酸和肽代谢途径有3 条:甘氨酸、丝氨酸和苏氨酸的代谢,丙酮酸代谢,谷胱甘肽代谢;光合作用途径有3 条:光合作用,光合作用―天线蛋白,光合生物中的碳固定;糖代谢途径有两条:糖酵解/糖异生,磷酸戊糖途径。12 h vs 24 h 和0 h vs 12 h 相比,随着胁迫时间的延长,光合作用途径中增加了卟啉和叶绿素代谢途径;氨基酸代谢富集途径逐渐减少:0 h vs 12 h 氨基酸代谢途径为甘氨酸、丝氨酸和苏氨酸的代谢,丙酮酸代谢,苯丙氨酸代谢,半胱氨酸和蛋氨酸的代谢,氰氨基酸代谢,胁迫12 hvs 24 h 其氨基酸代谢途径为甘氨酸、丝氨酸和苏氨酸的代谢,丙酮酸代谢;谷胱甘肽代谢的富集显著性随着干旱时间的延长逐渐增强;糖代谢途径逐渐增多,增加了半乳糖代谢、果糖和甘露糖代谢途径。这些代谢通路的富集变化与高粱叶片干旱胁迫相关:干旱胁迫早期主要以光合作用和氨基酸代谢为主,干旱胁迫后期主要以糖代谢和光合作用为主。这些相同的代谢途径表明,干旱胁迫下氨基酸代谢途径、光合作用途径和糖代谢途径等可能是抗旱品种具有较强抗旱调节能力的重要原因,作物可以靠调节这些代谢途径的富集显著性来增加自身的抗旱性,提高在干旱胁迫下的存活几率。
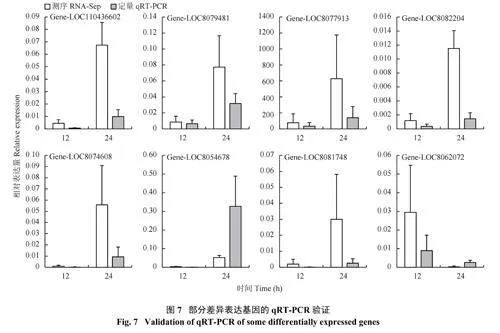
2.9 实时荧光定量PCR 验证
随机挑选8 个差异表达基因对转录组数据进行qRT-PCR 验证,通过转录组测序结果和 qRT-PCR 分析结果比较可以看出,这些基因的相对表达量和转录数据的基因表达模式基本一致(图7),说明转录组数据较为可靠。
3 讨论
3.1 干旱胁迫对苗期高粱生理指标的影响
在逆境胁迫下,植物体内会产生对自身有害的活性氧,一些抗氧化物酶及抗氧化物质具有清除活性氧的功能,使活性氧的产生与清除达到平衡状态,使植物抵抗逆境胁迫,维持正常生长[34]。在植物体的保护酶系统中,SOD 通过催化活性氧发生歧化反应产生无毒分子氧和过氧化氢[35],POD 和CAT 可清除植物体内多余的H2O2、降低植物逆境胁迫中细胞膜脂过氧化的程度。以往研究表明, 高粱以CAT 为主要抗氧化酶,同时具有较高的SOD 和POD 活性[9]。本研究中,在12 和24 h 的干旱胁迫下,幼苗叶片的抗氧化酶活性与对照(干旱胁迫0h) 相比均发生不同程度的改变,SOD 呈先下降再升高的趋势,POD 和CAT 的活性则呈持续升高的趋势,SOD 与CAT的活性在各个时段均发生了显著变化,而POD 的活性则在胁迫12 h 之后发生显著变化,24 h 时各抗氧化酶活性均保持了较高的水平,与以往研究结果相符。丙二醛含量的高低通常反映细胞膜过氧化损伤的程度和植物对逆境条件的抵抗能力[36]。谷胱甘肽是一种非酶促活性氧清除剂,其作用类似于抗氧化酶,可以清除干旱胁迫诱导的自由基和过氧化物。转录组结果显示,干旱胁迫24 h 之内,编码F8、U17、GSTF 和 GSTU 的差异表达基因均有上调表达,基因的表达调控谷胱甘肽的代谢,对于清除细胞代谢过程中累积的自由基,减轻细胞所受的干旱胁迫损伤具有重要作用。本研究中,因植株自身保持了较高的保护酶活性和谷胱甘肽活性,使丙二醛的积累量维持在一个相对较低的水平,因此降低了叶片的膜脂过氧化程度,减少了逆境条件给植物本身带来的伤害。由此可见,抗氧化物的积累是植物应对干旱胁迫的重要途径,对于植物抵抗干旱逆境带来的不利影响具有积极的效应。
3.2 干旱胁迫对苗期高粱氮、磷、钾含量的影响
氮、磷、钾均与植物的抗旱能力具有相关性。氮参与植物叶绿体、蛋白质和核酸等物质的构成,影响植物核酸和蛋白降解、酶活性、细胞代谢及光合性能等[37];磷素是叶绿体的主要组成成分,植物光合作用过程主要依赖磷和含磷化合物[38];钾离子作为最主要的渗透物质移动性强、再利用率高,能够促进叶绿素的合成和稳定,维持和调节干旱条件下的许多生理生化过程与代谢平衡之间的关系[ 3 9 ]。氮、磷、钾等可移动元素可以被植物体循环利用[40],本研究中,在没有外界营养物质摄入的情况下,幼苗叶片在经历12 和24 h 的干旱胁迫后,体内的氮、磷、钾含量均发生了改变,其中氮含量在胁迫24 h 时发生显著变化。氮素在植物体内主要以NO3−和 NH4+的形式存在,植物体内的NO3−需还原为NH4+才能被植物利用,NH4+在GS/GOGAT 途径分别被同化成谷氨酰胺和谷氨酸[ 4 1 ] , 这两种氨基酸可以为其他的氨基酸、核酸和其他含氮化合物(如叶绿素) 的生物合成提供氮素。本研究中,幼苗感受到干旱胁迫后,包括甘氨酸、丝氨酸和苏氨酸的代谢,苯丙氨酸代谢,半胱氨酸和蛋氨酸的代谢,氰氨基酸代谢,酪氨酸代谢和丙氨酸、酪氨酸及色氨酸的生物合成途径在内的氨基酸代谢途径发生了显著富集,认为干旱胁迫可能提高了NO3−还原为NH4+的速率,促进了谷氨酰胺和谷氨酸的合成,为氨基酸代谢提供氮素。谷氨酰胺和谷氨酸还可用于形成天冬氨酸和天冬酰胺,这4 种氨基酸共同完成有机氮的输送和转化[42]。本研究中与氮素相关的差异表达基因在有机氮化合物的生物合成过程、细胞氮复合代谢过程、有机氮复合代谢过程、氮复合代谢过程、细胞氮化合物的生物合成等途径中显著富集,认为幼苗在干旱胁迫下,可能通过调控有机氮的代谢和生物合成的基因表达来促进氨基酸的代谢,从而调节植物的抗旱性。磷和钾均与叶绿体的合成和光合作用有关,GO 分析显示,干旱胁迫下,与磷相关的差异表达基因在磷代谢过程、转移酶活性(转移含磷集团) 有显著富集;与钾相关的差异表达基因主要富集在钾离子转运、钾离子跨膜转运体活性等途径中,两种元素均在0 到12 h 富集的差异表达基因数目较多,12到24 h 富集的较少,这可能与光系统蛋白、与叶绿体相关的其他酶和蛋白在干旱胁迫的0 到12 h 上调表达,12 到24 h 下调表达有关,以此调节幼苗对干旱胁迫的适应性。
3.3 干旱胁迫对苗期高粱基因表达的影响
植物对干旱胁迫的响应是一个复杂的过程,包括生长状态、生理生化和分子水平的调节。植物通过这些调节机制来应对干旱造成的损害,以保证自身的正常生长发育,植物对干旱胁迫在生理水平上的响应,其机制在于干旱信号诱导下相应基因的表达及调控。不同干旱胁迫时间下,高粱幼叶差异表达基因共有17396 个,0 到24 h 差异表达的基因数目逐渐增加,对不同时段共表达的差异基因分析显示,其生物学功能主要富集过氧化物酶、叶绿素a-b结合蛋白、光系统蛋白、与叶绿体相关的其他酶和蛋白上。本研究中,过氧化物酶调控基因作为共表达基因在3 个比较组中的表达均具有显著差异性,与0 h 相比,12、24 h 均呈现上调表达,其表达促进了抗氧化酶及相关物质的产生,使过氧化物酶活性升高,从而抵抗引起活性氧生成的响应基因,提高活性氧清除能力,降低干旱胁迫对植物细胞的损伤。叶绿素是植物吸收太阳光能进行光合作用,将光能转变为化学能的主要色素[43]。本研究中,叶绿素a-b 结合蛋白1、4、5、M9、CP24 10B、1B-21,叶绿素a-b 结合蛋白LHCII III 型、LHCII I 型在3 个比较组中均为上调表达,叶绿素的生物合成过程需要酶的参与,过氧化物酶基因的上调表达和谷胱甘肽代谢途径的显著富集在一定程度上促进了叶绿素相关基因的表达,这可能是叶绿素a-b 蛋白基因上调表达的主要原因。叶绿体是植物细胞光合作用、能量流动和产生活性氧的最为重要的细胞器。光系统蛋白、与叶绿体相关的其他酶和蛋白在干旱胁迫的0 到12 h 上调表达,12 到24 h 呈现下调表达,可能是因为随着干旱迫时间的延长,植物细胞内渗透势逐渐升高,为了维持细胞内正常的生理活动,叶片中光系统蛋白、与叶绿体相关的其他酶等多个蛋白下调表达以降低光合作用速率,使高粱适应干旱胁迫环境。综上所述,我们认为过氧化物酶基因的富集和叶绿素相关基因的富集是影响高粱抗旱性的主要原因,而光系统蛋白、与叶绿体相关的其他酶和蛋白的基因表达调控在高粱抗旱性中起到了一定的积极作用。
3.4 干旱胁迫对苗期高粱代谢通路的影响
KEGG 富集分析显示,干旱胁迫下基因表达在氨基酸代谢、光合生物固碳作用、磷酸戊糖途径和碳代谢途径中具有显著的差异性。本研究中,氨基酸代谢途径在不同胁迫时间下均产生了显著富集,0 到12 h,富集显著的氨基酸代谢途径有4 条,分别为甘氨酸、丝氨酸和苏氨酸的代谢,苯丙氨酸代谢,半胱氨酸和蛋氨酸的代谢,氰氨基酸代谢。0到24 h,显著富集的氨基酸代谢途径为5 条,减少了氰氨基酸代谢,增加了酪氨酸代谢和丙氨酸、酪氨酸及色氨酸的生物合成途径。氨基酸作为蛋白质合成的基本单元,在植物逆境胁迫中能够作为渗透调节物质并维持生物膜稳定[44],氨基酸代谢途径和富集显著性的改变说明干旱胁迫引起了植物体内渗透调节物质的改变,影响了生物膜的稳定性,植物可以通过氨基酸代谢维持细胞的渗透压,增强抗旱性。碳代谢是植物体内最基本、最重要的生理代谢过程之一[45],其在作物生育期间的动态变化,直接影响了光合产物的形成、转化及蛋白质的合成和矿质营养的吸收等过程。可溶性糖在植物体内是重要的碳源,也是重要的渗透调节剂,对植物抗逆有至关重要的促进作用,其含量变化是植物抗旱性强弱的标志之一[46],有研究[47]表明,只有在重度干旱胁迫下,可溶性糖含量增加。本研究中,干旱胁迫24 h与干旱胁迫12 h 相比,糖代谢途径富集的条目增加、富集的显著性增强,说明其渗透调节能力在轻度和中度干旱胁迫下较强,但在重度干旱胁迫下则有所下降,这也是高粱对逆境胁迫的适应性反应。
4 结论
高粱在受到干旱胁迫时通过改变生理代谢途径进行调节,其调节过程涉及多个生物过程的协同互作,主要包括抗氧化系统对自由基的清除和渗透调节物质积累;过氧化物酶、叶绿素a-b 结合蛋白、光系统蛋白、与叶绿体相关的其他酶和蛋白的基因表达调控,这些调控作用在高粱苗期抗旱分子应答中起着关键作用;氨基酸代谢、光合作用和糖代谢过程是高粱抵御干旱胁迫的主要富集通路。
