超声处理对牡蛎肌原纤维蛋白溶解性的影响
2024-12-31李逍燕左硕静刘晓涵张晴怀向前桑亚新
摘 要:选择牡蛎肌原纤维蛋白为对象,以功率200 W、频率20~22 kHz的超声为处理条件,分别设置不同超声处理时间(0、10、20、30、40、50 min)。通过测定十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)、内源性荧光、表面疏水性、总巯基含量、游离巯基含量和二硫键含量等相关指标,研究不同超声处理时间对牡蛎肌原纤维蛋白溶解性的影响。结果表明:经一定时间的超声处理后,SDS-PAGE的肌球蛋白重链条带明显加深,但蛋白条带无明显变化;肌原纤维蛋白的内源性荧光强度降低;此外,肌原纤维蛋白内部埋藏的巯基基团暴露并转化为二硫键。这些变化均显著提高了牡蛎肌原纤维蛋白的溶解度,然而,过长时间的超声处理也会导致蛋白改性过度,从而降低其功能性质。本研究结果为牡蛎肌原纤维蛋白超声处理提供了理论基础,并拓展了其在食品溶解性方面的应用前景。
关键词:超声处理;牡蛎;肌原纤维蛋白;溶解性
Effects of Ultrasonic Treatment on Solubility of Oyster Myofibrillar Protein
LI Xiaoyan, ZUO Shuojing, LIU Xiaohan, ZHANG Qing, HUAI Xiangqian, SANG Yaxin*
(College of Food Science and Technology, Hebei Agricultural University, Baoding 071001, China)
Abstract: The objective of this study was to examine the impact of ultrasonic treatment on the solubility of oyster myofibrillar protein. Oyster myofibrillar protein was subjected to ultrasonic treatment at 200 W and 20–22 kHz for different durations (0, 10, 20, 30, 40 and 50 min) and evaluated for sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) patterns, endogenous fluorescence intensity, surface hydrophobicity, total sulfhydryl content, free sulfhydryl content, and disulfide bond content. SDS-PAGE results demonstrated a noticeable increase in the intensity of myosin heavy chain bands but no changes in the intensity of protein bands after ultrasonic treatment for a certain period. In addition, the intrinsic fluorescence intensity of myofibrillar protein decreased, which was accompanied by the exposure and conversion into disulfide bonds of hydrophobic groups buried inside myofibrillar protein. These changes significantly improved the solubility of oyster myofibrillar protein. Nevertheless, excessive ultrasonic treatment led to excessive modification of the protein, resulting in a decline in its functional properties. The findings of this study provide a theoretical foundation for the application of ultrasonic treatment to oyster myofibrillar protein and for expanding its potential applications in improving the solubility of food products.
Keywords: ultrasound treatment; oyster; myofibrillar protein; solubility
DOI:10.7506/rlyj1001-8123-20240229-044
中图分类号:TS254.4" " " " " " " " " " " " " " " " " " " " 文献标志码:A 文章编号:1001-8123(2024)07-0008-07
牡蛎(Crassostrea gigas)营养丰富,肉质十分鲜美,蛋白质含量高达50%以上,素有“海洋牛奶”之称[1]。
牡蛎所含的蛋白质包括肌原纤维蛋白(myofibrillar protein,MP)、肌浆蛋白和基质蛋白,其中MP为牡蛎的优质蛋白,直接决定着牡蛎产品的感官品质和物化性质。MP属于盐溶性蛋白,需要一定浓度的盐溶液(>0.3 mol/L)才能提取,而作为决定蛋白质功能特性的主要蛋白质,MP由肌球蛋白、肌动蛋白、原肌球蛋白和少量调节结构的蛋白构成[2],其功能特性对食品加工有重要影响[3]。
MP具有乳化性[4]、凝胶性[5]和起泡性[6]等功能特征,但多数蛋白自身的特性往往无法满足工业需求。因此需要通过对蛋白进行改性,对蛋白质的结构进行人为修饰改造以提高蛋白质的功能性质,从而拓宽蛋白质在食品工业中的应用。常见的改性方法有物理改性、化学改性和生物改性。其中物理改性所涉及的方法较多,主要包括超高压处理技术、超微粉碎技术与超声波技术[7]。超声波技术作为一种环保、无毒、安全的加工技术被广泛应用,也被称为“绿色能源”[8]。根据超声波的频率和强度可以分为高频超声和低频超声两种。超声波改性技术主要是通过机械效应、空化效应、热效应和化学效应作用于蛋白质,从而进一步改善蛋白质的功能特性[9]。Hao Pan等[10]研究发现,超声处理牡蛎胶原蛋白可以改善蛋白质流变性能,并改变蛋白质结构,增加其表面疏水性。Yu Cuiping等[11]研究超声波对牡蛎分离蛋白理化性质的影响,并发现先超声处理可以提高牡蛎分离蛋白的持油性、乳化活性指数、乳化稳定性指数、起泡性和泡沫稳定性。Tang Ling等[12]研究发现,高强度超声处理可以有效提升罗非鱼肌球蛋白的溶解度。Jambrak等[13]研究发现,高强度超声可以显著提升大豆蛋白的溶解度。研究表明,不同的超声处理条件与蛋白种类可能对其理化性质的影响不同,目前超声波技术对于MP的功能特性改善尚未全面研究报道。
因此,本研究在超声功率200 W、频率20~22 kHz的超声处理下,探究不同超声处理时间(0、10、20、30、40、50 min)对MP结构变化和溶解度的影响。通过分析MP十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)、内源性荧光、表面疏水性、巯基和二硫键含量等指标反映其溶解度的变化,旨在为超声波处理蛋白制品和贝类的综合利用提供一定的理论依据和技术参数。
1 材料与方法
1.1 材料与试剂
新鲜牡蛎 河北省保定市海鲜市场。
蛋白Maker(10~250 kDa)、5×SDS-PAGE上样缓冲液 北京赛文创新有限公司;尿素、氯化钠、磷酸氢二钠、磷酸二氢钠(分析纯)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、SDS、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)、8-苯胺-1-萘磺酸盐(8-anilino-1-naphthalenesulfonic acid,ANS)、考马斯亮蓝G250、牛血清白蛋白(bovine serum albumin,BSA) 美国Sigma公司。
1.2 仪器与设备
TGL-16M台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;HH-2数显水浴锅 常州国华电器有限公司;Tanon EPS 300电泳仪、Tanon 4600凝胶成像仪 上海天能科技有限公司;F-320荧光分光光度计 天津港东仪器有限公司;N5000紫外-可见分光光度计 海佑科仪器有限公司;JP96L均质机 浙江苏泊尔股份有限公司;JY92-IIDN超声波粉碎机 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 原材料预处理
牡蛎用冰块运送至实验室,清洗并剥除外壳,用蒸馏水对牡蛎肉进行2 次冲洗,切成适当大小的块状,4 ℃贮藏,备用。
1.3.2 MP的提取
参照Zhang Longteng等[14]的方法并进行适当调整。将新鲜的牡蛎肉切成小块,按照1∶4(g/mL)的比例加入磷酸盐缓冲液A(20 mmol/L磷酸盐缓冲液,含100 mmol/L
氯化钠、1 mmol/L EDTA,pH 7)混合,使用均质机均质90 s,离心(6 790×g、4 ℃、20 min),收集沉淀物,并重复此过程2 次。将沉淀物以1∶4(g/mL)的比例加入磷酸盐缓冲液B(25 mmol/L磷酸盐缓冲液,含0.6 mol/L氯化钠,pH 7),在冰水浴中使用均质机均质90 s,离心(6 790×g、4 ℃、20 min)并收集上清液,即为MP溶液。通过使用BSA作为标准品,使用双缩脲法测定MP质量浓度。
1.3.3 不同超声时间处理MP
将所得MP溶液稀释至5 mg/mL,在功率200 W、频率20~22 kHz的超声波下分别处理0、10、20、30、40、50 min,处理后的样品保存在4 ℃的环境中,并尽快使用。
1.3.4 SDS-PAGE测定
参考Balange等[15]的方法,并略作调整。将MP溶液稀释至3 mg/mL,取20 μL MP溶液与5 μL 5×SDS-PAGE缓冲液混合均匀,水浴加热10 min。制备10%的分离胶与5%的浓缩胶,使用100 V恒定电压,直至指示剂靠近凝胶边缘约5 mm处停止电泳。电泳结束后,将制备的凝胶用考马斯亮蓝G250进行染色15 min,之后用5%甲醇+7.5%乙酸脱色液进行脱色处理。脱色结束后,在凝胶成像仪上进行图像捕捉。
1.3.5 内源性荧光测定
参考Jia Na等[16]的方法。将MP溶液稀释至0.5 mg/mL,利用荧光分光光度计设定激发波长为295 nm,激发波长和发射波长狭缝宽度均为10 nm,在315~420 nm发射波长范围内进行荧光扫描。
1.3.6 表面疏水性测定
参考Liu Xiaohan等[17]的方法,并稍做调整。将MP溶液稀释至0、0.2、0.4、0.6、0.8、1.0 mg/mL,分别取5 mL稀释液与25 μL 8 mmol/L ANS溶液(溶于20 mmol/L
磷酸盐缓冲液,pH 7.5)混合,在25 ℃下黑暗处静置25 min,利用荧光分光光度计测定激发波长374 nm和发射波长485 nm处的相对荧光强度。计算荧光强度与MP质量浓度的比值,即为MP的表面疏水性。
1.3.7 巯基含量测定
参考Liu Xiaohan等[18]方法,并稍作修改。采用DTNB方法进行测定。
总巯基含量测定:用磷酸盐缓冲液B将MP溶液稀释至1 mg/mL。取0.5 mL MP溶液加入4.5 mL试剂A(8 mol/L尿素、10 mmol/L EDTA、pH 6)中,随后加入100 μL Ellman’s试剂(0.1 mol/L磷酸二氢钠、10 mmol/L DTNB,pH 6),充分混匀后,在25 ℃的环境中避光静置25 min,利用紫外分光光度计在412 nm波长处测定吸光度。空白对照组采用不含DTNB的MP溶液。
游离巯基含量测定:吸取5 mL稀释后的MP溶液与20 μL 10 mmol/L DTNB溶液混合,在25 ℃的环境中避光静置1 h,利用紫外分光光度计在412 nm波长处测定吸光度。空白对照组同样采用不含DTNB的MP溶液。
巯基含量按式(1)计算:
巯基含量/(μmol/g)=A-A0/ε×p (1)
式中:A为412 nm处样品的吸光度;A0为412 nm处空白试剂的吸光度;ε为摩尔消光系数(13 600 L/(mol·cm));ρ为样品中蛋白质量浓度/(mg/mL)。
1.3.8 二硫键含量测定
二硫键含量按式(2)计算:
二硫键含量/(μmol/g)=C1-C2/2 (2)
式中:C1为总巯基含量/(μmol/g);C2为游离巯基含量/(μmol/g)。
1.3.9 浊度测定
参考Kaur等[19]的方法,并稍作修改。使用25 mmol/L磷酸盐缓冲液(pH 7.0)将MP溶液稀释至1 mg/mL,在25 ℃下静置30 min,利用紫外分光光度计在340 nm波长下测定吸光度,即为MP的浊度。
1.3.10 溶解度测定
参考Kaur等[19]的方法,并稍作修改。将MP溶液质量浓度调整至5 mg/mL,在4 ℃、6 890×g条件下离心20 min,使用双缩脲法测定离心前后上清液中的蛋白质量浓度。蛋白质溶解度按式(3)计算:
溶解度/%=ρ1-ρ2×100% (3)
式中:ρ1为上清液蛋白质量浓度/(mg/mL);ρ2为原液蛋白质量浓度/(mg/mL)。
1.4 数据处理
所有实验均至少重复进行3 次,结果以平均值±标准差表示。采用SPSS 22.0软件(芝加哥,IL,USA)进行单因素方差分析,分析数据间差异显著性(P<0.05)。
2 结果与分析
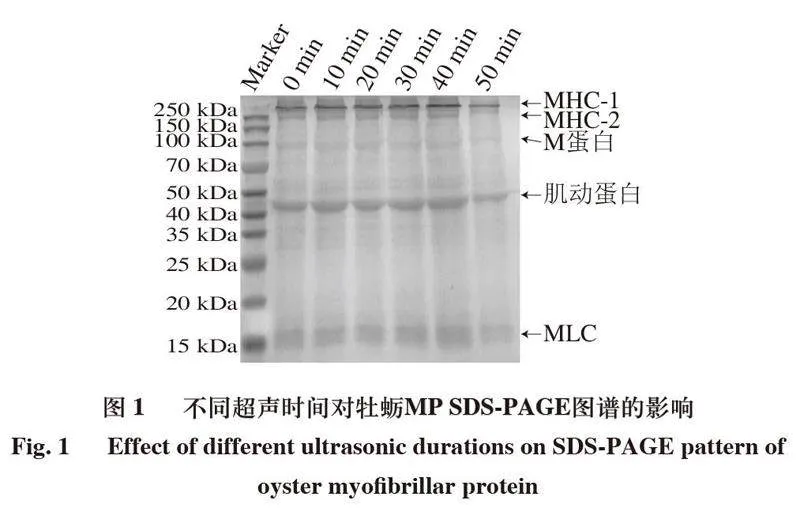
2.1 超声处理对牡蛎MP SDS-PAGE的影响SDS-PAGE主要反映蛋白质的一级结构[20]。
如图1所示,所有样品均表现出牡蛎MP典型的蛋白条带,包括2 条肌球蛋白重链(myosin heavy chain,MHC)(MHC-1、MHC-2,220 kDa)、M蛋白(97 kDa)、肌动蛋白(44.3 kDa)和肌球蛋白轻链(myosin light chain,MLC,16 kDa)。与对照组相比,超声处理时间10~40 min时,MHC-1的条带颜色逐渐变深,但当超声处理时间达到50 min时,MHC-1的条带变浅。该结果表明,随着超声处理时间的延长,MHC条带逐渐加深后变浅,可能是由于超声波的空化效应,蛋白质分子发生聚集,从而使MHC条带加深,但随着超声时间的持续延长使蛋白质发生降解,条带变浅。说明一定时间的超声处理能够引起蛋白聚集且形成大分子蛋白。通过与空白组对比,其他小分子质量的蛋白条带并没有发现明显的变化,表明超声处理没有引起小分子蛋白的聚集,该结果与Wang Jingyu等[21]的结果相似。
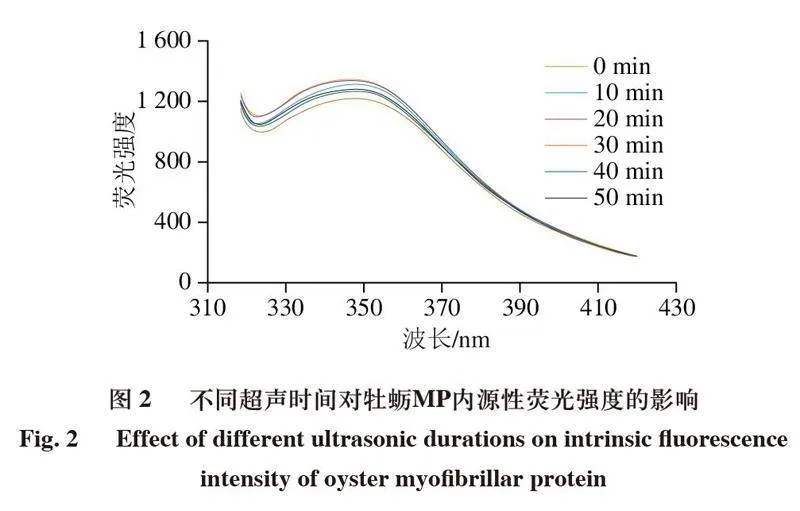
2.2 超声处理对牡蛎MP内源性荧光的影响
蛋白质的内源性荧光主要反映蛋白质的三级结构,荧光强度主要由蛋白质芳香族氨基酸(酪氨酸、色氨酸和苯丙氨酸)产生[22],内源性荧光强度发生变化往往表示蛋白质的三级结构发生了变化。如图2所示,超声处理后牡蛎MP内源性荧光光谱在340 nm左右有一个发射峰,并且随着超声时间的延长,MP荧光发射峰的位置变化不明显。但在超声处理10 min后,最大荧光强度下降,并在30 min时达到最低。经超声处理后,色氨酸氧化,导致荧光发生猝灭,使荧光强度降低[23]。当超声时间延长到20 min时,最大荧光强度增加,可能是由于超声波的空化效应可使Trp/Tyr残基以及蛋白质疏水集团暴露,使荧光性增加[24]。当超声时间延长到30 min时,最大荧光强度显著下降且达到最低,这是由于Trp/Tyr残基促进疏水区域之间的分子间疏水相互作用和聚集体的产生,从而使芳香族氨基酸重新包埋,荧光强度下降。40~50 min荧光强度逐步上升,由于超声时间过长,蛋白逐渐失活,荧光强度显著降低。
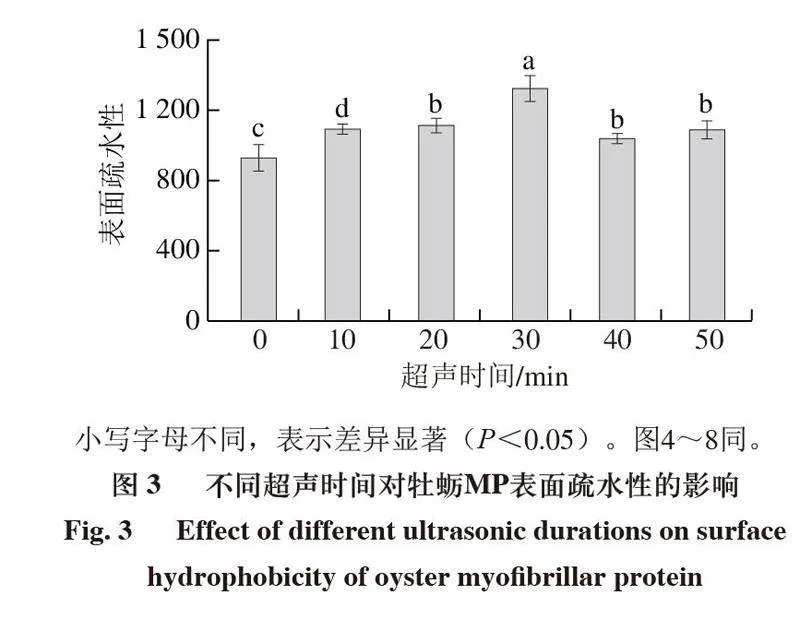
2.3 超声处理对牡蛎MP表面疏水性的影响
表面疏水性的变化主要反映蛋白质表面疏水基团的数量以及表征蛋白质三、四级结构的变化[25]。如图3
所示,与对照组相比,超声处理后的MP表面疏水性均显著增加(P<0.05)。并且随着超声处理时间的延长,MP的表面疏水性呈现先升高后降低的趋势并在超声处理30 min达到最高。与对照组相比,MP经过30 min超声处理后,表面疏水性从935.00±73.87增加到1 332.80±67.34。表面疏水性的增加可能是由于超声波的空化作用与物理剪切作用产生的活性基团通过氧化暴露蛋白质内部的疏水基团,同时物理剪切作用引起的湍流使蛋白质分子展开[26-27]。随着超声处理时间延长到40 min后,其表面疏水性显著降低,这可能是由于超声处理的时间过长,蛋白在表面疏水基团的相互作用下重新聚集包埋,使表面疏水性下降[28]。
小写字母不同,表示差异显著(P<0.05)。图4~8同。
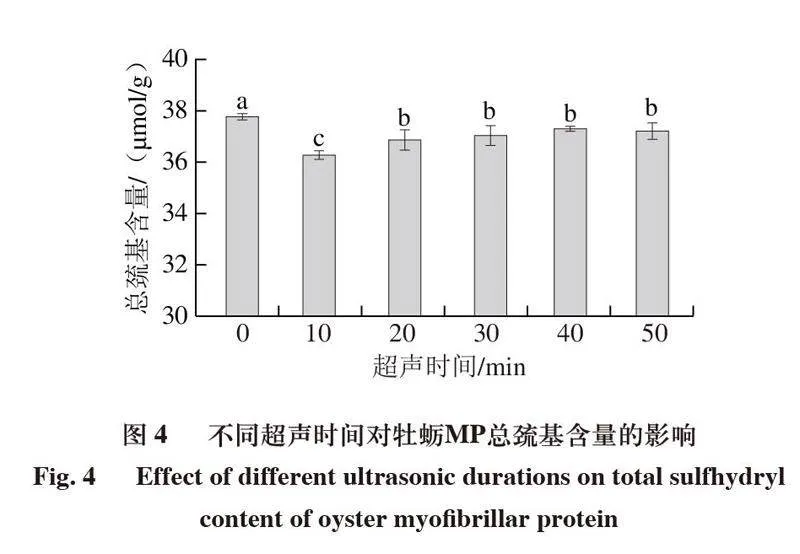
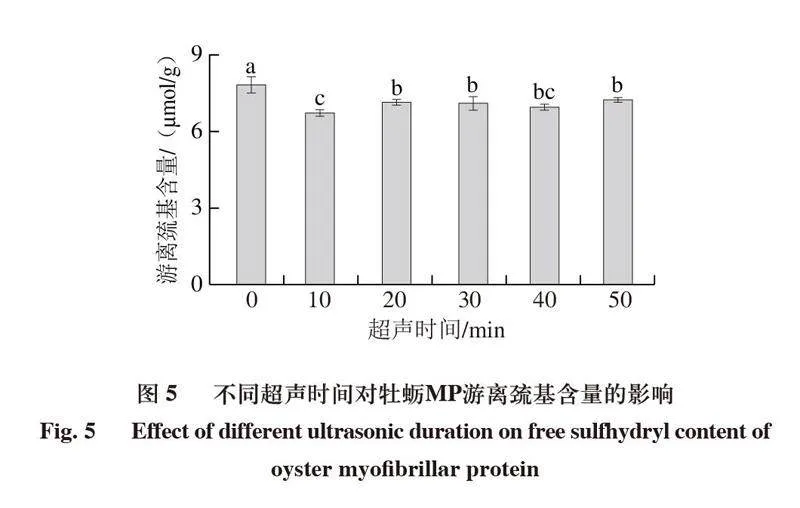
2.4 超声处理对牡蛎MP巯基含量的影响
总巯基含量是指暴露在表面与包埋于蛋白内部的巯基总和,它表示MP的结构与氧化变化,游离巯基为暴露于蛋白质表面的巯基[29]。如图4所示,所有样品经超声处理后,总巯基含量均显著下降(P<0.05)。与对照组相比,经超声波处理10 min的总巯基含量从(37.81±0.07)μmol/g下降到(36.31±0.15)μmol/g。总巯基含量的降低可能是由于游离巯基在超声波空化作用下氧化成二硫键[30]。随着超声处理时间的进一步延长(20~50 min),总巯基含量变化不显著,可能是由于在空化现象的高压和剪切力下,一些埋藏的蛋白质巯基暴露。
如图5所示,与对照组相比,经超声波处理后牡蛎MP游离巯基含量显著下降(P<0.05),游离巯基含量的降低表明经超声处理后,埋藏在内部的巯基基团暴露,转化成二硫键。超声处理时间20~50 min时,游离巯基含量相较于10 min时显著增加(P<0.05),说明MP进一步展开,更多的游离巯基暴露[31]。
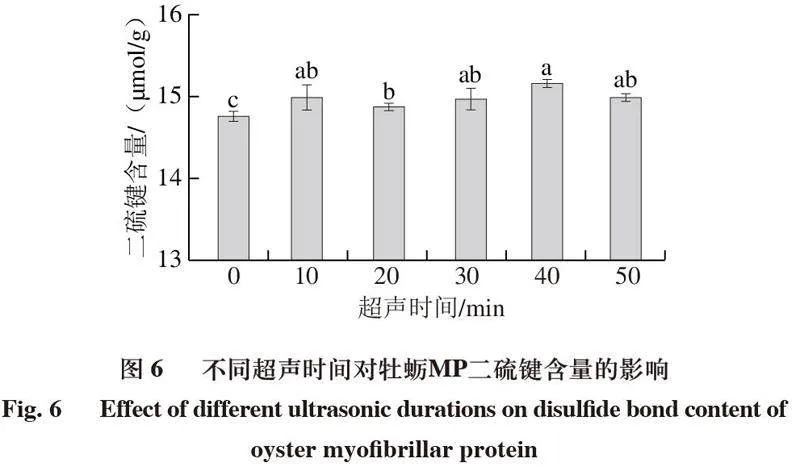
2.5 超声处理对牡蛎MP二硫键含量的影响
巯基基团的暴露可以通过半胱氨酸的氧化形成二硫键,二硫键在稳定蛋白质构象和保持蛋白质活性方面起着重要作用[32]。如图6所示,与对照组相比,经超声处理后二硫键含量均显著升高(P<0.05)。经超声处理40 min的牡蛎MP二硫键含量达到最高,由未经处理的(14.66±0.06)μmol/g上升到(15.17±0.04)μmol/g。可能的原因是超声处理后的蛋白巯基基团结构比较松散,使内部的巯基暴露,加之超声波的空化效应使水分子解离成羟基活性自由基,进而将自由巯基氧化为二硫键,使二硫键的含量增加[33]。超声处理显著提高二硫键的含量,另一方面的原因可能是由于高强度的超声产生的自由基使蛋白质的半胱氨酸残基氧化形成二硫键,诱导蛋白分子的交联[34]。
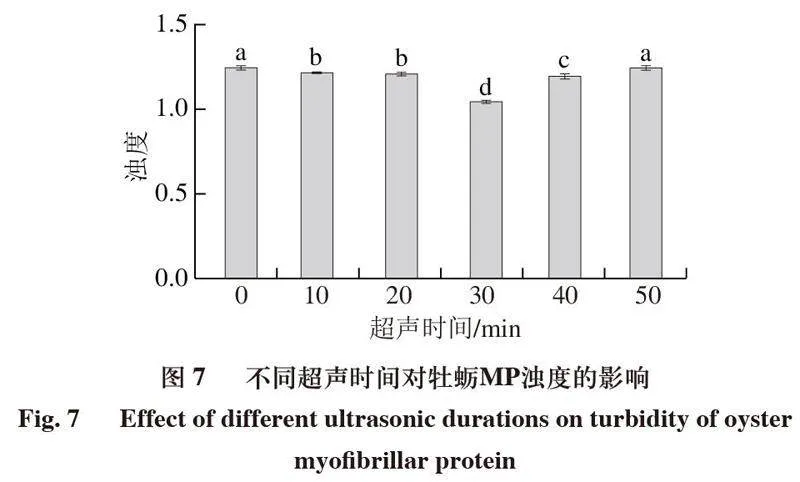
2.6 超声处理对牡蛎MP浊度的影响
浊度反映蛋白分子的聚集程度,从而反映蛋白颗粒的大小[35]。MP的粒径变大,吸光度变大,浊度增加。如图7所示,与对照组相比,经超声处理后的蛋白浊度显著下降(P<0.05)。随着超声处理时间的延长,MP的浊度呈现先降低后升高的趋势,并在30 min时达到最低值,即1.049。这可能是因为超声波的高剪切作用使蛋白质的原始结构遭到破坏,同时在超声空化效应的影响下,蛋白质的粒径减小,增加了光散射的比表面积[36-37],使MP的浊度降低,随着超声时间的进一步延长,MP的浊度又逐渐上升,可能是因为超声引起蛋白质的“过度加工”[2]。
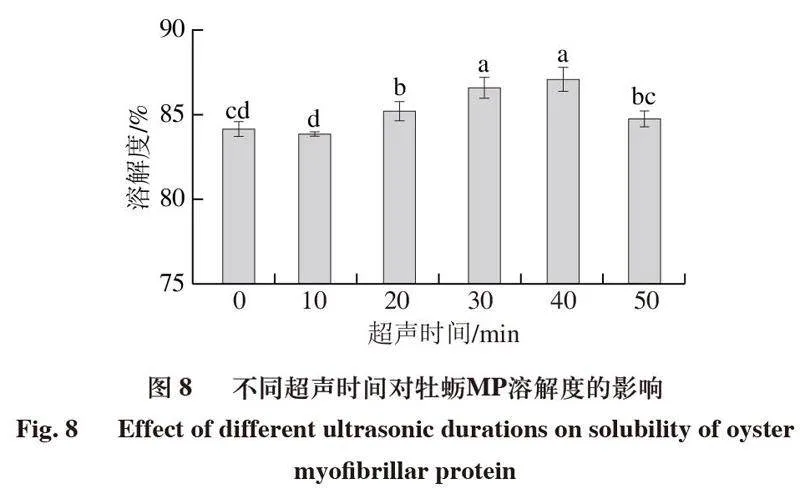
2.7 超声处理对牡蛎MP溶解度的影响
溶解度是蛋白质最基本的物理性质,同时也影响蛋白质的功能特性[13]。如图8所示,随着超声时间的延长,MP的溶解度呈现先升高后降低的趋势。与对照组相比,MP的溶解度在40 min达到最大,为87.09%。溶解度的增加可能是由于超声波的空化效应使蛋白质的结构展开,造成亲水氨基酸暴露,从而使溶解性增加[38],超声处理后的蛋白质粒径减小,进而增加了蛋白质与水分子的相互作用[39]。Liu Xiaohan等[17]的研究认为,超声波的空化作用影响了MP中的肌球蛋白含量,因为肌球蛋白的粒径减小,增加了蛋白-水分子之间的相互作用力,使蛋白质的溶解度增加。但随着超声时间持续延长到50 min,蛋白质的溶解度下降,可能是超声时间过长导致亲水基团聚集,使氨基酸的溶解度降低,此时蛋白质可能已经丧失部分功能。
3 结 论
在超声功率200 W、频率20~22 kHz条件下,探究不同超声时间(0、10、20、30、40、50 min)对牡蛎MP结构修饰、聚集行为和溶解性的影响。结果表明,适当的超声处理能够改变蛋白的构象(SDS-PAGE的MHC条带加深、稳定的三级结构以及疏水基团和巯基的暴露),减轻聚集行为(浊度降低),从而获得较高的溶解度。本研究能为了解超声处理赋予牡蛎MP良好的溶解性提供关键的见解。
参考文献:
[1] 汪何雅, 杨瑞金, 王璋. 牡蛎的营养成分及蛋白质的酶法水解[J]. 水产学报, 2003(2): 163-168. DOI:10.3321/j.issn:1000-0615.2003.02.011.
[2] CRUZ-ROMERO M, SMIDDY M, HILL C, et al. Effects of high pressure treatment on physicochemical characteristics of fresh oysters (Crassostrea gigas)[J]. Innovative Food Science and Emerging Technologies, 2004, 5(2): 161-169. doi:10.1016/j.ultsonch.2020.105160.
[3] LIU H T, ZHANG H, LIU Q, et al. Solubilization and stable dispersion of myofibrillar proteins in water through the destruction and inhibition of the assembly of filaments using high-intensity ultrasound[J]. Ultrasonics Sonochemistry, 2020, 67: 105160. doi:10.1016/j.ultsonch.2020.105160.
[4] WANG K, LI Y, ZHANG Y M, et al. Improving myofibrillar proteins solubility and thermostability in low-ionic strength solution: a review[J]. Meat Science, 2022, 189: 108822. doi:10.1016/j.meatsci.2022.108822.
[5] GAO T X, ZHAO X, LI R, et al. Synergistic effects of polysaccharide addition-ultrasound treatment on the emulsified properties of low-salt myofibrillar protein[J]. Food Hydrocolloids, 2022, 123: 107143. DOI:10.1016/i.foodhyd.2021.107143.
[6] 叶浪, 李美良, 赵冰, 等. 三聚磷酸钠对猪肉肌原纤维蛋白功能特性的影响[J]. 肉类研究, 2019, 33(1): 1-6. doi:10.7506/rlyj1001-8123-20181121-218.
[7] LIU X H, TIAN G F, ZHAO J R, et al. Integrated ultra-high pressure and salt addition to improve the in vitro digestibility of myofibrillar proteins from scallop mantle (Patinopecten yessoensis)[J]. Food Chemistry, 2024, 447: 138985. doi:10.1016/j.foodchem.2024.138985.
[8] 陈笑迎, 田桂芳, 陈智慧, 等. 贝类蛋白改性技术研究进展[J].
食品工业科技, 2022, 43(6): 420-428. DOI:10.13386/j.issn1002-0306.2021030163.
[9] AMIRI A, SHARIFIAN P, SOLTANIZADEH N. Application of ultrasound treatment for improving the physicochemical, functional and rheological properties of myofibrillar proteins[J]. International Journal of Biological Macromolecules, 2018, 111: 139-147. DOI:10.1016/j.ijbiomac.2017.12.167.
[10] PAN H, ZHANG X H, NI J B, et al. Effects of ultrasonic power on the structure and rheological properties of skin collagen from albacore (Thunnus alalunga)[J]. Marine Drugs, 2024, 22(2): 84. DOI:10.3390/MD22020084.
[11] YU C P, WU F, CHA Y, et al. Structural and functional changes in ultrasonicated oyster protein isolates[J]. International Journal of Food Engineering, 2019, 15(3/4): 20180190. DOI:10.1515/ijfe-2018-0190.
[12] TANG L, YONGSAWATDIGU J. Physicochemical properties of tilapia (Oreochromis niloticus) actomyosin subjected to high intensity ultrasound in low NaCl concentrations[J]. Ultrasonics Sonochemistry, 2020, 63: 104922. DOI:10.1016/j.ultsonch.2019.104922.
[13] JAMBRAK R A, LELAS V, MASON J T, et al. Physical properties of ultrasound treated soy proteins[J]. Journal of Food Engineering, 2009, 93(4): 386-393. DOI:10.1016/j.jfoodeng.2009.02.001.
[14] ZHANG L T, LI Q, HONG H, et al. Prevention of protein oxidation and enhancement of gel properties of silver carp (Hypophthalmichthys molitrix) surimi by addition of protein hydrolysates derived from surimi processing by-products[J]. Food Chemistry, 2020, 316(C): 126343. DOI:10.1016/j.foodchem.2020.126343.
[15] BALANGE A, BENJAKUL S. Enhancement of gel strength of bigeye snapper (Priacanthus tayenus) surimi using oxidised phenolic compounds[J]. Food Chemistry, 2008, 113(1): 61-70. DOI:10.1016/j.foodchem.2008.07.039.
[16] JIA N, WANG L T, SHAO J H, et al. Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J]. Meat Science, 2017, 127: 45-50. DOI:10.1016/j.meatsci.2017.01.004.
[17] LIU X H, MAO K M, SANG Y X, et al. Physicochemical properties and in vitro digestibility of myofibrillar proteins from the scallop mantle (Patinopecten yessoensis) based on ultrahigh pressure treatment[J]. Frontiers in Nutrition, 2022, 9: 873578. doi:10.3389/fnut.2022.873578.
[18] LIU X H, TIAN G F, HOU Y K, et al. Monosaccharide-induced glycation enhances gelation and physicochemical properties of myofibrillar protein from oyster (Crassostrea gigas)[J]. Food Chemistry, 2023, 428: 136795. doi:10.1016/j.foodchem.2023.136795.
[19] KAUR L, ASTRUC T, VÉNIEN A, et al. High pressure processing of meat: effects on ultrastructure and protein digestibility[J]. Food Function, 2016, 7(5): 23; 89-97. doi:10.1039/c5fo01496d.
[20] LI X X, SUN X, MA Y Y, et al. Effects of ultrasonic treatment on physico-chemical properties and structure of tuna (Thunnus tonggol) myofibrillar proteins[J]. Journal of Food Composition and Analysis, 2022, 108: 104438. DOI:10.1002/jsfa.9752.
[21] WANG J Y, YANG Y L, TANG X Z, et al. Effects of pulsed ultrasound on rheological and structural properties of chicken myofibrillar protein[J]. Ultrasonics Sonochemistry, 2017, 38: 225-233. DOI:10.1016/j.ultsonch.2017.03.018.
[22] WANG Y Y, RASHID M T, YAN J K, et al. Effect of multi-frequency ultrasound thawing on the structure and rheological properties of myofibrillar proteins from small yellow croaker[J]. Ultrasonics Sonochemistry, 2020, 70: 105352. DOI:10.1016/j.ultsonch.2020.105352.
[23] CAI L Y, CAO M J, CAO A L, et al. Ultrasound or microwave vacuum thawing of red seabream (Pagrus major) fillets[J]. Ultrasonics Sonochemistry, 2018, 47: 122-132. DOI:10.1016/j.ultsonch.2018.05.001.
[24] ZOU Y, XU P P, WU H H, et al. Effects of different ultrasound power on physicochemical property and functional performance of chicken actomyosin[J]. International Journal of Biological Macromolecules, 2018, 113: 640-647. DOI:10.1016/j.ijbiomac.2018.02.039.
[25] EHRENSHAFT M, DETERDING L J, MASON R P. Tripping up Trp: modification of protein tryptophan residues by reactive oxygen species, modes of detection, and biological consequences[J]. Free Radical Biology and Medicine, 2015, 89: 220-228. DOI:10.1016/j.freeradbiomed.2015.08.003.
[26] SANTE-LHOUTELLIER V, AUBRY L, GATELLIER P. Effect of oxidation on in vitro digestibility of skeletal muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 2007, 55(13): 5343-5348. DOI:10.1021/jf070252k.
[27] LI K, FU L, ZHAO Y Y, et al. Use of high-intensity ultrasound to improve emulsifying properties of chicken myofibrillar protein and enhance the rheological properties and stability of the emulsion[J]. Food Hydrocolloids, 2020, 98: 105275. DOI:10.1016/j.foodhyd.2019.105275.
[28] 李可, 张俊霞, 王欣瑶, 等. 不同超声波功率处理对类PSE鸡肉肌原纤维蛋白结构和乳化稳定性的影响[J]. 食品科学, 2023, 44(13): 23-31. doi:10.7506/spkx1002-6630-20220624-269.
[29] LI X X, MA Y Y, SUN P, et al. Effect of ultrasonic thawing on protein properties and muscle quality of Bonito[J]. Journal of Food Processing and Preservation, 2020, 45(4). DOI:10.1111/JFPP.14930.
[30] ZHANG Z Y, REGENSTEIN J M, ZHOU P, et al. Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel[J]. Ultrasonics Sonochemistry, 2017, 34: 960-967. DOI:10.1016/j.ultsonch.2016.08.008.
[31] AMIRI A, MOUSAKHANI-GANJEH A, SHAFIEKHANI S, et al. Effect of high voltage electrostatic field thawing on the functional and physicochemical properties of myofibrillar proteins[J]. Innovative Food Science and Emerging Technologies, 2019, 56: 102191. DOI:10.1016/j.ifset.2019.102191.
[32] 田悦, 杜军保. 二硫键和巯基在蛋白质结构功能中的作用及分析方法[J]. 中华实用儿科临床杂志, 2007, 22(19): 1499-1501. DOI:10.3969/j.issn.1003-515X.2007.19.030.
[33] GÜLSEREN İ, GÜZEY D, BRUCE B D, et al. Structural and functional changes in ultrasonicated bovine serum albumin solutions[J]. Ultrasonics Sonochemistry, 2007, 14(2): 173-183. DOI:10.1016/j.ultsonch.2005.07.006.
[34] LIU H T, WANG Z, BADAR I H, et al. Combination of high-intensity ultrasound and hydrogen peroxide treatment suppresses thermal aggregation behaviour of myofibrillar protein in water[J]. Food Chemistry, 2022, 367: 130756. DOI:10.1016/j.foodchem.2021.130756.
[35] CHEN J H, ZHANG X, XUE S W, et al. Effects of ultrasound frequency mode on myofibrillar protein structure and emulsifying properties[J]. International Journal of Biological Macromolecules, 2020, 163: 1768-1779. DOI:10.1016/j.ijbiomac.2020.09.114.
[36] ZHANG Z Y, REGENSTEIN J M, ZHOU P, et al. Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel[J]. Ultrasonics Sonochemistry, 2017, 34: 960-967. DOI:10.1016/j.ultsonch.2016.08.008.
[37] HIGUERA-BARRAZA O A, DEL TORO-SANCHEZ C L, RUIZ-CRUZ S, et al. Effects of high-energy ultrasound on the functional properties of proteins[J]. Ultrasonics Sonochemistry, 2016, 31: 558-562. DOI:10.1016/j.ultsonch.2016.02.007.
[38] ZHAO R X, LIU X S, LIU W, et al. Effect of high-intensity ultrasound on the structural, rheological, emulsifying and gelling properties of insoluble potato protein isolates[J]. Ultrasonics Sonochemistry, 2022, 85: 105969. DOI:10.1016/j.ultsonch.2022.105969.
[39] HIGUERA-BARRAZA O A, DEL TORO-SANCHEZ C L, RUIZ-CRUZ S, et al. Effects of high-energy ultrasound on the functional properties of proteins[J]. Ultrasonics Sonochemistry, 2016, 31: 558-562. doi:10.1016/j.ultsonch.2016.02.007.
