尼克酰胺转甲基酶通过介导细胞内活性氧影响肝癌细胞铁死亡的作用研究
2024-12-31王锦春戴永青王亚清陈珏刘祖平李烨佳



[摘要]"目的"探究尼克酰胺转甲基酶介导细胞内活性氧(reactive"oxygen"species,ROS)在肝癌细胞铁死亡中的影响及其机制。方法"选取2019年3月至2020年2月于笔者医院接受治疗的40例原发性肝细胞癌患者作研究对象,分别取患者的癌旁组织标本及肝癌组织标本。使用串联液相质谱仪检测细胞中甲基尼克酰胺(methyl"nicotinamid,MNA)表达,使用流式细胞仪检测ROS及过氧化脂质的平均荧光强度,采用蛋白质印迹法(Western"blot)法检测人肝癌细胞(SK-Hep-1、Hep3B)细胞表达的情况变化。采用免疫组化法检测癌旁组织、肝癌组织中尼克酰胺转甲基酶(nicotinamide"N-methyltransferase,NNMT)及ROS水平,采用CCK-8法检测不同铁浓度细胞的生存活性。结果"肝癌组织组中的MNA水平较癌旁组织组有所提升差异有统计学意义(Plt;0.05)。与癌旁组织组比较,肝癌组织组的ROS平均荧光强度表达升高,过氧化脂质平均的荧光强度表达降低,SK-Hep-1、Hep3B细胞表达量上升,差异有统计学意义(Plt;0.05)。与对照组比较,NNMT组2、10、20及25μmol/L的细胞生存活性水平升高(Plt;0.05)。与NNMT组比较,铁抑制组不同铁浓度(2μmol/L、10μmol/L、20μmol/L、25μmol/L)的细胞生存活性表达下降差异有统计学意义(Plt;0.05)。结论"经尼克酰胺转甲基酶介导可引导产生ROS及能量紊乱,提高了肿瘤细胞的死亡率。
[关键词]"肝癌;尼克酰胺转甲基酶;细胞内活性氧;铁死亡
[中图分类号]"R735.7""""""[文献标识码]"A""""""[DOI]"10.3969/j.issn.1673-9701.2024.23.007
Study"on"the"effect"of"NNMT"enzyme"on"iron"death"of"hepatocellular"carcinoma"cells"by"mediating"ROS
WANG"Jinchun1,"DAI"Yongqing1,"WANG"Yaqing1,"CHEN"Jue1,"LIU"Zuping2","LI"Yejia3
1.Department"of"Blood"Transfusion,"Affiliated"Hospital"of"Shaoxing"University,"Shaoxing"312000,"Zhejiang,"China;"2.Department"of"Pathology,"Affiliated"Hospital"of"Shaoxing"University,"Shaoxing"312000,"Zhejiang,"China;"3.Department"of"Clinical"Laboratory,"Affiliated"Hospital"of"Shaoxing"University,"Shaoxing"312000,"Zhejiang,"China
[Abstract]"Objective"To"explore"the"effect"of"nicotinamide"transmethylase"on"intracellular"reactive"oxygen"species"(ROS)"in"iron"death"of"hepatocellular"carcinoma"cells"and"its"mechanism."Methods"Methyl"nicotinamide"(MNA)"expression"in"cells"was"detected"using"a"tandem"liquid"chromatography-mass"spectrometry."The"average"fluorescence"intensity"of"ROS"and"lipid"peroxidation"was"measured"using"a"flow"cytometer."Western"blot"was"used"to"detect"changes"in"the"expression"of"human"liver"cancer"cells"(SK-Hep-1,"Hep3B)."Forty"patients"with"primary"hepatocellular"carcinoma"who"received"treatment"in"our"hospital"from"March"2019"to"February"2020"were"selected"as"the"study"subjects,"and"their"adjacent"tissue"samples"and"liver"cancer"tissue"samples"were"collected."Immunohistochemical"methods"were"used"to"detect"the"levels"of"nicotinamide"N-methyltransferase"(NNMT)"and"ROS"in"adjacent"and"liver"cancer"tissues."CCK-8"method"was"used"tonbsp;detect"the"survival"activity"of"cells"with"different"iron"concentrations."Results"The"MNA"levels"in"the"liver"cancer"tissue"group"were"higher"than"those"in"the"adjacent"tissue"group"(Plt;0.05)."Compared"with"the"adjacent"tissue"group,"the"average"fluorescence"intensity"expression"of"ROS"in"the"liver"cancer"tissue"group"increased,"while"the"average"fluorescence"intensity"expression"of"lipid"peroxidation"decreased"(Plt;0.05)."Compared"with"the"adjacent"tissue"group,"the"expression"levels"of"SK"Hep-1"and"Hep3B"cells"in"the"liver"cancer"tissue"group"increased"(Plt;0.05)."Compared"with"the"control"group,"NNMT"groups"2,"10,"20,"and"25"μmol/L"The"cell"survival"activity"level"increased"(Plt;0.05);"Compared"with"the"NNMT"group,"the"iron"inhibition"group"had"different"iron"concentrations"(2μmol/L,"10μmol/L,"20μmol/L,"25μmol/L."The"expression"of"cell"viability"decreased"(Plt;0.05)."Conclusion"ROS"mediated"by"nicotinamide"methyltransferase"can"be"guided"to"produce"ROS"and"energy"disorders,"leading"to"increased"tumor"cell"death.
[Key"words]"Liver"cancer;"Nicotinamide"methyltransferase;"Intracellular"reactive"oxygen"species;"Ferroptosis
肝细胞癌为原发性肝癌中的重要类型(gt;80%),其死亡率位居世界肿瘤疾病第2位,目前新发肝细胞癌例数及病死率不断上升[1]。对于早期肝细胞癌患者实施肝移植、肝脏切除或是局部消融有利于改善患者预后,而肝硬化或晚期肝细胞癌患者预后治疗效果较差[2-3]。尼克酰胺转甲基酶(nicotinamide"N-methyltransferase,NNMT)是甲基转移酶家族中依赖于S-腺苷甲硫氨酸的一员,属于肝脏组织中较高表达的代谢酶,NNMT主要针对外源性化合物及多类药物给予生物性解毒与转化,也参与尼克酰胺的代谢过程,尤其是经甲基化之后对尼克酰胺的清除可帮助调节细胞中尼克酰胺的表达[4-5]。同时NNMT在人体疾病状况与健康状况下都有较广的生物学能力,如NNMT能够在调节肝脏及脂肪代谢中有所参与,与胃癌、胰腺癌、肝癌等多类癌症的进展或是其他类型的癌细胞转移及入侵有关,此外NNMT在机体中表达较高时具备保护性和致病效果,这与NNMT下游效应器激活及组织分布相关[6]。
细胞内活性氧(reactive"oxygen"species,ROS)在肝脏组织细胞中的积聚可造成细胞自噬、脱氧核糖核酸(deoxyribonucleic"acid,DNA)受损、耐药等多种类生物学作用,且经对细胞中ROS表达进行调节,可有助于肿瘤细胞凋亡。研究表明,ROS可能参与了肿瘤细胞铁死亡过程[7]。基于此,本研究探讨NNMT是否与ROS反应相关联,以及后者是否有助于诱导体内肝癌细胞出现铁死亡,为临床靶向治疗肝细胞癌提供有利参考。
1""材料与方法
1.1""实验材料
人肝癌细胞系SK‐Hep‐1、Hep3B和正常肝细胞系(中国科学院上海细胞库);RPMI-1640培养基(上海百赛生物技术股份有限公司,货号:10-040-CM);光镜(广州市明美光电技术有限公司,型号:MF52-N);Lipofectamine"TM"2000转染试剂(11668019)(北京百奥创新科技有限公司);磷酸缓冲液(phosphate"buffer,PBS)(上海阿拉丁生化科技股份有限公司,型号:P196987-500ml);CCK-8液体(汉恒生物工程(上海)有限公司,HB-CCK-8-500T);酶标检测仪(美谷分子仪器(上海)有限公司,型号:SpectraMax"iD5);ROS试剂盒流式细胞仪(上海顶仪科技有限公司,型号:FACSCalibur);蛋白质定量试剂盒(BCA试剂盒)(赛默飞世尔科技,货号:23221-23230);Hoechst"33342染色(北京索莱宝科技有限公司,货号:C0031)。
1.2""培养与检测方法
1.2.1""细胞培养""选择SK-Hep-1(高表达"NNMT)和Hep3B(低表达"NNMT)两种肝癌细胞株与正常肝细胞(对照组)进行实验。将5%青链霉素混合液+10%"胎牛血清+RPMI-1640培养基放温度5%CO2、37℃、饱和湿度的环境下予以培养,每24h观察细胞的生长情况,平均48h对培养基予以更换或是传代,光镜下SK-Hep-1、Hep3B细胞贴壁成长,细胞呈现圆形或多边形。
1.2.2""细胞转染""用含有shRNA-NNMT"慢病毒对SK-Hep-1"细胞转染,获取低表达NNMT的细胞株;经构建NNMT"质粒对Hep3B"细胞进行转染,获取NNMT高表达的细胞株,或于Hep3"B细胞培养液内放MNA以发挥补充NNMT的效果。
1.2.3""转染效率验证""采用实时荧光定量(real"time"polymerase"chain"reaction,RT-PCR)法测定NNMT的转染效率,在NNMT转染24h后取各组的细胞,提取RNA,用Takara反转录试剂盒行反转录,获取总cDNA,用Primer5.0软件设计引物序列,开启PCR仪,反应条件:94"℃预变性2"s、97℃"6s、65℃"30s,共循环45次,通过2-△△Ct方法算出NNMT的表达量,反应体系:0.5"μl"上下游引物、2μl""cDNA模板、8"μl""SYB"Green,放蒸馏水到25"μl"。Notch1引物序列:上游:5’-AGCTGGAGAAGTGGCTGAAG-3’,下游:5’-"TGGACCCTTGACTCTGTTCC-3’,内参GAPDH引物序列:上游:5’-GATTGGAATCTGGCTACT-3’,下游:5’-TAGGGCTGAAGACAGGG-3’。重复试验3次。
1.2.4""串联液相质谱仪检测细胞中MNA的表达""使用串联液相质谱仪及试剂盒测定每组细胞中MNA表达,步骤主要按试剂盒说明书予以完成。试验重复3次。
1.2.5""流式细胞仪检测ROS及过氧化脂质的平均荧光强度""集取细胞,用PBS清洗,按ROS试剂盒说明书的步骤进行操作,加ROS试剂,在避光环境中培养30min,用流式细胞仪测定每组的ROS、过氧化脂质的平均荧光强度。
1.2.6""Western"blot法检测NNMT表达""取70%~"80%生长密度的SK-Hep-1、Hep3B细胞,按每孔细胞3×105个在6孔板内接种,待细胞贴壁24h之后培养至50~60%时,后PBS冲洗细胞2次,加入蛋白裂解液(RIPA的裂解液)60μl",放于冰上裂解(4min),收集蛋白的裂解液,在6℃、8min、转速10"000r/min下给予离心处理,分离清液,用BCA法检测细胞浓度,在电泳处理、转至聚偏二氟乙烯膜(PVDF膜)内、脱脂奶粉5%后进行2h密封。5℃环境中培养,过夜,后用0.1%"Tris"盐缓冲液(TBS+Tween,TBST)进行洗膜,加入静电式扬声器(electrostatic"loudspeaker,ESL)给予曝光、显影处理,以获得每组SK-Hep-1、Hep3B细胞表达量。
1.2.7""免疫细胞形态学检测""首先将癌旁组织及癌组织样本切片,分别用NNMT"抗体、Perl铁染色试剂及ROS"荧光施以Hoechst"33342染色,且阴性对照组反应同时实施,无放抗体的步骤。通过使用四级评分系统对染色强度进行表示(阴性=0、低于5%,弱阳=+1、6%~24%,中度阳=+2、25%~50%,强阳=+3、高于50%),以5%阈值作阳性标准,免疫组化法染色的结果主要通过2名病理学专科医师予以检测。
1.2.8""CCK-8法检测不同铁浓度细胞的生存活性""首先培养SK-Hep-1、Hep3B细胞直到对数生长时期,重悬消化,于96孔板内以细胞密度1×104个/mL接种,每孔250μl,孵育直到细胞贴壁,分别用浓度"""0、2、10、20、25μmol/L的NNMT对细胞予以处理,每组设有3个复孔,在培养48h之后,移去培养液,PBS洗涤3次,每孔滴加CCK-8溶液120μl,避光环境、37℃下培养1.0~1.5h,检测酶标检测仪460nm处的波长,即为吸光度A值。细胞生存活性=(NNMT组A-铁抑制组A)/(NNMT组A-对照组A)×100%。
1.3""统计学方法
采用SPSS"19.0统计学软件对数据进行处理分析,计量资料以均数±标准差( )表示,两组间比较采用t检验,多组间进行比较采用F检验。Plt;0.05为差异有统计学意义。
)表示,两组间比较采用t检验,多组间进行比较采用F检验。Plt;0.05为差异有统计学意义。
2""结果
2.1""MNA、ROS、过氧化脂质平均的荧光强度表达水平比较
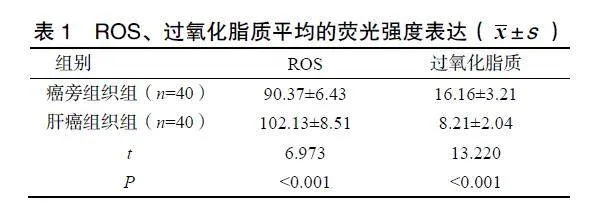
肝癌组织组的MNA表达水平为81.13±7.51,而癌旁组织组的MNA表达水平为64.37±5.43,明显低于肝癌组织组,差异有统计学意义(Plt;0.05)。肝癌组织组的ROS平均荧光强度表达高于癌旁组织组,而过氧化脂质平均的荧光强度表达低于癌旁组织组,差异有统计学意义(均Plt;0.05),见表1。
2.2""SK-Hep-1、Hep3B细胞表达水平比较
肝癌组织组的SK-Hep-1、Hep3B细胞表达量高于癌旁组织组,差异有统计学意义(Plt;0.05),见表2。
2.3""细胞形态学检测
对各组肝脏细胞进行染色并用光镜进行观察,观察对照组和NNMT组的荧光强度。在激发最大波长575nm、发射最大的波长598nm时,与对照组比较,NNMT组的线粒体形态显著性缩减,细胞核状态有所改变,细胞中荧光强度上升,细胞的增值率下降,对于细胞的浓度有一定依赖性,见图1。
2.4""不同铁浓度细胞的生存活性表达比较
NNMT组2、10、20及25μmol/L的铁浓度细胞生存活性水平明显高于对照组,差异有统计学意义(均Plt;0.05)。铁抑制组的不同铁浓度(2μmol/L、10μmol/L、20μmol/L、25μmol/L)细胞生存活性表达较NNMT组下降,差异有统计学意义(均Plt;0.05),见表3。
3""讨论
肝细胞癌为高病死率的原发性肝癌,其进展快速、恶性程度较高,患者远期预后效果较差[8-9]。肝细胞癌的发生进展为复杂的细胞生化及病理学的过程,有较多研究证明肝癌细胞中存在明显铁代谢水平失衡[10-11]。研究显示,铁代谢水平障碍在肝细胞癌疾病中有较广泛存在[12-13]。经铁调素-排铁蛋白轴有较多铁聚集于肝癌细胞中,导致氧化应激水平失衡。因此对于铁代谢的调控机制的研究能为临床靶向诊治肝细胞癌疾病提供新思路。
NNMT是指近几年发现的一类癌症相关蛋白,属于甲基转移酶,NNMT可有效对甲基予以催化从S-腺苷蛋氨酸转移至尼克酰胺,分别出现甲基尼克酰胺及S-腺苷同型半胱氨酸。近来研究显示,NNMT能提高对肝癌细胞的转移能力及改善患者预后不良[14-15]。铁代谢障碍极易引起细胞发生铁死亡,而铁死亡属于一类依赖于铁的以ROS与脂质过氧化物积聚作为主要因素的新细胞死亡的形式[16]。目前,铁死亡在癌症发展及化疗、放疗中已被表明可发挥出较重要的作用。在肝癌细胞内铁死亡期间调控多种上游信号通路,如p53可调控铁死亡而诱导肝细胞癌病症发展,铁硫结构域蛋白1(CDGSH铁流域I)能够有效对铁死亡予以调控,对肝细胞癌的进程、产生也有较大影响[17]。
本研究肝癌组织组的MNA水平较癌旁组织组有所提升(Plt;0.05)。与癌旁组织组比较,肝癌组织组的ROS平均荧光强度表达升高,过氧化脂质平均的荧光强度表达降低(Plt;0.05)。故全面分析铁死亡可有效减缓肝细胞癌疾病的发展。NNMT的底物NAM及铁均可作为细胞中参与电子传导的重要指标,在探究NNMT活性水平变化及铁过载小鼠模型时,都能对还原型烟酰胺腺嘌呤二核苷酸(nicotinamide"adenine"dinucleotide,NADH)表达变化清晰观察,表明铁可经电子传导对NNMT表达造成一定影响[18]。研究显示,在小鼠正常的肝脏组织细胞内,过量铁可显著性减少肝脏中NNMT转录的表达量,且在人正常血清内,肝脏NNMT转录表达和铁含量呈现负相关[19-20]。由于对铁和NNMT水平间关系的考虑,预测NNMT表达与铁死亡状况可能有着紧密联系,需更深一步分析NNMT在肝癌细胞产生铁死亡中具体的调控病理机制。
本研究中,与癌旁组织组比较,肝癌组织组的SK-Hep-1、Hep3B细胞表达量上升(Plt;0.05)。肝细胞癌患者体内铁蛋白上升,证实肝细胞癌患者伴有显著的铁代谢障碍。研究表明,NNMT能有效降低肿瘤细胞ROS含量,而降低NNMT水平后可引导ROS表达上升,能有助于肿瘤细胞自噬及凋亡提升,降低其对药物化疗的耐药性[21]。研究证实,在结直肠癌细胞内提高NNMT表达能有效降低细胞的凋亡,而NNMT水平下降可明显提升细胞的凋亡概率。且下调NNMT可提升ROS,而ROS的出现可作为观察铁死亡产生的重要信号之一,但引发ROS生成病理机制尚未清晰[22]。
本研究中,与对照组比较,NNMT组2、10、20及25μmol/L的细胞生存活性水平升高(Plt;0.05);与NNMT组比较,铁抑制组不同铁浓度(2μmol/L、10μmol/L、20μmol/L、25μmol/L)的细胞生存活性表达下降(Plt;0.05)。提示通过尼克酰胺转甲基酶介导ROS,可有效诱发肝癌细胞中铁死亡,缓解细胞的活性,对MNA表达进行调节,改善ROS、过氧化脂质的荧光强度变化水平,以促进疾病恢复加快,与其他研究结果较相似[23-25]。原因可能肿瘤的进展、产生属于多因素、多基因相互作用的一种结果,在进展的不同时期,不同的抑癌基因或癌基因的种类、数量、作用等各不同,其在NNMT能对细胞凋亡、传导信号、物质代谢(糖、脂类等)、分化细胞有关基因水平,故证明NNMT能够在肿瘤细胞生物能力中有所参与,而NNMT水平及癌细胞的转移与肿瘤时期呈正相关,因此,可将NNMT作为一类能有效转移肿瘤细胞的调控指标。表明NNMT能有效调节肝癌细胞中的铁代谢,诱导细胞出现铁死亡,缓和过氧化脂质、ROS水平,改善疾病。
综上所述,肝癌细胞因存有较常见的铁代谢水平障碍,极易引发细胞中铁死亡,对于调控铁死亡可对肝细胞癌的发展有一定影响,且在肝细胞内NNMT和铁代谢水平有一定关联,NNMT水平提升可有效增强肿瘤细胞增殖、侵袭及迁移能力,提高了肿瘤细胞对于疾病用药物化疗中的耐药效果,而降低NNMT,可经引导产生ROS及能量紊乱,提高了肿瘤细胞的死亡,使得细胞的生存水平下降。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] SHIMADA"S,"MOGUSHI"K,"AKIYAMA"Y,"et"al."Comprehensive"molecular"and"immunological"characterization"of"hepatocellular"carcinoma[J]."EBio"Med,"2019,"40:"457–470.
[2] TEMRAZ"S,"NASSAR"F,"KREIDIEH"F,"et"al."Hepatocellular"carcinoma"immunotherapy"and"the"potential"influence"of"gut"microbiome[J]."Int"J"Mol"Sci,"2021,"22(15):"7800.
[3] TAN"D"J"H,"NG"C"H,"LIN"S"Y,"et"al."Clinical"characteristics,"surveillance,"treatment"allocation,"and"outcomes"of"non-alcoholic"fatty"liver"disease-related"hepatocellular"carcinoma:"A"systematic"review"and"meta-analysis[J]."Lancet"Oncol,"2022,"23(4):"521–530.
[4] 张彦亭,"杨振威,"原姗姗,"等."ZEB1通过诱导NNMT的表达调控胃癌细胞的免疫逃逸[J]."医学分子生物学杂志,"2021,"18(5):"360–365.
[5] 杨雨嘉,"姚茜,"霍慧敏,"等."鼻咽癌细胞体外诱导肿瘤相关成纤维细胞形成并上调NNMT表达[J]."广西医科大学学报,"2022,"39(4):"520–525.
[6] 赵磊,"王姝昊,"孙紫洋,"等."NQO1生物活性药物β-Lapachone抑制皮肤鳞状细胞癌A431增殖、诱导周期阻滞及ROS生成[J]."临床与实验病理学杂志,"2022,"38(2):"187–190.
[7] 陶洁,"薛淑萍,"马晓梅."Ⅳ期肺腺癌患者ROS1基因状态与使用培美曲塞联合铂类方案化疗效果的关系[J]."中国医药导报,"2022,"19(11):"111–114.
[8] 马娇阳,"保欣晨,"张振宁,"等."正常肝细胞和肝癌细胞对镉暴露毒性响应差异分析[J]."环境科学研究,"2022,"35(1):"257–264.
[9] 杜红蕾,"张锋,"张咏华,"等."毛茛总苷通过circ_0079593/miR-324-5p通路抑制肝癌细胞增殖、迁移及侵袭的机制研究[J]."肝癌电子杂志,"2022,"9(1):"48–54.
[10] 杨蕙华,"陈大红,"刁文婧,"等."G6PD调控PI3K/Akt信号通路诱导肝癌细胞索拉非尼耐药的机制研究[J]."中国药房,"2022,"33(19):"2338–2342.
[11] 周董董,"冯婷,"徐静."红树林内生真菌来源dicerandrol"A及其对肝癌HepG2细胞的增殖抑制作用和机制的初步研究[J]."中国抗生素杂志,"2022,"47(5):"481–487.
[12] 姚元谦,"吕建林,"柳琳琳,"等."铁死亡基因及相关长链非编码RNA在肝细胞癌发生与预后中的作用[J]."中国医药导报,"2022,"19(26):"9–14.
[13] 罗羽田,"李世朋,"徐红伟,"等."铁死亡在肝癌中的调控机制及作用研究进展[J]."新乡医学院学报,"2021,"38(1):"91–96.
[14] 鞠薇薇,"于生金,"林黎娟,"等."尼克酰胺-N-甲基转移酶在肺腺癌间质中的表达及其生物学功能[J]."天津医药,"2021,"49(2):"113–118.
[15] 文智慧,"梁炜祺,"钟依秀,"等."烟酰胺-N-甲基转移酶在胃癌中高表达并与预后负相关:"基于生物信息学方法[J]."南方医科大学学报,"2021,"41(6):"828–838.
[16] 张飞宇,"阿迪拉·亚克普,"赵金明,"等."铁死亡的发生机制及在肝脏疾病中的作用[J]."临床肝胆病杂志,"2021,"37(6):"1454–1458.
[17] 孙伟,"孙立新,"郎庆赋,"等."铁死亡发生机制及其与消化系统恶性肿瘤发病的关系研究进展[J]."山东医药,"2021,"61(35):"92–96.
[18] 周嘉梁,"吴佳,"黄建锋,"等."烟酰胺N甲基转移酶在食管癌中的表达及机制研究[J]."中国血液流变学杂志,"2021,"31(4):"514–517.
[19] 邴钟兴,"王桂阁,"王彦卿,"等."烟酰胺N甲基转移酶在食管癌中的表达及其机制[J]."中华实验外科杂志,"2022,"39(1):"29.
[20] 陈珍英,"傅芳萌,"郑山,"等."99Tc"m-3PRGD"2"SPECT显像对乳腺癌新辅助化疗后病理完全缓解的预测价值及与"18F-FDG"PET/CT的比较研究"[J]."中华核医学与分子影像杂志,"2022,"42(2):"96–103.
[21] 杨洪秀,"宋苗苗,"胡思翠,"等."1例尼克酰胺转氢酶基因突变家族性糖皮质激素缺乏症的诊断[J]."山东医药,"2022,"62(18):"86–88.
[22] 张伟娇,"张巍."尼克酰胺腺嘌呤二核苷酸磷酸氧化酶在血管性认知障碍中的作用及其机制的研究进展[J]."中华老年医学杂志,"2021,"40(2):"255–259.
[23] 殷东杰,"薛梦恒,"杨过,"等."芡实壳醇提物抑制人胃癌SGC7901细胞和人肝癌HepG2细胞增殖并促进其凋亡[J]."现代食品科技,"2022,"38(6):"55–65.
[24] 胡连涛,"邓文俊,"鹿士振,"等."CC趋化因子配体20在肝细胞癌组织中的表达及其在肝细胞肝癌预后评估中作用的生物信息学分析[J]."吉林大学学报:"医学版,"2022,"48(4):"1010–1017.
[25] 陈凯,"张竹青,"马涛,"等."miR-664及其靶基因在肝癌细胞及组织中的表达及其与化疗敏感性关系研究[J]."中国免疫学杂志,"2022,"38(9):"1082–1088.
(收稿日期:2024–01–26)
(修回日期:2024–05–30)
