化学反应中的能量变化图像的分析方法
2024-12-31李智


摘 要:化学反应中的能量变化图像题是中学化学中的一个热门题型,在各级各类考试中的出现率均比较高.为了帮助学生更好地掌握此类题型的解题方法,本文分析高频高点,明确解题思路,以期提高学生求解此类题型的效率,培养其思维能力.
关键词:化学反应;能量变化图像;命题特点;高频考点;解题
中图分类号:G632"" 文献标识码:A"" 文章编号:1008-0333(2024)31-0136-03
收稿日期:2024-08-05
作者简介:李智(1976.12—),男,安徽省太湖人,本科,中学一级教师,从事高中化学教学研究.
通常,化学反应能量变化图像题以化学原理及工业生产实践为背景,利用新颖、直观且简洁的图像,将原本抽象的化学反应原理及问题信息呈现出来,主要考查了学生图像阅读、信息提取能力,故此类题型目是考试题型中的热点及重点.
1 基本概念
在化学反应过程中,能量变化一般以热量的变化为体现,还涉及发光、放电等能量形式.通常,吸热与放热反应均以化学反应为分析对象,一个化学反应到底是吸收热量还是释放热量,和反应条件之间并不存在必然的联系[1].在对吸热、放热反应进行判断之时,通常以宏观与微观分析为入手点.
高频考点1 与化学反应中的能量变化图像相结合对吸热和放热反应进行判断.
以微观为视角来看,可以将化学反应划分为两个重要过程,其一为旧化学键的断裂,其二为新化学键的生成.在旧化学键断裂的过程中,伴随着能量的吸收,而在新化学键的产生过程中,又有能量的释放相伴随,在学生学习与解题过程中常见的吸热与放热即由两种能量之间的差异而造成.从本质上来看,化学反应还能以参加反应的物质中含有的能量为视角展开思考,某一类物质的能量越小,意味着其稳定性越高,化学键键能越大,实际反应过程中化学键的形成及其断裂所需能量都比较多;与之相对应,某一类物质的能量越大,意味着其稳定性越低,化学键键能越小,实际反应过程中化学键的形成及其断裂所需能量都比较少[2].
例1 在化学反应中,能量的变化可以通过图1所示两种情况来表示,请选出以下描述中正确的选项(" ).
A.图1中的甲图能够用来表示放热反应中能量发生的变化
B.在图1的乙图中,相较于反应物而言,生成物的稳定性更高
C.图1中的甲图能够用来表示生石灰与水发生反应时能量发生的变化
D.图1中的甲图所表示的反应有需要加热的可能,而图1中的乙图所表示的反应能够发生于常温条件下
例题解析 对图1中的甲图进行观察可以知道,该图表示的化学反应能量呈现出降低之势,意味着反应物有比较高的能量,故可用来表示放热反应,A为正确选项;对图1中的乙图进行观察可以知道,该图表示的化学反应能量呈现出升高之势,意味着生成物有比较高的能量,根据前文分析,某一物质能量越低,其就会有越高的稳定性表现,故而反应物的稳定性比较高,B为错误选项;石灰与水发生反应属于放热反应,因而其与图1中的甲图相符,C为正确选项;在化学反应中,放热和吸热与人们日常生活中的加热与不加热并没有必然的联系存在,就算处于加热条件之下,依旧有可能发生放热反应,不仅如此,就算处于常温或低温条件之下,同样有发生吸热反应的可能,故D为正确选项.综合上述分析,本题答案为ACD.
2 涉及过渡态的图像
过渡态并非真实存在的,但是中间体是真实存在的.在一个化学反应中,只需要一步便能直接转化为所需产物的反应被称为基元反应,反应中包括过渡态但是不含中间体;与基元反应相对应的即非基元反应,不仅包括过渡态,也包括中间体,如图2所示.
高频考点2 与反应历程相结合对化学反应能量的变化进行分析.
任意化学反应历程中均会有能量的变化相伴随,利用图像,能够了解每一步实际发生何种反应,并对各步反应需要的活化能进行计算,在此基础上,以活化能大小为依据完成对反应速度快慢的判断[3].
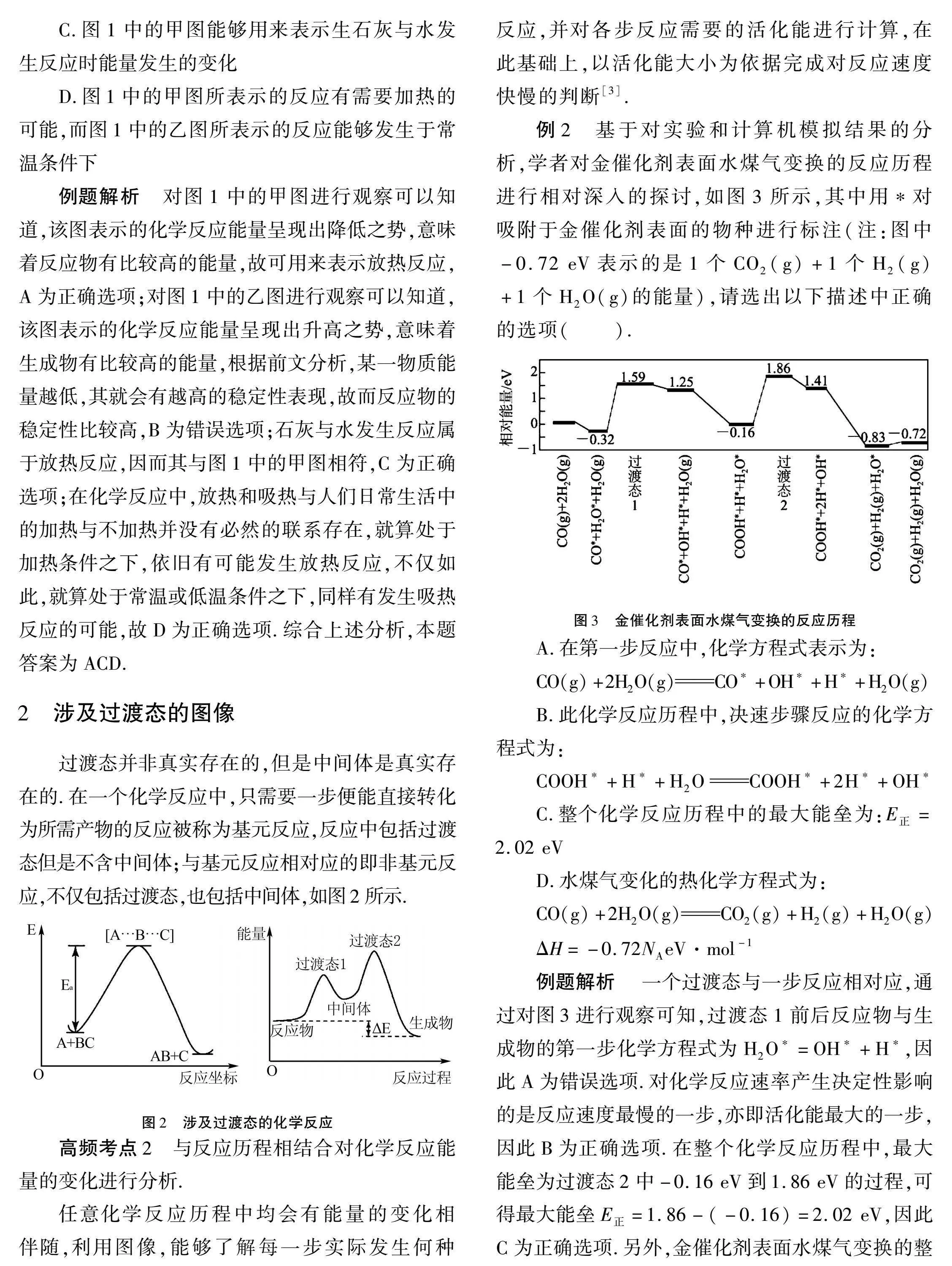
例2 基于对实验和计算机模拟结果的分析,学者对金催化剂表面水煤气变换的反应历程进行相对深入的探讨,如图3所示,其中用*对吸附于金催化剂表面的物种进行标注(注:图中-0.72 eV表示的是1个CO2(g)+1个H2(g)+1个H2O(g)的能量),请选出以下描述中正确的选项(" ).
A.在第一步反应中,化学方程式表示为:
CO(g)+2H2O(g)CO*+OH*+H*+H2O(g)
B.此化学反应历程中,决速步骤反应的化学方程式为:
COOH*+H*+H2OCOOH*+2H*+OH*
C.整个化学反应历程中的最大能垒为:E正=2.02 eV
D.水煤气变化的热化学方程式为:
CO(g)+2H2O(g)CO2(g)+H2(g)+H2O(g)
ΔH=-0.72NAeV·mol-1
例题解析 "一个过渡态与一步反应相对应,通过对图3进行观察可知,过渡态1前后反应物与生成物的第一步化学方程式为H2O*=OH*+H*,因此A为错误选项.对化学反应速率产生决定性影响的是反应速度最慢的一步,亦即活化能最大的一步,因此B为正确选项.在整个化学反应历程中,最大能垒为过渡态2中-0.16 eV到1.86 eV的过程,可得最大能垒E正=1.86-(-0.16)=2.02 eV,因此C为正确选项.另外,金催化剂表面水煤气变换的整个化学反应历程为1个CO(g)+2个H2O(g)反应生成1个CO2(g)+1个H2O(g)+1个H2(g),能量变化为-0.72eV,由于ΔH是与1 mol反应所对应的能量变化,反应ΔH即-0.72NAeV·mol-1,因此D为正确选项.综合上述分析,本题答案为BCD.
3 盖斯定律的应用
在进行盖斯定律计算的过程中,需要结合已知条件将目标方程式确定下来,并明确在目标方程式中未出现却出现于已知方程式中的物质,在此基础上,对已知方程式的“加、减、乘、除”四则运算加以运用,将缺失的物质消除.
高频考点3 利用盖斯定律对ΔH进行计算
对ΔH进行计算之时,可以对燃烧热、中和热、图像、方程式、化学键以及盖斯定律等加以运用.在利用键能对反应热进行计算的过程中,明确常见单质、化合物中所含共价键的类型及其数目尤为重要(见表1).
例3 根据图4,H2(g)和ICl(g)的反应主要分反应①与反应②两个步骤进行,请选出以下描述中正确的选项(" ).
A.反应①属于放热反应
B.反应②属于放热反应
C.相较于反应②而言,反应①的速率要更慢一些,不会受到相应正反应活化能的影响
D.对于反应①与反应②,焓变和为ΔH=-218 kJ·mol-1
例题解析 通过对图5进行观察可知,在H2(g)和ICl(g)的两个反应步骤中,反应物总能量相较于生成物总能量始终更大,意味着反应①与反应②都属于放热反应,因此AB均为正确选项.另外,反应①相较于反应②的速度更慢一些,意味着前者正反应的活化能相较于后者要更大,因此C为错误选项.进一步应用盖斯定律,H2(g)和ICl(g)的反应焓变仅会受到始态与终态的影响,反应途径并不会对其产生影响,故可以确定两个步骤的焓变和为ΔH=-218 kJ·mol-1,D为正确选项.综合上述分析,本题答案为ABD.
4 结束语
化学反应中能量变化图像题型用于考查学生思维能力.面对形式多元化、抽象性与综合性不断增加的化学反应能量变化图像题型,教师应对学生进行引导,让他们合理运用图像题认知模型,从整体层面对图像信息进行综合分析,做好信息整合工作.通过对化学图像的观察、识别、抽象、比较及概括,实现问题的准确与快速解答.
参考文献:
[1]江已舒,王叶梅.把握考向,归类题型:化学反应中的能量变化考点分析[J].高中数理化,2021(23):70-74.
[2] 洪敏婷.化学反应原理图象题的解答策略与命题特点分析[J].高中数理化,2021(12):55-56.
[3] 孙红霞.化学反应历程和能量变化图像例析[J].高中数理化,2022(24):63-64.
[责任编辑:季春阳]
