失眠患者睡眠障碍特征与丘脑亚区体积关联性的年龄差异:基于MRI成像
2024-12-31潘星朵王雅君李铭李燕燕周小燕张贞刘传豪吴垠林增如
摘要:目的 观察不同年龄段失眠患者的睡眠障碍表现,并基于MRI成像采集各年龄段失眠患者脑核磁数据,比较其丘脑亚区的体积差异,探讨睡眠障碍与丘脑亚区体积之间的相关性。方法 纳入2023年7月~2024年6月就诊于福建中医药大学附属康复医院的原发性失眠患者60例,根据年龄分为青年组(18~44岁),中年组(45~59岁)和老年组(60~75岁),20例/组,采用匹兹堡睡眠质量指数评估各组患者的睡眠质量及失眠程度,并采用西门子3.0T Prisma核磁成像系统,采集患者3D T1结构像数据,自动分割并测量丘脑及6个亚区的体积,分析比较各组患者丘脑亚区的体积差异;同时采用偏相关分析方法探讨患者睡眠障碍表现与丘脑亚区体积的相关性。结果 不同年龄段的原发性失眠患者匹兹堡睡眠质量指数量表总分、入睡时间、睡眠效率及失眠程度分级的差异有统计学意义(Plt;0.05),内侧丘脑、外侧丘脑、后部丘脑和丘脑总体积的组间差异有统计学意义(Plt;0.05);偏相关分析结果显示睡眠效率与后部丘脑体积呈负相关(r=-0.274,P=0.038)。结论 不同年龄段的原发性失眠患者睡眠障碍表现不同,利用MRI成像采集并分析失眠患者脑核磁数据发现可能与丘脑系统部分脑区灰质结构萎缩有关,这为患者个体化治疗、改善临床预后提供了重要的参考依据。
关键词:失眠;睡眠障碍;丘脑亚区;年龄;结构MRI
Age-related differences in the association between sleep disorder characteristics and
thalamic subregion volumes in patients with insomnia: based on MRI
PAN Xingduo 1, 2 , WANG Yajun 3 , LI Ming 1, 2 , LI Yanyan 1, 2 , ZHOU Xiaoyan 1, 2 , ZHANG Zhen 1, 2 , LIU Chuanhao 1, 2 , WU Yin 1, 2 , LIN Zengru 1, 2
1 Department of Imaging, Rehabilitation Hospital affiliated to Fujian University of Traditional Chinese Medicine, Fuzhou 350003, China;
2 Fujian Key Laboratory of Rehabilitation Technology, Fuzhou 350003, China;" 3 Department of Rehabilitation Medicine, Fuzhou Second
General Hospital, Fuzhou 350007, China
Abstract: Objective To observe the performance of sleep disorders in insomnia patients of different ages, and to compare thevolume differences of thalamic subregions in insomnia patients of all ages based on MRI acquisition of nuclear magnetic dataof the brain, and to explore the correlation between sleep disorders and the volume of thalamic subregions. Methods Sixtypatients with primary insomnia who attended the Rehabilitation Hospital of Fujian University of Traditional Chinese Medicinefrom July 2023 to June 2024 were categorized by age into young group (18-44 years old), middle-aged group (45-59 years old),and old-aged group (60-75 years old), 20 cases per group. The Pittsburgh sleep quality index was used to assess the sleepquality and degree of insomnia of the patients in each group, and the Siemens 3.0T Prisma magnetic imaging system was usedto collect 3D T1 structural image data of the patients, to automatically segment and measure the volumes of the thalamus andsix subregions, and to analyze and compare the thalamic subregions of the patients in each group. We analyzed and comparedthe volume differences of the thalamic subregions in each group of patients, and explored the correlation between the patients'sleep disorders and the volume of the thalamic subregions using partial correlation analysis. Results The Pittsburgh sleepquality index total score, sleep latency, habitual sleep efficiency and insomnia degree grading differed among patients withprimary insomnia of different ages (Plt;0.05), and significant intergroup differences existed among the medial thalamus, lateralthalamus, posterior thalamus and thalamus total volume (Plt;0.05). Moreover, the results of the partial correlation analysisshowed that the sleep efficiency was negatively correlated to the volume of posterior thalamus (r=-0.274, P=0.038). ConclusionPrimary insomnia patients of different age groups have different manifestations of sleep disorders. MRI was used to collectbrain nuclear magnetic data from insomnia patients, and the analysis of the MRI data revealed that it might be related to theatrophy of grey matter structures in some brain regions of the thalamic system, which provides an important reference forindividualized treatment of the patients and improvement of clinical prognosis.
Keywords: insomnia; sleep disorder; thalamic subregion; age; structural MRI
失眠是心血管疾病、认知功能障碍、情感障碍及肥胖等多种健康问题发生的重要风险因素[1-3] 。研究指出老年人的失眠患病率为30%~48%,显著高于年轻人[4] 。个体的睡眠-觉醒模式和昼夜节律对睡眠质量有着重要影响,昼夜节律和睡眠巩固会随着正常衰老而中断[5] 。与青年及中年人相比,老年人表现出总睡眠时间减少、睡眠效率降低、睡眠潜伏期增加及夜间清醒次数增多等现象[6]。
丘脑作为调节睡眠-觉醒的关键结构,在睡眠障碍的病理生理中占据重要地位[7] 。研究发现,原发性失眠患者的丘脑结构存在明显的异常改变[8-10] ,与正常睡眠者相比,失眠患者的丘脑灰质体积较小[11] 。丘脑的不同亚区具有不同的功能,如中央内侧丘脑核对注意力、运动准备和觉醒相关活动至关重要[12-15] ,而下丘脑后部的结节乳头体核参与觉醒产生[16, 17] ,前部的腹外侧视前核则与睡眠的产生有关[18] 。这些觉醒与睡眠中心相互抑制,从而调节觉醒与睡眠状态的转换[19] 。此外,研究还发现丘脑体积随着年龄增长显著减小,与年龄显著相关的亚区主要集中在丘脑的内侧和后部[20]。
既往研究通过功能核磁共振低频振幅分析法发现,失眠障碍患者右侧丘脑的激活程度与匹兹堡睡眠质量指数量表(PSQI)及失眠严重程度指数(ISI)呈显著负相关[21] ;左侧丘脑的低频振荡分数幅度与清晨觉醒分数也呈显著负相关[22] 。利用基于体素水平的图论度量值—功能连接密度分析方法的研究发现,原发性失眠患者双侧丘脑的功能连接密度值较健康对照组显著减少,且与ISI呈显著负相关[23] 。这些研究结果提示丘脑的结构及功能改变与睡眠障碍密切相关。然而目前关于丘脑/丘脑亚区与睡眠障碍的相关性研究,多集中在丘脑与大脑不同区域的功能连接上,而关于丘脑/丘脑亚区体积与睡眠障碍的相关性研究相对较少,且关系尚不明确。虽有研究将原发性失眠患者双侧丘脑体积与PSQI、ISI等失眠量表评分进行相关性分析,但结果并未发现显著相关性[24] ;一项针对老年失眠患者的双侧丘脑体积与ISI的相关性分析也未发现相关性[25] 。但这些研究存在样本量少、未对患者进行年龄分组或仅选取老年患者的局限性,且均未将丘脑细分为不同亚区进行探讨。
本研究以年龄作为分组依据,对不同年龄段的失眠患者分别进行失眠程度及丘脑体积的评估与测量,同时将丘脑划分为不同亚区,以探讨不同年龄段原发性失眠患者中具体哪个丘脑亚区出现异常,从而导致睡眠障碍的不同表现。鉴于年龄是影响原发性失眠患者睡眠昼夜节律的重要因素,且睡眠障碍的发生与丘脑及其亚区的异常改变有关,本研究旨在通过观察不同年龄段原发性失眠患者的睡眠及丘脑亚区结构特征,阐明不同年龄段原发性失眠的临床特征及其潜在机制,为其早期预防及干预提供理论和科学依据。
1 资料与方法
1.1 研究对象
收集2023年7月~2024年6月在福建中医药大学附属康复医院就诊的失眠患者60例,按年龄分为青年组(18~44岁)、中年组(45~59岁)和老年组(60~75岁),20例/组。本研究已通过福建中医药大学附属康复医院伦理委员会审批(审批号:2023KY-031-001).
纳入标准:符合《美国精神障碍诊断与统计手册(第5版)》中原发性失眠的诊断标准;年龄18~75岁;PSQI总得分gt;7分。排除标准:患有严重的心血管、肝、肾或造血系统疾病;失眠由神经系统疾病(如中风、帕金森病)引起;患者长期服用抗失眠药物或参与筛选前1月内服用抗失眠药物超过1周/次;孕妇或哺乳期妇女;患有幽闭恐惧症。
1.2 研究方法
1.2.1 睡眠质量评估 采用PSQI评估受试者主观评定最近1月的睡眠质量[26] 。PSQI由19个自评条目和5个他评条目构成,总分为0~21分,得分越高表示睡眠质量越差。该量表 Cronbach's α 系数为 0.842,信效度较好[26, 27],包括主观睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物、日间功能障碍等7个维度(本研究中排除服用催眠药物的患者,故不计入该维度)。每个维度按0~3分计分。根据国内PSQI修订版标准,PSQI总分gt;7表示有睡眠质量问题,7~11分为轻度睡眠障碍,12~16分为中度睡眠障碍,17~21分为严重睡眠障碍[28]。
1.2.2 丘脑MRI数据采集 MRI数据采用3.0T Prisma核磁成像系统(西门子)采集,使用64通道头颈联合线圈,采集高分辨率T1解剖结构图像,采用T1加权的梯度回波成像序列。扫描参数如下:脉冲重复时间/回波时间=2200/2.48 ms,扫描矩阵256×256,视野230 mm×230mm,层厚1 mm,层数176层,翻转角度8°,翻转时间900ms。
1.2.3 丘脑亚区体积分割 T1像预处理后,在Freesurfer软件中使用丘脑分割命令完成丘脑亚区自动化分割。首先,使用Freesurfer “recon‐all”功能处理T1图像,校正MRI强度不均匀性和波动,去除颅骨,并对皮质和皮质下大脑结构进行基于强度的自动分割。然后,将左右丘脑分成25个不同的核团,再根据既往研究模型将其分为前部、腹侧、内侧、外侧、后部、内髓板6个部分[29] 。其中,前部包含前腹核;腹侧包含腹前核、腹前侧大细胞区、腹外侧前核、腹外侧后核、腹内侧核、腹后外侧核;内侧包含背内侧的内侧大细胞区、背内侧的外侧小细胞区、腹内侧、带旁核;外侧包含背外侧核、外后侧核;后部包含枕前侧核、枕内侧核、枕下侧核、枕外侧核、外侧膝状体、内侧膝状体、界膜;内髓板包含中央内侧核、中央中核、中央外侧核、中央旁核、束旁核。最后计算估计颅内总体积(eTIV),以控制不同个体大脑大小的影响。
1.3 统计学分析
采用 SPSS 25.0软件进行数据分析。计量资料以均数±标准差或中位数(四分位数间距)表示,计数资料以n(%)表示。年龄、受教育年限不符合正态分布,采用非参数Kruskal-Wallis检验;性别采用χ 2 检验。由于不同组别患者的受教育年限基线不均,将其作为协变量,采用广义线性模型进行分析。丘脑亚区体积分析中,除受教育年限外,还将丘脑总体积纳入作为协变量,采用一般线性模型或广义线性模型进行分析;比较丘脑总体积差异时,将受教育年限和eTIV作为协变量。以Plt;0.05为差异有统计学意义。将上述组间差异有统计学意义的脑区和PSQI分数进行偏相关分析,以受教育年限和eTIV/丘脑总体积为协变量,探索其相关性。
2 结果
2.1 一般人口学资料及PSQI评分
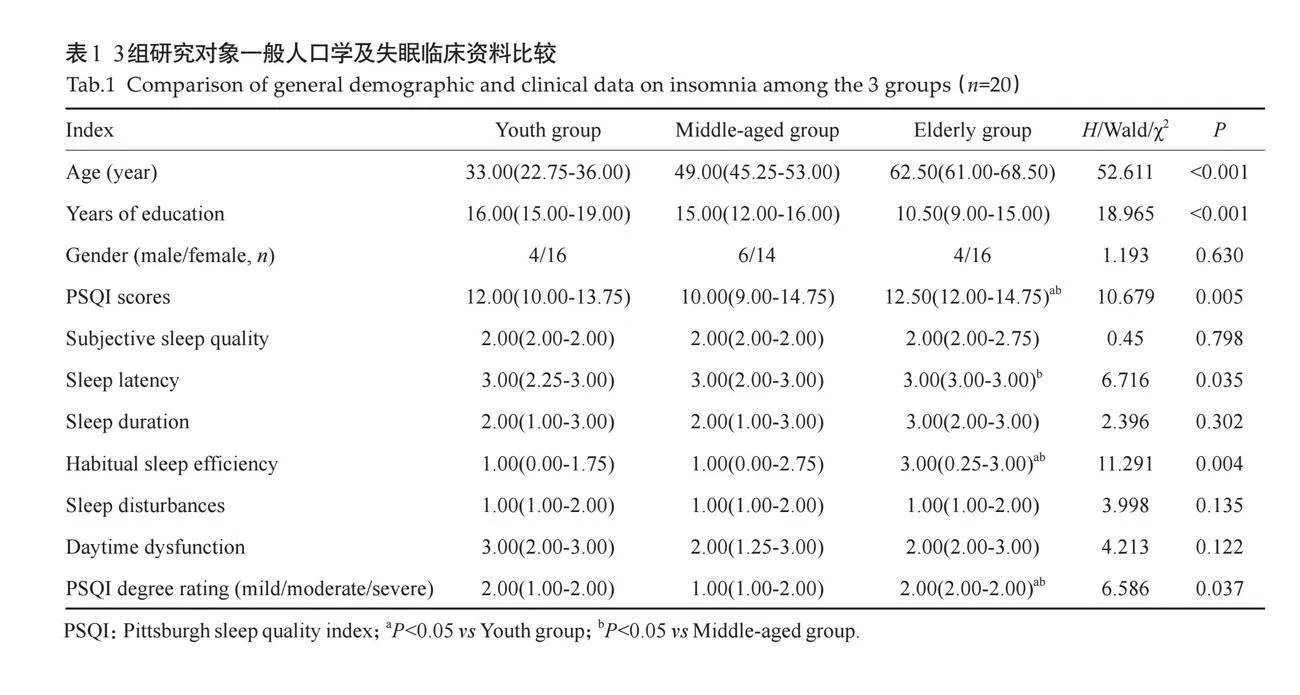
3组失眠患者的性别差异无统计学意义(Pgt;0.05),受教育年限的差异有统计学意义(Plt;0.001),因此将其作为协变量。PSQI总得分及失眠程度分级的差异有统计学意义(Plt;0.05),两两比较发现青年组、中年组与老年组之间的差异有统计学意义(Plt;0.05),而青年组与中年组的差异无统计学意义(Pgt;0.05);PSQI中入睡时间及睡眠效率两个维度也存在差异(Plt;0.05),青年组、中年组与老年组之间睡眠效率的差异均有统计学意义(Plt;0.05),中年组和老年组的入睡时间差异也有统计学意义(Plt;0.05)。3组睡眠质量、睡眠时间、睡眠障碍、日间功能的差异无统计学意义(Pgt;0.05,表1)。
2.2 丘脑亚区体积
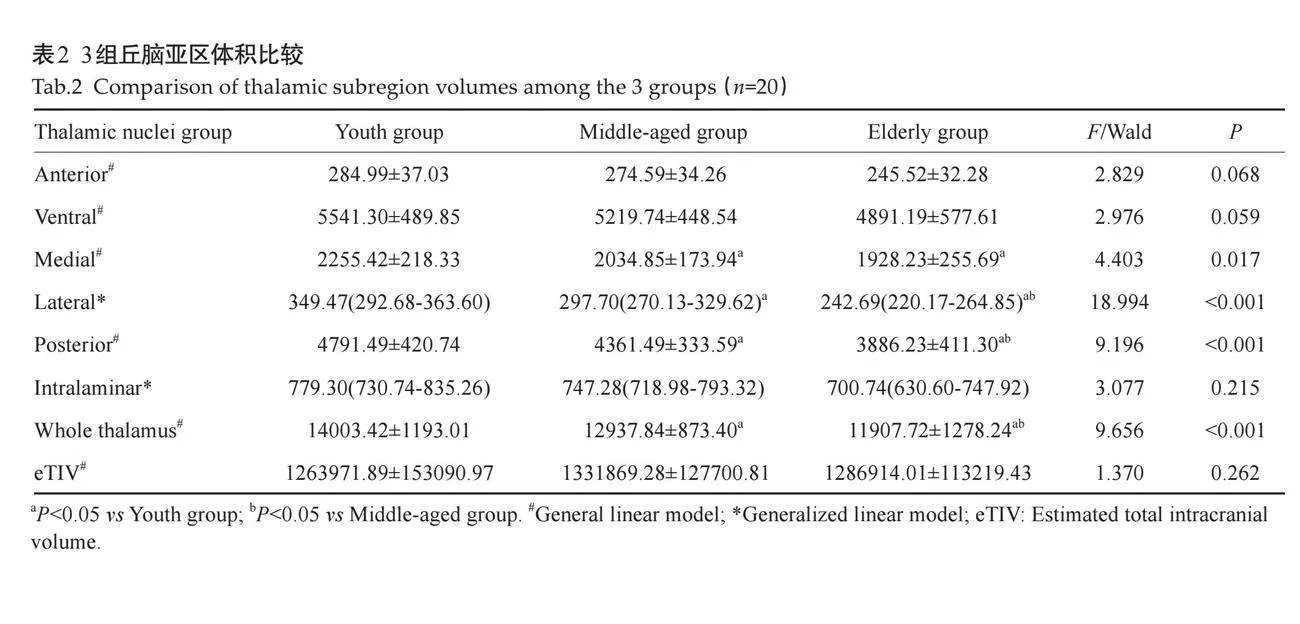
3组失眠患者中,内侧、外侧、后部这3个丘脑亚区体积以及丘脑总体积的差异均有统计学意义(Plt;0.05)。随着年龄的增大,这些区域的体积呈现减小趋势。组间两两比较发现,外侧丘脑亚区、后部丘脑亚区以及丘脑总体积在3组间的差异均有统计学意义,而内侧丘脑亚区的体积差异则仅在青年组与中年组、青年组与老年组之间有统计学意义(Plt;0.05,表2)。
2.3 相关性分析
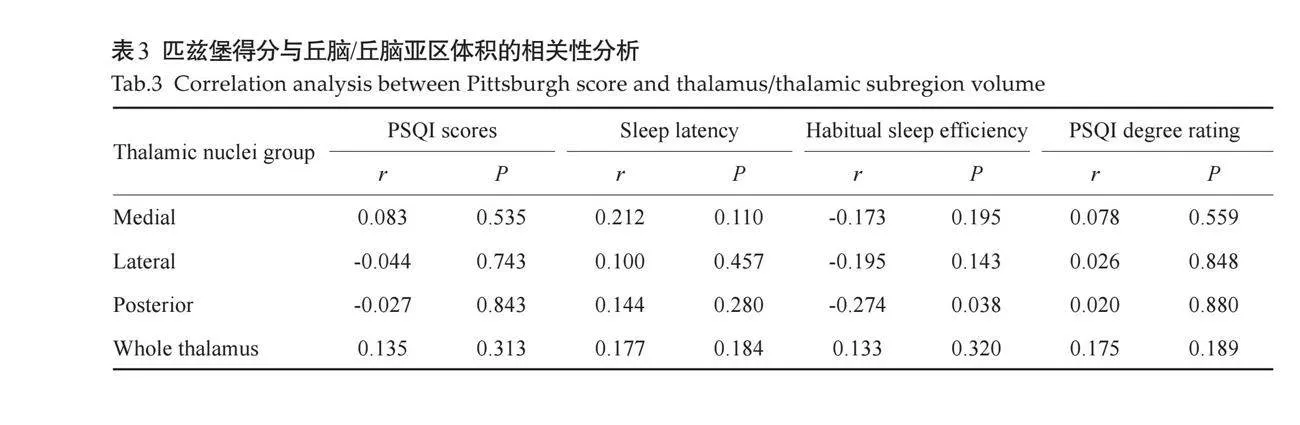
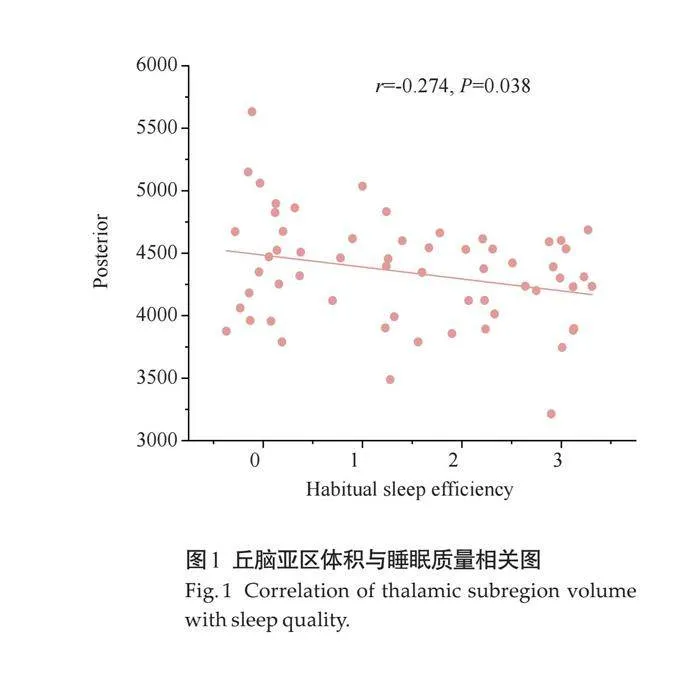
将PSQI评分中存在差异的项目(包括PSQI总分、失眠严重程度、入睡时间和睡眠效率)与丘脑亚区中体积存在差异的区域(即内侧、外侧、后部丘脑亚区以及丘脑总体积)进行相关性分析。结果显示,睡眠效率与后部丘脑体积之间存在负相关关系(r=-0.274,P=0.038)。而其他丘脑亚区与失眠的各项表现之间无相关性(Pgt;0.05,表3、图1)。
3 讨论
本研究深入探讨了不同年龄段失眠患者的睡眠障碍表现,并着重分析了丘脑亚区体积的变化及其与睡眠障碍之间的相关性。结果表明,老年组的PSQI得分高于青年组和中年组,反映出老年患者的失眠严重程度加剧。进一步分析入睡时间和睡眠效率,发现不同年龄组的患者呈现出明显差异。具体而言,青年组与中年组睡眠效率的差异无统计学意义,但老年组的睡眠效率得分升高,说明随着年龄增长,患者的睡眠质量逐渐恶化;入睡时间的差异主要体现在中年组与老年组之间,进一步印证了年龄对睡眠模式的影响。
随着年龄的增长,这些关键区域的体积逐渐减小,这一趋势与先前关于丘脑功能衰退与失眠之间关系的研究相吻合[21-23]。本研究在以下几个方面提供了新的见解:首先,本研究不仅观察了不同年龄段失眠患者的整体睡眠障碍表现,还深入分析了丘脑亚区体积的变化。既往研究多集中在单一年龄段或整体丘脑体积的变化上,而本研究首次揭示了不同年龄失眠患者丘脑内侧、外侧和后部多个亚区体积变化的特异性模式。其次,本研究发现后部丘脑亚区体积与PSQI睡眠效率子维度之间存在显著的负相关关系,这一发现直接支持了丘脑在调节睡眠效率中的关键作用,并与先前关于丘脑功能衰退与失眠之间关系的研究相吻合[21-23],此外,本研究还与先前关于丘脑簇系数与睡眠质量负相关的发现相呼应[30] ,进一步巩固了丘脑在整体睡眠调节中的核心地位。
然而,本研究也发现了一些与既往研究不完全一致的结果。例如,在内侧丘脑亚区,青年组与中年组及老年组之间存在明显的体积差异,但中年组与老年组之间并未表现出显著的体积变化。随着年龄的增长,丘脑作为深部核团之一,也会经历体积缩小[20]。这种年龄相关的变化可能与丘脑内部不同亚区的功能退化和重塑有关,特别是内侧和后部亚区。这种变化不仅影响了个体的睡眠-觉醒功能,还可能对认知、情感等高级功能产生深远的影响。这一发现可能与样本量、研究设计或患者特征有关,也可能反映了不同年龄段失眠患者在丘脑亚区受影响程度和方式上的差异。为了深入理解这些差异的原因,未来的研究可以进一步探讨丘脑内部不同亚区之间的相互作用机制,以及这些机制如何受到年龄、性别、遗传等多种因素的影响。
本研究发现丘脑作为大脑中至关重要的中继站,在睡眠与觉醒的调控中发挥着独特而重要的作用[31] 。丘脑不仅能够诱导睡眠,还能引导觉醒,确保在需要时能够快速唤醒大脑和身体。这种平衡与调节机制对于维持个体的日常功能和生活质量至关重要。然而,当个体遭受长期失眠的困扰时,丘脑的结构和功能可能会受到显著影响。
影像学研究显示,失眠患者的丘脑及其部分亚区体积会发生变化,这种变化可能反映了大脑在应对睡眠剥夺或质量下降时的应对策略—无论是适应性调整还是损伤性反应。丘脑结构的萎缩,特别是与睡眠-觉醒调控密切相关的亚区的萎缩,可能会削弱其对外界刺激的精确传导能力,进而影响个体的睡眠质量和觉醒状态[32] 。本研究观察到的丘脑后部体积减小与较高的睡眠效率得分(即较差的睡眠质量)呈负相关,进一步证实了丘脑在睡眠调节中的重要性,并提示丘脑后部体积的减小可能是导致老年人睡眠效率降低的一个重要因素。
此外,本研究还强调了丘脑与其他脑区之间的紧密联系和互动,共同构成了复杂的睡眠-觉醒调控网络。这进一步凸显了丘脑在维持正常睡眠-觉醒周期中的不可或缺性[33]。当丘脑或其相关环路受到损伤时,就可能引发严重的睡眠-觉醒障碍[34] 。例如,丘脑枕在睡眠起始阶段发挥着关键作用,它通过向大脑皮层发送相位推进信号,引导个体从清醒状态逐渐过渡到睡眠状态[7]。这一发现为理解失眠的神经病理机制提供了新的视角,并为制定更加个性化和有效的治疗方案提供了科学依据。
丘脑的不同核团在认知、睡眠及觉醒调控中也扮演着不可替代的角色。中线丘脑群通过调节皮质-丘脑振荡,确保了睡眠过程的平稳进行[35] ,而丘脑后群,特别是丘脑枕和外侧膝状体核,则专注于处理更为基础但也至关重要的功能,如视觉空间信息的整合和睡眠-觉醒周期的初步调节[7, 36]。这些发现有助于加深对丘脑功能的理解,为未来的研究提供了新的方向。
综上所述,本研究利用MRI成像采集失眠患者脑核磁数据,不仅验证了丘脑与睡眠质量的紧密联系,还揭示了丘脑内部不同亚区在睡眠调节中的具体分工和相互作用,为患者个体化治疗、改善临床预后提供了重要的参考依据。但本研究仍存在一些局限性,如样本量有限、未全面考虑其他潜在影响因素等。未来的研究应扩大样本规模,并纳入更多可能影响睡眠质量的变量进行多因素控制分析,以更全面地验证丘脑与睡眠质量之间的关系。同时,结合功能性磁共振成像、正电子发射断层扫描或脑电图等技术,可以更全面地了解丘脑在睡眠和觉醒过程中的动态变化。此外,未来还应综合考虑遗传变异、生活方式、心理压力、共病情况等多个方面,以更全面地揭示失眠的发病机制,并为临床治疗提供新的靶向策略。
参考文献:
[1] Buysse DJ. Insomnia[J]. J Am Med Assoc, 2013, 309(7): 706.
[2] Shi L, Chen SJ, Ma MY, et al. Sleep disturbances increase the risk ofdementia: a systematic review and meta-analysis[J]. Sleep MedRev, 2018, 40: 4-16.
[3] Goldstein AN, Walker MP. The role of sleep in emotional brainfunction[J]. Annu Rev Clin Psychol, 2014, 10: 679-708.
[4] Crowley K. Sleep and sleep disorders in older adults[J].Neuropsychol Rev, 2011, 21(1): 41-53.
[5] Mattis J, Sehgal A. Circadian rhythms, sleep, and disorders of aging[J]. Trends Endocrinol Metab, 2016, 27(4): 192-203.
[6] Moraes W, Piovezan R, Poyares D, et al. Effects of aging on sleepstructure throughout adulthood: a population-based study[J]. SleepMed, 2014, 15(4): 401-9.
[7] Gent TC, Bassetti C, Adamantidis AR. Sleep-wake control and thethalamus[J]. Curr Opin Neurobiol, 2018, 52: 188-97.
[8] Li M, Wang RN, Zhao M, et al. Abnormalities of thalamus volumeand resting state functional connectivity in primary insomnia patients[J]. Brain Imaging Behav, 2019, 13(5): 1193-201.
[9] Kang JMK, Joo SWJ, Son YDS, et al. Low white-matter integritybetween the left thalamus and inferior frontal gyrus in patients withinsomnia disorder[J]. J Psychiatry Neurosci, 2018, 43(6): 366-74.
[10]Huang G, Fang YY, Zhang WW, et al. Altered thalamic functionalconnectivity and cerebral blood flow in insomnia disorder: a resting-state functional magnetic resonance imaging study[J]. ClinImaging, 2022, 88: 17-23.
[11]Grau-Rivera O, Operto G, Falcón C, et al. Association betweeninsomnia and cognitive performance, gray matter volume, and whitematter microstructure in cognitively unimpaired adults[J].Alzheimers Res Ther, 2020, 12(1): 4.
[12]Barthó P, Slézia A, Mátyás F, et al. Ongoing network state controlsthe length of sleep spindles via inhibitory activity[J]. Neuron, 2014,82(6): 1367-79.
[13]Oboudiyat C, Glazer H, Seifan A, et al. Alzheimer’s disease[J].Semin Neurol, 2013, 33(4): 313-29.
[14]Bennett C, Arroyo S, Hestrin S. Subthreshold mechanismsunderlying state-dependent modulation of visual responses[J].Neuron, 2013, 80(2): 350-7.
[15]Polack PO, Friedman J, Golshani P. Cellular mechanisms of brainstate-dependent gain modulation in visual cortex[J]. Nat Neurosci,2013, 16(9): 1331-9.
[16]Steiger A. Neurochemical regulation of sleep[J]. J Psychiatr Res,2007, 41(7): 537-52.
[17]Tatemoto K, Rökaeus A, Jörnvall H, et al. Galanin - a novelbiologically active peptide from porcine intestine[J]. FEBS Lett,1983, 164(1): 124-8.
[18]Saper CB, Chou TC, Scammell TE. The sleep switch: hypothalamiccontrol of sleep and wakefulness[J]. Trends Neurosci, 2001, 24(12):726-31.
[19]Nauta WJH. Hypothalamic regulation of sleep in rats; anexperimental study[J]. J Neurophysiol, 1946, 9: 285-316.
[20]郑凤莲. 基于形态学的正常成人脑结构与年龄的相关性研究
[D].济南: 山东第一医科大学, 2019.
[21]姚 萍. 不同睡眠时长失眠障碍患者功能脑影像特点
[D]. 呼和浩特: 内蒙古医科大学, 2020.
[22]Liu CH, Liu CZ, Zhang JH, et al. Reduced spontaneous neuronalactivity in the insular cortex and thalamus in healthy adults withinsomnia symptoms[J]. Brain Res, 2016, 1648(Pt A): 317-24.
[23]任雪会, 刘瑜琳, 王金丽, 等. 基于静息态fMRI的原发性失眠全脑功能连接密度的改变[J]. 中国医学影像学杂志, 2023, 31(12): 1244-9.
[24]李 敏. 原发性失眠患者丘脑结构与功能异常影像学研究
[D]. 西安: 西安电子科技大学, 2019.
[25]Falgàs N, Illán-Gala I, Allen IE, et al. Specific cortical andsubcortical grey matter regions are associated with insomnia severity[J]. PLoS One, 2021, 16(5): e0252076.
[26]Buysse DJ, Reynolds CF 3rd, Monk TH, et al. The Pittsburgh SleepQuality Index: a new instrument for psychiatric practice and research[J]. Psychiatry Res, 1989, 28(2): 193-213.
[27]刘贤臣, 唐茂芹, 胡 蕾, 等. 匹兹堡睡眠质量指数的信度和效度研究[J]. 中华精神科杂志, 1996, 29(2): 103-7.
[28]Xiao MJ, Huang GQ, Feng L, et al. Impact of sleep quality on post-stroke anxiety in stroke patients[J]. Brain Behav, 2020, 10(12):e01716.
[29]Iglesias JE, Insausti R, Lerma-Usabiaga G, et al. A probabilistic atlasof the human thalamic nuclei combining ex vivo MRI and histology[J]. Neuroimage, 2018, 183: 314-26.
[30]Ding XQ, Li QM, Tang YY. The thalamic clustering coefficientmoderates the vigor-sleep quality relationship[J]. Sleep BiolRhythms, 2023, 21(3): 369-75.
[31]Fernandez LMJ, Lüthi A. Sleep spindles: mechanisms and functions[J]. Physiol Rev, 2020, 100(2): 805-68.
[32]Long ZL, Cheng F, Lei X. Correction: age effect on gray mattervolume changes after sleep restriction[J]. PLoS One, 2021, 16(2):e0246799.
[33]邓 弦. 丘脑非特异性核团在睡眠-觉醒调节及全身麻醉中的作用[J]. 国际麻醉学与复苏杂志, 2023, 44(7): 780-4.
[34]Shine JM, Hearne LJ, Breakspear M, et al. The low-dimensionalneural architecture of cognitive complexity is related to activity inmedial thalamic nuclei[J]. Neuron, 2019, 104(5): 849-55.e3.
[35]Vertes RP, Linley SB, Hoover WB. Limbic circuitry of the midlinethalamus[J]. Neurosci Biobehav Rev, 2015, 54: 89-107.
[36]Zhou HH, Schafer RJ, Desimone R. Pulvinar-cortex interactions invision and attention[J]. Neuron, 2016, 89(1): 209-20.(编辑:熊一凡)
