不同甜瓜品种遗传转化再生体系的建立与基因编辑植株的快速获取
2024-12-31卡地尔阿依•买买提周婷婷韩盛梅丽克汗•热西提玉山江•麦麦提




摘 要:【目的】研究不同甜瓜品种遗传转化再生体系的建立与基因编辑植株的快速获取。
【方法】选用巴吾顿、老汉瓜、其里甘、新密杂11号(86-1)4个甜瓜品种的子叶为外植体,通过农杆菌介导法侵染甜瓜子叶,采用组织培养法建立老汉瓜的遗传转化再生体系,运用PCR法检测获取基因编辑植株。
【结果】从4个甜瓜品种中筛选出老汉瓜为优势品种作为外植体,在MS+6-BA 1.0 mg/L+NAA 0.05 mg/L培养基预培养2 d和共培养3 d,在MS+6-BA 1.0 mg/L+NAA 0.05 mg/L+潮霉素5 mg/L+头孢霉素250 mg/L筛选培养基上继续培养7 d,在MS+6-BA 1.0 mg/L+NAA 0.05 mg/L+潮霉素5 mg/L+头孢霉素250 mg/L的不定芽诱导培养基上培养1~2周可见长出的小芽,将诱导芽分别放置于不加潮霉素和加潮霉素的芽伸长培养基上培养,诱导芽在不加潮霉素的芽伸长培养基上的生长速度比加潮霉素的培养基生长快,可使芽生长至2叶苗期缩短3周,在无菌环境下剪去一个芽提取DNA ,并采用RT-PCR方法检测获得21株转化植株。
【结论】筛选出基因编辑植株嫩芽,不加潮霉素的芽伸长培养基可将获得基因编辑植株周期缩短3周。
关键词:甜瓜; 农杆菌介导; 遗传转化;基因编辑植株
中图分类号:S652"" 文献标志码:A"" 文章编号:1001-4330(2024)07-1666-07
0 引 言
【研究意义】甜瓜(Cucumis melo L.)属于葫芦科(Cucurbitaceae)[1],属一年生匍匐或攀援草本植物[2]。甜瓜具有独特的芳香味道和多种形状[3]。我国新疆厚皮甜瓜种植面积较大[4]。分子生物学技术在品种改良方面应用广泛[5-6]。甜瓜遗传转化上存在效率低和周期较长等问题 [7]。因此,研究不同甜瓜品种遗传转化再生体系的建立,对基因编辑植株的快速获取有实际意义。【前人研究进展】农杆菌介导的转基因技术为众多植物提供了高效的基因转移系统[8]。Fang等[9]在20世纪80年代利用农杆菌介导的方法,将含NPT II基因Ti质粒的农杆菌,于菌株LBA4404接种甜瓜子叶外植体,并获得了抗卡那霉素的转基因甜瓜植株。田红梅等[10]通过农杆菌介导方法,获得了抗卡那霉素的抗性苗。王雪[11]也利用农杆菌介导方法进行甜瓜遗传转化,获得了3株抗性苗。【本研究切入点】选育抗逆甜瓜品种有助于提高甜瓜产量及品质[12]。虽然目前甜瓜遗传转化体系较为普遍,但是不同甜瓜品种的遗传转化体系尚不成熟,不同甜瓜品种的转化效率在0%~12.5%,遗传转化效率差异较大[13]。【拟解决的关键问题】以巴吾顿、老汉瓜、其里甘、新密杂11号(86-1)等4个甜瓜品种的子叶为外植体,利用农杆菌介导的方法,设置潮霉素抗性基因编辑植株的试验,选取遗传转化再生体系较好的甜瓜品种,缩短基因编辑植株的获得周期,为快速获取基因编辑植株提供技术支持。
1 材料与方法
1.1 材 料
选用巴吾顿、老汉瓜、其里甘和新密杂11号4个甜瓜品种,其中巴吾顿和老汉瓜品种由新疆农业科学院植物保护研究所提供,其里甘和新密杂11号品种由昌吉益丰公司提供。6-BA(6-苄氨基嘌呤)购自上海源叶生物有限公司,MS改良培养基和琼脂粉购自北京酷来搏科技有限公司,硫酸卡那霉素(kan)、潮霉素、利福平(Rifampicin)、NAA(萘乙酸)、GA3(赤霉素)和IBA购自索莱宝生物公司。所需试剂配制为母液后过滤,使用5 mL的注射器和0.22 μm的过滤器,在-20℃冰箱保存备用。农杆菌SG10592、SG10594、SG10610和pP1C.4线性化载体由新疆农业科学院植物保护研究所提供。
1.2 方 法
1.2.1 农杆菌的活化与侵染液体的制备
将-80℃冰箱保存的农杆菌活化后,采用分区划线法划线至均含有100 mg/L的利福平和卡那霉素的YEB固体培养基,28℃的培养箱黑暗培养24~48 h,单菌落长出之后,挑取SG10592、SG10594和SG10610的单菌落分别放置于均含有100 mg/L的卡那霉素(kan)和利福平(Rif)1 mL的YEB培养基,在28℃恒温摇床中,黑暗条件下培养24 h。吸取100 μL的24 h摇的农杆菌菌液,加入到50 mL YEB(含有100 mg/L 的卡那霉素(kan)和100 mg/L利福平(Rif)),黑暗条件下培养至OD值0.5~0.6 时即可[14]。
1.2.2 外植体的获取
选取新鲜粒大饱满并成熟的甜瓜种子,将胚胎从种皮中剥出来,分别在75%的酒精处理40 s,期间用无菌镊子不停地搅拌。将种子分别放在5%的次氯酸钠(NaClO)消毒20 min[14],用无菌镊子不断搅拌。取出种子用无菌水清洗5~6遍,置于无菌滤纸上至水分完全吸干,接种到不含任何激素的培养基的锥形瓶中,每个处理15粒种子,放置于光照/黑暗=16 h/8 h,温度为28℃,光强为15 000 lx的培养条件下7 d进行无菌苗培养。
1.2.3 预培养
在超净工作台中,将无菌培养7 d后的子叶取出放置于无菌滤纸上,分别切去子叶近胚轴端和远胚轴端2~3 mm,取中间段,沿子叶主脉切成2份,将子叶外植体接入到含不同激素的芽诱导培养基的平板中,每个平板10个外植体。将外植体放置在28℃、光强为15 000 lx,光照/黑暗=16 h/8 h的条件MS+6-BA 1.0 mg/L+NAA 0.05 mg/L的培养基上预培养2 d[15]。
1.2.4 农杆菌侵染外植体
(1)将预培养后甜瓜子叶,置于100 mL的无菌组培瓶中。
(2)向每个放入预培养处理甜瓜子叶的组培瓶中加入50 mL的农杆菌侵染菌液,置于28℃,160 r/min恒温摇床中,黑暗条件下震荡培养15 min。
1.2.5 共培养
将侵染的子叶取出倒入无菌的培养皿里,用无菌蒸馏水清洗6~7次,置于无菌滤纸上将水分充分吸干,放置于MS+6-BA 1.0 mg/L+NAA 0.05 mg/L共培养基中,28℃黑暗条件下共培养3 d[15]。
1.2.6 筛选培养
在黑暗条件下,将共培养之后的子叶置于MS+6-BA 1.0 mg/L+NAA 0.05 mg/L+潮霉素5 mg/L+头孢霉素250 mg/L筛选培养基中培养,每个平板放置于10片侵染子叶,培养7 d后,从筛选培养及上选取绿色的子叶,弃黄色并枯死的子叶,用灭菌过的蒸馏水清洗5次后,换置于不定芽诱导培养基。
1.2.7 基因编辑植株不定芽诱导
在筛选培养基培养之后的子叶置于MS+6-BA 1.0 mg/L+NAA 0.05 mg/L+潮霉素5 mg/L+头孢霉素250 mg/L的不定芽诱导培养基中培养2周,每个平板放置于10片侵染子叶,14 d之后统计生长状况。
1.2.8 不定芽伸长
在不定芽诱导培养基上培养14 d之后的外植体放置于芽伸长培养基上培养7 d。
1.2.9 快速获取基因编辑植株
在芽伸长培养基上培养7 d之后的抗潮霉素芽的一部分在加潮霉素的芽伸长培养基(MS+6-BA 0.05 mg/L+GA3 0.15 mg/L+潮霉素5 mg/L+头孢霉素250 mg/L)上培养,另一部分不加潮霉素的芽伸长培养基(MS+6-BA 0.05 mg/L+GA3 0.15 mg/L头孢霉素250 mg/L)上培养,14 d之后观察芽伸长状况。
1.2.10 生根培养基
芽伸长大概3~4 cm时置于MS+IBA(0.5)mg/L+潮霉素5 mg/L+头孢霉素250 mg/L的生根培养基上培养15 d左右。
1.2.11 移苗或炼苗
根部生长2周之后,用无菌水清洗根部的培养基残留,移至无菌土的营养钵上,在人工气候箱内放5~7 d,放置于人工气候室培养。
1.2.12 提取基因编辑植株的叶片DNA
采用多糖多酚植物基因组DNA提取试剂盒,抗性植株有3~4片子叶时可提取子叶的DNA,操作步骤按照使用说明书进行。
1.2.13 引物设计
从eIF4E基因的合适位点选择sgRNA的靶向序列,针对该基因设计sgRNA的靶向序列引物(上海生工生物工程股份有限公司)。表1
1.2.14 PCR检测
以获得的DNA为模板,HPT-1F ,HPT-1R为上下游引物,进行RT-PCR,反应条件:94℃ 4 min预变性,94℃ 30 s变性,55℃ 30 s退火,72℃ 35 s延伸,共35个循环,反应体系。表2
2 结果与分析
2.1 甜瓜不同品种出愈率、不定芽诱导率及芽伸长率之间的差异
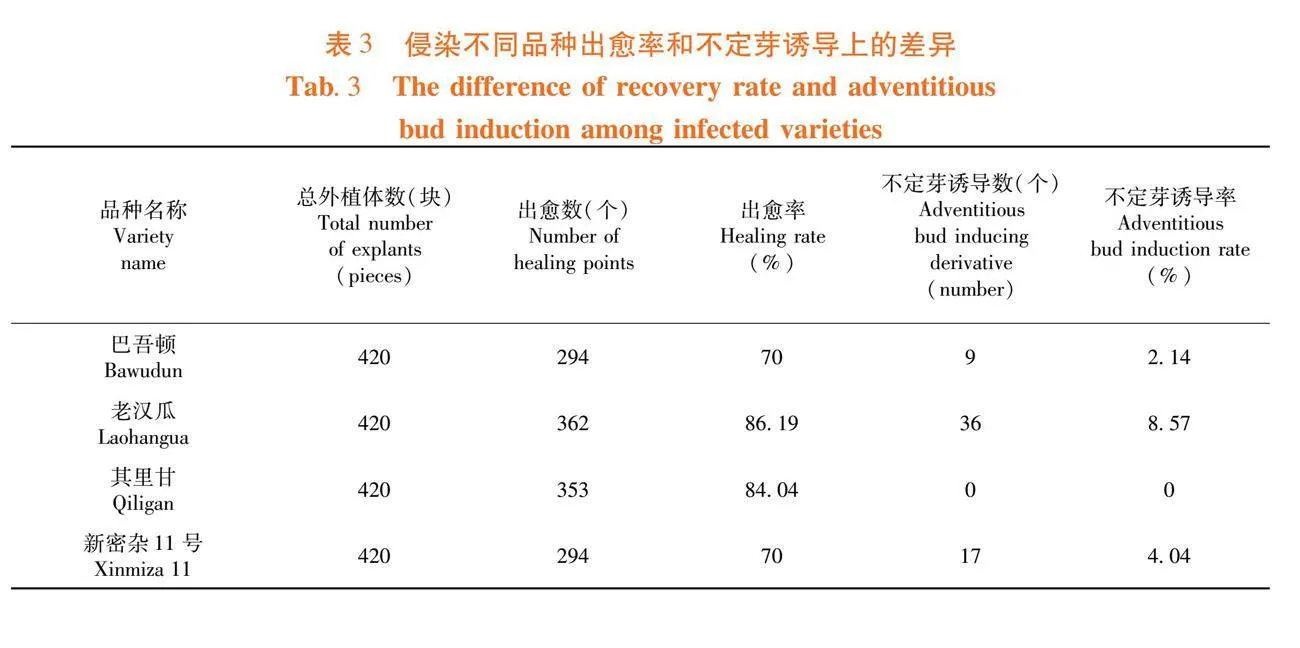
研究表明,在MS+6-BA 1.0 mg/L+NAA 0.05 mg/L+潮霉素5 mg/L+头孢霉素250 mg/L的不定芽诱导培养基上,巴吾顿、老汉瓜、其里甘和新密杂11号4个品种的出愈率分别为70%、86.19%、84.04%和70%,其中出愈率最佳的为老汉瓜,出愈率最低的是巴吾顿和新密杂11号,为70%。巴吾顿、老汉瓜、其里甘和新密杂11号4个品种的芽诱导率分别为2.14%、8.57%、0%和4.04%,其中芽诱导率最佳的是老汉瓜。表3
2.2 甜瓜不同品种的褐化率和不定芽伸长上的差异
研究表明,在MS+6-BA 0.05 mg/L+GA3 0.15 mg/L+潮霉素 5 mg/L+头孢霉素250 mg/L的芽伸长培养基上,巴吾顿、老汉瓜、其里甘和新密杂11号4个品种的褐化率分别为57.85%,47.61%,61.90%和52.38%。褐化率最高的为其里甘,最低为老汉瓜。巴吾顿、老汉瓜、其里甘和新密杂11号4个品种不定芽伸长率分别为0.23%、1.90%、0%和0.23%,芽伸长率最高的老汉瓜为1.90%,最低的巴吾顿为0.23%。表4
2.3 基因编辑芽的快速获取
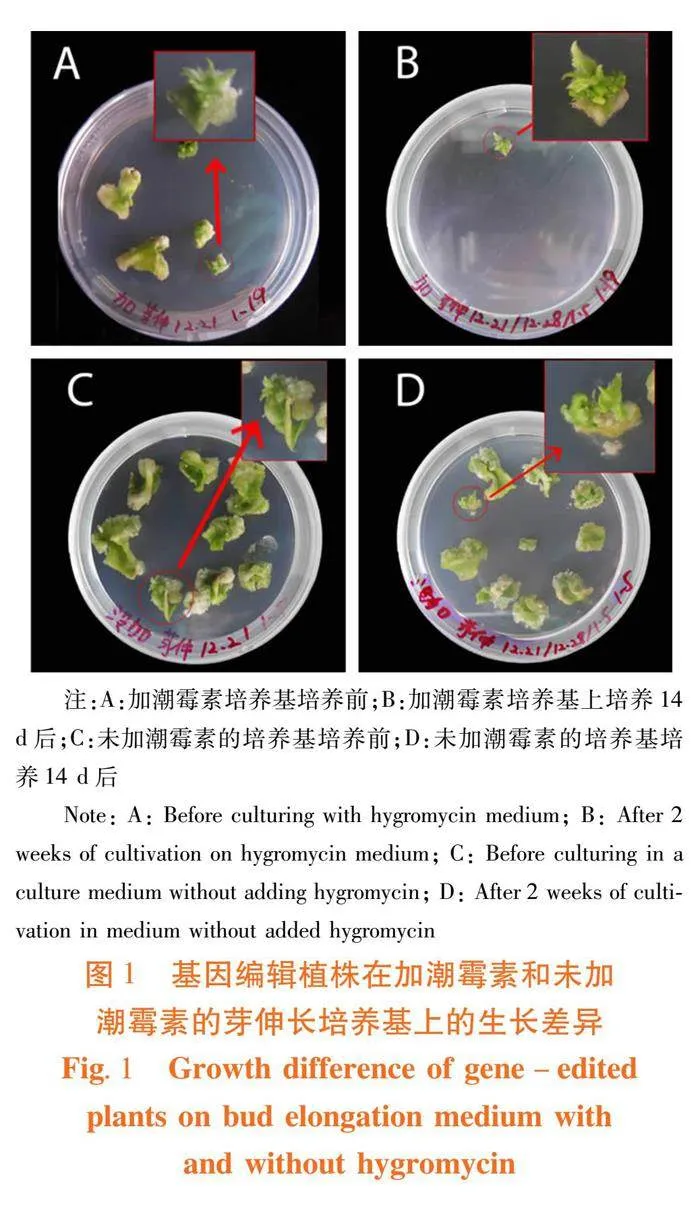
研究表明,在芽伸长培养基上培养一周后的外植体切去周围多余的愈伤组织,放置于加潮霉素的芽伸长培养基(MS+6-BA 0.05 mg/L+GA3 0.15 mg/L+潮霉素 5 mg/L+头孢霉素250 mg/L),培养2周之后芽伸长较慢,甚至无明显的伸长。放置于不加潮霉素的芽伸长培养基(MS+6-BA 0.05 mg/L+GA3 0.15 mg/L头孢霉素250 mg/L)上的芽明显伸长较快。图1
2.4 抗性基因编辑芽的基因组提取DNA
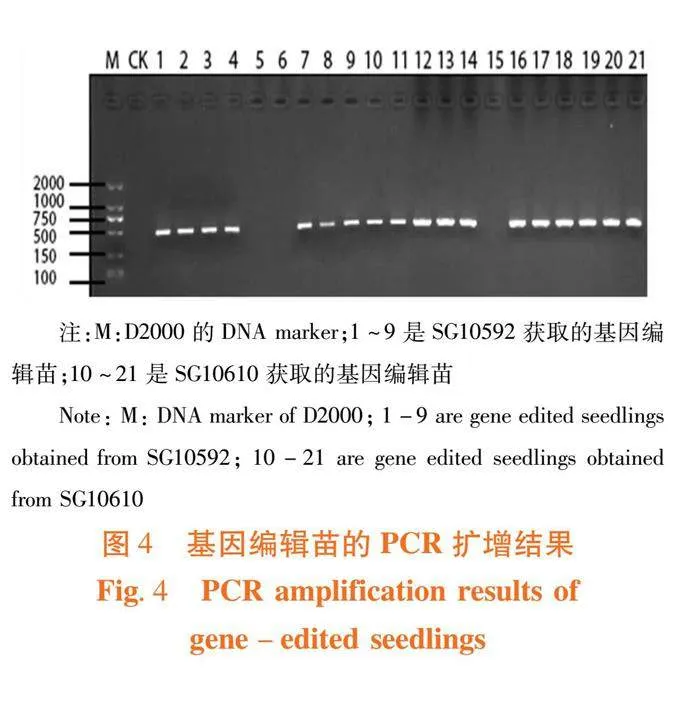
研究表明,1~21号的DNA提取较好,条带清晰,经1%的琼脂糖凝胶电泳检测后,提取得DNA可以进行后续PCR检测。提取的DNA在-20℃冰箱保存备用。图2,图3
2.5 抗性基因编辑苗的 PCR检测
研究表明,潮霉素筛选获得植株共21株,阳性苗18株,其中SG10592和SG10610转化的阳性苗分别为7株和11株。1~4号、7~14号和16~21号基因编辑植株均扩增出目的片段,5号、6号和15号获取的甜瓜基因编辑植株未扩增出来目的片段,出现假阳性。图4,图5
3 讨 论
3.1
基因编辑技术已被众多植物的基因工程和基因表达广泛应用[16]。在甜瓜遗传转化和农杆菌介导的研究中,甜瓜离体再生作为前提和重要部分[17]。不同甜瓜的遗传转化体系和转化率不同[18],试验结果表明,老汉瓜的芽诱导率,芽伸长率和转化率最高。
3.2
在确定抗生素的浓度时,需要即对外植体的危害性低,又能够筛选出抗性植株,抗生素的浓度过高将导致外植体的快速褐化,甚至导致植物组织的迅速死亡[19]。颜雪等[20]的试验预培养3 d,李建勇等[15]的试验结果表明,预培养2 d和共培养3 d的转化率高,试验的结果表明预培养3 d的效果最佳,与颜雪等[20]、李建勇等[15]的试验效果一致。夏雪琴[21]的试验结果表明,共培养时间超过3 d时抗性芽的分化率下降,共培养为3 d的时间有利于芽的分化,试验利用相同的共培养时间为3 d时,芽的分化率最佳。常尚连[22]的试验结果显示,最合适的侵染时间为15 min,试验中外植体侵染时间为15 min时试验效果最佳。王爽[23]的研究结果表明,头孢浓度250mg/L是抑制菌的效果最好,试验进一步验证了使用250 mg/L的头孢效果最佳。
4 结 论
采用RT-PCR方法检测获得21株转化植株。老汉瓜品种的芽诱导率和芽伸长率与其他3个品种相对较好,4个品种中老汉瓜作为农杆菌侵染的优势品种。
参考文献(References)
[1]
Garcia-Mas J, Benjak A, Sanseverino W, et al. The genome of melon (Cucumis melo L.)[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(29): 11872-11877.
[2] 池慧芳, 翟丽丽, 刘丽娜, 等. 甜瓜组织培养研究进展及应用概况[J]. 内蒙古农业科技, 2014, 42(5): 108-109.
CHI Huifang, Zhai Lili,Liu Lina, et al. Research progress and application prospect of melon tissue culture[J]. Inner Mongolia Agricultural Science and Technology, 2014, 42(5): 108-109.
[3] Nunez-Palenius H G, Gomez-Lim M, Ochoa-Alejo N, et al. Melon fruits: genetic diversity, physiology, and biotechnology features[J]. Critical Reviews in Biotechnology," 2008, 28(1): 13-55.
[4] 张铁刚, 宁雪飞, 王贤磊, 等. 新疆甜瓜“皇后” 再生体系的建立[J]. 北方园艺, 2012, (15): 122-125.
ZHANG Tiegang, NING Xuefei, WANG Xianlei, et al. Establishment of regeneration system for Cucumis melo L.cv.'Queen' of Xinjiang melon[J]. Northern Horticulture, 2012, (15): 122-125
[5] M.Galperin,L.Patlis,A.Ovdia,等.自交系BU-21/3——甜瓜(Cucumis meloL.)转基因育种的有效工具[J].中国西瓜甜瓜,2003, (4): 26-27.
M.Galperin,L.Patlis,A.Ovdia, et al. Effective tools for genetically modified breeding[J]. Foreign Watermelon and Melon Technology, 2003, (4):26-27.
[6] Puonti-Kaerlas J. Cassava biotechnology[J]. Biotechnology and Genetic Engineering Reviews, 1998, 15(1): 329-364.
[7] 王平勇, 徐永阳, 赵光伟, 等. 发根农杆菌介导甜瓜转基因过表达体系的建立[J]. 中国瓜菜, 2019, 32(12): 15-18, 30.
WANG Pingyong, XU Yongyang, ZHAO Guangwei, et al. Establishment of Agrobacterium rhizogenes-mediated gene overexpression system in melon[J]. China Cucurbits and Vegetables, 2019, 32(12): 15-18, 30.
[8] Potrykus I. Gene transfer methods for plants and cell cultures [C]//Ciba Foundation Symposium 154‐Bioactive Compounds from Plants: Bioactive Compounds from Plants: Ciba Foundation Symposium 154. Chichester, UK: John Wiley amp; Sons, Ltd., 2007: 198-212.
[9] Fang G, Grumet R. Agrobacterium tumefaciens mediated transformation and regeneration of muskmelon plants[J]. Plant Cell Reports, 1990, 9(3): 160-164.
[10] 田红梅,孙丽萍,孔庆国等. 厚皮甜瓜高效再生体系及遗传转化体系的研究[C]//.中国园艺学会第七届青年学术讨论会论文集,2006:528-531.
TIAN Hongmei, SUN Liping, KONG Qingguo, et al. Study on Efficient Regeneration System and Genetic Transformation System of Thick Skin Melon[C]. Proceedings of the 7th Youth Academic Symposium of the Chinese Horticultural Society, 2006:528-531.
[11] 王雪. CRISPR-Cas系统对老汉瓜ACC合成酶基因定点敲除及功能验证[D]. 乌鲁木齐: 新疆大学, 2017.
WANG Xue. Knocking Out ACC Synthase Gene by CRISPR-Cas System and Verifying the Function in “Laohan” Melon[D]. Urumqi: Xinjiang University, 2017.
[12] 魏爱民, 杜胜利, 韩毅科, 等. 黄瓜转基因技术体系及相关基因转化研究进展[J]. 长江蔬菜, 2010, (20): 4-8.
WEI Aimin, DU Shengli, HAN Yike, et al. Progress in cucumber transformation techniques and the related genes[J]. Journal of Changjiang Vegetables, 2010, (20): 4-8.
[13] Nuez-Palenius H G, Cantliffe D J, Huber D J, et al. Transformation of a muskmelon ‘Galia’ hybrid parental line (Cucumis melo L. var. reticulatus Ser.) with an antisense ACC oxidase gene[J]. Plant Cell Reports, 2006, 25(3): 198-205.
[14] 何丹. RNAi介导抗WMV、ZYMV、CMV转基因甜瓜材料的研究[D].乌鲁木齐:新疆农业大学,2016.
HE Dan. Studying on RNA mediated to resistgance WMV, ZYMV in transgenic melon materials [D].Urumqi: Xinjiang Agricultural University, 2016.
[15] 李建勇, 丁淑丽, 孙利祥, 等. 影响西瓜农杆菌介导的高效遗传转化效率的主要因子[J]. 浙江农业学报, 2007, 19(3): 197-201.
LI Jianyong, DING Shuli, SUN Lixiang, et al. Establishment of efficient transgenic system mediated by Agrobacterium tumefaciens in watermelon[J]. Acta Agriculturae Zhejiangensis, 2007, 19(3): 197-201.
[16] Bezirganoglu I, Hwang S Y, Shaw J F, et al. Efficient production of transgenic melon via Agrobacterium-mediated transformation[J]. Genetics and Molecular Research: GMR, 2014, 13(2): 3218-3227.
[17] 栾非时, 白晶, 朱子成, 等. 农杆菌介导薄皮甜瓜遗传转化体系建立[J]. 东北农业大学学报, 2019, 50(1): 11-18.
LUAN Feishi, BAI Jing, ZHU Zicheng, et al. Establishment of Agrobacterium mediated genetic transformation system of muskmelon[J]. Journal of Northeast Agricultural University," 2019, 50(1): 11-18.
[18] 方丽, 任海英, 茹水江, 等. 根癌农杆菌介导的甜瓜遗传转化[J]. 浙江农业学报, 2009, 21(3): 211-214.
FANG Li, REN Haiying, RU Shuijiang, et al. Agrobacterum tumefaciens-mediated genetic transformation in melon[J]. Acta Agriculturae Zhejiangensis, 2009, 21(3): 211-214.
[19] 许娜, 储俊, 夏海武, 等. 黄瓜‘新津春四号’遗传转化体系的建立[J]. 热带亚热带植物学报, 2010, 18(6): 679-684.
XU Na, CHU Jun, XIA Haiwu, et al. Establishment of genetic transformation system of cucumber ‘new Jinchun 4’[J]. Journal of Tropical and Subtropical Botany, 2010, 18(6): 679-684.
[20] 颜雪, 赵惠新, 王贤磊, 等. 甜瓜抗枯萎病基因表达载体的构建及其转化[J]. 生物技术, 2008, 18(3): 9-11.
YAN Xue, ZHAO Huixin, WANG Xianlei, et al. Construction of expression vector with R-fom-2 gene and its genetic transformation in melon[J]. Biotechnology, 2008, 18(3): 9-11.
[21] 夏雪琴. 甜瓜CmHSP83基因克隆与遗传转化[D]. 武汉: 华中农业大学, 2015.
XIA Xueqin. Cloningofthemelon’ CmHSP83 Gene and Genetic Transformation[D]. Wuhan: Huazhong Agricultural University, 2015.
[22] 常尚连. 西瓜糖代谢及甜瓜酸性转化酶反义基因的西瓜遗传转化[D]. 泰安: 山东农业大学, 2006.
CHANG Shanglian. Sugar Metabolism and Watermelon Genetic Transformation of Acid Invertase Antisense Gene of Melon[D]. Taian: Shandong Agricultural University, 2006.
[23] 王爽. ‘羊角蜜’甜瓜再生与遗传转化体系的建立[D]. 哈尔滨:东北农业大学,2021.
WANG Shuang. Establishment of Plant Regenerationand Genetic Transformation System for Melon ‘16SB29’ [D]. Harbin: Northeast Agricultural University,2019.
Establishment of genetic transformation and regeneration
systems for different melon varieties and rapid acquisition
of gene edited plants
Kadierayi Maimaiti1,ZHOU Tingting1,HAN Sheng1,
Meilikehan Rexiti2,Yushanjiang Maimaiti1
(1. Key Laboratory of Integrated Pest Management on Crops in Northwestern Oasis,Ministry of Agriculture and Rural Affairs, P . R. China / Institute of Plant Protection,Xinjiang Academy of Agricultural Sciences,Urumqi 830091, China; 2. Hami Agricultural Machinery Technology Promotion Service Center, Hami Xinjiang 839000,China)
Abstract:【Objective】 Study on establishment of genetic transformation and regeneration systems for different melon varieties and rapid acquisition of gene edited plants.
【Methods】 The cotyledons of four melon varieties, including Bawudun, Laohangua, Qiligan, and Xinmiza No. 11 (86-1).The sweet melon cotyledons were infected by Agrobacterium tumefaciens mediated method, and a genetic transformation and regeneration system of Laohan melon was established by tissue culture method and then genetically edited plants were obtained through PCR detection.
【Results】" The results showed that Laohan melon was selected as the dominant variety from four melon varieties as the explants. It was pre-cultured on MS+6-BA 1.0 mg/L+NAA 0.05 mg/L medium for 2 days and co-cultured for 3 days, then it was further cultured on MS+6-BA 1.0 mg/L+NAA 0.05 mg/L+hygromycin 5 mg/L+cephalosporin 250 mg/L screened medium for 7 days, after that, small buds were seen growing on MS+6-BA 1.0 mg/L+NAA 0.05 mg/L+hygromycin 5 mg/L+cephalosporin 250 mg/L adventitious bud induction medium for 1-2 weeks. The induced buds were placed on both non hygromycin and hygromycin added bud elongation medium for cultivation. It was found that the growth rate of the induced buds on the non hygromycin added bud elongation medium was faster than that on the hygromycin added medium, which shortened the growth of the buds to the two leaf seedling stage by 3 weeks. One bud DNA was cut off in a sterile environment and 21 transformed plants were examined by RT-PCR.
【Conclusion】"" Gene edited plant buds were successfully selected on a shoot elongation medium with added hygromycin. The use of a shoot elongation medium without added hygromycin can shorten the time for obtaining gene edited plants by 3 weeks.
Key words:muskmelon; Agrobacterium mediated; genetic transformation;genome edited plant
Fund projects:The Regional Science Foundation project of the National Natural Science Foundation of China \"Study on Polyvirus Disease Based on Crispr / Cas 9 Technology\" (31760511)
Correspondence author: Yushanjiang Maimaiti(1978-),male,from Xinjiang,doctor,professor,master supervisor ,research direction:melon crop pest" control,(E-mail)yusanjan418@163.com
收稿日期(Received):
2023-11-15
基金项目:
国家自然科学基金地区科学基金项目“基于CRISPR/Cas9技术的哈密瓜抗多病毒病非转基因材料创制研究”(31760511)
作者简介:
卡地尔阿依·买买提(1996-),女,新疆人,硕士研究生,研究方向为植物病虫害防治,(E-mail)2432443698@qq.com
通讯作者:
玉山江·麦麦提(1978-),男,新疆人,研究员,博士,硕士生导师,研究方向为瓜类作物病虫害防治,(E-mail)yusanjan418@163.com
