低温胁迫下不同藜麦品种苗期的生理响应
2024-12-31姚庆王杰花西尔娜依•阿不都拉地力木拉提•吐拉洪崔宏亮


摘 要:【目的】研究低温胁迫对不同藜麦品种幼苗生理生化特性的影响,为探索藜麦耐寒品种选育提供理论依据。
【方法】选用近几年在新疆伊犁河谷选育出的藜麦品种,经藜麦种子低温发芽试验,选出抗寒性较强的4个藜麦品种(系)编号分别为YN1、YN2、YN3、YN4为试验材料,采取营养土育苗的方法,在人工模拟低温胁迫条件下(-4℃)进行低温处理,设置正常自然温度处理为对照。
【结果】(1)藜麦对连续的-4℃低温处理具有较强的耐受性。经过低温处理的藜麦抗寒差异显著,其中YN4的抗低温能力最强,YN1的耐低温能力较强,YN3和YN2的耐低温能力较弱。(2)低温胁迫可导致叶片净光合速率、气孔导度的显著降低,光合速率由于气孔的关闭导致生长速率的降低。低温胁迫未对藜麦的光合代谢产生较大的负向影响。(3)抗氧化酶是调节藜麦耐寒性的重要活性物质,品种间活性差异显著。低温处理可显著提升超氧化物歧化酶SOD、过氧化物酶POD和丙二醛MDA活性,降低过氧化氢酶CAT的活性。耐寒性较强的品种通过提升关键性抗氧化酶活性抵抗低温胁迫。(4)稳定同位素和茎秆氮素浓度可衡量藜麦耐低温能力。
【结论】低温处理使藜麦显著降低了水分和氮素代谢过程。耐低温品种通过加速水分吸收,加速氮素代谢进程来缓解低温导致的伤害。藜麦较耐低温胁迫,但是不同品种的耐受程度有所差异。
关键词:藜麦;苗期;低温胁迫;生理生化
中图分类号:S512.9"" 文献标志码:A"" 文章编号:1001-4330(2024)07-1597-08
0 引 言
【研究意义】作物苗期若遇倒春寒灾害天气,表现为低温及持续时间跨度大,致使植株生长发育和产量形成上受到不同程度影响[1],当前我国藜麦主要在高海拔的冷凉山区(青藏高原、云贵高原等)栽培,地处内陆、降水较少的干旱沙地(河西走廊、伊犁河谷等)和高纬度盐碱含量较高的盐碱地(东北松嫩平原、华北沿海地区等)区域种植[2]。虽然藜麦适宜生长在冷凉地区,但是适宜的温度是作物生长的基本条件之一,在植物生长至不同阶段均需要与之相适应的温度才能继续维持生命活动。低温胁迫对植物的危害根据温度的不同可以分为2种:冰点以上的低温对植物造成的危害称为冷害,冰点以下的低温对植物造成的危害称为冻害[3]。在低温胁迫下,植物的茎、叶暴露在空气中,相比于地下器官,地上器官受到的影响最大,也可反映植物对低温逆境的适应特点。探索植物抗寒性机理不仅对基础理论丰富化具有重要意义,在解决实际生产的问题也具有广泛的应用价值[4]。【前人研究进展】Jacobsen等[5]利用秘鲁高原藜麦品种和安第斯谷地品种作对比,发现秘鲁高原品种能在-8℃存活4 h,抗冻性明显优于安第斯谷地品种。Geerts等[6]对于藜麦的抗性机理的研究显示,藜麦对低温的应激反应主要是积累碳水化合物以及酶的改变。沈菊等[7]通过人工模拟环境试验和自然环境试验相结合,分析青藜1号在-10℃,且低于0℃以下14 h藜麦进入休眠期,在-14℃且低于0℃以下15 h藜麦幼苗枯萎。沈忱[8]利用不同苜蓿品种对其种子进行低温胁迫,通过比较其种子萌发期耐寒性筛选出耐寒性强的苜蓿品种。温日宇等[3]以红藜、白藜、黑藜3种不同藜麦为材料,对藜麦幼苗进行人工模拟低温(4℃)胁迫,脯氨酸含量越高的品种抗逆性越强,POD、SOD活性越强,藜麦抗寒性越强。【本研究切入点】虽然藜麦是一种相对较耐寒的作物,但幼苗受到低温胁迫后,细胞膜受损,透性增大,外渗量增加,相对电导度增大。而抗寒性强的品种电导率增长幅度较小。低温刺激使可溶性糖的含量增加,可提高细胞液的浓度,对原生质体起一定的保护作用。在植株受到低温胁迫时,脯氨酸含量增加,有助于细胞或组织保水,是酶和细胞结构的保护剂[9]。不同藜麦品种在低温条件胁迫下生理生化反应不同,不同品种各个指标表现不尽一致,需明确不同藜麦品种的抗寒性强弱。【拟解决的关键问题】选取在藜麦低温发芽试验中已筛选出的4个藜麦品种(系),在温室条件下育苗后,取单株进行-4℃的低温胁迫,取样测定多项生理生化指标。从膜系统稳定性、活性氧酶促防御体系、光合生理、叶绿素特性、渗透调节物质等,阐述在低温胁迫温度下不同品种藜麦的生理指标变化特征,分析藜麦幼苗对低温胁迫的生理生化响应机制,筛选出苗期抗寒性好的藜麦品种。
1 材料与方法
1.1 材 料
材料采用新疆伊犁哈萨克自治州农业科学研究所选育的藜麦品种(系),经低温发芽试验,选出抗寒性较强的4个品种(系)编号分别为YN1、YN2、YN3和YN4。
1.2 方 法
1.2.1 试验设计
采用育苗钵育苗,基质为草炭和沙土混合物,进行催芽,露白生根之后选取单株栽入塑料花盆中,下垫2/3高度土壤,上覆2 cm土层;育苗钵置于托盘放至室外进行自然光照,给予合理水肥。
当试验植株4叶期时,每个材料选取3株进行低温处理,将藜麦苗放入-4℃恒温冷藏室内12 h(每个品种放3株),时间设定为18:00至凌晨06:00,日间拿出置于日光下,相同处理连续开展3 d。同时,每个品种选取相同长势的藜麦苗3株,夜间置于室温条件下,作为对照(CK)处理。
1.2.2 指标测定
1.2.2.1 光合作用参数
使用Licor6400测定处理前后叶片的光合指标:净光合速率(Pn)、气孔导度(GS)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、水分利用率(WUEI)。藜麦植株达到测试标准后,取长势一致的植株作为材料。处理前取部分植株测定第1片真叶的相关光合、荧光指标,作为对照数据。第3 d处理完后09:00测量光合指标。
1.2.2.2 叶绿素含量
低温处理前后使用SPAD520测量叶片叶绿素含量。
1.2.2.3 抗氧化酶活性
称取300 mg鲜样,加入预冷的50 mM pH7.5 的Tris-HCl缓冲液,冰浴研磨,以10 000 r/min冷冻离心15 min,取上清液待测。
1.2.2.4 丙二醛(MDA)含量
采用TBA-MDA显色法[10]。
MDA浓度(nmol/mL)=6.45×(A532-A600)-0.56×A450。
MDA含量(nmol/g)=[MDA浓度×V总/0.01]/W。
V总:反应体系总体积,0.5 mL;W:样本质量,g;A450、A532、A600分别为MDA显色反应液在450、532和600 nm处吸光值。
1.2.2.5 超氧化物歧化酶(SOD)
采用NBT光化还原法[11]。
SOD活性=(ODc-ODs)×VODc×0.5×Vs×t×m.
ODc:照光对照管反应混合液的吸光度;ODs:样品管反应混合液的吸光度;V:样品提取液总体积,5 mL;Vs:测定时所取样品提取液体积,0.5" mL;t:光照反应时间(15 min);m:样品质量,0.2 g。
1.2.2.6 过氧化物酶(POD)
采用愈创木酚法[12]。按照下列公式计算POD含量:以每分钟内OD470值变化1.0表示1个酶活性单位。
POD活性[U/(g·FW·min)]=ΔA470/min×VVs×m" .
式中,ΔA470/min:每分钟酶液吸光度变化值;V:提取酶液总体积,10 mL;Vs:测定时取用酶液体积,0.5 mL;m:样品质量,0.1 g。
1.2.2.7 过氧化氢酶(CAT)
采用愈创木酚法[13]。CAT的活性单位以每分钟OD值减少0.1表示一个酶活力单位。
ΔOD240=OD0-(OD1+OD2+OD3+OD4)4.
CAT活性(U/(g·FW·min))=ΔOD240×V0.1×Vs×m×t .
式中,OD0:加入煮死酶液的对照管OD值;V:酶提取液总体积,5 mL;OD1、OD2、OD3、OD4:每分钟记录样品管OD值;Vs:测定时取用酶液体积,0.1mL;m:样品质量,0.1 g;t:测定时间,4 min。
1.2.2.8 碳氮同位素
将300 mg 藜麦叶片,置于烘箱内 65℃ 下烘干 72 h 至恒重。所有样品用球磨机粉碎,粉碎后的样品采用同位素质谱仪(MAT253,Finnigan MAT,Bremen,Germany) 测定藜麦叶片δ13C、δ15。
δA = (R样品 /R标准 - 1) × 1 000‰.
式中,δA 为植物叶片δ13C、δ15N ;R样品是植物叶片13C / 12C、15N / 14N 值;R标准是标样13C / 12C、15N / 14N 值,碳、氮同位素的标样分别为国际通用标准物质 V-PDB 和空气中 N2。
1.3 数据处理
试验数据均为3次重复,用SPSS 22软件进行差异显著性分析,用Excel 2019软件作表。
2 结果与分析
2.1 低温对光合作用参数的影响
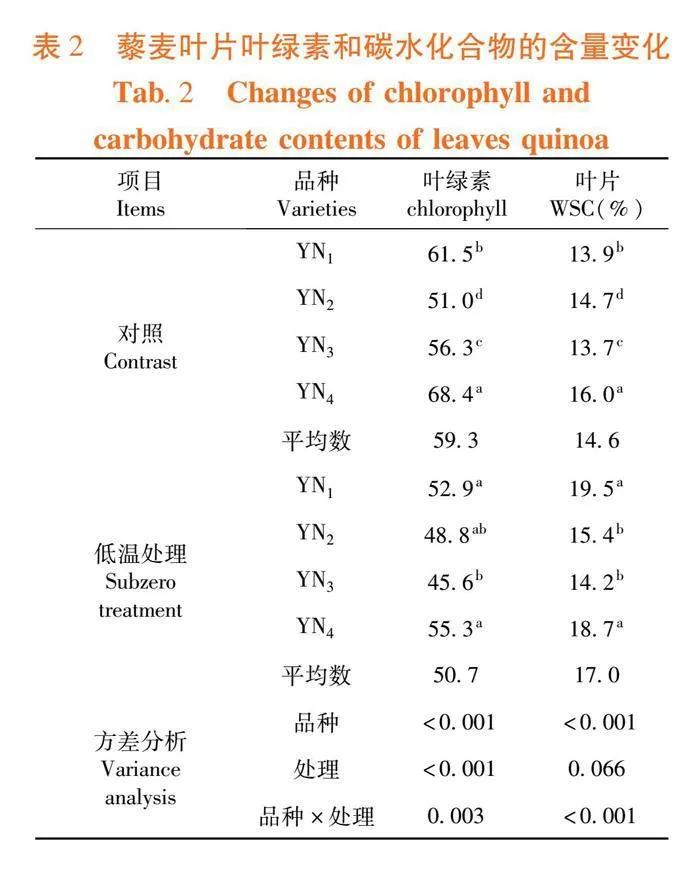
研究表明,净光合速率在不同品种间差异显著性,其中YN4的净光合速率显著低于其他品种,但是经过低温胁迫以后,YN1和YN4 的净光合速率显著高于YN2、YN3,YN4 、YN1耐低温性较强。低温处理会显著降低叶片的气孔导度,正常条件下YN4气孔导度要显著低于其他3个品种,而YN3经低温处理后气孔导度较高,此种状态下极易水分散失。胞间CO2浓度变化趋势与净光合速率相同,YN4的胞间CO2浓度在对照的情况下最低;经过低温处理后YN3的胞间CO2浓度较高,呈显著升高的状态,该品种的耐寒能力较低。经过低温处理的藜麦叶片YN4显著高于其他品种,具有较高的水分利用能力。低温可以显著降低水分利用效率。表1
2.2 低温对叶绿素和碳水化合物的影响
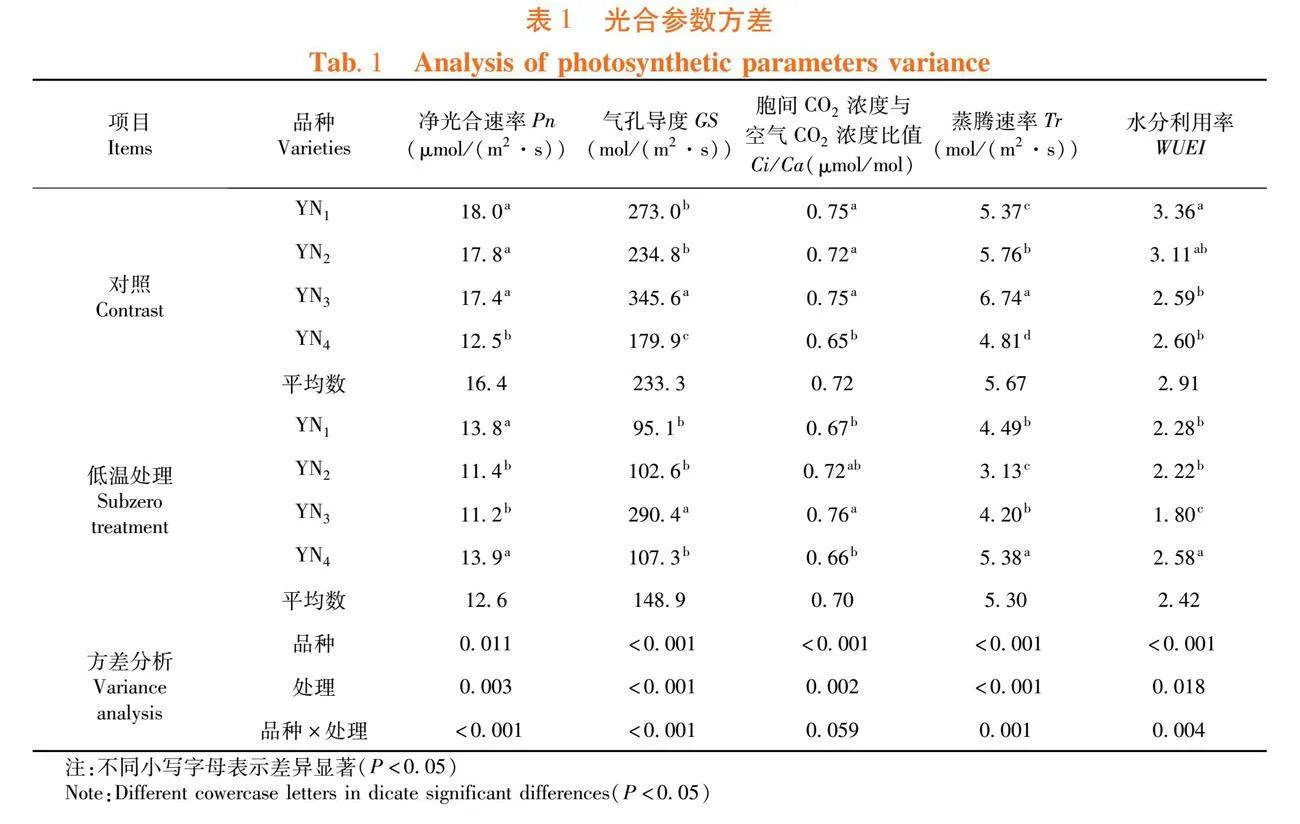
研究表明,不同藜麦材料在苗期的叶绿素含量具有显著差异,从高到低依次为YN4、YN1、YN3、YN2;经过低温处理后,叶绿素含量也显著降低。YN1和YN4显著高于YN2和YN3,经过低温处理后对YN1和YN4叶片的叶绿素含量影响较小。低温处理前,试验品种间叶片的碳水化合物含量无显著差异。经过低温处理后,品种间的碳水化合物差异显著,其中YN4和YN1显著高于其他2品种。表2
2.3 低温对藜麦抗氧化酶活性的影响
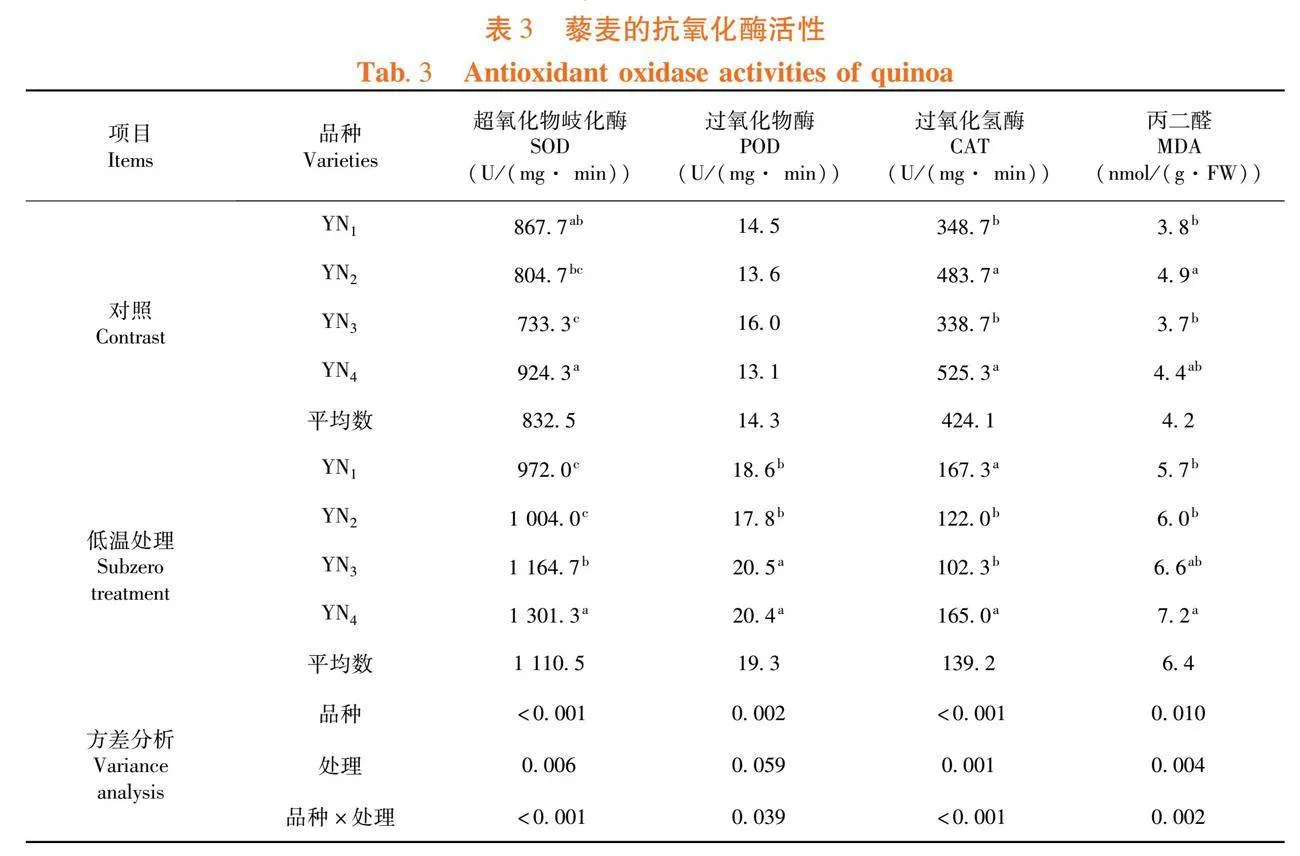
研究表明,不同藜麦品种间的SOD活性差异显著,其中YN1和YN4显著高于其他品种。经过低温胁迫后,叶片中SOD活性显著升高。经过低温处理的植株SOD活性呈YN1<YN2<YN3<YN4的排列顺序,藜麦可以通过提升SOD活性来获得抗低温的能力,但是不同品种的抗性差异显著。叶片POD活性在不同品种间无显著差异,但是经过低温处理后POD活性显著提升。低温处理后,品种间的POD活性变化趋势基本与SOD相同。各品种的CAT活性具有显著性差异,经过低温处理后活性开始降低,但是耐低温品种呈现出显更高的活性,以YN1和YN4 表现更好。对照处理下的品种MDA活性具有显著性差异,经过低温处理后叶片MDA具有升高的趋势,其中YN3和YN4显著高于其他2个品种。表3
2.4 低温对藜麦碳氮元素及其同位素的影响
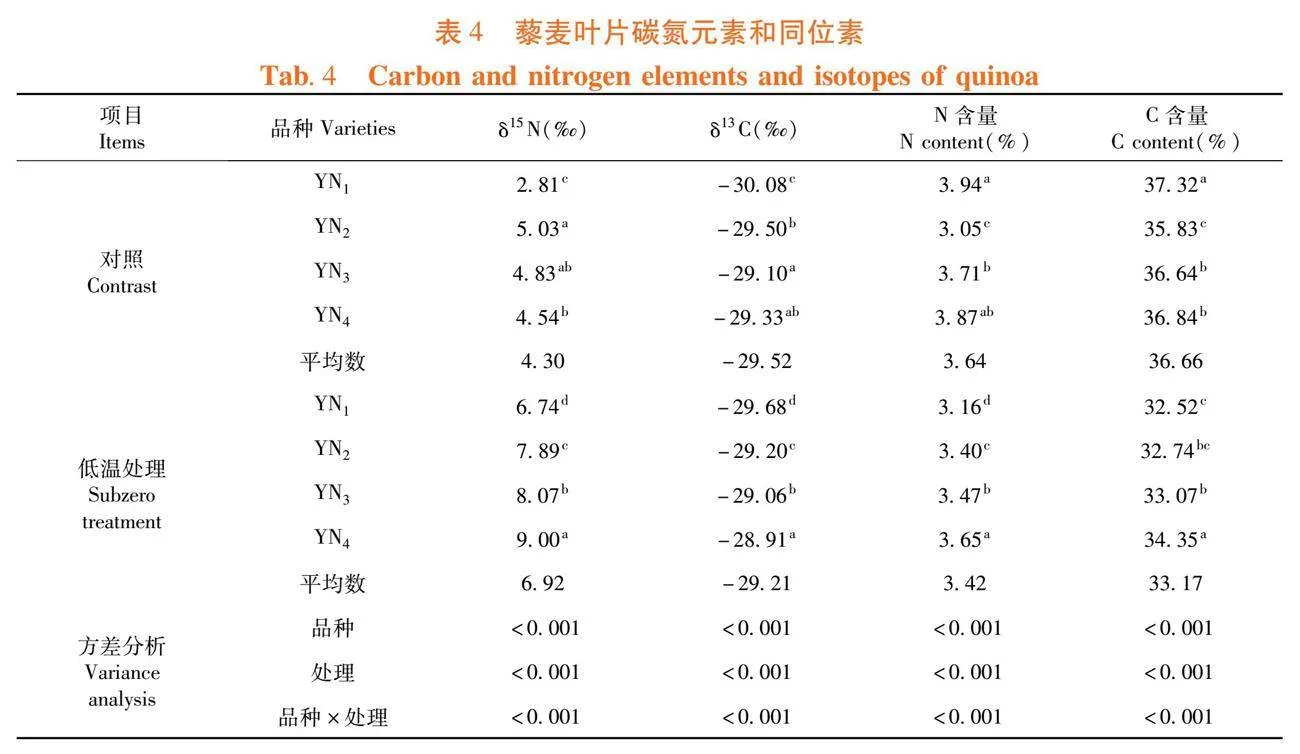
研究表明,品种间的δ15N值具有显著的差异,呈YN2>YN3>YN4>YN1的排列顺序,在藜麦品种遭受低温胁迫前,已经体现出植株的耐低温能力(负向)。经过低温处理后,较耐寒品种YN4呈现较高的δ15N值,较耐寒的品种在遭受低温胁迫后,仍能维持自身氮素代谢相关蛋白的活性而呈现较强的代谢能力。经过低温处理的藜麦呈现δ13C值的提升,品种间的δ13C值呈YN4>YN1>YN2>YN3的排列顺序,低温降低了藜麦水分利用能力,YN4在试验品种中的抗寒性最好。表4
3 讨 论
3.1
植物体内产生较高的碳水化合物有利于抵抗低温胁迫,在小麦、苜蓿等作物中已发现[14]。超氧化物歧化酶(SOD)是生物体内存在的一种抗氧化金属酶,它能够催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用[15]。
研究利用低温发芽试验中筛选出的4个在低温条件下萌发较好的藜麦品种,从幼苗叶片光合特性、叶绿素及碳水化合物、抗氧化活性酶、碳氮元素及其同位素等方面进行研究分析,筛选出苗期抗寒性较好的藜麦品种。
低温环境中,作物利用光能的能力不断下降,几乎对作物光合作用的所有环节造成影响[16],杨猛等[17]通过研究发现,低温胁迫下,玉米叶片光合速率、气孔导度、蒸腾速率及PSⅡ光能转化率均呈下降趋势,植株可以通过调节气孔导度、蒸腾速率、胞间CO2浓度、水分利用率进行自我调控。试验表明,低温胁迫条件下导致4个藜麦品种叶片净光合速率、气孔导度的显著降低,光合速率由于气孔的关闭导致生长速率的降低。而胞间CO2、蒸腾速率及水分利用率虽有降低,但是降低幅度较小,说明低温胁迫未对藜麦的光合代谢产生较大的负向影响,为藜麦的抗寒提供了保障。
3.2
当作物受到低温胁迫时,打破了细胞内自由基的平衡,大量积累的活性氧阻碍了叶绿素的合成,导致叶绿素的破坏降解[18],试验4个藜麦品种的叶绿素含量均有不同程度的下降,这与高丽慧等[19]研究结果一致,所以当4个藜麦品种经过低温处理后,叶片均有不同程度的发红,这是由于幼苗叶片叶绿体中的叶绿素下降,类胡萝卜素显色的原因。YN1和YN4的叶绿素含量及碳水化合物含量要显著高于其他2个品种,说明耐寒性较强的材料具有较高的叶绿素含量,使其在受到胁迫时维持正常的光合作用,为其生长提供能量[20,21]。
3.3
低温冷害会使植物体内膜脂过氧化,而丙二醛(MDA)是膜脂过氧化的最终产物,其含量是作为评价膜系统受伤害程度的重要标记[22],植物抗氧化保护方面起主要作用的是酶促防御体系[23],其中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)是保护膜系统的主要酶[24],试验表明,4个藜麦品种间具有显著的活性差异;低温处理可显著提升SOD、POD和MDA活性,降低CAT的活性,耐寒性较强的品种(系)会通过提升关键性抗氧化酶活性来抵抗低温胁迫。
3.4
作物叶片δ13C可以反映在一段时间内作物水分散失和碳收获之间的相对关系,整合了作物叶片的光合作用,常被用来指示作物的长期水分利用率[25],降水量与温度等环境梯度的变化往往影响作物叶片的δ13C值,研究结果与王国安等[26]研究一致,4个藜麦品种叶片δ13C值与温度呈负相关。氮元素是影响和限制植物生长最重要的营养元素,δ15N值在很大程度上受到周边生长环境及气候因素的影响[27],温度作为影响δ15N值的重要气候因子,温度与δ15N值呈正相关[28],但也有研究发现于此不一致的结论,试验研究结果表明,4个藜麦品种δ15N值随着温度的降低出现不同程度的升高,与刘卫国等[29]研究一致。稳定同位素(δ13C值)和茎秆氮素浓度(δ15N值)是衡量藜麦耐低温能力的重要依据。低温处理使藜麦显著降低了水分和氮素代谢过程。耐低温品种通过加速水分吸收,加速氮素代谢进程来缓解低温导致的伤害。
4 结 论
藜麦对连续的-4℃低温处理具有较强的耐受性。经过低温处理的藜麦品种表现出显著的抗寒差异,其中YN4的耐低温能力最强,YN1的耐低温能力次之,YN3和YN2的低温能力较弱,表型生长状态不佳。
参考文献(References)
[1]
武辉, 戴海芳, 张巨松, 等. 棉花幼苗叶片光合特性对低温胁迫及恢复处理的响应[J]. 植物生态学报, 2014, 38(10): 1124-1134.
WU Hui, DAI Haifang, ZHANG Jusong, et al. Responses of photosynthetic characteristics to low temperature stress and recovery treatment in cotton seedling leaves[J]. Chinese Journal of Plant Ecology, 2014, 38(10): 1124-1134.
[2] 齐天明, 李志坚, 秦培友, 等. 藜麦栽培技术研究与应用展望[J]. 中国农业科技导报, 2022, 24(3): 157-165.
QI Tianming, LI Zhijian, QIN Peiyou, et al. Research and application prospect of quinoa cultivation technology[J]. Journal of Agricultural Science and Technology, 2022, 24(3): 157-165.
[3] 温日宇, 刘建霞, 李顺, 等. 低温胁迫对不同藜麦幼苗生理生化特性的影响[J]. 种子, 2019, 38(5): 53-56.
WEN Riyu, LIU Jianxia, LI Shun, et al. Effect of low temperature stress on physiological and biochemical characteristics of different quinoa seedlings[J]. Seed, 2019, 38(5): 53-56.
[4] 任贵兴, 杨修仕, 么杨. 中国藜麦产业现状[J]. 作物杂志, 2015, (5): 1-5.
REN Guixing, YANG Xiushi, YAO Yang. Current situation of quinoa industry in China[J]. Crops, 2015, (5): 1-5.
[5] Jacobsen S E, Mujica A, Jensen C R. The resistance of quinoa (Chenopodium quinoaWilld.) to adverse abiotic factors[J]. Food Reviews International, 2003, 19(1/2): 99-109.
[6] Geerts S, Raes D, Garcia M, et al. Crop water use indicators to quantify the flexible phenology of quinoa (Chenopodium quinoaWilld.) in response to drought stress[J]. Field Crops Research, 2008, 108(2): 150-156.
[7] 沈菊, 杨起楠, 成明锁. 高原藜麦幼苗期抗寒性分析[J]. 现代农业科技, 2020, (19): 9-11.
SHEN Ju, YANG Qinan, CHENG Mingsuo. Analysis of cold resistance of quinoah at seedling stage in plateau[J]. Modern Agricultural Science and Technology, 2020, (19): 9-11.
[8] 沈忱. 不同苜蓿品种种子萌发及幼苗生长对温度和干旱的响应[D]. 长春: 吉林农业大学, 2018.
SHEN Chen. Seed Germination and Seedling Growth Responses of Six Alfalfa Cultivars to Temperature and Drought[D]. Changchun: Jilin Agricultural University, 2018.
[9] 顾娴, 黄杰, 魏玉明, 等. 藜麦研究进展及发展前景[J]. 中国农学通报, 2015, 31(30): 201-204.
GU Xian, HUANG Jie, WEI Yuming, et al. Development prospect and research progress ofChenopodium quinoa[J]. Chinese Agricultural Science Bulletin, 2015, 31(30): 201-204.
[10]Masayasu M,Hiroshi Y.A simplified assay method of superoxide dismutase activity for clinical use[J]. Clinica Chimica Acta.
[11] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
LI Hesheng. Principles and techniques of plant physiological biochemical experiment[M]. Beijing: Higher Education Press, 2000.
[12] 陈建勋, 王晓峰. 植物生理学实验指导(2版) [M]. 广州: 华南理工大学出版社, 2006.
CHEN Jianxun, WANG Xiaofeng. Experimental instruction of plant physiology(2nd ed)[M]. Guangzhou: South China University of Technology Press, 2006.
[13] 张治安, 陈展宇. 植物生理学实验技术[M]. 长春: 吉林大学出版社, 2008.
ZHANG Zhian, CHEN Zhanyu. Experimental technology of plant physiology[M]. Changchun: Jilin University Press, 2008.
[14] 潘庆民, 韩兴国, 白永飞, 等. 植物非结构性贮藏碳水化合物的生理生态学研究进展[J]. 植物学通报, 2002, 37(1): 30-38.
PAN Qingmin, HAN Xingguo, BAI Yongfei, et al. Advances in physiology and ecology studies on stored non-structure carbohydrates in plants[J]. Chinese Bulletin of Botany, 2002, 37(1): 30-38.
[15] 和红云, 田丽萍, 薛琳. 植物抗寒性生理生化研究进展[J]. 天津农业科学, 2007, 13(2): 10-13.
HE Hongyun, TIAN Liping, XUE Lin. Research progress on physiology and biochemistry of plant cold hardiness[J]. Tianjin Agricultural Sciences, 2007, 13(2): 10-13.
[16]刘春英,陈大印,盖树鹏,等.高、低温胁迫对牡丹叶片PSⅡ功能和生理特性的影响[J]. 应用生态学报,2012,23(1),133-139.
LIU Chunying,CHEN Dayin,GAI Shunpeng,et al.Effects of high and low temperature Stress on PSⅡ function and physiological characteristics of peony leaves[J].Ecological Processes,2012,23(1),133-139.
[17] 杨猛, 魏玲, 胡萌, 等. 低温胁迫对玉米幼苗光合特性的影响[J]. 东北农业大学学报, 2012, 43(1): 66-71.
YANG Meng, WEI Ling, HU Meng, et al. Effect of low temperature stress on photosynthetic characteristics of maize seedling[J]. Journal of Northeast Agricultural University, 2012, 43(1): 66-71.
[18] 徐田军, 董志强, 兰宏亮, 等. 低温胁迫下聚糠萘合剂对玉米幼苗光合作用和抗氧化酶活性的影响[J]. 作物学报, 2012, 38(2): 352-359.
XU Tianjun, DONG Zhiqiang, LAN Hongliang, et al. Effects of PASP-KT-NAA on photosynthesis and antioxidant enzyme activities of maize seedlings under low temperature stress[J]. Acta Agronomica Sinica, 2012, 38(2): 352-359.
[19] 高丽慧, 易津, 李菲, 等. 三种禾本科牧草低温胁迫的生理响应[J]. 中国草地学报, 2011, 33(3): 107-111.
GAO Lihui, YI Jin, LI Fei, et al. The physiological response to low temperature stress of three gramineous pastures[J]. Chinese Journal of Grassland, 2011, 33(3): 107-111.
[20] 闫世江, 司龙亭, 张建军, 等. 黄瓜苗期低温弱光下耐寒性及光合参数遗传分析[J]. 烟台大学学报(自然科学与工程版), 2012, 25(1): 28-32, 48.
YAN Shijiang, SI Longting, ZHANG Jianjun, et al. Genetic analysis of chilling tolerance and photosynthetic parameters in low temperature and weak light on cucumber seedling[J]. Journal of Yantai University (Natural Science and Engineering Edition), 2012, 25(1): 28-32, 48.
[21] 张帆, 万雪琴, 朱小琼, 等. 自然低温对慈竹和撑绿杂交竹生理特性的影响[J]. 浙江农林大学学报, 2012, 29(1): 17-22.
ZHANG Fan, WAN Xueqin, ZHU Xiaoqiong, et al. Physiological characteristics of Neosinocalamus affinis and Bambusa pervariabilis × Dendrocalamopsis grandis with natural low temperature[J]. Journal of Zhejiang A amp; F University, 2012, 29(1): 17-22.
[22] 孙存华, 孙存玉, 张亚红, 等. 低温对香樟膜脂过氧化和保护酶活性的影响[J]. 广东农业科学, 2011, 38(4): 58-60, 65.
SUN Cunhua, SUN Cunyu, ZHANG Yahong, et al. Effect of low temperature stress on membrane lipid peroxidation and protective enzyme activity ofCinnamomum camphora[J]. Guangdong Agricultural Sciences, 2011, 38(4): 58-60, 65.
[23] 施大伟, 张成军, 陈国祥, 等. 低温对高产杂交稻抽穗期剑叶光合色素含量和抗氧化酶活性的影响[J]. 生态与农村环境学报, 2006, 22(2): 40-44.
SHI Dawei, ZHANG Chengjun, CHEN Guoxiang, et al. Effects of low temperature on photosynthetic pigments and antioxidant enzymes in flag leaves of high-yielding hybrid rice cultivars[J]. Journal of Ecology and Rural Environment, 2006, 22(2): 40-44.
[24] Anderson M D, Prasad T K, Stewart C R. Changes in isozyme profiles of catalase, peroxidase, and glutathione reductase during acclimation to chilling in mesocotyls of maize seedlings[J]. Plant Physiology, 1995, 109(4): 1247-1257.
[25] Stewart G R, Turnbull M H, Schmidt S, et al. 13C natural abundance in plant communities along a rainfall gradient: a biological integrator of water availability[J]. Australian Journal of Plant Physiology, 1995, 22(1): 51-55.
[26] 王国安, 韩家懋, 周力平. 中国北方C3植物碳同位素组成与年均温度关系[J]. 中国地质, 2002, 29(1): 55-57.
WANG Guoan, HAN Jiamao, ZHOU Liping. The annual average temperature in Northern China[J]. Chinese Geology, 2002, 29(1): 55-57.
[27] 刘艳杰, 许宁, 牛海山. 内蒙古草原常见植物叶片δ13C和δ15N对环境因子的响应[J]. 生态学报, 2016, 36(1): 235-243.
LIU Yanjie, XU Ning, NIU Haishan. Response patterns of foliar δ13C and δ15 to environmental factors for the dominant plants in Inner Mongolia steppe, China[J]. Acta Ecologica Sinica, 2016, 36(1): 235-243.
[28] 刘贤赵, 张勇, 宿庆, 等. 陆生植物氮同位素组成与气候环境变化研究进展[J]. 地球科学进展, 2014, 29(2): 216-226.
LIU Xianzhao, ZHANG Yong, SU Qing, et al. Progress of research on relationships between terrestrial plant nitrogen isotope composition and climate environment change[J]. Advances in Earth Science, 2014, 29(2): 216-226.
[29] 刘卫国, 王政. 黄土高原现代植物-土壤氮同位素组成及对环境变化的响应[J]. 科学通报, 2008, 53(23): 2917-2924.
LIU Weiguo, WANG Zheng. Nitrogen isotopic composition of modern plant-soil in Loess Plateau and its response to environmental change[J]. Chinese Science Bulletin, 2008, 53(23): 2917-2924.
Physiological responses of different quinoa varieties during
seedling stage under low temperature stress
YAO Qing, WANG Jiehua,Xiernayi Abudula,Dilimulati Tulahong,CUI Hongliang
(Institute of Agricultural Science of Yili Prefecture,Ining Xinjiang 835000,China)
Abstract:【Objective】 To explore the effects of low temperature stress on physiological and biochemical characteristics of quinoa seedlings, and to provide theoretical basis for exploring the cold tolerance mechanism and breeding of quinoa varieties.
【Methods】" The top 4 varieties YN1, YN2, YN3 and YN4 with strong cold resistance were selected as experimental materials through low temperature germination test of quinoa seeds selected in Yili Valley in recent years, and the seedlings were raised in nutrient soil and treated at low temperature under artificial simulated low temperature stress environment (-4℃). Normal natural temperature treatment was set as control.
【Results】 (1) Quinoa had strong tolerance to continuous low temperature treatment of -4℃. When treated with low temperature it showed significant differences in cold resistance, among which variety YN4 had the strongest low temperature resistance, variety YN1 had the stronger low temperature resistance, and variety YN3 and variety YN2 had the weaker low temperature resistance. (2) Low temperature stress could significantly reduce the net photosynthetic rate and stomatal conductance of leaves, and the photosynthetic rate decreased the growth rate due to stomatal closure. Low temperature stress had no negative effect on photosynthetic metabolism of quinoa. (3) The active substances of antioxidant enzymes were important substances to regulate the cold tolerance of quinoa, and there were significant differences in activity among varieties. The activities of SOD, POD and MDA were significantly increased by low temperature treatment, while the activities of CAT were decreased. Strains with strong cold tolerance would have low resistance to low temperature stress by increasing the activity of key antioxidant enzymes. (4) Stable isotope and stem nitrogen concentration were important criteria for measuring the low temperature tolerance of quinoa. Low temperature treatment significantly reduced water and nitrogen metabolism of quinoa.
【Conclusion】 Low temperature resistant varieties could alleviate the damage caused by low temperature by accelerating water absorption and nitrogen metabolism." The results showed that quinoa was more tolerant to low temperature stress, but the tolerance degree of different varieties was different.
Key words:quinoa; seedling stage; low temperature stress; physiology and biochemistry
Fund projects:Major R amp; D Program Project of Xinjiang Uygur Autonomous Region \"Xinjiang Quinoa Green Production Key Technology R amp; D Project\" (2022B02010-3);Project of Natural Science Foundation of Xinjiang \"Physiological Response of Cold Stress and Adaptability of Quinoa Plant Stage \" (2020D01B54)
Correspondence author:CUI Hongliang(1981-), male, from Yuzhou,Henan,associate professor, research direction: crop cultivation and physiology research,(E-mail)chl8129@126.com
收稿日期(Received):
2023-12-27
基金项目:
新疆维吾尔自治区重点研发计划项目“新疆藜麦绿色生产关键技术研发”课题三“藜麦病虫草害绿色防控技术的研究”(2022B02010-3);新疆维吾尔自治区自然科学基金项目“藜麦苗期低温胁迫的生理响应及旱作冷凉区适应性研究”(2020D01B54)
作者简介:
姚庆(1986-),男,甘肃张掖人,助理研究员,研究方向为作物育种与栽培,(E-mail)452760959@qq.com
通讯作者:
崔宏亮(1981-),男,河南禹州人,副研究员,研究方向为作物栽培及生理,(E-mail)chl8129@126.com
