不同盐渍环境对胡杨叶解剖结构及离子含量的影响
2024-12-31姚诗雨王杰黄文娟焦培培彭承志熊丹陈月王鑫


摘 要:【目的】研究胡杨 (Populus euphratica )对盐渍环境的适应特点,揭示其耐盐生理机制。
【方法】以不同盐渍生境中的胡杨叶片为试材,采用沸水水提法与消煮法测定离子含量,采用石蜡切片法在光学显微镜观察叶片的解剖结构,分析叶片各离子含量及比较解剖结构特征。
【结果】(1)在低盐生境中,胡杨叶片中栅栏组织较大,叶片厚度、海绵组织、中脉维管束面积最大,且海绵组织厚度与其他环境中相比差异显著;中盐生境中,上、下表皮厚度、栅栏组织及粘液细胞面积均大于其他环境;高盐生境中,胡杨叶片增加下表皮厚度、海绵组织的厚度及叶片厚度;(2)从低盐环境到高盐环境,胡杨叶片中Na+、Mg2+、Ca2+、HCO3-和Cl-含量均减少,叶片中K+含量增加,叶片中离子平衡得以维持;(3)栅栏组织、粘液细胞面积、栅栏组织/海绵组织、叶片紧密度与HCO3-和Na+含量呈显著或极显著正相关,与K+含量呈显著或极显著负相关。叶片中K+含量易受环境影响,与土壤pH值、全盐、电导率均呈极显著相关;叶片上下表皮厚度、粘液细胞体积、栅海比等与土壤盐分和含水量相关性较强,受到盐分胁迫时通过改变其自身结构抵御胁迫环境。
【结论】在不同的盐渍环境条件下,胡杨叶片主要通过盐分离子在叶片中的调控储存并作用于叶片各部位,保证树体正常生理代谢,并形成不同的叶片解剖结构特征以适应环境。
关键词:盐渍环境;胡杨;离子;叶片解剖结构
中图分类号:S72 ""文献标志码:A ""文章编号:1001-4330(2024)08-2004-10
收稿日期(Received):2023-12-07
基金项目:国家自然科学基金地区基金项目“胡杨异形叶发育的分子调控网络及其功能基因挖掘”(32160355);“兵团英才”第二周期人才项目;塔里木盆地生物资源保护利用重点实验室开放课题(BRFW2101);新疆生产建设兵团财政科技计划项目“胡杨苗期性别鉴定DNA分子标记的开发及应用”(2022CB001-10)
作者简介:姚诗雨(1998-),女,江西上饶人,硕士研究生,研究方向为荒漠区植物保育,(E-mail)1091275698@qq.com
通讯作者:黄文娟(1980-),女,黑龙江富锦人,教授,硕士生导师,研究方向为荒漠区植物生理生态和植物多样性保育,(E-mail)hwjzky@163.com
0 引 言
【研究意义】我国盐渍土总面积约1×108 hm2[1]。高温、降雨量小蒸发量大,以及不合理的水分灌溉方式均导致土壤盐渍化[2]。影响植物生长的其中一个重要环境因素就是盐胁迫,盐胁迫通过离子毒害、营养失衡和渗透胁迫的方式,引起植物体的生理生化代谢失调,从而影响其生长发育[3],并成为制约植被分布、生存和演替的重要因子[4]。耐盐植物长期适应盐环境使其逐渐形成了特有的防御机制,在生理功能与形态构造等方面逐渐形成了一套完整适应盐环境的方式[5]。【前人研究进展】叶片作为整株植株中可塑性最强的器官,其形态和解剖结构能够快速响应并适应环境的变化,受到高浓度盐胁迫时,叶片的形态最先发生改变[6],并表现出与干旱胁迫极为相似的形态解剖结构[7],如叶片肉质,气孔下陷、孔径和面积减小且气孔导度下降,表皮细胞排列紧密,具有厚角质膜等[8]。解剖结构方面,Parida等[9]研究发现,叶片栅栏组织细胞长度与海绵组织层数在高盐环境下减小,细胞直径与细胞间隙也同时减小,从而导致了叶肉厚度减小。由于不同盐胁迫时间长短、不同植物种对盐胁迫的敏感程度以及植物所处生育时期有所差异[10],盐胁迫对不同种的植物会产生不同程度的影响,从而促使植物产生相应的适应调节机制。胡杨(Populus euphratica)是杨柳科(Salicaceae)杨属(Populus)的落叶乔木,主要分布在中亚、西亚与地中海地区,胡杨在我国新疆分布较为集中,是我国干旱荒漠区的唯一优势成林树种,新疆胡杨林面积占我国胡杨林总面积的90%以上[11]。胡杨在干旱、盐碱和风沙环境适应性强,可防风固沙,调节绿洲气候以及形成森林土壤[12]。【本研究切入点】胡杨具有异形叶,其叶片能通过不同的形态、结构与生理变化从而适应不同微环境与各发育时期的不同环境[13],因而胡杨适应环境变化的能力强[14]。近年来,对胡杨的耐盐性的研究主要集中于盐分对胡杨的渗透胁迫与离子效应方面[13,15],且多以盆栽试验为主,缺少野外自然条件下胡杨耐盐性方面的研究报道。需研究胡杨 (Populus euphratica )对盐渍环境的适应特点,揭示其耐盐生理机制。【拟解决的关键问题】以新疆阿克苏地区沙雅县分布的天然胡杨林为研究对象,采用野外调查和室内分析方法,分析不同土壤生境中的胡杨叶片解剖结构和离子含量及二者的关系,研究自然条件下胡杨叶片解剖结构指标与土壤水盐指标的协同关系,揭示胡杨叶片对盐渍环境的适应机制,为胡杨耐盐研究提供参考。
1 材料与方法
1.1 材 料
研究区位于新疆阿克苏地区沙雅县塔里木河两岸面积22.67×104hm2(
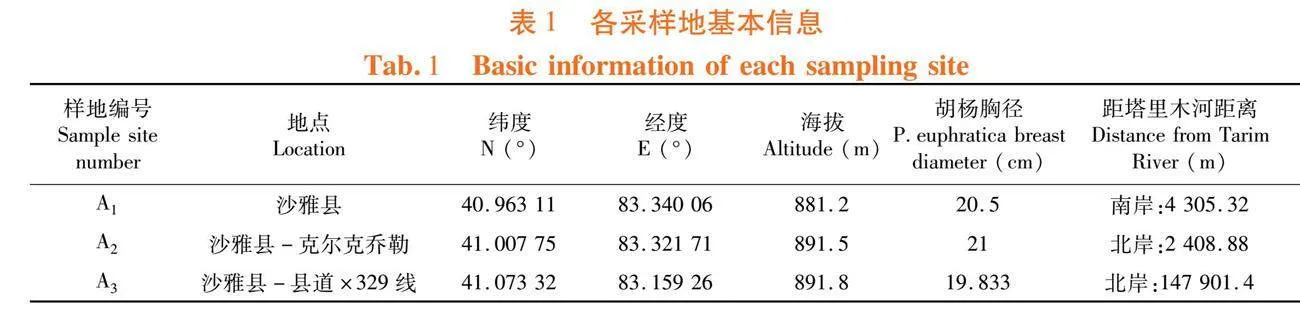
340万亩)的天然胡杨林(81°45′~84°47′ N,39°31′~41°25′E),该地区属于温带荒漠气候,日照充足,降水稀少,气候极为干燥,昼夜温差大,年均日照时数为3 031.2 h,年均气温10.7℃,年均降水47.3 mm,年均蒸发量2 000.7 mm。主要植物种类有胡杨(Populus euphratica Oliv.)、多枝柽柳(Tamarix ramosi-ssima Ledeb.)、刚毛柽柳(Tamarix hispida Willd.)、骆驼刺(Alhagi sparsifolia Shap.)、胀果甘草(Glycyrrhiza inflata Batalin)、芦苇(Phragmites australis (Cav.) Trin. ex Steud.)、黑果枸杞(Lycium ruthenicum Murr.)等。垂直河岸不同距离选择3块样地,作为采样点。表1
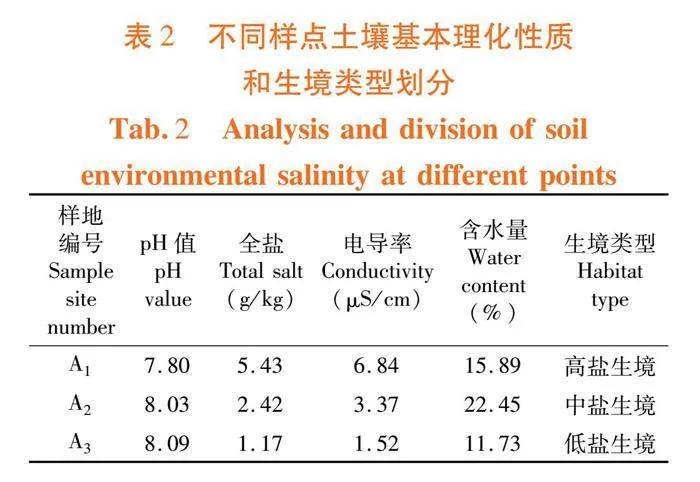
参照孙兆军[16]方法,将样地土壤按盐分高低划分3类:高盐生境(4.0~8.0 g/kg)、中盐生境(2.0~4.0 g/kg)和低盐生境(0.6~1.5 g/kg)。A1为高盐生境,A2为中盐生境,A3为低盐生境。表2
1.2 方 法
1.2.1 试验设计
在3个样地内,随机选取胸径在18~22 cm的成年胡杨各5株作为样株。测量样株的胸径大小及其各项数据并作好记录。每棵胡杨样株均从树冠下部约1/3处从向阳方位取健康完整的叶片,取下的叶片一部分装于自封袋内保存于便携式冰箱备用,并尽快回到室内进行前处理。另选取20片,擦去表面污物后现场剪取经中脉部位的材料(约1.5 cm×0.5 cm),投入装有FAA的青霉素瓶中,并抽气带回实验室,放置48 h以上,用作叶片解剖结构观察研究。
采集叶片同时,在每个样株附近用土钻按0~20 cm、20~40 cm、40~60 cm、60~80 cm、80~100 cm取新鲜土样,一部分迅速盛入铝盒并密封用于土壤含水量测定,另一部分土样装入自封袋内用于其他盐分指标的测定,将样品带回室内作进一步处理,将同一样株附近各层土壤指标测定值的平均值作为最终值。
1.2.2 测定指标
1.2.2.1 植物离子
带回的植物样品清洗后,烘箱105℃杀青15 min,后80℃烘12~24 h,烘至恒重,再用研磨粉碎机进行粉碎,过直径1 mm筛。植物样品测定:Ca2+、Mg2+、SO2-4、HCO3-和Cl-含量采用沸水水提法作测定液;Na+、K+含量采用H2SO4-H2O2消煮法,制做提取液并用火焰光度法测定,Cl-含量用硝酸银滴定法测定,Ca2+、Mg2+含量用EDTA滴定法测定,SO2-4含量采用EDTA间接络合滴定法测定,HCO3-含量采用双指试剂-中和滴定法测定。并计算叶片中K+/Na+、Ca2+/Na+和Mg2+/Na+比值。
1.2.2.2 解剖结构
FAA固定好的叶片经脱水、透明、透蜡、包埋、切片、染色、封片等步骤制成永久制片,于显微镜下观察记录并拍照。使用INS软件测量胡杨叶上表皮、下表皮、上表皮角质层、栅栏组织、海绵组织、中脉维管束与粘液细胞。
栅海比=栅栏组织厚度/海绵组织厚度;
叶片结构紧密度=栅栏组织厚度/叶厚度;
叶片结构疏松度=海绵组织厚度/叶厚度。
1.2.2.3 土壤
采回的土壤自然风干,过直径2 mm筛。测定土壤全盐含量、含水量、电导率和pH值。土壤全盐量测定采用残渣烘干法测定;含水量用铝盒烘干称重法测定;电导率和pH值分别用电导率仪和pH计测定。
1.3 数据处理
使用Excel 2007整理数据,SPSS19.0软件进行数据分析:采取单因素方差分析对胡杨叶片离子含量及解剖结构进行比较,并用Origin2021软件作图。
2 结果与分析
2.1 不同生境胡杨叶片解剖结构特征的比较
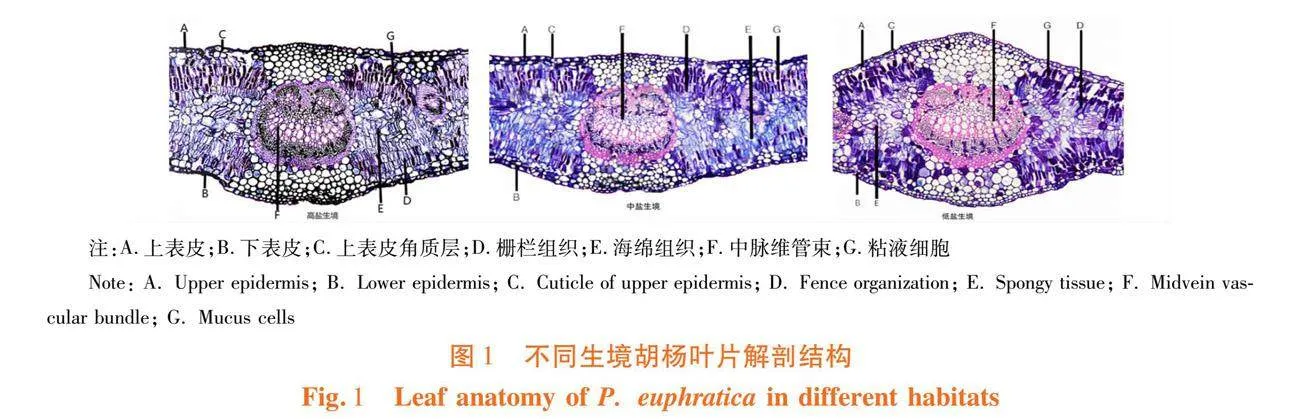
研究表明,胡杨叶片上、下表皮均不具表皮毛,胡杨叶片的上下表皮均为双层细胞所构成的复表皮,上、下表皮均有加厚的角质层,胡杨的叶肉分化出栅栏、海绵组织,胡杨叶中脉维管束通常仅有1个,在叶肉和叶脉处均可见少量染色较深的粘液细胞存在。
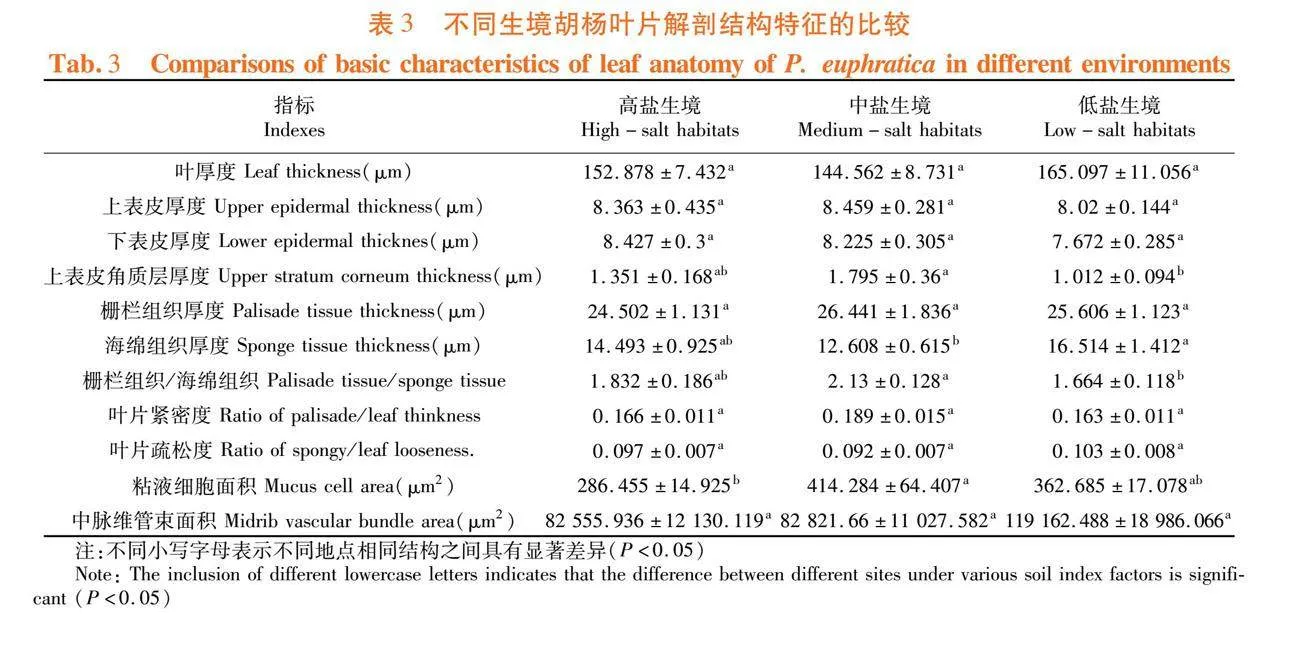
不同生境中胡杨叶片解剖结构特征差异显著(P<0.05),上表皮角质层厚度与栅海比在低盐与高盐环境的差异达到显著水平(P<0.05),上表皮角质层厚度最高达到1.795 μm,最小为1.012 μm,栅海比最高为2.130,最小为1.664;海绵组织厚度在中盐环境与低盐生境中差异达到显著水平(P<0.05)海绵组织厚度最大为16.514 μm,最小为12.608 μm;粘液细胞面积在中盐与高盐生境中差异达到显著水平(P<0.05)最高为414.284 μm2,最低为286.445 μm2;其余结构差异均未达到显著水平。叶片厚度、海绵组织厚度、叶片疏松度以及中脉维管束面积,均在低盐生境中最高,上表皮厚度、上表皮角质层厚度、栅栏组织厚度、栅海比、叶片紧密度、粘液细胞面积在中盐生境中最高,高盐生境中仅下表皮厚度最高。表3,图1
2.2 不同生境胡杨叶片离子含量比较
2.2.1 不同生境胡杨叶片离子含量比较
研究表明,胡杨叶片中HCO3-、Cl-、Ca2+、Mg2+和SO2-4含量在高盐、中盐、低盐生境中的差异均未达到显著水平,但在不同生境下仍有差异变化。胡杨叶片中HCO3-、Ca2+含量均在中盐、低盐生境中含量较高,在高盐生境中含量最低;叶片中Cl-、Mg2+含量均在高盐和中盐生境中含量较低,在低盐生境下含量最高;叶片中SO2-4含量在中盐生境中含量最高,在低盐生境中含量最低。
胡杨叶片中Na+含量由高盐生境到低盐生境依次增加,且低盐与高盐生境中含量差异达到显著水平。叶片中K+含量在不同生境下的含量与Na+含量相反,高盐生境下最高,且显著高于中盐和低盐生境。图2
2.2.2 不同生境胡杨叶片离子比含量比较
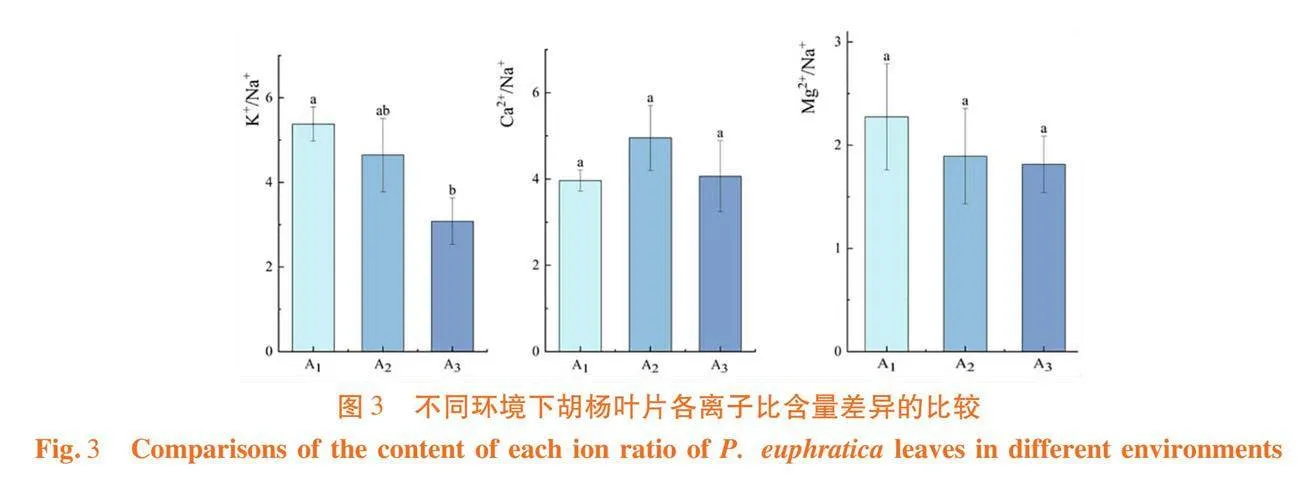
研究表明,叶片在高盐生境中的K+/Na+比值最高,为5.445,从高盐生境到低盐生境叶片离子比值降低;Ca2+/Na+比值在中盐生境中最高,为4.953;Mg2+/Na+比值在高盐生境下最高,为2.274,高盐生境至低盐生境比值降低;仅低盐生境中的K+/Na+比值显著低于高盐生境,Ca2+/Na+与Mg2+/Na+比值在3种生境中差异均未达显著水平。图3
2.3 胡杨叶片解剖结构与离子含量相关性
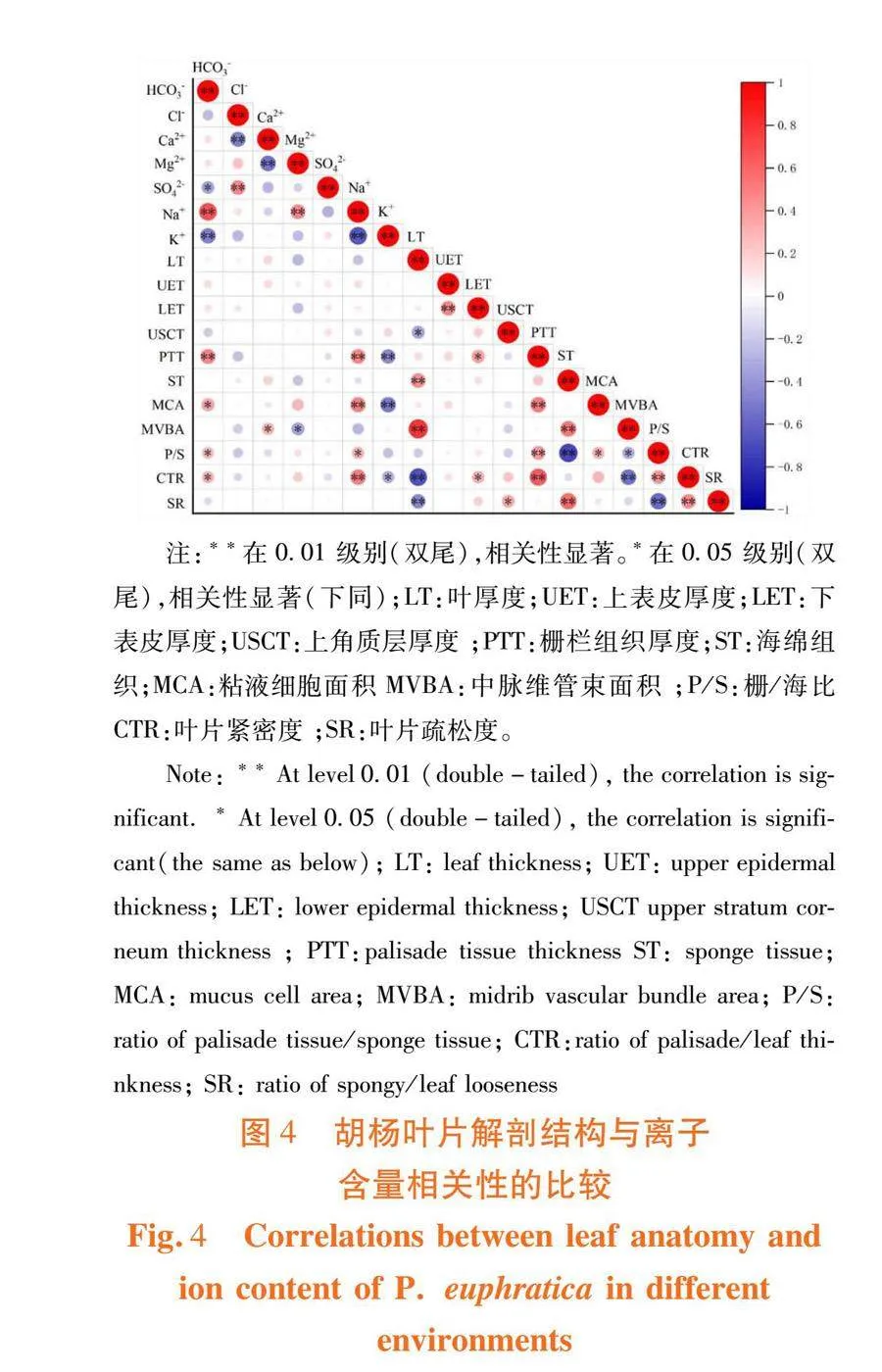
研究表明,栅栏组织、粘液细胞面积、栅/海比、叶片紧密度与HCO3-和Na+含量呈显著或极显著正相关,与K+呈显著或极显著负相关,与其他离子之间相关性不显著;中脉维管束面积与Ca2+含量呈显著正相关,与Mg2+含量呈显著负相关,Ca2+、Mg2+含量与其他指标均无显著相关性。图4
2.4 叶片解剖结构、离子与土壤相关性
研究表明,土壤pH值与叶片Na+含量呈极显著正相关,而与K+含量呈显著极显著负相关;土壤全盐与叶片SO2-4、K+含量呈极显著正相关;土壤电导率与K+、SO2-4呈极显著正相关,与HCO3-含量呈显著负相关。土壤pH值与栅/海比呈极显著正相关、与海绵组织呈显著负相关,土壤全盐与上、下表皮厚度呈显著或极显著正相关,土壤含水量与栅栏组织厚度、粘液细胞面积以及栅/海比呈显著极显著正相关,土壤电导率与上表皮厚度显著正相关。表4
3 讨 论
3.1 胡杨叶片解剖结构特征
盐穗木(Halostachys caspica)植物在盐胁迫下,叶表皮厚度会增加以减轻盐害,但叶片下表皮对盐胁迫的反应较慢;复合盐环境中,叶片上表皮厚度会随着盐浓度的升高而增加,耐盐性植物对低浓度盐胁迫的反应较小[17];肖磊等[18]在研究胡杨叶片表皮角质层抗逆性时发现,在盐胁迫环境中会诱导植物加速细胞壁物质合成使角质层加厚;洪文君等[19]对竹柳(Salix spp.)的研究发现,在盐胁迫时植物会通过增加角质层厚度保证正常生长应对环境改变。
研究中,不同盐分胁迫下胡杨叶片解剖结构发生改变从而应对环境的变化:在低盐生境中胡杨叶片厚度最高,而上下表皮厚度最低,叶片上表皮细胞角质层厚度也最小随着盐浓度的升高,上表皮厚度、栅栏薄壁组织厚度与叶片紧密度均呈先升高后降低的趋势,与贾文飞等[20]盐碱胁迫下越橘叶片解剖结构的变化一致。在中盐生境中,受盐分渗透胁迫影响叶厚变小;在高盐生境中,吸收水分使叶片变厚抵御盐害。表明胡杨叶片在胁迫程度较小环境中叶肉组织发育较好,促进叶肉细胞生长叶片增厚,叶片通过增加表皮细胞和角质膜厚度来实现储存水分、减少蒸腾的作用[21],防止叶片中水分向大气中散失,缓解植物因胁迫导致的失水及适应盐环境。
燕玲等[22]在研究阿拉善盟濒危植物的营养器官解剖结构中发现,植物发达的栅栏组织可以提高水分运输效率高,叶片紧密度可抑制蒸腾作用失水;王斌等[23]研究不同盐度处理小叶桦发现,海绵组织厚度与物种的耐盐性呈负相关;李志军等[24]在研究胡杨叶片解剖结构时发现栅栏组织中存在大量粘液细胞以减小细胞的渗透势,从而有助于植物吸收、保持叶片水分。研究发现,低盐生境中海绵组织最大,但高盐生境中的海绵组织厚度比中盐环境又有所增加,是因为盐胁迫引起离子失衡导致叶肉组织紊乱。中盐生境中叶片栅栏组织与叶片紧密度最大,说明胡杨叶片可以通过调节叶肉细胞发育,增加其栅栏组织比例,提高水分运输能力或者缓解由盐胁迫带来的危害;粘液细胞面积随盐胁迫先增加再减小,是因为较低盐胁迫时胡杨通过增加叶片细胞渗透压来吸水,使叶片储水增多粘液细胞增大,而高盐生境中Na+被截留在根系,叶片中的Na+主要储存在液泡中,因此叶片受盐害较低吸水能力较小,粘液细胞面积小。
戴凌燕[25]等发现苏打盐碱胁迫可使甜高粱叶中脉厚度明显减小。陈旭等[26]发现轻度盐碱树种的各项叶脉解剖结构指标均呈最大,随着盐碱程度加剧叶脉的各解剖结构指标呈减小趋势,说明在低盐胁迫下促进了叶片中脉厚度与维管束组织的生长发育。研究中,胡杨叶片中脉维管束面积在低盐生境中最大,发达的主脉维管束更利于胡杨生长及运输水分盐分及养分,表明较低盐胁迫可能促进了叶片中脉维管束发育,提高对水分养分的吸收,抵御盐害。
3.2 胡杨叶片离子含量及离子比特征
土壤中盐分过多会导致离子进入植物体内,对植物造成离子毒害和渗透胁迫,这会影响植物对营养元素的吸收[27]。植物在盐胁迫下对离子吸收选择性降低,大量的Na+和Cl-含量进入细胞后,细胞质内Na+、Cl-含量过高,从而抑制了K+、Ca2+和Mg2+含量的吸收,植物体内原有的离子平衡被破坏,造成了植物离子胁迫[28]。张瑾[29]认为植物体内总盐含量受植株本底值差异影响不显著,如果叶内盐分含量出现变化,则表明试验期间胡杨对土壤盐分变化曾有响应。李菊艳[13]等研究认为幼苗叶片Na+和Cl-的含量均随盐浓度的增大显著增加。研究中,从低盐生境到高盐生境,胡杨叶中Na+、Mg2+、Ca2+、HCO3-和Cl-含量均减少,K+、SO2-4含量增加,与前人研究结果不尽相同,是由于环境盐分增大,根系截留盐离子的能力增强,降低了叶片中离子的含量,并通过细胞内区域化作用稀释盐分将其从细胞质和细胞器中清除或储存在液泡中。
新疆南疆的盐土主要以氯化物或硫酸盐-氯化物为主[30],根系对SO2-4含量截留能力弱,导致SO2-4含量在叶片中积累增多。Schmidt A[31]认为硫酸盐胁迫导致大量S元素在植物体内积累,植物体内的S元素易形成游离的硫化物并与细胞色素结合,从而抑制线粒体呼吸,进而对叶片发育与根茎伸长造成影响。中盐生境中叶片各类离子中SO2-4含量最高的同时叶片解剖结构的多项指标也是最高的,当SO2-4含量增多时叶片通过改变其结构来适应并正常生长。
植物有时会受到Na+毒害和K+亏缺2种叠加伤害,而维持细胞中的较高的K+与K+/ Na+比可以减少2种因素带来的毒害,保证机体进行正常生理代谢[32]。植物能否在盐渍环境条件下生存很大程度上取决于其体内维持 K+/ Na+、Ca2+/ Na+比值平衡的能力[33],植物体内相对较高的K+/ Na+、Ca2+/ Na+比值是植物耐盐性强的表现,同时能表征植物体内离子平衡受盐胁迫破坏的程度:其比值越小,表明Na+含量抑制植株吸收K+、Mg2+、Ca2+含量程度越大,植株受盐害的程度越严重[34]。随土壤盐分减少,胡杨叶片中K+/Na+、Mg2+/Na+比值减少,叶片Mg2+/Na+、K+/Na+比值的下降主要是因为Na+含量增加,说明在盐渍生境下胡杨叶片对盐离子的相对吸收增加,盐胁迫下Na+的大量进入,阻碍了胡杨叶片对其他营养离子的吸收,破坏了离子平衡。而Ca2+/Na+比值的增大可能是叶片的离子选择吸收与离子平衡调节所造成。
3.3 胡杨叶片解剖结构与离子的相关性
栅栏组织、粘液细胞面积、栅栏组织/海绵组织、叶片紧密度与HCO3-和Na+含量呈显著或极显著正相关,与K+含量呈显著或极显著负相关,胡杨叶片在盐渍生境中受到一定的Na+毒害,而HCO3-导致碱胁迫对光合器官直接的毒害引起的非气孔限制使植物光合作用受到抑制[35]使叶片中相关的组织就会发生改变,吸收更多的K+减缓叶片的损伤促进植物进行光合作用。盐碱胁迫对胡杨叶片该类组织的影响比其它组织大,胡杨叶片的耐盐性随着胁迫程度的增加而提高,叶片保水作用越强。中脉维管束面积与Ca2+含量呈显著正相关,与Mg2+含量呈显著负相关,即发生拮抗作用[36],且Ca2+可以通过木质部汁液运输到叶肉细胞[37],中脉维管束中的木质部含有大量Ca2+,与前人研究结果一致。栅栏组织、粘液细胞面积、栅栏组织/海绵组织、叶片紧密度、中脉维管束与叶片的蒸腾作用以及吸收、储存水分的能力有关,降低植物体内盐碱浓度,进而提高植物本身对盐碱胁迫的抗性,胡杨在盐碱生境中,叶片会通过改变其自身结构来抵御胁迫环境,提高其对盐碱环境的适应能力。
3.4 叶片解剖结构、离子与土壤相关性
土壤盐胁迫会影响到植物组织的离子分布[38],大部分土壤因子与叶片离子中的K+含量呈极显著相关,土壤中的盐离子会降低土壤渗透势使植物吸水困难,植物受到盐胁迫时体内会积累大量的无机离子[39],叶片通过叶肉细胞液泡组织区隔Na+并在叶片中储存K+来减轻盐害[40]。
叶片表皮、栅栏组织及粘液细胞大小与植物控制蒸腾、保持水分的功能密切相关,对于大多数植物来说,在盐胁迫下叶片表皮细胞增厚、角质层厚度增加以及栅栏组织发达[20]。研究中,胡杨叶片上下表皮厚度与土壤全盐和电导率呈显著正相关,增厚的表皮提高了胡杨叶片的保水能力以适应高盐环境。紫穗槐、三叶木通的叶片厚度、表皮细胞厚度和栅栏组织厚度在受到干旱胁迫时,表现出不同程度的减小[6],研究中胡杨栅栏组织厚度、粘液细胞面积和栅/海比等也表现出与土壤含水量间存在显著或极显著正相关的特点。
4 结 论
4.1 低盐生境中,胡杨通过发达的栅栏组织、海绵组织和中脉维管束构建发育良好的叶肉组织;中盐生境中,通过增大上、下表皮厚度、栅栏组织及粘液细胞面积,弥补中脉维管束运输水分的功能,保障叶片所需的水分,抵御盐害;高盐生境中,胡杨通过增加下表皮和海绵组织的厚度,减少蒸腾作用,保持植物体内的水分,提高在植物在盐胁迫环境中的适应性。
4.2 从低盐生境到高盐生境盐胁迫增加,胡杨根系截留能力使胡杨叶中Na+、Mg2+、Ca2+、HCO3-和Cl-含量均减少,降低叶中的离子含量从而减少对光合器官伤害以及缓解地上部分盐毒害,同时增加叶片中K+含量维持叶片中离子平衡。根系对SO2-4含量截留能力较弱,因此当叶片中SO2-4含量增多时改变叶片的结构维持其正常的生长。
4.3 栅栏组织、粘液细胞面积、栅栏组织/海绵组织、叶片紧密度与HCO3-和Na+含量呈显著或极显著正相关,与K+含量呈显著或极显著负相关;土壤pH值、全盐和电导率与K+呈极显著相关,叶片中K+易受环境影响。胡杨叶片受到胁迫时,将通过改变其自身结构来抵御胁迫环境,叶片解剖结构及其离子含量与其适应盐环境有着密切联系。
参考文献(References)
[1]王遵亲. 中国盐渍土[M]. 北京: 科学出版社, 1993.
WANG Zunqin. Saline soil in China[M]. Beijing: Science Press, 1993.
[2] Meloni D A, Oliva M A, Martinez C A, et al. Photosynthesis and activity of superoxide dismutase, peroxidase and glutathione reductase in cotton under salt stress[J]. Environmental and Experimental Botany, 2003, 49(1): 69-76.
[3] 乔旭, 黄爱军, 褚贵新. 植物对盐分胁迫的响应及其耐盐机理研究进展[J]. 新疆农业科学, 2011, 48(11): 2089-2094.
QIAO Xu, HUANG Aijun, CHU Guixin. Research progress in the effects of salt stress on plant and the mechanism of plant resistance[J]. Xinjiang Agricultural Sciences, 2011, 48(11): 2089-2094.
[4] 赵春彦, 秦洁, 贺晓慧, 等. 荒漠河岸林胡杨对盐胁迫的适应机制[J]. 干旱区资源与环境, 2022, 36(7): 166-172.
ZHAO Chunyan, QIN Jie, HE Xiaohui, et al. Mechanisms underlying adaption of Populus Euphratica to salt stress in desert riparian forests[J]. Journal of Arid Land Resources and Environment, 2022, 36(7): 166-172.
[5] Albaladejo I, Meco V, Plasencia F, et al. Unravelling the strategies used by the wild tomato species Solanum pennellii to confront salt stress: From leaf anatomical adaptations to molecular responses[J]. Environmental and Experimental Botany, 2017, (135): 1-12.
[6] 岑湘涛, 沈伟, 牛俊乐, 等. 基于植物叶片解剖结构的抗逆性评价研究进展[J]. 北方园艺, 2021,(18): 140-147.
CEN Xiangtao, SHEN Wei, NIU Junle, et al. Research progress of stress resistance evaluation based on the anatomy of plant leaves[J]. Northern Horticulture, 2021,(18): 140-147.
[7] 李芳兰, 包维楷. 植物叶片形态解剖结构对环境变化的响应与适应[J]. 植物学通报, 2005, 40(S1): 118-127.
LI Fanglan, BAO Weikai. Response and adaptation of plant leaf morphological and anatomical structure to environmental changes[J]. Chinese Bulletin of Botany, 2005, 40(S1): 118-127.
[8] 章英才, 闫天珍. 花花柴叶片解剖结构与生态环境关系的研究[J]. 宁夏农学院学报, 2003, 24(1): 31-33.
ZHANG Yingcai, YAN Tianzhen. Study on relationship between anatomical structure of leaves of karelinia capsia (pall) less and ecological environment[J]. Journal of Ningxia Agricultural College, 2003, 24(1): 31-33.
[9] Parida A K, Das A B, Mittra B. Effects of salt on growth, ion accumulation, photosynthesis and leaf anatomy of the mangrove, Bruguiera parviflora[J]. Trees, 2004, 18(2): 167-174.
[10] 顾骁, 杨文丽, 吴远燕, 等. 植物对盐胁迫的适应机制及其提高耐盐能力的主要途径[J]. 农技服务, 2021, 38(7): 92-96.
GU Xiao, YANG Wenli, WU Yuanyan, et al. The adaptive mechanism of plants to salt stress and the main ways to improve salt tolerance[J]. Agricultural Technology Service, 2021, 38(7): 92-96.
[11] 皇甫文君, 李继武. 塔里木河流域胡杨林退化情况及生态保护建议[J]. 新疆林业, 2021,(2): 4-6.
HUANGFU Wenjun, LI Jiwu. Degradation of Populus euphratica forest in Tarim River Basin and suggestions on ecological protection[J]. Forestry of Xinjiang, 2021,(2): 4-6.
[12] 鲁艳, 雷加强, 曾凡江, 等. NaCl处理对胡杨生长及生理生态特征的影响[J]. 干旱区研究, 2015, 32(2): 279-285.
LU Yan, LEI Jiaqiang, ZENG Fanjiang, et al. Effects of NaCl treatments on growth and ecophysiological characteristics of Populus euphratica[J]. Arid Zone Research, 2015, 32(2): 279-285.
[13] 李菊艳, 赵成义, 闫映宇, 等. 盐分对胡杨(Populus euphratica)幼苗生长和离子平衡的影响[J]. 干旱区地理, 2016, 39(3): 613-620.
LI Juyan, ZHAO Chengyi, YAN Yingyu, et al. Effect of salinity on growth, ionic homeostasis in organs of Populus euphratica seedlings[J]. Arid Land Geography, 2016, 39(3): 613-620.
[14] 张霞, 曾幼玲, 李金耀, 等. 胡杨(Populus euphratica oliv)的耐盐性[J]. 植物生理学通讯, 2006,(6):1190-1194.
ZHANG Xia, ZENG Youling, LI Jinyao, et al. Salt tolerance in Populus euphratica oliv[J]. Plant Physiology Communications, 2006,(6):1190-1194.
[15] 张肖, 王旭, 焦培培, 等. 胡杨(Populus euphratica)种子萌发及胚生长对盐旱胁迫的响应[J]. 中国沙漠, 2016, 36(6): 1597-1605.
ZHANG Xiao, WANG Xu, JIAO Peipei, et al. Response of seed germination and embryo growth to salt stress and drought stress of Populus euphratica[J]. Journal of Desert Research, 2016, 36(6): 1597-1605.
[16] 孙兆军. 银川平原盐碱荒地改良模式研究[D]. 北京: 北京林业大学, 2011.
SUN Zhaojun. Amelioration Models for Saline-alkali Wasterland in Yinchuan Plain[D]. Beijing: Beijing Forestry University, 2011.
[17] 王虹, 齐政, 张富春. 不同浓度盐胁迫下盐穗木叶片结构的比较观察[J]. 新疆农业科学, 2016, 53(11): 2098-2105.
WANG Hong, QI Zheng, ZHANG Fuchun. Leaf anatomical structure of Halostachys caspica under different concentrations of salt stress[J]. Xinjiang Agricultural Sciences, 2016, 53(11): 2098-2105.
[18] 肖磊, 陈宁美, 陈悦, 等. 内蒙古与北京地区胡杨异形叶表皮蜡质及气孔形态显微结构差异[J]. 中央民族大学学报(自然科学版), 2016, 25(3): 85-91.
XIAO Lei, CHEN Ningmei, CHEN Yue, et al. The difference of cuticle wax crystallization and Stoma morphology of lanceolate and broad-ovate leaves of Populus euphratica olive between Ejina Area in Inner Mongolia and Beijing Area[J]. Journal of Minzu University of China (Natural Sciences Edition), 2016, 25(3): 85-91.
[19] 洪文君, 申长青, 庄雪影, 等. 盐胁迫对竹柳幼苗生理响应及结构解剖的研究[J]. 热带亚热带植物学报, 2017, 25(5): 489-496.
HONG Wenjun, SHEN Changqing, ZHUANG Xueying, et al. Effect of NaCl stress on physiological responses and anatomical structure of Salix spp. seedlings[J]. Journal of Tropical and Subtropical Botany, 2017, 25(5): 489-496.
[20] 贾文飞, 魏晓琼, 聂小兰, 等. 盐碱胁迫对越橘生理特性及叶片解剖结构的影响[J]. 西北农林科技大学学报(自然科学版), 2022, 50(5): 115-126.
JIA Wenfei, WEI Xiaoqiong, NIE Xiaolan, et al. Effects of saline-alkali stress on physiological characteristics and anatomic structure of blueberry leave[J]. Journal of Northwest A amp; F University (Natural Science Edition), 2022, 50(5): 115-126.
[21] 章英才. 几种不同盐生植物叶的比较解剖研究[J]. 宁夏大学学报(自然科学版), 2006, 27(1): 68-71.
ZHANG Yingcai. Studies of comparative anatomy structure of several different saline plants leaves[J]. Journal of Ningxia University (Natural Science Edition), 2006, 27(1): 68-71.
[22] 燕玲, 李红, 贺晓, 等. 阿拉善地区9种珍稀濒危植物营养器官生态解剖观察[J]. 内蒙古农业大学学报(自然科学版), 2000, 21(3): 65-71.
YAN Ling, LI Hong, HE Xiao, et al. Ecological anatomy of nine priority species in a la San arwa[J]. Journal of Inner Mongola Institute of Agriculture and Animal Husbandry, 2000, 21(3): 65-71.
[23] 王斌, 巨波, 赵慧娟, 等. 不同盐梯度处理下沼泽小叶桦的生理特征及叶片结构[J]. 林业科学, 2011, 47(10): 29-36.
WANG Bin, JU Bo, ZHAO Huijuan, et al. Photosynthetic performance and variation in leaf anatomic structure of Betula microphylla var. paludosa under different saline conditions[J]. Scientia Silvae Sinicae, 2011, 47(10): 29-36.
[24] 李志军, 吕春霞, 段黄金. 胡杨和灰叶胡杨营养器官的解剖学研究[J]. 塔里木农垦大学学报, 1996, 8(2): 21-25, 33.
LI Zhijun, LYU Chunxia, DUAN Huangjin. Anatomical studies on the vegetative organs of Populus euphtatica oliv. and Populus pruinosa schrenk[J]. Journal of Tarim University of Agricultural Reclamation, 1996, 8(2): 21-25, 33.
[25] 戴凌燕, 张立军, 阮燕晔, 等. 苏打盐碱胁迫对甜高粱叶片结构及抗性指标的影响[J]. 农业环境科学学报, 2012, 31(3): 468-475.
DAI Lingyan, ZHANG Lijun, RUAN Yanye, et al. Effects of saline-sodic stress on the blade structure and resistant indexes in sweet Sorghum(Sorghum bicolor L.Moench)[J]. Journal of Agro-Environment Science, 2012, 31(3): 468-475.
[26] 陈旭, 刘洪凯, 赵春周, 等. 山东滨海盐碱地11个造林树种叶解剖特征对土壤条件的响应[J]. 植物生态学报, 2019, 43(8): 697-708.
CHEN Xu, LIU Hongkai, ZHAO Chunzhou, et al. Responses of foliar anatomical traits to soil conditions in 11 tree species on coastal saline-alkali sites of Shandong, China[J]. Chinese Journal of Plant Ecology, 2019, 43(8): 697-708.
[27] Ruiz-Lozano J M, Porcel R, Azcón C, et al. Regulation by arbuscular mycorrhizae of the integrated physiological response to salinity in plants: new challenges in physiological and molecular studies[J]. Journal of Experimental Botany, 2012, 63(11): 4033-4044.
[28] 左照江, 张汝民, 高岩. 盐胁迫下植物细胞离子流变化的研究进展[J]. 浙江农林大学学报, 2014, 31(5): 805-811.
ZUO Zhaojiang, ZHANG Rumin, GAO Yan. Advances in plant cell ion flux with salt stress: a review[J]. Journal of Zhejiang A amp; F University, 2014, 31(5): 805-811.
[29] 张瑾. 胡杨吸盐能力的研究[D]. 呼和浩特: 内蒙古大学, 2013.
ZHANG Jin. The Research on the Abiliti of Absorbing Salt of Populus Euphratica[D]. Hohhot: Inner Mongolia University, 2013.
[30]新疆维吾尔自治区农业厅、新疆维吾尔自治区土壤普查办公室.新疆土壤[M]. 北京:科学出版社,1996.
Department of Agriculture of Xinjiang Uygur Autonomous Region, Soil Census Office of Xinjiang Uygur Autonomous Region. Xinjiang Soil [M].Beijing: Science Press,1996.
[31]Schmidt A. Metabolic background of H2S release from plants [J]. Landbauforschung Volkenrode,2005,283(S1):121-129.
[32] Shabala S, Cuin T A. Potassium transport and plant salt tolerance[J]. Physiologia Plantarum, 2008, 133(4): 651-669.
[33] Sun J, Chen S L, Dai S X, et al. Ion flux profiles and plant ion homeostasis control under salt stress[J]. Plant Signaling amp; Behavior, 2009, 4(4): 261-264.
[34] 罗青红, 周斌, 李英仑, 等. 盐渍土壤大果沙枣树主要矿质阳离子的吸收和分配特征[J]. 西北植物学报, 2021, 41(8): 1371-1379.
LUO Qinghong, ZHOU Bin, LI Yinglun, et al. Absorption and distribution of main mineral cations of Elaeagnus moorcroftii in salinized land[J]. Acta Botanica Boreali-Occidentalia Sinica, 2021, 41(8): 1371-1379.
[35] Brugnoli E, Lauteri M. Effects of salinity on stomatal conductance, photosynthetic capacity, and carbon isotope discrimination of salt-tolerant (Gossypium hirsutum L.) and salt-sensitive (Phaseolus vulgaris L.) C(3) Non-Halophytes[J]. Plant Physiology, 1991, 95(2): 628-635.
[36] Tang R J, Luan S. Regulation of calcium and magnesium homeostasis in plants: from transporters to signaling network[J]. Current Opinion in Plant Biology, 2017, (39): 97-105.
[37] De Silva D L R, Hetherington A M, Mansfield T A. Where does all the calcium go? Evidence of an important regulatory role for trichomes in two calcicoles[J]. Plant, Cell amp; Environment, 1996, 19(7): 880-886.
[38] 朱义, 谭贵娥, 何池全, 等. 盐胁迫对高羊茅(Festuca arundinacea)幼苗生长和离子分布的影响[J]. 生态学报, 2007, 27(12): 5447-5454.
ZHU Yi, TAN Guie, HE Chiquan, et al. Effect of salinization on growth and ion homeostasis in seedlings of Festuca arundinacea[J]. Acta Ecologica Sinica, 2007, 27(12): 5447-5454.
[39] 齐琪, 马书荣, 徐维东. 盐胁迫对植物生长的影响及耐盐生理机制研究进展[J]. 分子植物育种, 2020, 18(8): 2741-2746.
QI Qi, MA Shurong, XU Weidong. Advances in the effects of salt stress on plant growth and physiological mechanisms of salt tolerance[J]. Molecular Plant Breeding, 2020, 18(8): 2741-2746.
[40] Wakeel A, Farooq M, Qadir M, et al. Potassium substitution by sodium in plants[J]. Critical Reviews in Plant Sciences, 2011, 30(4): 401-413.
Effects of different saline environments on anatomical structure
and ion content of Populus euphratica leaves
YAO Shiyu1, WANG Jie1, HUANG Wenjuan1,2, JIAO Peipei1,2, PENG Chengzhi1,
XIONG Dan1, CHEN Yue1, WANG Xin1
(1.College of Life Science and Technology, Tarim University, Aral Xinjiang 843300,China;2. Key Laboratory of Biological Resources Protection and Utilization in Tarim Basin (Co-Established by Xinjiang Production and Corctrution Corp and MARA), Aral Xinjiang 843300, China)
Abstract:【Objective】 To discuss(Populus euphratica) the adaptation characteristics of the saline environment and reveal the physiological mechanism of salt tolerance.
【Methods】 P. euphratica leaves in different saline habitats were used as experimental test materials, the ions were determined by boiling water extraction and boiling method, and the anatomical structure of the leaves was observed under light microscope by paraffin sectioning method, and the content of each ion of the leaves and the comparative anatomical structure characteristics of the leaves were studied.
【Results】 (1) In the low-salt environment, the fence tissue in the leaf of P. euphraticawas larger, the leaf thickness, sponge tissue and midvein vascular bundle area were the largest, and the sponge tissue thickness was significantly different compared with other environments. In the medium salt environment, the thickness of the upper and lower epidermis, the area of fence tissue and mucus cells were greater than those of other environments. In a high-salt environment, P. euphratica leaves increased the thickness of epidermis, sponge tissue and leaf thickness. (2) From low salt environment to high salt environment, the contents of Na+, Mg2+, Ca2+, HCO3- and Cl- in poplar leaves decreased, and the K+ content in leaves increased, thus the ion balance in leaves being maintained. (3) Fence tissue, mucus cell area, fence tissue/sponge tissue, and leaf compactness were significantly or very positively correlated with HCO3- and Na+, and significantly or very negatively correlated with K+;K+ in leaves was susceptible to environmental influences, which was significantly correlated with soil pH, total salt and conductivity. The epidermal thickness, mucus cell volume, and grid-to-sea ratio on the leaves were strongly correlated with soil salinity and water content, indicating that when stressed by salinity, they would resist the stress environment by changing their own structure.
【Conclusion】 Under different saline environmental conditions, the leaves of P. euphratica chinensis are mainly regulated and stored in the leaves by salt separators and act on all parts of the leaves, so as to ensure the normal physiological metabolism of the tree body and form different leaf anatomical characteristics to adapt to the environment.
Key words:saline environment; Populus euphratica; ion; leaf anatomical structure
Fund projects:The Project of National Natural Foundation of China \"Molecular Regulatory Networks and Their Functional Gene Mining in Populus euphratica\"(32160355); Second Phase Talents Project of XPCC \"the Open Project of the Key Laboratory of Biological resources Protection and Utilization in Tarim Basin\" (BRFW2101); Fiscal Science and Technology Program Project \"Development and Application of DNA Molecular Markers in Populus euphratica Seedling Stage\" (2022CB001-10)
Correspondence author:HUANG Wenjuan(1980-),female,from Fujin, Heilongjiang, professor, master, master's supervisor, research direction: plant physiological ecology and plant diversity conservation in desert areas,(E-mail)hwjzky@163.com
