利妥昔单抗生物类似药与原研药在初治弥漫性大B细胞淋巴瘤中的疗效与安全性研究
2024-12-18张杰蒋依憬沈辉孙欣然徐小红

[摘" "要]" "目的:比较利妥昔单抗生物类似药(汉利康®)和原研药(美罗华®)联合CHOP方案治疗初治弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)的临床效果和安全性。方法:回顾性分析2018年1月—2021年3月南通市肿瘤医院收治的采用R-CHOP方案免疫化疗的91例初治DLBCL的临床病理资料。根据所用利妥昔单抗品牌的不同分为美罗华治疗组(R-CHOP组)(n=50)和汉利康治疗组(H-CHOP组)(n=41)。观察两组患者的客观缓解率(objective response rate, ORR)、无进展生存期(progression free survival, PFS)、总生存期(overall survival, OS)和治疗相关不良事件(treatment emergent adverse event, TEAE)。结果:中位随访40个月,R-CHOP组和H-CHOP组的ORR为74.0% vs 87.8%(P=0.100),两组患者中位PFS和OS均未达到(P=0.302和P=0.284)。安全性方面,R-CHOP组和H-CHOP组最常见的TEAE均为白细胞减少和中性粒细胞减少,两组整体TEAE发生率相当(P=0.887)。结论:国产利妥昔单抗生物类似药(汉利康®)与原研药(美罗华®)在初治DLBCL中疗效和安全性相当,患者耐受性良好。
[关键词]" "弥漫性大B细胞淋巴瘤;利妥昔单抗;生物类似药;汉利康®;美罗华®;安全性
[中图分类号]" "R733.4" " " " " " " "[文献标志码]" "A" " " " " " " "[文章编号]" "1674-7887(2024)05-0431-04
Study on the efficacies and safeties of rituximab biosimilars and innovator drugs in the initial treatment of diffuse large B-cell lymphoma*
ZHANG Jie1**, JIANG Yijing2, SHEN Hui3, SUN Xinran1, XU Xiaohong1***" " " " (1Department of Oncology, Tumor Hospital Affiliated to Nantong University, Nantong Tumor Hospital, Jiangsu 226361; 2Department of Pathophysiology, Medical School, Nantong University; 3Department of Oncology, the People?蒺s Hospital of Rugao)
[Abstract]" "Objective: To compare the clinical efficacies and safeties of rituximab biosimilars(HLX01®) and innovator drugs(Mabthera®) combined with CHOP regimen in the initial treatment of diffuse large B-cell lymphoma(DLBCL). Methods: The clinicopathological data of 91 DLBCL patients initially treated with R-CHOP regimen in Nantong Tumor Hospital from January 2018 to March 2021 were retrospectively analyzed. According to the different brands of rituximab used, they were divided into Mabthera treatment group(R-CHOP group)(n=50) and HLX01 treatment group(H-CHOP group)(n=41). The objective response rate(ORR), progression free survival(PFS), overall survival(OS) and treatment emergent adverse event(TEAE) in the two groups were observed. Results: The median follow-up time was 40 months. The ORR was 74.0% in the R-CHOP group and 87.8% in the H-CHOP group(P=0.100). The median PFS and OS were not reached in the two groups(P=0.302 and P=0.284). In terms of safety, the most common TEAEs in both R-CHOP group and H-CHOP group were decreased white blood cell count and neutrophil count, and the overall incidence of TEAEs was similar between the two groups(P=0.887). Conclusion: The efficacy and safety are comparable between domestic rituximab biosimilars(HLX01®) and the innovator drugs(Mabthera®) in the initial treatment of DLBCL, and both drugs are well tolerated in the patients.
[Key words]" "diffuse large B-cell lymphoma; rituximab; biosimilar; HLX01®; Mabthera®; safety
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是成人最常见的淋巴系统恶性肿瘤,占非霍奇金淋巴瘤(non-Hodgkin?蒺s lymphoma, NHL)的30%~40%[1]。国内的流行病学调查[2]显示NHL的发病率和死亡率为4.99/10万和2.23/10万。DLBCL具有高度异质性和侵袭性,大多数患者确诊时为晚期,约2/3的患者经一线免疫化疗后可治愈,但仍有约1/3的患者出现难治或复发[3]。
CD20是一种由279个氨基酸组成的跨膜磷蛋白,分子质量为33~37 ku,在95%以上B细胞来源的恶性肿瘤细胞中表达,而造血干细胞、浆细胞和其他正常组织均不表达[4]。利妥昔单抗——美罗华®(Mabthera®),作为靶向CD20的人鼠嵌合单克隆抗体药物成为全球首款单抗在1997被美国食品和药品管理局批准上市,用于治疗NHL[5]。近20多年来,R-CHOP方案(利妥昔单抗+环磷酰胺+阿霉素+长春新碱+泼尼松)已成为DLBCL一线治疗方案的基石,显著改善了患者的预后[6-7]。然而,原研利妥昔单抗因其高昂的价格,使许多患者望而却步。
2019年2月22日,我国首个利妥昔单抗生物类似药——汉利康®(HLX01®)经国家药品监督管理局获批上市[8]。获批适应证为:(1)复发或耐药的滤泡性中央型淋巴瘤;(2)未经治疗的CD20阳性Ⅲ~Ⅳ期滤泡性NHL;(3)CD20阳性DLBCL。汉利康®自上市后,凭借与美罗华®相当的疗效和相对低廉的价格在DLBCL的治疗中占有一席之地。今年是汉利康®上市的第5年,目前鲜有真实世界中其与美罗华®头对头的临床疗效和安全性分析比较。本研究回顾性收集在南通市肿瘤医院接受R-CHOP方案治疗的初治DLBCL患者的临床病理资料并进行随访,旨在比较汉利康®与美罗华®的临床疗效与安全性。
1" "资料与方法
1.1" "一般资料" "回顾性分析2018年1月—2021年3月南通市肿瘤医院收治且经病理确诊的初治DLBCL患者病例资料。纳入标准:(1)经组织学病理诊断为CD20阳性DLBCL;(2)年龄≥18岁;(3)美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体能状态(performances status, PS)评分0~2分;(4)预计生存期≥6个月;(5)接受R-CHOP方案免疫化疗。排除标准:(1)合并严重心、肝、肾等脏器功能不全;(2)合并其他恶性肿瘤;(3)患有严重基础疾病不能接受化疗。最终符合入组标准的患者共91例,男55例,女36例。根据使用的利妥昔单抗品牌将患者分为两组:美罗华®治疗组(R-CHOP组)50例和汉利康®治疗组(H-CHOP组)41例。本研究通过南通市肿瘤医院伦理审查委员会审批[通肿伦审(课题)2021-081]。
1.2" "治疗方案" "所有患者均接受R-CHOP方案免疫化疗:利妥昔单抗(375 mg/m2,静脉滴注,d0),环磷酰胺(750 mg/m2,静脉滴注,d1),多柔比星(40~50 mg/m2,静脉滴注,d1)或表柔比星(60~70 mg/m2,静脉滴注,d1),长春新碱(1.4 mg/m2,静脉注射,d1)(最大剂量2 mg),泼尼松(100 mg,口服,d1~5),每21天重复。R-CHOP组的利妥昔单抗采用美罗华®(Roche Diagno-stics GmbH,国药准字SJ20170002),H-CHOP组的利妥昔单抗采用汉利康®(上海复宏汉霖生物制药有限公司,国药准字S20190021)。利妥昔单抗使用前常规给予解热镇痛药、抗组胺药和糖皮质激素进行预处理,输注过程中进行心电监测。化疗药物剂量由临床医师依据患者身体耐受程度进行酌情调整。
1.3 " 疗效评估" "每治疗2个周期后CT检查进行疗效评估,其中第4周期或所有治疗周期结束后有条件的患者通过PET-CT进行治疗中期或治疗结束后疗效评估。根据2014版Lugano会议修订的淋巴瘤疗效评价标准评估患者的治疗效果,包括完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)。客观缓解率(objective response rate, ORR)=(CR+PR)/总例数×100%。
1.4 " 治疗相关不良事件(treatment emergent adverse event, TEAE)评估" "依据常见不良事件通用术语标准(common terminology criteria for adverse events, CTCAE)5.0版进行TEAE评估。主要的TEAE包括血液学毒性(WBC减少、中性粒细胞减少、血红蛋白减少、PLT减少)和非血液学毒性(恶心、呕吐、ALT升高、AST升高、发热、寒战、食欲减退、乏力、感染、间质性肺炎等)。
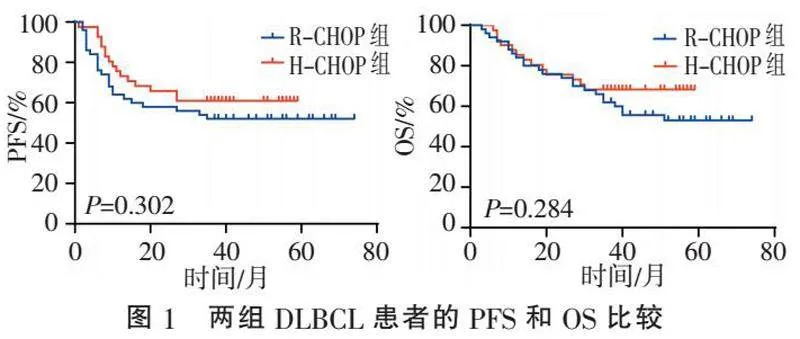
1.5 " 随访" "91例患者均通过门诊或电话形式随访,随访截止到2024-03-18,随访时间3~74个月,中位随访时间40个月,无失访病例。无进展生存期(progression free survival, PFS)作为次要预后研究终点,定义为接受治疗开始至首次出现疾病进展、死亡或末次随访时间。总生存期(overall survival, OS)作为主要预后研究终点,定义为治疗开始至患者死亡或末次随访时间。
1.6 " 统计学方法" "采用SPSS 25.0和GraphPad Prism 10.2软件对数据进行统计分析并绘图。通过χ2检验进行计数资料组间比较。采用Kaplan-Meier法进行生存分析,组间差异通过Log-rank检验比较。检验水准α=0.05(双尾)。
2" "结" " " 果
2.1 " 一般资料比较" "R-CHOP组年龄32~86岁,中位年龄68.5岁;H-CHOP组年龄49~87岁,中位年龄71岁。两组间的临床及病理特征比较差异均无统计学意义(均P>0.05),具有可比性,见表1。
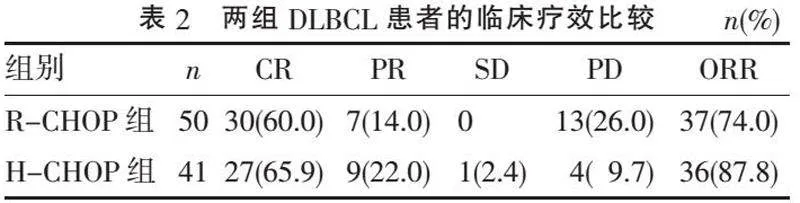
2.2 " 疗效比较" "两组患者的CR、PR、SD和PD差异无统计学意义( χ2=5.335,P=0.149),ORR差异亦无统计学意义( χ2=2.706,P=0.100),见表2。结果表明,R-CHOP组和H-CHOP组在疾病缓解上疗效相当。
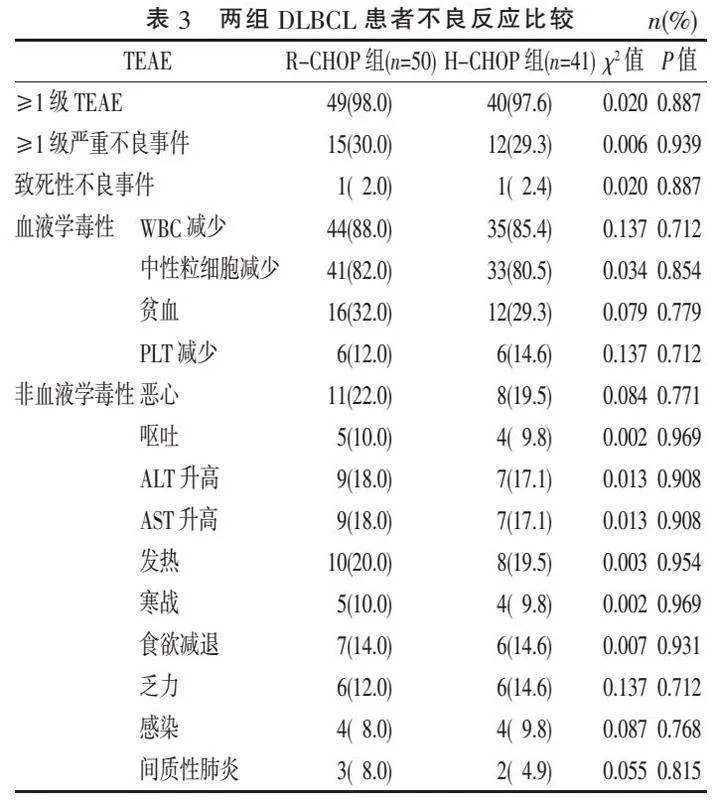
2.3 " TEAE比较" "两组的TEAE发生率相当(Pgt;0.05);两组最常见的血液学毒性为WBC减少,其次是中性粒细胞减少;最常见的非血液学毒性为恶心,见表3。两组各有1例致死性TEAE,均为间质性肺炎,继而出现呼吸功能衰竭,最终导致死亡。结果表明,R-CHOP组和H-CHOP组在用药安全性及不良反应的耐受性上表现良好。
2.4 " 生存分析比较" "R-CHOP组和H-CHOP组的中位PFS和中位OS均未达到,差异无统计学意义( χ2=1.066、1.146,P=0.302、0.284),见图1。结果表明,R-CHOP组和H-CHOP组在长、短期生存预后方面疗效相当。
3" "讨" " " 论
DLBCL是一类在形态学、遗传学以及临床表现等方面具有明显异质性的疾病。自1976年起,CHOP方案就已成为DLBCL治疗的“金标准”方案[9]。然而,在过去的很长一段时间内,患者的CR率始终难以突破50%,5年OS率不足40%。直至1997年利妥昔单抗(美罗华®)上市才打破这一僵局。B.COIFFIER等[6]发起的首个大型CD20-CHOP研究表明,R-CHOP组的2年无事件生存(event free survival,EFS)率和OS率均显著优于CHOP组(EFS:57% vs 38%,P<0.001;OS:70% vs 57%,P=0.007),奠定了R-CHOP方案在利妥昔单抗时代DLBCL治疗的基石地位。GELALNH98-5研究的5年随访[10]和10年随访[11]结果再次证实在CHOP方案基础上加入利妥昔单抗可显著提高DLBCL患者的长期临床疗效。自2000年美罗华®进入中国市场后,由管忠震教授[12]和沈志祥教授[13]分别牵头的两项多中心临床研究均显示美罗华®的加入可以显著改善中国DLBCL患者的临床疗效及预后。然而,美罗华®作为原研药物其研制难度大、周期长、成本高,并受医保限制,价格一直居高不下,大部分国内DLBCL患者因经济原因未能使用。在此背景下,由本土研发的生物类似药应运而生。
汉利康®是我国研发的首个利妥昔单抗生物类似药,在安全性与免疫原性方面与美罗华®等效[14]。Ⅰ期临床研究[15]结果证实了汉利康®与美罗华®具有相似的药代动力学、药效学和安全性,中国CD20阳性的B细胞淋巴瘤患者接受汉利康®治疗的安全性和耐受性良好。Ⅲ期临床研究[16]显示,汉利康®与美罗华®在CD20阳性的初治DLBCL患者的ORR、1年OS和PFS差异均无统计学意义,且两组的安全性相似。Y.QIN等[17]更新的汉利康®Ⅲ期临床研究5年随访结果显示汉利康®与美罗华®的1、3、5年OS和PFS差异均无统计学意义,两者长、短期疗效相当。本研究中R-CHOP组的ORR为74.0%,中位OS和中位PFS未达到,H-CHOP组的ORR为87.8%,中位OS和中位PFS亦未达到,两组的ORR、OS和PFS差异均无统计学意义(均P>0.05)。由此可见,汉利康®与美罗华®的等效性具有与Ⅲ期临床研究一致的结果。
在安全性方面,本研究两组患者的TEAE发生率相当(98.0% vs 97.6%),血液学毒性以WBC减少为主(88.0% vs 85.4%),最常见非血液学毒性为恶心(22.0% vs 19.5%),差异均无统计学意义(Pgt;0.05)。两组患者各出现1例致死性TEAE,均为间质性肺炎继发呼吸衰竭。这表明汉利康®在治疗安全性与不良反应耐受性上与美罗华®相当。
综上所述,国产生物类似药汉利康®与原研药美罗华®疗效相当,汉利康®作为中国首个上市的生物类似药,在中国淋巴瘤治疗上具有里程碑意义,将在未来惠及更多的中国DLBCL患者。
[参考文献]
[1]" "SEHN L H, SALLES G. Diffuse large B-cell lymphoma[J]. N Engl J Med, 2021, 384(9):842-858.
[2]" "LIU W, LIU J, SONG Y, et al. Burden of lymphoma in China, 1990-2019: an analysis of the global burden of diseases, injuries, and risk factors study 2019[J]. Aging (Albany NY), 2022, 14(7):3175-3190.
[3]" "GOURD E. New treatment option for relapsed or refractory DLBCL[J]. Lancet Oncol, 2019, 20(12):e670.
[4]" "郑淑贞, 周逢云, 代虎, 等. 抗CD20单克隆抗体药物的研发进展[J]. 中国医药工业杂志, 2021, 52(11):1452-1459.
[5]" "SALLES G, BARRETT M, FO?魥 R, et al. Rituximab in B-cell hematologic malignancies: a review of 20 years of clinical experience[J]. Adv Ther, 2017, 34(10):2232-2273.
[6]" "COIFFIER B, LEPAGE E, BRIERE J, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma[J]. N Engl J Med, 2002, 346(4):235-242.
[7]" "POLETTO S, NOVO M, PARUZZO L, et al. Treatment strategies for patients with diffuse large B-cell lymphoma[J]. Cancer Treat Rev, 2022, 110:102443.
[8]" "复星医药. 十年磨一剑!首个国产生物类似药正式获批[J]. 上海医药, 2019, 40(5):38-38.
[9]" "MORRISON V A. Frontline therapy with R-CHOP for diffuse large B-cell lymphoma: where have we come(or not come)? A perspective[J]. J Geriatr Oncol, 2021, 12(2):320-325.
[10]" "FEUGIER P, VAN HOOF A, SEBBAN C, et al. Long-term results of the R-CHOP study in the treatment of elderly patients with diffuse large B-cell lymphoma: a study by the groupe d?蒺Etude des lymphomes de l?蒺Adulte[J]. J Clin Oncol, 2005, 23(18):4117-4126.
[11]" "MOUNIER N, HEUTTE N, THIEBLEMONT C, et al. Ten-year relative survival and causes of death in elderly patients treated with R-CHOP or CHOP in the GELA LNH-985 trial[J]. Clin Lymphoma Myeloma Leuk, 2012, 12(3):151-154.
[12]" "林桐榆, 张红雨, 黄岩, 等. R-CHOP与CHOP方案治疗初治弥漫大B细胞型淋巴瘤在中国的多中心随机对照研究[J]. 癌症, 2005, 24(12):1421-1426.
[13]" "李军民, 沈杨, 陈方源, 等. 利妥昔单抗联合CHOP方案治疗弥漫大B细胞性淋巴瘤的多中心临床研究(英文)[J]. 中国新药与临床杂志, 2004, 23(1):5-9.
[14]" "XU Y, XIE L, ZHANG E, et al. Physicochemical and functional assessments demonstrating analytical similarity between rituximab biosimilar HLX01 and the MabThera®[J]. MAbs, 2019, 11(3):606-620.
[15]" "SHI Y, ZHANG Q, HAN X, et al. Phase 1 studies comparing safety, tolerability, pharmacokinetics and pharmacodynamics of HLX01(a rituximab biosimilar) to reference rituximab in Chinese patients with CD20-positive B-cell lymphoma[J]. Chin J Cancer Res, 2021, 33(3):405-416.
[16]" "SHI Y K, SONG Y P, QIN Y, et al. A phase 3 study of rituximab biosimilar HLX01 in patients with diffuse large B-cell lymphoma[J]. J Hematol Oncol, 2020, 13(1):38.
[17]" "QIN Y, SONG Y, WANG D, et al. Long-term outcomes with HLX01(HanliKang®), a rituximab biosimilar, in previously untreated patients with diffuse large B-cell lymphoma: 5-year follow-up results of the phase 3 HLX01-NHL03 study[J]. BMC Cancer, 2024, 24(1):124.
[收稿日期] 2024-03-29
