“环形”反应机理图与“梯形”能量关系图分析技巧
2024-12-11文瑞

摘 要:化学反应机理的研究是现代化学科学的基础和核心.本文详细介绍了化学反应机理研究中常用的“环形”反应机理图和“梯形”能量关系图的分析技巧.通过具体实例的解析,展示了如何运用这些技巧来解析复杂的化学反应过程,并强调了掌握这些分析技巧对于学生的重要性,以期为化学教学提供参考和启示.
关键词:化学反应;环形反应;梯形能量;分析技巧
中图分类号:G632"" 文献标识码:A"" 文章编号:1008-0333(2024)34-0127-03
收稿日期:2024-09-05
作者简介:文瑞(1991.1—),男,云南省宣威人,本科,中级职称,从事高中化学教学研究.
在化学反应机理的学习中,高中化学题目常使用“环形”反应机理图和“梯形”能量关系图来描述和解析反应过程,这些图表能够清晰地展示反应的步骤和过渡状态.本文将详细介绍这两种图表的分析技巧,并通过具体实例,展示如何运用这些技巧来解析复杂的化学反应过程.掌握这些分析技巧,对于学生来说具有重要的实际意义.1 “环形”反应机理图分析技巧
“环形”反应机理图分析步骤可分为三步:第一,把握题干信息,判断催化剂,识别反应的起点和终点;第二,把握一个要旨——环上的物质除催化剂外,其余物质均为中间体;第三,同时判断哪些物质会出现在方程式中,找到反应物和生成物,根据“只进不出”和“只出不进”可判断反应物和生成物[1].
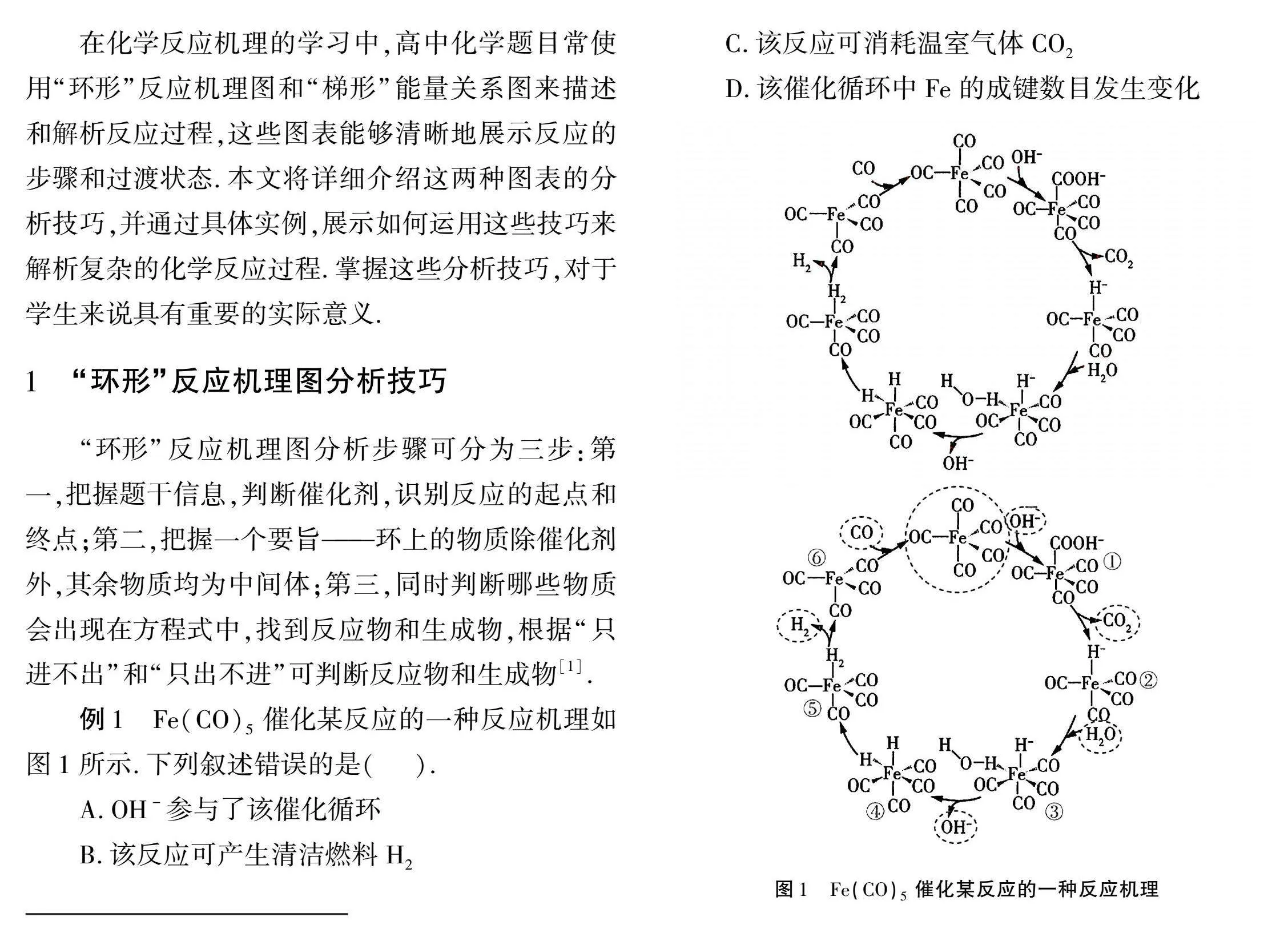
例1 Fe(CO)5催化某反应的一种反应机理如图1所示.下列叙述错误的是(" ).
A.OH-参与了该催化循环
B.该反应可产生清洁燃料H2
C.该反应可消耗温室气体CO2
D.该催化循环中Fe的成键数目发生变化
分析 (1)题目信息:Fe(CO)5催化某反应,从图1看,Fe(CO)5既是起点也是终点,根据以上两点可以判定该物质为催化剂;(2)“环上”的物质除催化剂外,其余为中间体:从反应机理来看,①⑥位于“环上”,且都是在上一步反应生成后,随即在下一
步反应就被消耗,因此①⑥都是中间产物(反应中间体),不会出现在总反应方程式中;(3)找反应物和生成物,注意量的关系:一般“箭头”指入的为反应物,“箭头”指出的为生成物.H2O和CO在反应中都是“只进不出”,因此H2O和CO为总反应的反应物;H2和CO2都是“只出不进”,因此H2和CO2为总反应的生成物;OH-又进又出,为催化剂或反应条件.总反应为H2O+CO催化剂H2+CO2.
解答 分析反应图1可知,OH-有进入的箭头也有出去的箭头,说明OH-参与了该催化循环,故A正确;根据上述分析可知,总反应为,可产生清洁燃料H2,故B正确;从总反应可知,该反应不消耗温室气体CO2,而是生成了温室气体CO2,故C错误;从结构式可知,催化剂Fe(CO)5和①、②、⑤中Fe的成键数目为5,③、④中Fe的成键数目为6,⑥中Fe的成键数目为4,该催化循环中Fe的成键数目发生变化,故D正确[2].
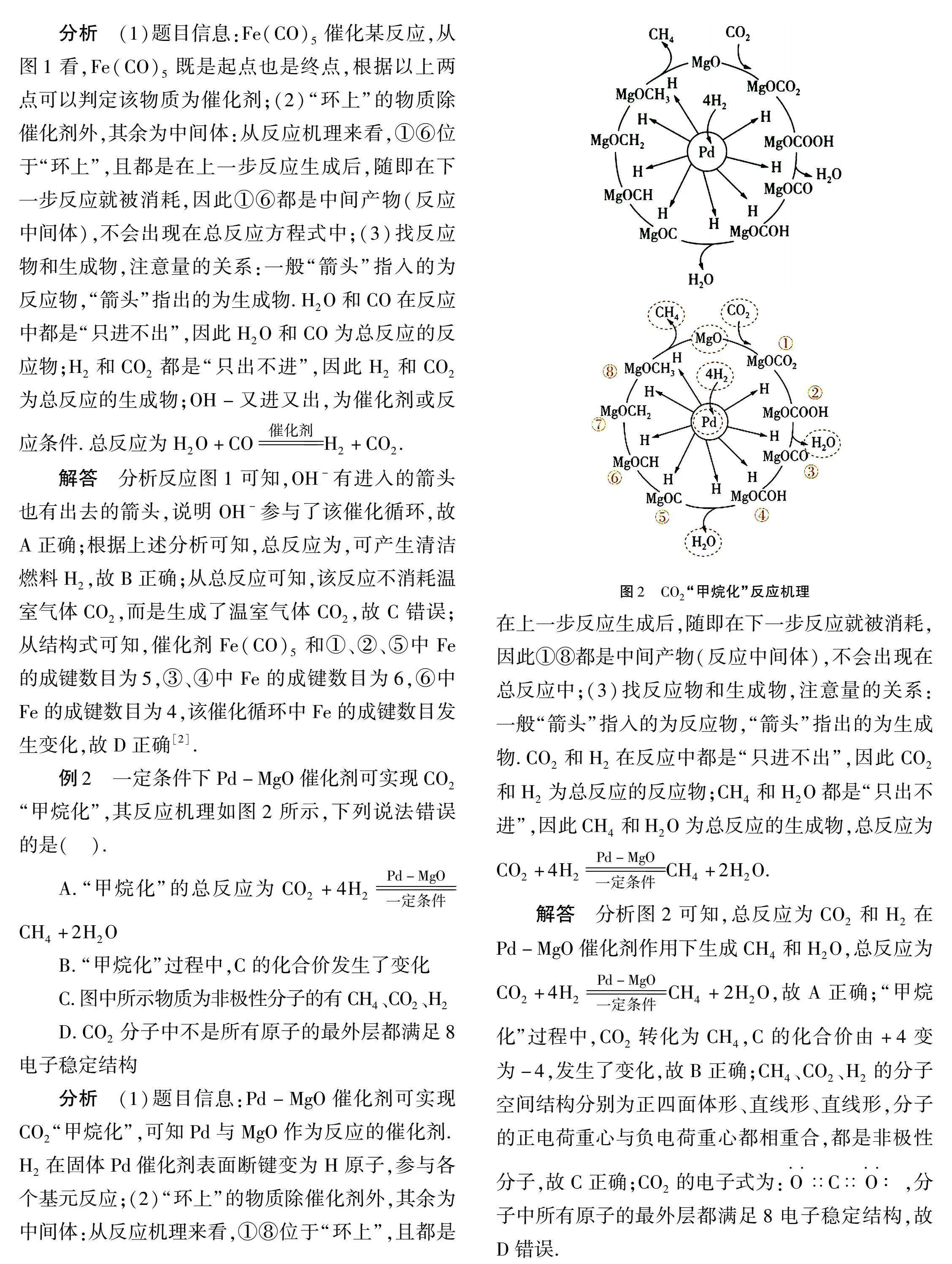
例2 一定条件下Pd-MgO催化剂可实现CO2“甲烷化”,其反应机理如图2所示,下列说法错误的是( ).
A.“甲烷化”的总反应为CO2+4H2Pd-MgO一定条件CH4+2H2O
B.“甲烷化”过程中,C的化合价发生了变化
C.图中所示物质为非极性分子的有CH4、CO2、H2
D.CO2分子中不是所有原子的最外层都满足8电子稳定结构
分析 (1)题目信息:Pd-MgO催化剂可实现CO2“甲烷化”,可知Pd与MgO作为反应的催化剂.H2在固体Pd催化剂表面断键变为H原子,参与各个基元反应;(2)“环上”的物质除催化剂外,其余为中间体:从反应机理来看,①⑧位于“环上”,且都是图2 CO2“甲烷化”反应机理在上一步反应生成后,随即在下一步反应就被消耗,因此①⑧都是中间产物(反应中间体),不会出现在总反应中;(3)找反应物和生成物,注意量的关系:一般“箭头”指入的为反应物,“箭头”指出的为生成物.CO2和H2在反应中都是“只进不出”,因此CO2和H2为总反应的反应物;CH4和H2O都是“只出不进”,因此CH4和H2O为总反应的生成物,总反应为CO2+4H2
Pd-MgO一定条件CH4+2H2O.
解答 分析图2可知,总反应为CO2和H2在Pd-MgO催化剂作用下生成CH4和H2O,总反应为CO2+4H2Pd-MgO一定条件CH4+2H2O,故A正确;“甲烷化”过程中,CO2转化为CH4,C的化合价由+4变为-4,发生了变化,故B正确;CH4、CO2、H2的分子空间结构分别为正四面体形、直线形、直线形,分子的正电荷重心与负电荷重心都相重合,都是非极性分子,故C正确;CO2的电子式为:O··∷C∷O··∶,分子中所有原子的最外层都满足8电子稳定结构,故D错误.
2 “梯形”能量关系图分析技巧
分析“梯形”能量关系图时,需要关注以下几个关键点:首先,识别反应物、过渡态和产物在图中的位置,以及它们之间的能量差;其次,观察活化能的大小,以判断反应的速率和可行性;最后,通过比较反应物和产物之间的能量差,判断反应是放热还是吸热[3].
例3 科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系,如图3所示,其中附在Pd(Ⅲ)表面的物种用标注.下列说法错误的是(" ).
A.②中包含C—H键的断裂过程
B.该历程中能垒(反应活化能)最小的是①
C.甲醇在Pd(Ⅲ)表面发生解离的四个路径中,制约反应速率的方程式为CH3OH*CH3O*+H*
D.由此历程可知:CH3OH(g)CO(g)+2H2(g),ΔHgt;0
解答 题目中解离路径与相对能量关系分析如图4所示,CH3O*中共价键为3个C—H键和1个C—O键,CH2O*中共价键为2个C—H键和1个C—O键,则②中由CH3O*→CH2O*包含C—H键的断裂过程,故A正确;反应活化能为过渡态能量与反应物的总能量之差,从图4中可以看出,①的活化能为100 kJ·mol-1,②的活化能为70 kJ·mol-1,③的活化能约为45 kJ·mol-1,④的活化能约为60 kJ·mol-1,⑤的活化能约为195" kJ·mol-1,则③反应活化能最小,故B错误;活化能越大,反应速率越慢,并且决定整个反应的反应速率,可知制约反应速率的即为慢反应,由图4可知,①的活化能最大,发生的反应为CH3OH*→CH3O*+H*,即为慢反应,故C正确;甲醇的相对能量为-40 kJ·mol-1,CO(g)+2H2(g)的相对能量约为50 kJ·mol-1,可知该历程最后能量升高了,反应CH3OH(g)CO(g)+2H2(g)的ΔHgt;0,故D正确.
3 结束语
通过本文的介绍,学生深入了解了“环形”反应机理图和“梯形”能量关系图的分析技巧.通过具体实例的解析,学生更加明确了如何运用这些技巧来解决实际问题.然而,在实际研究中,学生还需不断积累经验,提高自己的分析能力,以便更好地理解和利用这些图表.希望本文能为化学研究者提供一定的参考和启示,推动化学反应机理研究的发展.
参考文献:
[1]孙云,汤伟.2023年全国新课标高考理综化学选择题评析 [J].数理化学习(高中版),2023(10):57-60.[2] 王芳馨.探析反应机理与理解反应条件:中英高中化学“烯烃与溴的加成反应”内容比较 [J].化学教育(中英文),2022,43(11):27-30.
[3] 唐隆健.对高中化学增加“反应历程”内容特殊意义的思考 [J].化学教学,2021(10):87-91.
[责任编辑:季春阳]
