以壳聚糖和明胶为复合生物墨水3D打印的脊髓仿生支架及其生物相容性研究
2024-11-29刘永华贾月杨其昌
[摘" "要]" "目的:探究3D打印脊髓仿生支架的复合生物墨水配方及生物相容性和可靠性评估。方法:利用3D打印技术,以壳聚糖(chitosan, C)和明胶(gelatin, G)为基础复合生物墨水,比较不同配比复合生物墨水的理化性能:孔隙率、溶胀率、流变性能、降解速率、力学性能分析。通过优化打印参数,打印出特定空间构型的脊髓外形仿生支架。接着运用仿生支架材料浸提液与SH-SY5Y细胞共培养方法,通过扫描电子显微镜和CCK-8实验评估该支架材料的细胞毒性及其对细胞增殖能力的影响。结果:通过比较最终选择4%浓度的C和6%浓度G(4C6G)组为最适的复合生物墨水配方并进行后续的研究。在打印速度1.5 mm/s、压强0.09~0.11 MPa、层厚0.1 mm、间距1 mm、针头0.11 mm的参数下,可以实现打印出5 mm×5 mm×0.9 mm尺寸的蝴蝶形状高保真度的脊髓仿生支架。扫描电子显微镜可见SH-SY5Y细胞黏附在支架内部,并且能正常生长;CCK-8结果显示,浸提液无细胞毒性。结论:以C和G为复合生物墨水有望成为脊髓损伤修复仿生支架的原材料。
[关键词]" "3D打印;壳聚糖;明胶;组织工程;脊髓仿生支架
[中图分类号]" "R651.2" " " " " " " "[文献标志码]" "A" " " " " " " "[文章编号]" "1674-7887(2024)02-0121-07
Study on the biocompatibility of spinal cord high biomimetic scaffold 3D printed with chitosan and gelatin composite bioink*
LIU Yonghua1**, JIA Yue2, YANG Qichang1***" " " " (1Department of Pathology, Nantong First People′s Hospital, Jiangsu 226014; 2Medical College of Nantong University)
[Abstract]" "Objective: To explore the formulation and biocompatibility and reliability evaluation of composite bioink for 3D printed spinal cord bionic stent. Methods: Chitosan(C) and gelatin(G) were used as composite bioink by 3D printing technology. The physicochemical properties of composite bioinks with different ratios were compared, including porosity, swelling rate, rheological properties, degradation rate and mechanical properties. By optimizing the printing parameters, the spinal cord shape bionic stent with specific spatial configuration was printed. Then, the bionic scaffold extract was co-cultured with SH-SY5Y cells, and the cytotoxicity of the scaffold and its effect on cell proliferation were evaluated by scanning electron microscopy and CCK-8 assay. Results: By comparing the final selection of 4% concentration of C and 6% concentration of G(4C6G) group as the most suitable compound bioink formulation, and the follow-up study was carried out. Under the parameters of printing speed of 1.5 mm/s, pressure of 0.09-0.11 MPa, layer thickness of 0.1 mm, spacing of 1 mm and needle of 0.11 mm, the butterfly shape high-fidelity spinal cord bionic scaffold of 5 mm×5 mm×0.9 mm can be printed. Scanning electron microscopy showed that SH-SY5Y cells adhered to the interior of the scaffold and could grow normally. CCK-8 results showed that the extract had no cytotoxicity. Conclusion: C and G bioink is expected to be the raw material of bionic stent for spinal cord injury repair.
[Key words]" "3D printing; chitosan; gelatin; tissue engineering; spinal cord bionic stent
脊髓损伤(spinal cord injury, SCI)是一种严重的损伤性疾病,可导致损伤部位以下的运动、感觉和自主神经功能的部分或完全丧失,往往给患者、家庭及社会带来严重的生活和经济负担[1]。由于神经细胞对外部损伤的高度易感性及其微弱的再生能力,再加上受损脊髓日益恶化的病变特点,使SCI的临床治疗难以达到理想的效果[2]。近年来,神经再生组织工程技术为SCI的治疗提供了新的思路,基于生物材料的治疗已成为一种有效的治疗策略[3]。通过组织工程技术构建的桥神经可以连接损伤脊髓的两端,引导轴突定向生长,实现几乎正常生理结构的脊髓重建和再生[4]。
在组织工程中,高性能的支架是发挥关键作用的基础,而支架材料的选择和制造方法是决定其优劣的关键因素。目前常用的支架材料主要有天然材料和人工合成高分子材料。天然材料如:明胶(gelatin, G)[5]和壳聚糖(chitosan, C)[6]等,具有良好的生物相容性,但其力学性能较差,单独使用时难以模拟脊髓的3D结构[7]。大多数人工合成的高分子材料能够克服天然可降解材料力学性能差的缺点,但其降解产物的生物相容性很低,易引起宿主组织的严重炎症反应[8]。因此,复合材料之间的协同效应有望克服上述问题,最终实现神经组织功能修复[9]。
现有支架材料的制作方法有单管结构、多微通道结构、多通道结构和圆柱形海绵结构,这些结构可以引导再生轴突的延伸[10-11]。然而,脊髓的解剖结构较为复杂,例如脊髓灰质区主要包括神经元细胞体和神经网络,而白质区则由线状轴突束组成。因此,脊髓白质和灰质之间的生长需要不同的支架结构。课题组前期利用C材料制作了“分区式人工脊髓导管”,并取得一定的效果[11]。虽然该导管有孔隙,但是孔隙精度还不够细致,而新近的3D生物打印技术可以有效改善孔隙精度差的问题。3D生物打印技术是一种理想的生物结构材料制备方法,已被广泛用于骨[12]、软骨[13]、血管[14-15]和心脏[16]等不同组织工程领域。在受损的脊髓中,3D结构支架材料能够有效桥接轴突,跨越瘢痕屏障,并可搭载不同的干细胞和神经营养因子,在改善损伤微环境、促进轴突再生方面发挥着重要的作用[17]。例如,利用3D打印技术制备的胶原/C支架可以有效地重建轴突再生微环境,减少瘢痕和空洞的形成,促进神经纤维的再生和功能恢复,对SCI治疗获得了显著的疗效[18]。然而,目前3D打印的脊髓支架尚不能模拟正常脊髓的外观和结构。
本研究利用3D打印技术,以C和G为基础复合生物墨水,通过调节两者的不同配比筛选出形状保真度和生物相容性最佳的配方,打印出蝴蝶状的脊髓外形仿生支架,使SCI断面端能更好地吻合,进而寻求能有效改善SCI的临床策略。
1" "材料与方法
1.1" "水凝胶的制备" "以3C2G为例:电子天平称取3 g C粉末,倒入烧杯中,先加入100 mL双蒸水,使其充分搅拌,随后加入1 mL冰醋酸,充分搅拌后加入2 g G粉末,35 ℃下充分搅拌均匀,随后放入4 ℃冰箱过夜,凝胶后待用,其他组别(3C4G、3C6G、3C8G、4C2G、4C4G、4C6G、4C8G)方法与此类似。
1.2" "水凝胶孔隙率的测定" "将待测8组水凝胶样品冷冻干燥,浸入已知体积为V0的无水乙醇中,随后抽真空至0.08 kPa,将浸入乙醇的水凝胶样品和乙醇的总体积记为V1,去除水凝胶后,记录无水乙醇最终体积记为V2,每组设3个平行样。孔隙率(P)的计算公式如下:
P=(V0-V2)/(V1-V2)×100%
1.3" "水凝胶溶胀率的测定" "将准备好的水凝胶样品冻干,使其在干燥条件下进行称重,称的干重记为W0,将干燥的水凝胶样品在室温条件下放入PBS溶液中24 h,选择10、20、30 min、1、3、6、12、18、24 h的时间间隔,随后将样品用滤纸将表面残留的液体吸干再称重,此时称重的重量记为W1,每组设3个平行样。溶胀率(S)的计算公式如下:
S=(W1-W0)/W0×100%
1.4" "水凝胶黏度的测定" "将被测的8组水凝胶样品缓慢倒入测试容器中,直至水凝胶液面达到锥形面下部的边缘,再将转筒插入水凝胶直至完全浸没为止,随后把待测容器安放在仪器托架上,将转筒挂钩悬挂于仪器的左旋滚花螺母挂钩上,接着启动电机,转筒开始旋转并从初始晃动到对准中心,为了加速对准中心可将测试容器在托架上微量移动,当指针缓慢稳定后,读出的数值记为黏度值。
1.5" "水凝胶降解速率的测定" "将准备好的8种水凝胶样品冷藏冻干,在干燥条件下进行称重,称的干重记为W0。将干燥后的水凝胶样品浸泡在PBS溶液中,在不同的时间点(1、3、5、7、9、11、13、21、30、40 d)取出水凝胶样品,并在50 ℃的鼓风干燥箱干燥24 h后取出,用电子天平测量重量,记录此时凝胶样品重量为W1。每组设3个平行样。降解速率(DR)的计算公式如下:
DR=(W0-W1)/W0×100%
1.6" "水凝胶流变性能的测定" "用Haake RS6000旋转流变仪20 ℃下采用平行板(P20TiL, 直径为20 mm)进行流变学实验。在10%的应变、0.5 mm的间隙(CD模式)和1 Hz的频率下,对8种水凝胶样品进行时间扫描振荡测试,随后在预凝胶样品上进行应变扫描来验证线性响应,储能模量(G′)超过损耗模量(G′′)时的交点为凝胶点,每组设3个平行样。
1.7" "力学性能的测定" "压缩测试:先用模型制备压缩样品(长度1.5 cm,宽度1.5 cm,厚度0.9 cm),并以10 mm/min的位移速率测定其在压缩测试下的应力-应变曲线,直至水凝胶样品破裂。测试结束后,可得到应力-应变曲线,最大荷重等数据来反映水凝胶的力学性能。由于明胶有低温成胶的特性,所有的测试均严格控制在低温干燥的环境下操作(样品温度4 ℃,空气湿度80%,27 ℃),每组设置4个平行样。
1.8" "3D打印仿生支架" "对于3D打印技术,使用3D生物打印机(中国杭州捷诺飞)生成多孔结构,将预先设计的STL文件导入SolidWorks软件中(Dassault Systèmes, Vélizy, France)转换为STL,使用孔径为0.11 mm的直式针头进行支架的打印,并设置相应的打印参数:打印速度1.5 mm/s,层厚0.1 mm,间距1 mm。将G和C的混合水凝胶装入料筒中,打印喷头温度设置为26 ℃,通过逐层打印后,将3D打印的支架放入37 ℃鼓风干燥箱,干燥24 h后将支架浸入体积分数为0.3%氢氧化钠溶液中调节支架的酸碱度(pH=7),随后用去离子水反复冲洗,直至中性。然后将支架浸入75%乙醇中1 h,用去离子水反复冲洗,完全去除乙醇,紫外过夜照射,灭菌待用。
1.9" "支架与细胞共培养及扫描电镜观察" "将消毒过的无菌支架置于12孔板中,与SH-SY5Y细胞(5 000个/孔)一起共培养,分别培养1、3 d后在光学显微镜下观察细胞与支架贴附的程度和细胞的生长状态,再将支架样品规范处理后表面喷金处理,通过在30 kV的加速电压下对支架与细胞共同生长的状态进行扫描电镜观察并拍照。
1.10" "CCK-8实验" "将培养的SH-SY5Y细胞培养皿从37 ℃培养箱中取出,先用0.25%EDTA消化细胞3 min,在光镜下观察细胞变圆后,使用完全培养基终止细胞消化,随后轻轻吹打至细胞完全脱壁,用移液枪将混合液吸至15 mL无菌离心管中,用低倍离心机1 000 r/min离心5 min后弃上清,加入1 mL完全培养基,在电子细胞计数后,调节细胞密度,按3 000个/孔细胞接种到96孔板上,待24 h贴壁后,更换浸提液完全培养基(ECM)继续培养12、24、48 h后,每孔加10 μL CCK-8溶液,置于37 ℃、5%CO2的无菌培养箱中培养1~4 h。随后使用酶标仪在450 nm下测定每孔OD值,并进行统计学分析。
细胞活力/%=(A1-A0)/(A2-A0)
A0=具有培养基和CCK-8溶液而没有细胞的孔的OD值;A1=具有细胞、CCK-8溶液和浸提液的孔的OD值;A2=具有细胞、CCK-8溶液而没有浸提液的孔的OD值。
1.11" "统计学方法" "所有数据使用Graphpad Prism 5.0、Origin8.0软件分析,Photoshop软件进行图片处理,实验结果用±s表示,多组间进行ANOVA分析,Plt;0.05为差异具有统计学意义。
2" "结" " " 果
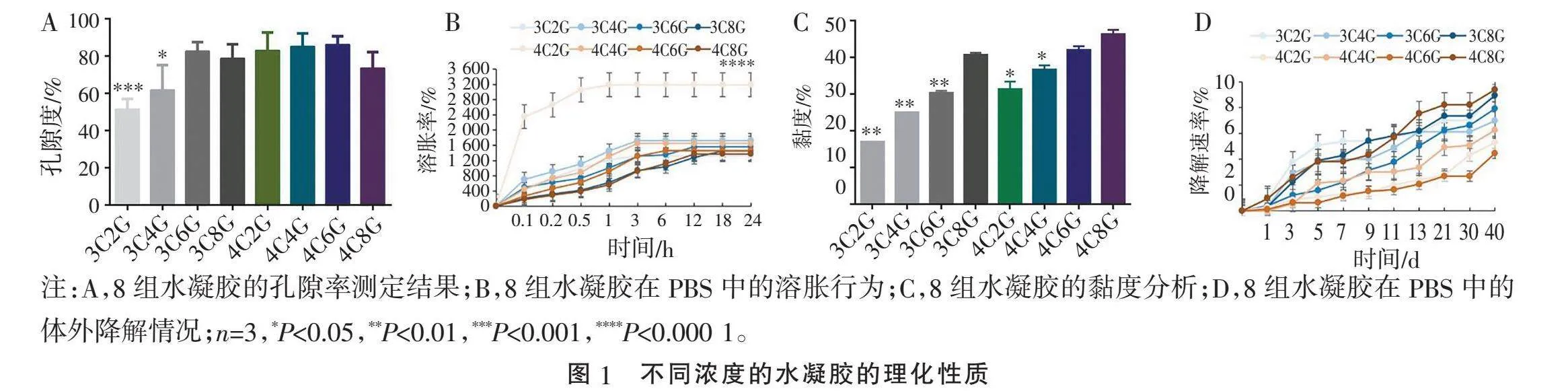
2.1" "水凝胶的孔隙率、溶胀率、黏度及降解速率分析" "本研究通过不同浓度的C和不同浓度的G混合来形成复合水凝胶,为了寻找最佳的配方,对不同配比水凝胶3D打印出的仿生支架的孔隙率、溶胀率、黏度及降解速率进行了详细分析。由图1A可见,对于3C组,3C2G组孔隙率仅为51.33%,显著低于4C6G(Plt;0.01),3C4G组孔隙率也低于4C6G组(Plt;0.05),随着G浓度的增加,孔隙率也逐渐增加;对于4C组,随着G浓度增加,孔隙率基本保持不变;最高浓度8G组都略有降低(lt;80%);随着C浓度的增加,4C2G组孔隙率为82.86%,4C4G组孔隙率为85.12%,4C6G组孔隙率为85.96%。符合脊髓仿生支架的孔隙率应为80%~90%,由此可见3C6G、4C2G、4C4G、4C6G这4个浓度符合脊髓仿生支架所需的孔隙要求。
神经脊髓支架移植物在植入体内时,应当具有一定的溶胀率。溶胀率是指材料与液体达到溶胀平衡时,溶胀后的体积与溶胀前的体积比。本实验选择的溶剂是PBS,模拟的生理环境。从图1B中可见,8组水凝胶在前1 h内增长迅速,随后增长速率明显减慢,3 h后8组水凝胶均已达到平衡状态。其中4C2G组的平衡溶胀率高达3 194%,明显高于4C6G组水凝胶的溶胀率(Plt;0.000 1),明显高于其他7组水凝胶,3C4G比4C6G组略高(Plt;0.05),这说明4C2G组水凝胶的内部结构不稳定,不具备神经仿生支架的生理要求。其余7组水凝胶的平衡溶胀率在1 300%~1 750%范围之内。说明其余7组复合水凝胶具备神经SCI修复仿生支架的溶胀能力。
合适的水凝胶黏度对3D打印的结果至关重要,由图1C可见,在相同C浓度下(3C、4C组),随着G浓度的增加水凝胶的黏度也逐渐增加;相同浓度下的G组,随着C浓度的增加水凝胶的黏度也增加,3C8G、4C4G、4C6G这3组对应的黏度范围为36%~42%。
由于SCI后需要1~2年的恢复时间,因此需要脊髓支架降解速率不宜过快,脊髓仿生支架的降解最佳速率应当与组织再生的速度相似。由图1D可见,前5 d,3C2G、3C4G、3C8G、4C8G组降解速率高于另外4个组,且3C2G组水凝胶的降解速率约为5%,高于其他7个组的降解速率。随着G浓度的增加,水凝胶降解速率变快,对比另外4个组的降解速率,随着C浓度的增加,水凝胶的降解速率变慢。4C8G组从11~21 d降解速率加快;21~30 d,除4C2G组外,其余7组水凝胶没有明显的降解行为,达到平衡状态;从30 d后,8组水凝胶均有不同程度的降解行为;40 d时,各组降解速率均lt;10%,其中4C6G组水凝胶降解最慢,降解速率约为4%,符合生物工程中对脊髓仿生支架的降解要求,因此该水凝胶材料可具备脊髓仿生支架的降解要求。
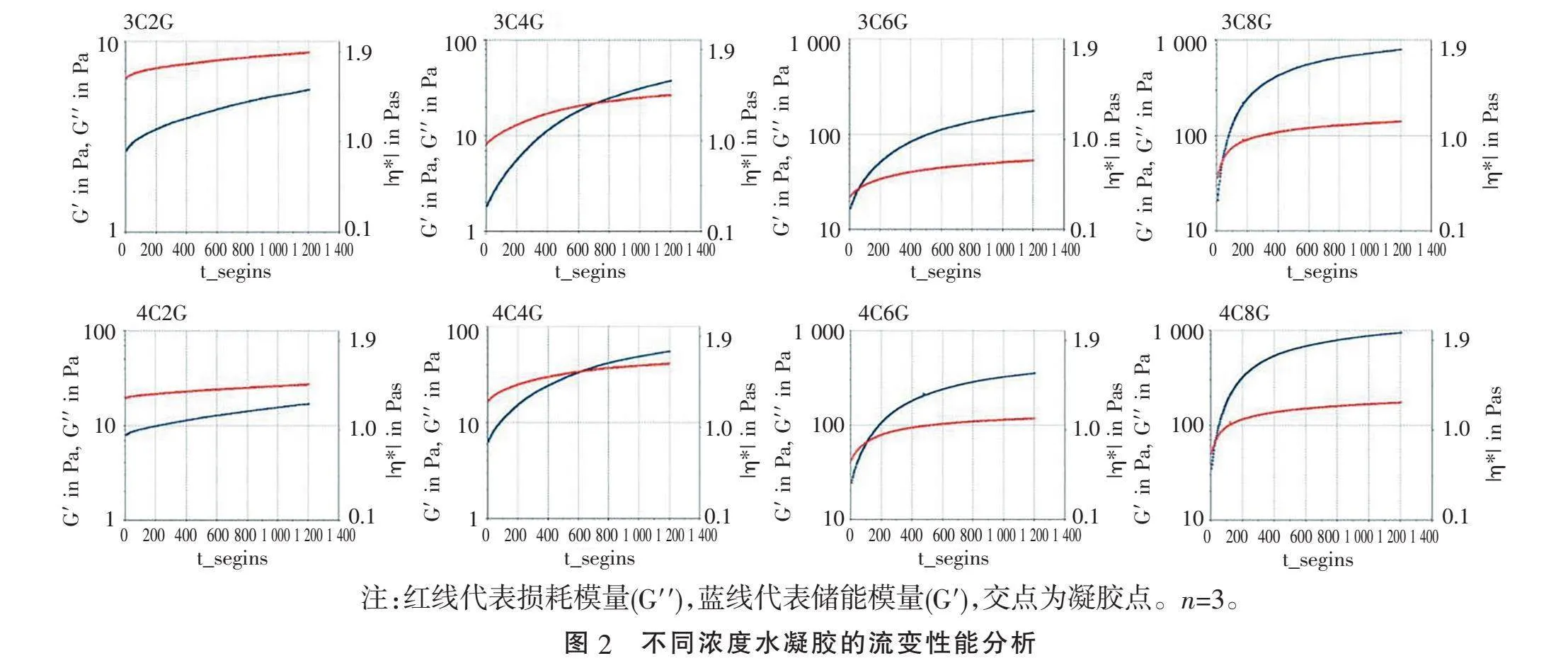
2.2" "水凝胶的流变性能分析" "为进一步了解水凝胶的凝胶化时间,进行了动态流变学实验。图2为不同浓度的水凝胶流变性能。Y轴代表储能模量(G′)超过损耗模量(G′′)时的交点即凝胶点。由图可见3C2G、4C2G组在20 min内并没有交点,说明这两个组的水凝胶流变性能不稳定,其他6个组水凝胶随着C和G浓度的增加,凝胶时间逐渐缩短。3C8G、4C6G、4C8G组的G′均gt;500 Pa,说明这3组水凝胶具有更加坚固的网络结构。
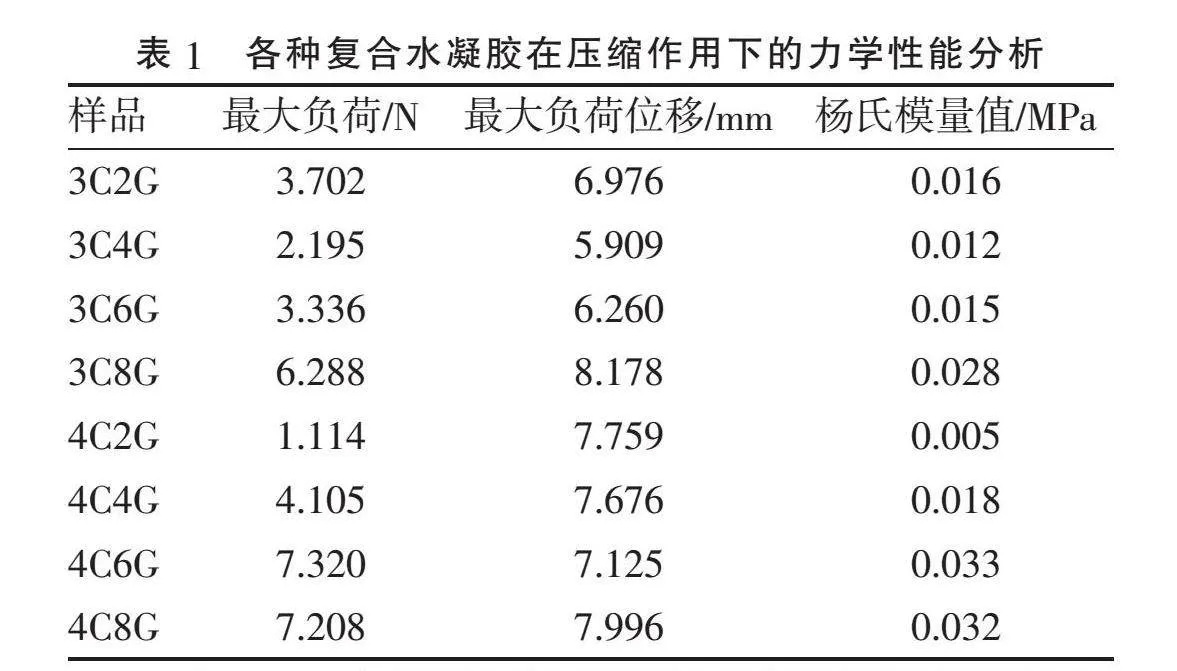
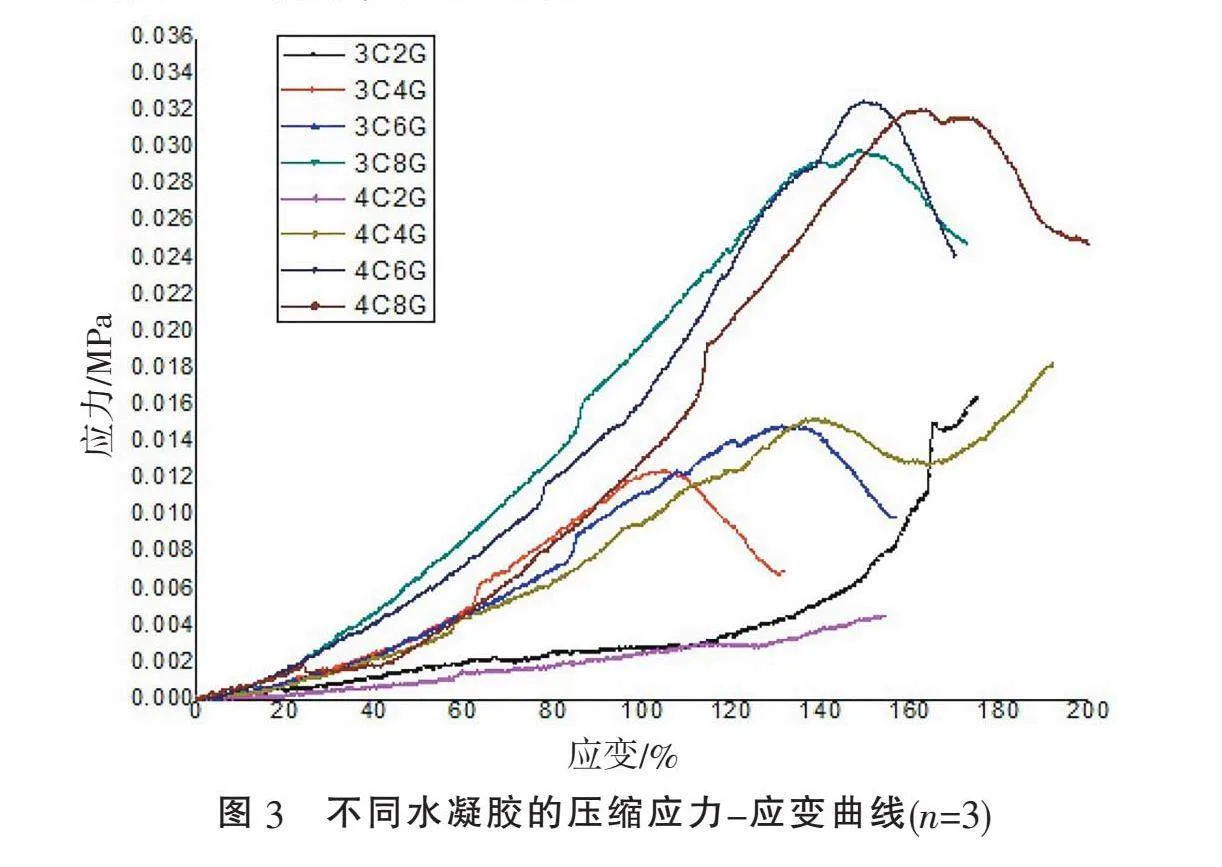
2.3" "力学性能分析" "作为脊髓仿生支架需要有一定的力学性能支撑细胞的生长环境,对8个样品进行了压缩实验,由图3可见,当样品从压缩时开始,不断加大压力直至断裂时的压力即为该水凝胶的最大应力,在图中用峰值表示。在所有不同浓度组别中,3C2G、4C2G组的机械性最低,随着C浓度的增加,水凝胶的力学性能发生了改变,力学性能逐渐增强;随着G浓度的增加,水凝胶力学性能也呈现逐渐增加趋势,但3C4G、3C6G、4C4G组总体机械性能较弱,而3C8G、4C6G、4C8G组应力的峰值相较而言最高,该3组的力学性能较好。由表1可见,4C6G、4C8G组最大负荷分别为7.320、7.208 N;杨氏模量值4C6G、4C8G组分别为0.033、0.032 MPa,其余组的最大负荷和杨氏模量值都不高,说明该两组水凝胶的力学性能较其他组较。
对8组不同水凝胶进行孔隙率、溶胀率、黏度、降解速率、流变性能以及力学性能的理化性质进行比较,最终确定4C6G为3D打印SCI模型的最适浓度,即4%的C和6% G混合的复合水凝胶。
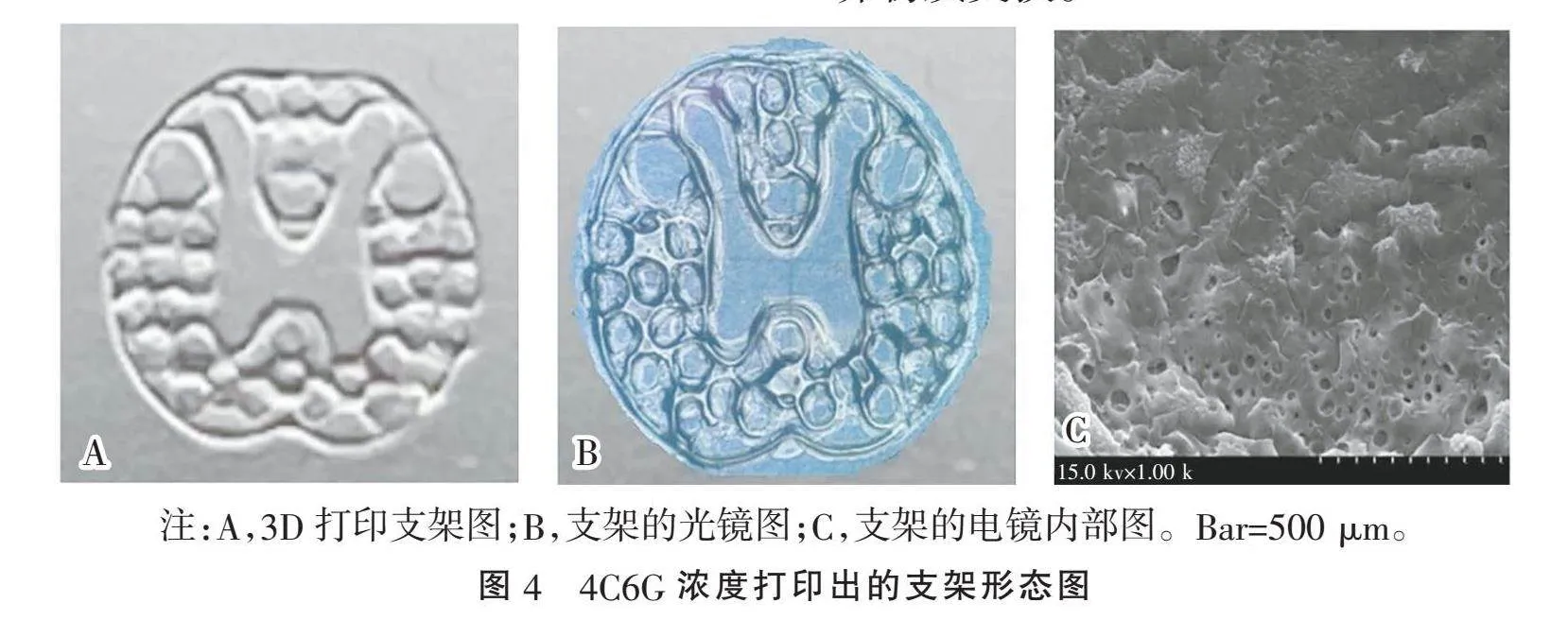
2.4" "4C6G浓度打印出的支架形态图" "根据G低温敏特性,实验期间经过不断尝试,在打印速度1.5 mm/s、压强0.09~0.11 MPa、层厚0.1 mm、间距1 mm、针头0.11 mm的参数下,可以实现打印出5 mm×5 mm×0.9 mm尺寸的较好空间构型(蝴蝶形状)高保真度的脊髓仿生支架,如图4所示,光镜下可以清楚看到该支架的形态完整,解剖学结构明确,支架的空心部分,有利于神经丝的穿入,而扫描电镜图可以看出支架的孔隙均匀分布,有利于移植物与机体组织的营养物质交换。
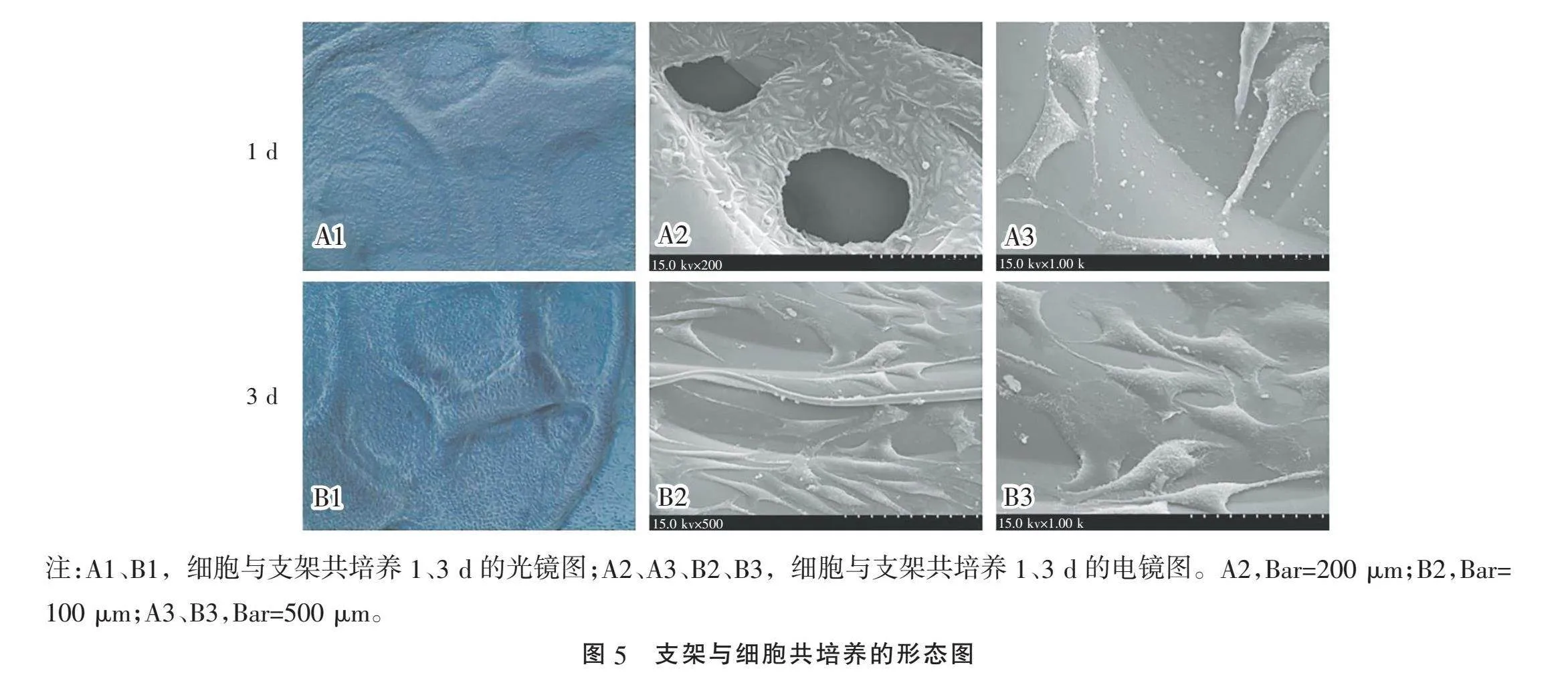
2.5" "支架与细胞共培养及扫描电镜观察" "为研究该支架的生物相容性,在体外使用支架与SH-SY5Y细胞共同培养1、3 d后,观察细胞的生长状态。如图5所示,支架对细胞有黏附作用,且对细胞的生长发育和形态均无明显改变。
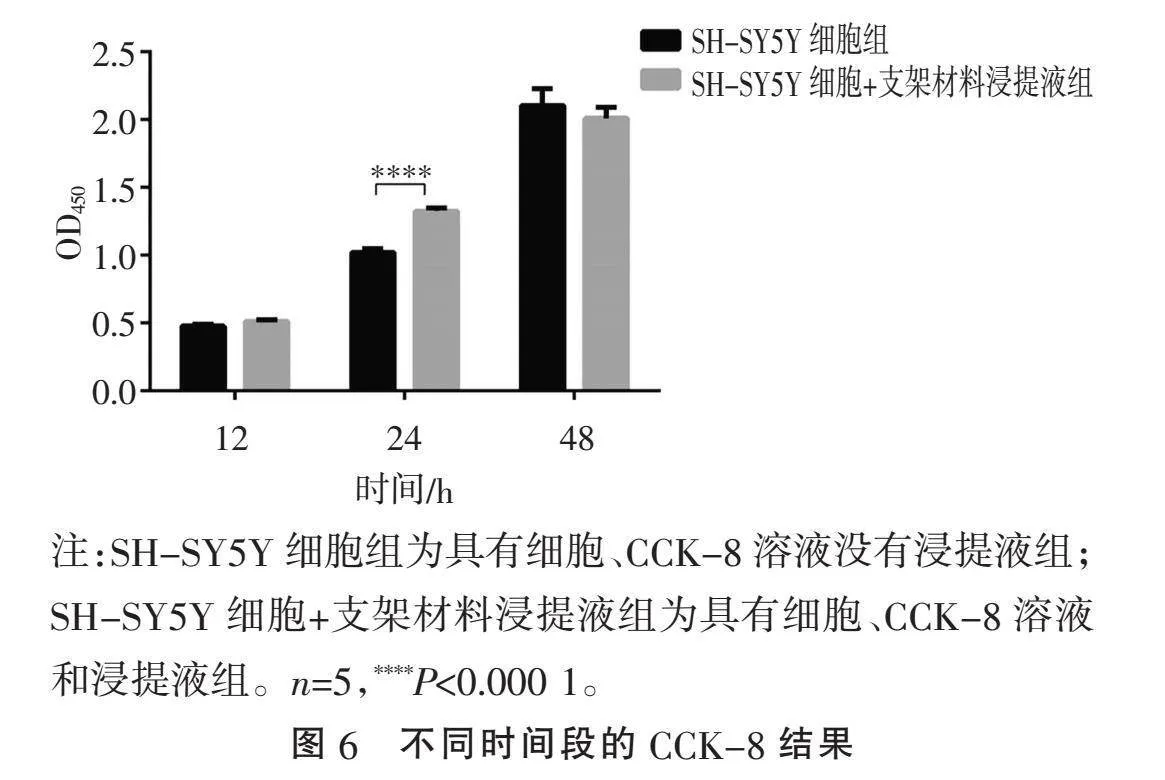
2.6" "支架的细胞毒性评价" "为进一步探索支架的生物相容性,用CCK-8法检验支架的毒性,采用浸提液的方法与细胞培养12、24、48 h后测得的OD值,观察细胞的活力和评估材料的毒性。如图6所示,当浸提液与细胞共培养24 h,可见SH-SY5Y细胞+支架材料浸提液组的OD值高于SH-SY5Y细胞组,说明这个时间段,浸提液能促进细胞的生长。当浸提液与细胞共培养48 h,两组OD值差异无统计学意义,说明该材料与细胞共培养48 h后,与正常细胞生长无明显差异,同时也说明该材料无明显毒性。
3" "讨" " " 论
目前,3D打印技术是制备多种生物活性仿生材料的有效策略[19]。仿生材料的组成是决定神经损伤修复支架有效性和适应性的一个重要因素。国内外利用C和G为复合材料3D打印脊髓仿生模型尚未见报道,C和G的混合比例尚不明确,因此本实验的目的就是通过比较8组水凝胶的理化性能,筛选出最合适的3D打印材料的配方比,通过不断优化打印参数,实现3D打印出具有空间构型的脊髓仿生支架,并对该材料的成分进行体外生物相容性的研究,以寻求SCI修复的有效治疗方法。根据前期对水凝胶的理化性能:孔隙率、溶胀率、流变性能、降解速率、力学性能,结合初步3D打印的结果,最终确定4C6G为3D打印SCI修复仿生支架的最适浓度。
考虑到脊髓仿生支架对机体的作用,该支架应当具备较好的生物相容性,SH-SY5Y细胞来源于神经母细胞瘤,是一种分化程度较低的肿瘤细胞,由于其在形态结构和生理功能方面与神经细胞有共同之处,故常用于神经系统疾病方面的研究,用来阐释疾病的发病机制和药物的作用及其机制[20]。又因SH-SY5Y细胞拥有小而短的轴突,较为适合观察细胞与支架共培养后细胞轴突的变化,且SH-SY5Y细胞活性好,成活率高,故本实验选用SH-SY5Y细胞进行实验研究。SH-SY5Y细胞与该支架共培养观察细胞的生长状态,用材料浸提液方法评估该支架材料的细胞毒性,以及对细胞增殖能力的影响。共培养1、3 d后,光镜下可见细胞数量随着培养天数的增加也增多,扫描电镜下观察,共培养1 d后,细胞在支架内部黏附生长,共培养3 d后,也可见细胞的形态完整,说明该支架对细胞有黏附作用,且对细胞的生长发育和形态均无明显影响。为进一步探讨支架的生物毒性,用CCK-8检验支架材料的毒性,本研究用材料的浸提液与细胞共同培养12、24、48 h观察细胞活力,评估细胞毒性。CCK-8实验中,当用材料浸提液培养细胞12 h时,可见两组的OD值差异无统计学意义;当浸提液与细胞共培养24 h时,可见SH-SY5Y细胞+支架材料浸提液组的OD值高于SH-SY5Y细胞组,说明在这个时间段,浸提液能促进细胞的生长;当浸提液与细胞共培养48 h时,两组细胞生长状态差异无统计学意义,说明该材料在与细胞共培养48 h,与正常细胞生长无明显差异,同时也反映该材料无细胞毒性。
综上所述,4C6G具有较好的生物相容性,无细胞毒性,支架具有细胞黏附能力,而且还能促进细胞的增殖和生长,因此该材料作为SCI修复仿生支架的原材料,具有较高的可靠性。本研究尚存在一些不足,虽然由C和G混合的水凝胶可作为3D打印SCI修复仿生支架的材料,但由于二者并未使用交联剂,故该支架的力学性能较低。在使用3D打印机时,由于机器及其环境等客观因素,相同条件下打印成功率约70%。打印的脊髓仿生支架高度还是较低,还需要调试不同的打印参数,以实现打印的精确性和完整性。目前已建立大鼠SCI模型,将3D打印支架放在损伤部位,观察材料的生物相容性、空间构型维持时间、支架的体内降解情况以及大鼠的预后恢复情况来评估支架的体内生物相容性,以寻求有效改善SCI的临床策略。
[参考文献]
[1]" "XIAO Z F, TANG F W, ZHAO Y N, et al. Significant improvement of acute complete spinal cord injury patients diagnosed by a combined criteria implanted with NeuroRegen scaffolds and mesenchymal stem cells[J]. Cell Transplant, 2018, 27(6):907-915.
[2]" "NAGOSHI N, SUGAI K, OKANO H, et al. Regenerative medicine for spinal cord injury using induced pluripotent stem cells[J]. Spine Surg Relat Res, 2023, 8(1):22-28.
[3]" "KOFFLER J, ZHU W, QU X, et al. Biomimetic 3D-printed scaffolds for spinal cord injury repair[J]. Nat Med, 2019, 25(2):263-269.
[4]" "SOUSA J P M, STRATAKIS E, MANO J, et al. Anisotropic 3D scaffolds for spinal cord guided repair: current concepts[J]. Biomater Adv, 2023, 148:213353.
[5]" "HU X Y, MAN Y, LI W F, et al. 3D bio-printing of CS/gel/HA/gr hybrid osteochondral scaffolds[J]. Polymers, 2019, 11(10):1601.
[6]" "MUXIKA A, ETXABIDE A, URANGA J, et al. Chitosan as a bioactive polymer: processing, properties and applications[J]. Int J Biol Macromol, 2017, 105(Pt2):1358-1368.
[7]" "LI P, FENG Z P, YU Z Y, et al. Preparation of chitosan-Cu2+/NH3 physical hydrogel and its properties[J]. Int J Biol Macromol, 2019, 133:67-75.
[8]nbsp; "CASTA?譙EDA-RODR?魱GUEZ S, GONZ?魣LEZ-TORRES M, RIBAS-APARICIO R M, et al. Recent advances in modified poly(lactic acid) as tissue engineering materials[J]. J Biol Eng, 2023, 17(1):21.
[9]" "ERWIN A, GALLEGOS C, CAO Q L, et al. A robotic platform for 3D forelimb rehabilitation with rats[C]//2019 IEEE 16th International Conference on Rehabilitation Robotics(ICORR). Toronto, ON, Canada. IEEE, 2019:429-434.
[10]" "CHEN X, WU J, SUN R C, et al. Tubular scaffold with microchannels and an H-shaped lumen loaded with bone marrow stromal cells promotes neuroregeneration and inhibits apoptosis after spinal cord injury[J]. J Tissue Eng Regen Med, 2020, 14(3):397-411.
[11]" "G?譈NTHER M I, WEIDNER N, M?譈LLER R, et al. Cell-seeded alginate hydrogel scaffolds promote directed linear axonal regeneration in the injured rat spinal cord[J]. Acta Biomater, 2015, 27:140-150.
[12]" "SHANJANI Y, PAN C C, ELOMAA L, et al. A novel bioprinting method and system for forming hybrid tissue engineering constructs[J]. Biofabrication, 2015, 7(4):045008.
[13]" "ZHANG X J, LI Y, CHEN Y E, et al. Cell-free 3D scaffold with two-stage delivery of miRNA-26a to regenerate critical-sized bone defects[J]. Nat Commun, 2016, 7:10376.
[14]" "YAO Q Q, WEI B, LIU N, et al. Chondrogenic regeneration using bone marrow clots and a porous polycaprolactone-hydroxyapatite scaffold by three-dimensional printing[J]. Tissue Eng Part A, 2015, 21(7/8):1388-1397.
[15]" "KOLESKY D B, HOMAN K A, SKYLAR-SCOTT M A, et al. Three-dimensional bioprinting of thick vascularized tissues[J]. Proc Natl Acad Sci USA, 2016, 113(12):3179-3184.
[16]" "JIA W T, GUNGOR-OZKERIM P S, ZHANG Y S, et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink[J]. Biomaterials, 2016, 106:58-68.
[17]" "PAWAR K, CUMMINGS B J, THOMAS A, et al. Biomaterial bridges enable regeneration and re-entry of corticospinal tract axons into the caudal spinal cord after SCI: association with recovery of forelimb function[J]. Biomaterials, 2015, 65:1-12.
[18]" "SUN Y, YANG C, ZHU X, et al. 3D printing collagen/chitosan scaffold ameliorated axon regeneration and neurological recovery after spinal cord injury[J]. J Biomed Mater Res A, 2019, 107(9):1898-1908.
[19]" "CHAKKA L R J, CHEDE S. 3D printing of pharmaceuticals for disease treatment[J]. Front Med Technol, 2023, 4:1040052.
[20]" "XIONG S Y, MA M M, XU Y P, et al. Protective effects of peptide FK18 against neuro-excitotoxicity in SH-SY5Y cells[J]. Exp Ther Med, 2021, 21(5):451.
[收稿日期] 2024-02-17
