双能量CT影像组学模型可在术前预测胃间质瘤Ki-67的表达
2024-11-20陈素月陈望郭荣
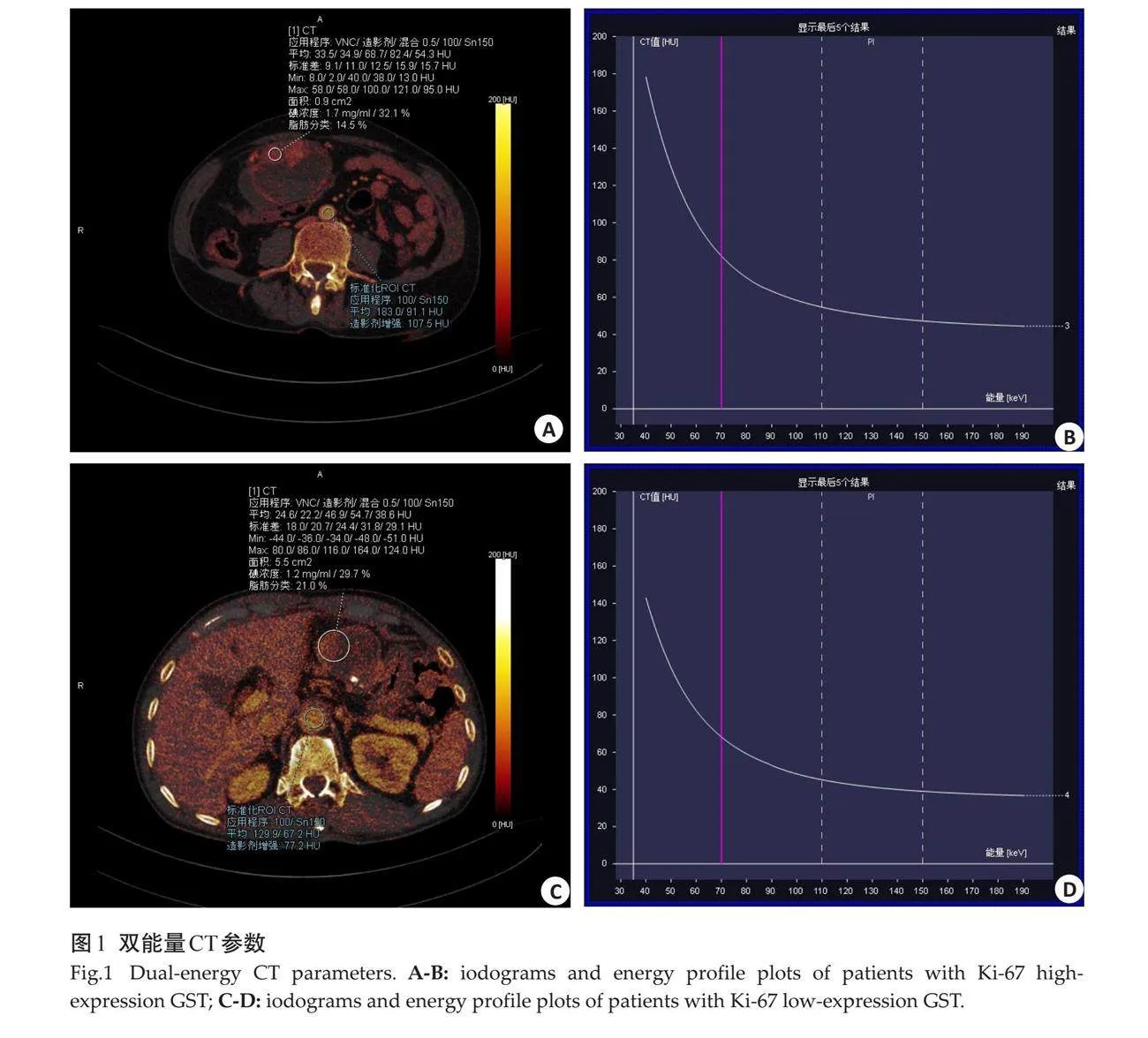
摘要:目的 "探讨基于双能量CT联合影像组学模型评估胃间质瘤(GST)Ki-67表达水平的应用价值。方法 "回顾性收集盐城市第一人民医院2021年11月~2023年9月行双能量CT增强扫描并经手术病理及免疫组化确诊的GST患者105例。按照7:3的比例随机分为训练组(n=74)及测试组(n=31)根据术后免疫组化结果再分为Ki-67高表达组及Ki-67低表达组。记录所有患者的一般临床特点,分析肿瘤的常规CT特征,于静脉期图像测量、计算病灶双能量CT定量参数、提取影像组学特征,利用单因素分析及LASSO算法对上述特征进行筛选,使用Logistic回归分别构建常规CT征象模型、双能量CT模型、影像组学模型及联合模型。采用ROC曲线下面积对各模型诊断效能进行比较。使用DeLong检验比较各模型间曲线下面积的差异。结果 "肿瘤最大径、标准化碘浓度、能谱曲线斜率及6个影像组学特征在两组间的差异有统计学意义(Plt;0.05),联合模型为最佳模型,具有最高的预测效能。联合模型与其他3个模型间的差异均有统计学意义(Plt;0.05),其余各模型间差异无统计学意义(Pgt;0.05)。结论 "基于双能量CT联合影像组学模型在评估GST Ki-67表达水平方面具有一定的临床价值。
关键词:胃间质瘤;双能量CT;影像组学;Ki-67
The dual-energy CT imaging model can predict the expression of Ki-67 in gastric stromal tumors before operation
CHEN Suyue, CHEN Wang, GUO Rong
Department of Medical Imaging, Yancheng No.1 People's Hospital, Affiliated Hospital of Medical School, Nanjing University, Yancheng 224000, China
Abstract: Objective To explore the application value of radiomics model based on dual-energy CT to predict the Ki-67 expression level of gastric stromal tumor (GST). Methods Retrospective analysis of 105 cases of GST who underwent dual-energy CT enhanced scanning and were diagnosed by surgical pathology and immunohistochemistry at the First People's Hospital of Yancheng City from November 2021 to September 2023. All cases were divided into training group (n=74) and test group (n=31) in a 7:3 ratio, and divided into Ki-67 high expression group and Ki-67 low expression group according to the postoperative immunohistochemistry results. General clinical characteristics of all patients were recorded, and conventional CT signs of the tumors were analyzed, quantitative dual-energy CT parameters were measured and calculated on venous phase, and imaging omics features were extracted. The above features were screened using univariate analysis and LASSO algorithm, and Logistic regression was used to establish a conventional CT sign model, a dual-energy CT model, an imaging histology model, and a combined model. The diagnostic efficacy of the models was compared using the ROC curve and AUC. DeLong test was used to compare the differences of each AUC. Results The differences in maximum tumor diameter, normalized iodine concentration, K and six imaging omics features between the two groups were statistically significant (Plt;0.05). The combined model was the best model with the highest predictive efficacy. The differences between the combined model and the other three models were statistically significant (Plt;0.05), while the differences between the other models were not statistically significant (Pgt;0.05). Conclusion The radiomics model based on dual-energy CT has clinical value in predicting Ki-67 expression levels in GST.
Keywords: gastric stromal tumor; dual-energy CT; radiomics; Ki-67
胃间质瘤(GST)具有高度异质性和恶性潜能,其发病率逐年增长[1-2]。有效预测其恶性潜能,对GST治疗方案选择和预后评估有着重要的作用。目前Ki-67被广泛应用于多种恶性肿瘤生物学行为的研究中,其表达水平越高,表明细胞核分裂象越多,细胞增殖越活跃[3-6],有研究表明Ki-67与胃肠道间质瘤的复发及预后密切相关[7-9]。然而,目前针对Ki-67表达水平的传统测定方法通常需要进行组织活检及免疫组化染色,为有创检查,有一定的风险性,因此需要寻找一种无创、便捷、精准的方法来代替或弥补其不足。
常规CT成像具有简便、快速、非侵入性等优势,可提供关于肿瘤的形态、定位、大小等信息,对GST的初步判断和评估具有重要价值[10-12];但常规CT征象评估存在一定的主观性,且定量参数相对单一。双能量CT扫描技术在提供常规CT征象的同时,还可以获取更多定量、定性参数,很大程度上弥补了常规CT的不足,在临床上的应用日益广泛。近年来,CT影像组学模型成为一种有效的预测肿瘤生物学特征的工具。已有研究表明双能量CT模型及CT影像组学模型均有助于评估胃肠道间质瘤的Ki-67表达,但是不同研究结果间存在一定差异,表明模型的稳定性有待进一步提高[13-22]。目前双能量CT联合影像组学应用于GST的研究较少,有研究分别构建了双能量CT定量参数模型、常规CT征象模型、影像组学模型以及联合诊断模型对胃肠道间质瘤的危险度分级进行预测评估,结果表明联合诊断模型的诊断效能最高[23];而两者联合模型在评估GST肿瘤增殖活性方面的研究未见报道。本研究旨在探讨基于双能量CT联合影像组学模型术前评估GST Ki-67表达水平的应用价值,以提高模型的预测性能和稳定性,为临床疗效评估及患者预后预测提供有效帮助。
1 "资料与方法
1.1 "一般资料
连续性回顾性收集盐城市第一人民医院2021年11月~2023年9月行双能量CT检查并经病理及免疫组化确诊的GST患者124例。纳入标准:术前2周内完成腹部CT增强扫描,均采用双能量扫描模式;检查前均未进行任何相关治疗。排除标准:图像伪影重,影响测量结果者;病灶较小(lt;1 cm),CT图像上无法分辨病灶及正常组织分界者;扫描方式及成像参数不符合统一标准者。排除图像质量不合格者5例,病灶较小者11例,检查前已接受化疗患者3例,最终纳入105例,男47例,女58例,男女比例为1:1.25;年龄为62.94±8.10岁,中位年龄63.5岁。其中因偶然发现而无明显症状者35例,存在上腹部不适者70例。按照7:3的比例将患者随机分为训练组(n=74)及测试组(n=31)。本研究通过盐城市第一人民医院伦理委员会许可批准(审批号:2024-J-009)。
1.2 "Ki-67检测方法及数据判读
利用甲醛将所取标本固定、脱水,组织蜡块切片层厚为4 μm,Ki-67抗体采用鼠抗人单克隆抗体,详细步骤按照相应的试剂盒进行检测。将制备好的切片于低倍镜下观察,Ki-67阳性表达的判定标准为肿瘤细胞核内呈现清晰的棕黄色或黄褐色颗粒,由病理科医师手动计算其百分比来记录Ki-67的表达水平。本研究参考相关文献[20],以5%为界,将患者分为Ki-67高表达组(≥5%)和低表达组(lt;5%)。
1.3 "双能量CT扫描方法
所有患者均行全腹部增强扫描,使用设备为SOMATOM Definition Force双源CT,采用100 kV/Sn 150 kV管电压组合双能量扫描模式,准直器宽度128×0.6 mm,螺距0.6,转速0.5 s,采用自动管电流技术,参考管电流分别为180 mAs和90 mAs。双能量重建层厚1 mm、层间距0.7 mm,卷积核Qr40。扫描范围上自膈顶部,下至耻骨联合下缘水平。为减少静脉伪影对图像质量造成影响,所有患者均经右肘静脉注射对比剂碘克沙醇(320 mgI/mL),采用Ulrich高压注射器,注射速率设置为3.5 mL/s,注射剂量为1.2 mL/kg体质量。采用智能血管追踪扫描技术,监测层面为右肾门水平,感兴趣区(ROI)置于腹主动脉,在注射对比剂10 s内完成低辐射剂量监测采集,当目标区域CT值达100 Hu时延迟6 s自动触发动脉期扫描,延迟40 s采集静脉期图像。
1.4 "双能量CT参数测量
由分别具备13年、20年影像诊断经验的2位资深放射科医师在经过统一培训后于双能量CT工作站(Syngo.via VB10, Dual Energy, Siemens)中对病灶进行测量,2位测量者在测量过程中均不知晓患者临床资料及病理结果。因本研究中所有病变均在静脉期显示更为清晰,所以最终选取静脉期影像进行靶区勾画。本研究所需要测量并计算的数据有:病灶静脉期标准化碘浓度(NIC)、能谱曲线斜率(K)。ROI勾画需遵循以下原则:选择实性成分较多、强化程度最高的层面;需尽量避开肿块内部钙化及坏死区域;ROI须放置于同一病灶的同一层面,且大小、形状尽量保持一致,再选取其上下两个层面测量,三者取平均值作为测量结果。最终将2位测量者测量的结果进行一致性检验,结果较好时取其平均值作为最终数值。
1.5 "提取影像组学特征
逐个将图像导入3D slicer软件,由2位医师各自手动于静脉期图像病灶逐层进行勾画和分割,生成体积感兴趣区(VOI)。VOI包括全部肿瘤,边缘避开气体、胃腔内容物以及周围脏器结构。利用Python软件基于pyradiomics库对以上VOI文件进行影像组学特征批量提取,提取的影像组学特征包括一阶统计特征、形态学特征、纹理特征及小波特征,共1329个。以组内相关系数(ICC)评价2位医师测量参数结果的一致性,ICC 0.75~1.0表示一致性较好。
1.6 "机器学习
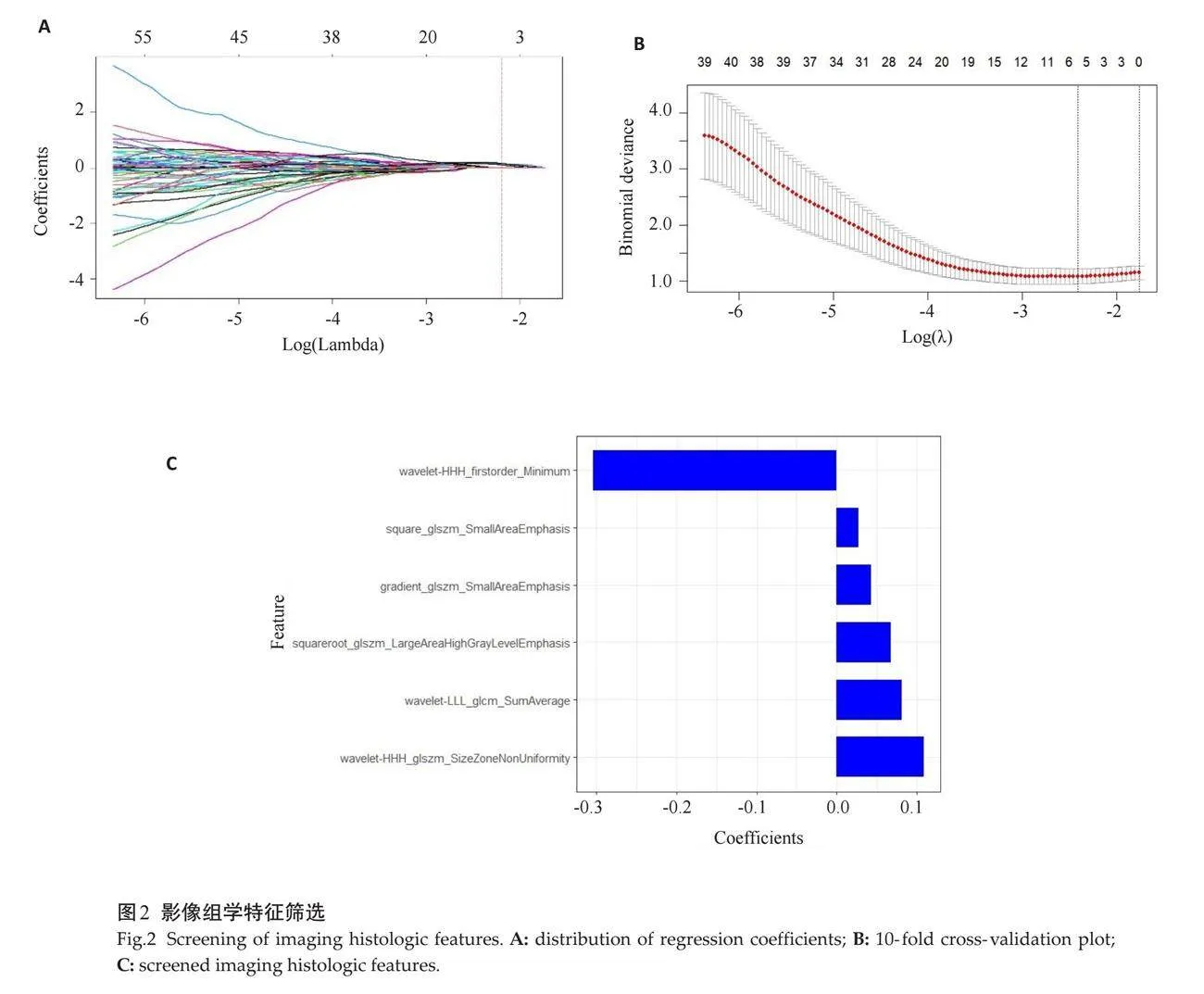
将数据导入R软件。特征筛选:通过独立样本t检验选出有效指标共292个,以Ki-67表达lt;5%设定为0、Ki-67表达≥5%设定为1作为诊断标签,以最小绝对收缩与选择算子(LASSO)算法对提取的特征参数进行筛选,通过调整权重参数将部分特征的系数抑制为0,以筛选最优特征,并以十折交叉验证法筛选特征参数的系数。
1.7 "统计学分析
采用SPSS26.0软件对所有数据进行统计分析。计量资料行正态性检验,满足正态分布的资料以均数±标准差表示,组间比较采用独立样本t检验;非正态分布的参数以中位数(四分位间距)表示,组间比较采用非参数检验;计数资料以n(%)表示,组间比较行卡方检验;不满足适用条件者,采用Fisher确切概率法。计算ROC曲线下面积(AUC)及敏感度、特异度。AUC比较使用DeLong检验。以Plt;0.05为差异有统计学意义。
2 "结果
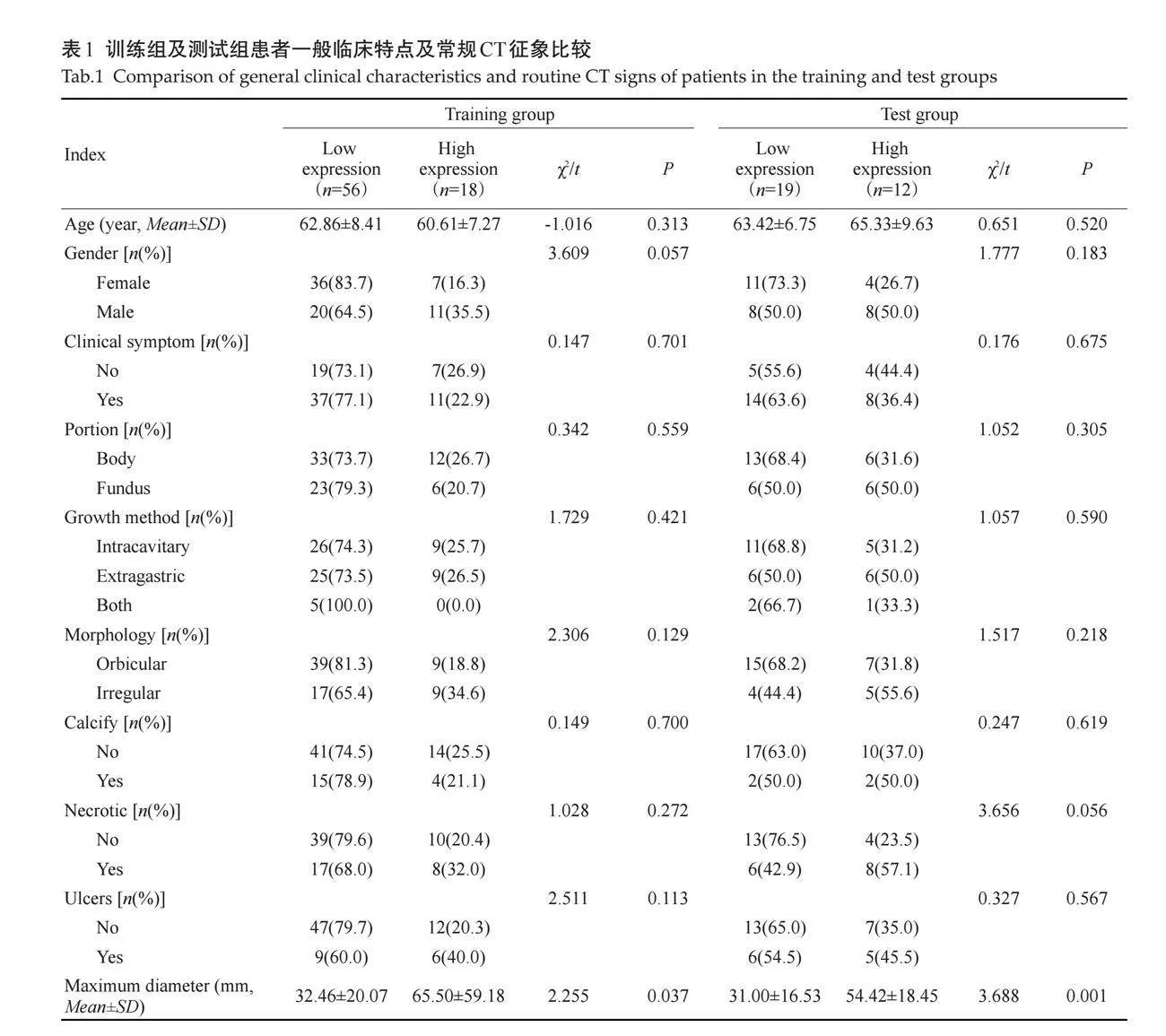
2.1 "GST患者一般临床特点及常规CT征象分析
训练组、测试组肿瘤大小的差异均有统计学意义(Plt;0.05),年龄、性别、症状、发生部位、生长方式、形态、钙化、坏死、溃疡的差异均无统计学意义(Pgt;0.05,表1)。
2.2 "GST患者双能量CT参数分析
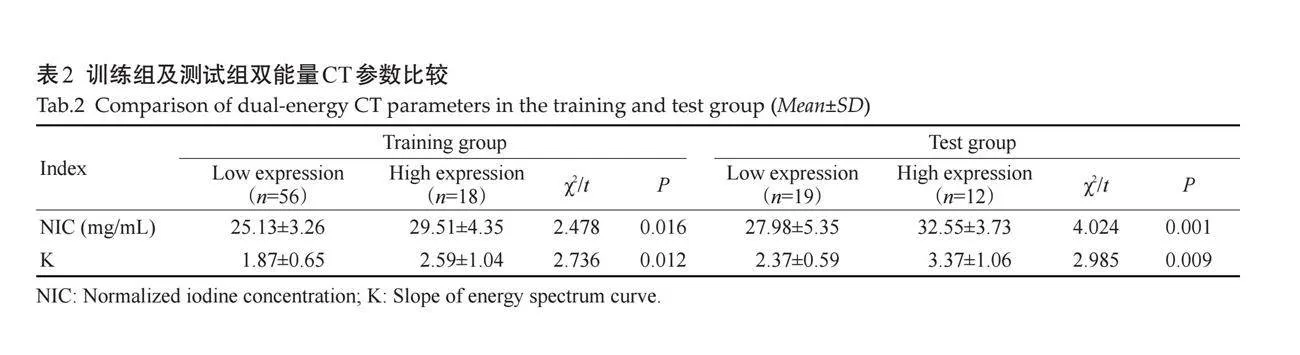
低表达组静脉期NIC及K值低于高表达组,在训练组及测试组的差异均有统计学意义(Plt;0.05,图1、表2)。
2.3 "GST患者CT影像组学特征提取
对肿瘤提取的影像组学特征进行一致性检验,有1329个组学特征具有较好一致性(ICCgt;0.75)。经LASSO算法降维后,筛选出的最佳组学特征有6个(图2)。
2.4 "预测模型的建立
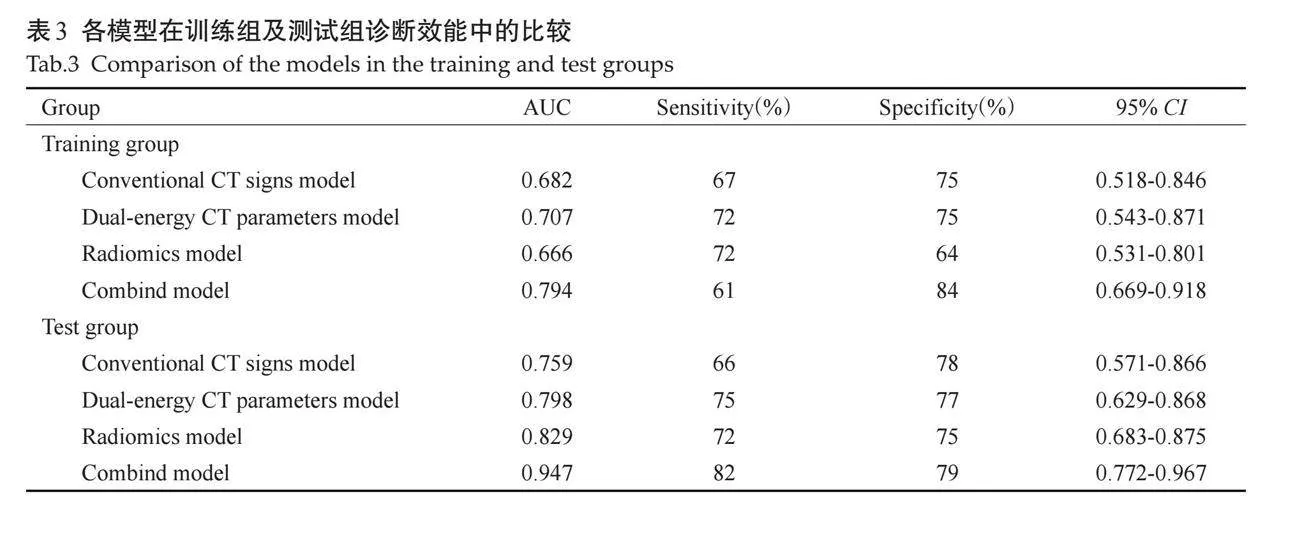
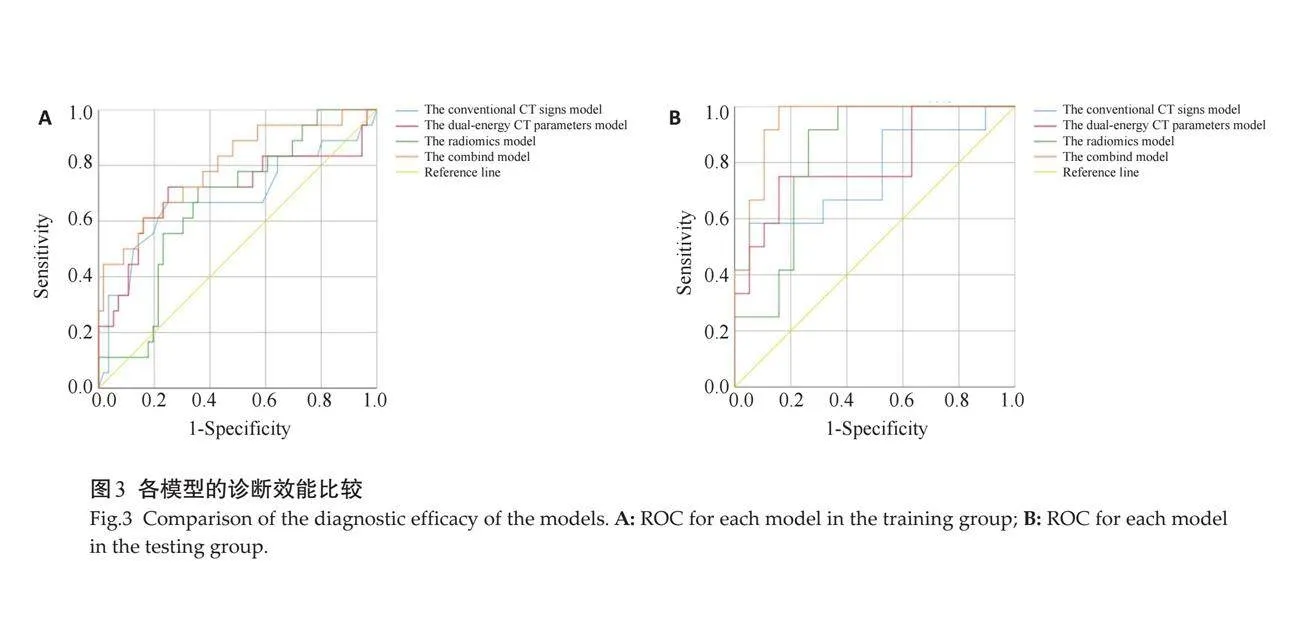
根据以上分析结果,共建立4个预测模型(图3、表3),包括1个常规CT征象模型、1个双能量CT模型、1个影像组学模型及1个联合模型(常规CT征象-双能量CT-影像组学模型),各诊断模型均有较高的诊断效能。
2.5 "4个预测模型效能比较及验证
DeLong检验结果表明,联合模型与其余3个模型的差异均有统计学意义(Plt;0.05),其余各模型间差异均无统计学意义(Pgt;0.05)。联合模型为最佳模型,具有最高的预测效能[训练组AUC=0.794(95%CI: 0.669~0.918);测试组AUC=0.947(95% CI: 0.772~0.967)]。
3 "讨论
目前临床上常采用CT扫描作为腹部肿瘤患者的首选影像学检查方法,常规CT扫描具有较高的时间分辨率及空间分辨率,检查禁忌少,能清楚显示肿瘤的形态特征,并明确其浸润范围。GST常规CT表现为实性肿块,边界多清晰,肿瘤较小时往往形态规则、密度均匀,部分可伴有钙化,肿瘤较大时可表现为不规则肿块、密度不均匀,瘤内可出现坏死,部分表面可形成溃疡[24-26]。
本研究表明肿瘤最大径在GST Ki-67高表达组与低表达组间差异有统计学意义,其余特征在两组间的差异均无统计学意义。其原因可能是Ki-67表达水平越高,其肿瘤细胞增值越活跃,肿瘤倍增速度越快,病灶体积则更大。既往有研究表明肿瘤直径、年龄均与GST Ki-67表达水平相关[13];另有研究证实除肿瘤直径外,是否伴有坏死亦与Ki-67表达水平相关[27],也有研究提示肿瘤发生部位与GST Ki-67表达水平相关,而其他一般临床特征及常规CT征象于两组间差异无统计学意义[28]。上述不同研究结果间的差异表明常规CT征象所建立的预测模型其稳定性、准确性均存在着一定的不足。
双能量CT扫描改变了常规CT的扫描模式,扫描速度更快,成像质量更高,在提供常规CT形态学征象的基础之上,还增加了一系列组织特征性信息。双能量CT扫描可以生成碘图、尿酸图、有效原子序数图及电子云密度图等,弥补了常规CT定量参数单一、密度分辨率不够高等不足。已有研究表明利用双能量CT多参数可以有效预测GST的Ki-67表达水平,且诊断效能较高(AUC=0.984)[13]。本研究发现Ki-67表达水平升高的同时,静脉期NIC及K值亦升高,于训练组及测试组中差异均有统计学意义(Plt;0.05)。NIC是对组织强化程度的量化,可以间接反映组织的血供情况。Ki-67水平代表肿瘤细胞增殖活跃程度的高低,其水平越高表明肿瘤细胞增殖越活跃、肿瘤组织生长速度愈快,其血供往往越充足,肿瘤强化则更明显,因此其NIC值越高。能谱衰减曲线反映的是不同物质的衰减系数随X线能量的变化趋势,其定量参数K值与组织内部构成有一定相关性。而肿瘤细胞Ki-67表达水平不同,肿瘤细胞的密度、代谢及凋亡、新血管生成等情况均会改变,因此K值亦会随之波动。
影像组学是借助计算机,在不增加检查成本的前提下,基于医学影像资料进一步提取海量定量特征,包括一阶统计学特征、形态特征、二阶及高阶纹理特征等[29]。结合统计学及机器学习方法,可筛选出最有价值的影像组学特征,用以解析临床信息。既往研究表明影像组学列线图模型在术前预测GST的Ki-67表达上具有较高价值[30]。本研究所构建的CT影像组学模型包括1个一阶特征、5个二阶及高阶特征,其中二阶及高阶特征分别为4个灰度尺寸区域矩阵特征、1个灰度共生特征矩阵。该模型在测试组中表现良好(AUC=0.829),在训练组中诊断效能(AUC=0.666)略低于常规CT征象模型(AUC=0.682)及双能量CT模型(AUC=0.707),经DeLong检验上述3个模型间的差异均无统计学意义。
基于常规CT征象+双能量CT定量参数+影像组学的联合模型在训练组及测试组中诊断效能均表现最佳(AUC=0.794、0.947),在训练组中双能量CT模型优于影像组学模型及常规CT征象模型(AUC=0.707、0.666、0.682),在测试组中影像组学模型优于双能量CT模型及常规CT征象模型(AUC=0.829、0.798、0.759),DeLong检验结果表明联合模型与其余3个模型间差异均有统计学意义。
本研究的创新点在于将CT影像组学技术与常规CT征象评估以及双能量CT多参数相结合,建立了一种新的联合诊断模型,提高了GST Ki-67表达水平的评估准确性和可靠性。此外,本研究还将机器学习算法应用于特征提取及筛选中,进一步提高了工作效率。
本研究仍存在一些局限性:本研究为单中心研究,可能存在一定偏倚,需要进一步扩大样本规模以提高研究结果的准确性;本研究仅关注了GST的Ki-67表达水平,未对其他与肿瘤相关的指标进行全面分析。未来的研究可以更深入地探索GST的其他影像特征和生物学特征之间的关系。
综上所述,基于双能量CT联合影像组学模型在评估GST Ki-67表达水平方面具有一定的临床价值。
参考文献:
[1] " Dermawan JK, Rubin BP. Molecular pathogenesis of gastrointestinal stromal tumor: a paradigm for personalized medicine[J]. Annu Rev Pathol, 2022, 17: 323-44.
[2] " Blay JY, Kang YK, Nishida T, et al. Gastrointestinal stromal tumours[J]. Nat Rev Dis Primers, 2021, 7(1): 22.
[3] " Gerdes J, Lemke H, Baisch H, et al. Cell cycle analysis of a cell proliferation-associated human nuclear antigen defined by the monoclonal antibody Ki-67[J]. J Immunol, 1984, 133(4): 1710-5.
[4] " "Liu QX, Peng ZH, Shen LF, et al. Prognostic and clinicopathological value of ki-67 in melanoma: a meta‑analysis[J]. Front Oncol, 2021, 11: 737760.
[5] " Flores AR, Rêma A, Mesquita JR, et al. Vimentin and Ki‑67 immunolabeling in canine gastric carcinomas and their prognostic value[J]. Vet Pathol, 2022, 59(6): 903-14.
[6] " Gown AM. The biomarker ki-67: promise, potential, and problems in breast cancer[J]. Appl Immunohistochem Mol Morphol, 2023, 31(7): 478-84.
[7] " Kadado KJ, Abernathy OL, Salyers WJ, et al. Gastrointestinal stromal tumor and ki-67 as a prognostic indicator[J]. Cureus, 2022, 14(1): e20868.
[8] " "Ma B, Huang XT, Zou GJ, et al. Relationship between Ki-67 and CD44 expression and microvascular formation in gastric stromal tumor tissues[J]. World J Clin Cases, 2022, 10(2): 469-76.
[9] " "陈泓臻, 邱惠芳. 胃肠道间质瘤患者Ki-67和钙激活通道蛋白1表达与预后的关系[J]. 浙江医学, 2022, 44(23): 2526-30.
[10] "陈长波, 马 "俊, 兰小惠. 胃肠道间质瘤CT诊断及与病理肿瘤恶性潜能相关性分析[J]. 中国CT和MRI杂志, 2022, 20(6): 156-8.
[11] "郭建榕, 蔡美花, 吴立萍. 老年胃肠道间质瘤患者临床诊断中多层螺旋CT应用的准确性[J]. 中国老年学杂志, 2021, 41(19): 4206-9.
[12] "陈 "馨, 陈 "晓, 刘永康, 等. DCE-CT鉴别诊断胃异位胰腺和间质瘤的价值[J]. 放射学实践, 2020, 35(8): 1048-53.
[13] "张于凤, 李 "辉, 李晶晶, 等. 能谱CT多模态参数联合临床参数对胃间质瘤Ki-67的预测价值[J]. 分子影像学杂志, 2022, 45(5): 688-692.
[14] "王学东, 刘爱连, 田士峰, 等. 单源双能CT能谱分析定量参数预测胃间质瘤Ki-67表达的可行性研究[J]. 放射学实践, 2020, 35(7): 893-9.
[15] "原士超, 赵 "庆, 范红燕. 双能CT对胃间质瘤中Ki-67表达的预测价值及其与病理参数的关系[J]. 临床荟萃, 2021, 36(11): 1013-8.
[16] Liu Y, He CY, Fang WD, et al. Prediction of Ki‑67 expression in gastrointestinal stromal tumors using radiomics of plain and multiphase contrast‑enhanced CT[J]. Eur Radiol, 2023, 33(11): 7609-17.
[17] Zhang QW, Gao YJ, Zhang RY, et al. Personalized CT‑based radiomics nomogram preoperative predicting Ki‑67 expression in gastrointestinal stromal tumors: a multicenter development and validation cohort[J]. Clin Transl Med, 2020, 9(1): 12.
[18] "刘 "芸, 李传明, 曾 "平, 等. 基于动脉期增强CT影像组学模型鉴别小肠间质瘤组织中Ki-67表达状态的应用[J]. 胃肠病学和肝病学杂志, 2023, 32(4): 405-8.
[19] "李 "根, 刘 "琨, 于海韵, 等. 基于增强CT的深度学习模型预测胃肠道间质瘤Ki-67表达的双中心研究[J]. 国际医学放射学杂志, 2024, 47(2): 172-7.
[20] Cai W, Guo K, Chen YX, et al. Sub‑regional CT radiomics for the prediction of ki‑67 proliferation index in gastrointestinal stromal tumors: a multi‑center study[J]. Acad Radiol, 2024: S1076-S6332(24)00421-5.
[21]Zhao YL, Feng MB, Wang MH, et al. CT radiomics for the preoperative prediction of Ki67 index in gastrointestinal stromal tumors: a multi-center study[J]. Front Oncol, 2021, 11: 689136.
[22] Xie ZH, Suo ST, Zhang W, et al. Prediction of high Ki‑67 proliferation index of gastrointestinal stromal tumors based on CT at non‑contrast‑enhanced and different contrast‑enhanced phases[J]. Eur Radiol, 2024, 34(4): 2223-32.
[23] "李晶晶, 张梦琪, 刘 "焱. 能谱CT影像组学及CT征象对GIST危险度分级探讨[J]. 中国CT和MRI杂志, 2024, 22(7): 156-9.
[24] "Liang YM, Li XH, Li WM, et al. Prognostic significance of PTEN, Ki-67 and CD44s expression patterns in gastrointestinal stromal tumors[J]. World J Gastroenterol, 2012, 18(14): 1664-71.
[25] "Zhang P, Tao KX. Pay attention to misdiagnosis and differential diagnosis of gastric gastrointestinal stromal tumor[J]. Chin J Gastrointest Surg, 2021, 24(9): 758-61.
[26] Shibata T, Koyama K, Yamada H, et al. The association between the growth pattern and malignancy in the formation of ulceration in gastric gastrointestinal stromal tumor[J]. Intern Med, 2023, 62(17): 2451-5.
[27] "杨采薇, 刘曦娇, 魏 "毅, 等. CT影像组学联合传统影像特征对胃肠道间质瘤Ki-67指数表达的预测价值[J]. 放射学实践, 2022, 37(9): 1068-73.
[28] "李卫卫. CT影像组学在预测胃间质瘤KIT基因突变及Ki-67表达中的应用研究[D]. 郑州: 郑州大学, 2021.
[29] "Rizzo S, Botta F, Raimondi S, et al. Radiomics: the facts and the challenges of image analysis[J]. Eur Radiol Exp, 2018, 2(1): 36.
[30] "贾济波, 刘原庆, 冯飞文, 等. CT影像组学列线图模型预测胃肠道间质瘤Ki-67表达的临床研究[J]. 临床放射学杂志, 2023, 42(5): 783-8.
(编辑:郎 "朗)
