一体化QuEChERS净化-超高效液相色谱-串联质谱法测定茶叶中27种吡咯里西啶类生物碱
2024-11-08姚蕾珺陈燕秋林浩汪璐瑶石培育张阳阳黄婷宋娟王义戴琴刘川


摘要:针对茶叶中吡咯里西啶类生物碱(Pyrrolizidine alkaloids,PAs)的残留风险,并为进一步提高传统QuEChERS的检测效率,研究建立使用一体化QuEChERS净化-超高效液相色谱-串联质谱测定茶叶中27种PAs的检测方法。该方法中的试样经1%甲酸乙腈提取,使用离心管一体盐包盐析和下压式QuEChERS净化,多反应监测模式(MRM)检测,基质匹配外标法定量。结果表明,27种PAs在各自浓度范围内线性关系良好,平均回收率为73.0%~111.8%,相对标准偏差为1.6%~13.8%(n=6)。该方法具有操作简单、检测通量大、灵敏度高、减少传统QuEChERS反复开盖等特点,能够满足茶叶中PAs的监测需求。对实际60批次茶叶样品进行检测,部分茶叶样品分别检出了不同含量的PAs,证明茶叶中有残留该类植物毒素的风险,建议持续跟踪监测。
关键词:茶叶;超高效液相色谱-串联质谱;QuEChERS;吡咯里西啶类生物碱
中图分类号:S571.1 文献标识码:A 文章编号:1000-369X(2024)05-831-12
Simultaneous Determination of 27 Pyrrolizidine Alkaloids in Tea by Ultra-High Performance Liquid Chromatography-Tandem Mass Spectrometry with Integrated QuEChERS Purification
YAO Leijun1,2,3,4, CHEN Yanqiu1,2,3,4, LIN Hao1,2,3,4, WANG Luyao1,2,3,4, SHI Peiyu1,2,3,4,
ZHANG Yangyang1,2,3,4, HUANG Ting1,2,3,4, SONG Juan1,2,3,4 , WANG Yi1,2,3,4,
DAI Qin1,2,3,4*, LIU Chuan1,2,3,4*
1. Chengdu Institute of Food Inspection, Chengdu 611130, China; 2. Key Laboratory of Monitoring and Assessment on Novel Food Raw Materials, State Administration for Market Regulation, Chengdu 611130, China; 3. Key Laboratory of Chemical Metrology and Applications on Nutrition and Health, State Administration for Market Regulation, Beijing 100029, China; 4. Irradiation Preservation Key Laboratory of Sichuan Province, Chengdu 611130, China
Abstract: In this study, an integrated QuEChERS purification-ultra-performance liquid chromatography-tandem mass spectrometry method was established to detect 27 pyrrolizidine alkaloids (PAs) in tea, taking into account the residual risk of PAs in tea and the challenges of traditional QuEChERS. The method involves extracting the sample with 1% formic acid in acetonitrile, salting out using the centrifuge tube integrated salt bag and Down-Pressure QuEChERS Cleanup, detecting by multiple reaction monitoring mode (MRM), and quantifying it using the matrix-matched external standard method. The 27 PAs exhibit a strong linear relationship within their concentration ranges, with average recovery rates ranging from 73.0% to 111.8% and relative standard deviations from 1.6% to 13.8% (n=6). This method has the characteristics of simple operation, large detection throughput, high sensitivity, and reduction of repeated opening of the traditional QuEChERS, meeting the monitoring requirements for PAs in tea. During the actual testing of 60 batches of samples, different levels of PAs were detected in some tea samples, proving that there is indeed a risk of these plant toxins in tea, and continuous monitoring and tracking is recommended.
Keywords: tea, UPLC-MS/MS, QuEChERS, pyrrolizidine alkaloids
茶叶及其制品作为一种在国内具有较大消费量和出口量的特殊食品类型[1],有关其农药残留、重金属、产地溯源等方面的质量安全与品质研究一直具有较高的关注度[2]。吡咯里西啶类生物碱(Pyrrolizidine alkaloids,PAs)为一类具有双稠吡咯啶结构的生物碱,广泛分布于紫草科、豆科、菊科等植物中,对人体肝脏、肾脏、胚胎等具有明显的毒性,甚至可致畸、致突变、致癌等,因此部分国家和组织均对食品中PAs的残留给予了高度关注[3-4]。以欧盟为例,其对茶叶中的PAs残留限量为150 μg·kg-1(21种PAs的残留量总和),并长期在欧盟食品和饲料快速预警系统(Rapid alert system for food and feed,RASFF)中发布有关茶叶及其制品中检出高含量PAs的通报,而中国作为茶叶消费大国,目前尚未对茶叶中该类物质的残留制定相关标准[5]。
茶叶中残留PAs的主要原因有两方面,其一是茶叶生长环境部分杂草中含有PAs,其在伴随茶叶采摘过程中造成茶叶污染[6-7];其二是茶园中土壤、水分等中的部分PAs被茶树吸收,造成茶叶的污染[8-9]。另外,茶叶中的PAs在冲泡过程中会转移至水中,这进一步增加了人体受Pas危害的风险[10]。且研究表明,PAs的部分氮氧化物的毒理学活性与PAs相当,应受到同等重视[11]。由此可见,茶叶中PAs的残留具有一定的随机性和偶然性,需要对茶叶中PAs残留持续监控。
目前,利用硫酸水溶液提取,MCX小柱净化,液相色谱-串联质谱定量分析是植物源性食品中PAs残留检测的主流方案。基于该种技术背景下,茶叶中的PAs残留被不断检出并显示潜在的食品安全风险,同时由于部分PAs为同分异构体且理化性质接近,导致部分PAs的色谱分离度较差[12-14]。针对PAs种类和同分异构体较多的情况,Rizzo等[8]利用高分辨质谱完成了118种PAs及其类似物的快速筛查,为该类未知化合物的定性、预测、解析提供了思路;而张新娜等[15]则利用QuEChERS法完成了甘草中多种PAs的风险评估,在证明该类化合物在部分药材中残留的同时为利用QuEChERS提取净化该类物质提供了参考。QuEChERS法可有效净化茶叶中多种色素、有机酸等物质,已经在茶叶中农药残留、污染物检测方面具有较为广泛的应用[7,16-17]。
本研究立足茶叶中PAs残留的现状并针对传统QuEChERS需要反复开盖、过程繁琐的缺陷,力求结合现有成品方案建立更为简便的一体化QuEChERS净化,结合超高效液相色谱-串联质谱测定27种PAs的检测方法,提高茶叶中PAs残留的监测水平,提升茶叶品质并助力茶叶产业发展。
1 材料与方法
1. 1 材料与试剂
含石松胺(Lycopsamine)、石松胺氮氧化物(Lycopsamine N-oxide)、倒千里光碱氮氧化物(Retrorsine N-oxide)、蓝蓟定氮氧化物(Echimidine N-oxide)、欧天芥菜碱(Europine)、欧天芥菜碱氮氧化物(Europine N-oxide)、春千里光碱氮氧化物(Senecivernine N-oxide)、克氏千里光碱(Senkirkine)、促黑激素(Intermedine)、芝麻菜叶千里光碱氮氧化物(Erucifoline N-oxide)、野百合碱(Monocrotaline)、野百合碱氮氧化物(Monocrotaline N-oxide)、促黑激素氮氧化物(Intermedine N-oxide)、倒千里光碱(Retrorsine)、毛束草碱(Trichodesmine)、千里光菲林碱(Seneciophylline)、千里光菲林碱氮氧化物(Seneciophylline N-oxide)、天芥菜碱(Heliotrine)、天芥菜碱氮氧化物(Heliotrine N-oxide)、千里光宁碱(Senecionine)、千里光宁碱氮氧化物(Senecionine N-oxide)、蓝蓟定(Echimidine)、毛果天芥菜碱(Lasiocarpine)、毛果天芥菜碱氮氧化物(Lasiocarpine N-oxide)、夹可灵(Jacobine)、夹可灵氮氧化物(Jacobine N-oxide)、春千里光碱(Senecivernine)等27种吡咯里西啶生物碱的甲醇混合标准溶液,购自天津阿尔塔科技有限公司,浓度均为100 μg·mL-1。
甲酸、甲醇、乙腈(色谱纯)购自德国Merck公司;盐包一体化离心管(6 g硫酸镁/1.5 g乙酸钠)购自山东青云化学科技有限公司;一体化下压式QuEChERS净化柱(900 mg硫酸镁/400 mg C18/400 mg PSA/120 mg GCB/200 mg POLY)购自天津安邦键合科技有限公司。试验用水符合GB/T 6682—2008实验室一级用水要求。
本研究过程中所用60份茶叶样品均为市购,采购地点为成都市。
1.2 仪器与设备
ACUITY I-Class-Triple Q 5500超高效液相色谱-串联串联质谱仪(美国Waters公司、美国SCIEX公司);Centrifuge 5810 R高速离心机(德国Eppendorf公司);Milli-Q超纯水仪(美国Millipore公司);BP211D型天平(德国Sartorius公司);ME203型天平(瑞士Mettler Toledo公司)。
1.3 试验方法
1.3.1 样品前处理
提取:称取粉碎后充分混匀的样品2 g(精确至0.01 g)置于50 mL盐包一体化离心管中,加10 mL水涡旋混匀,静置30 min。加入10 mL 1%甲酸乙腈,盖上离心管盖,1 500 r·min-1涡旋振荡2 min。
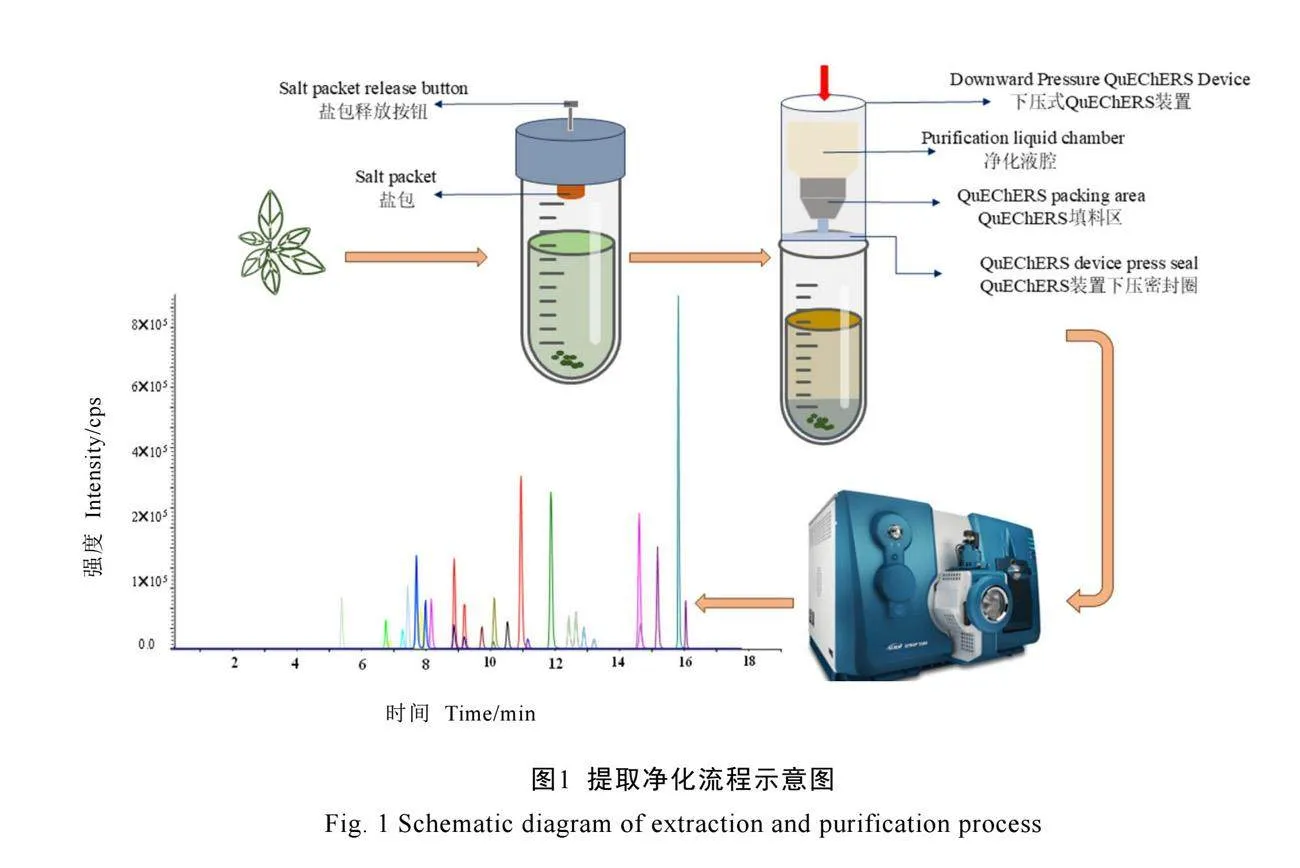
净化:按下盐包释放按钮,将盐包释放至提取溶液中,剧烈振摇离心管使提取溶液中水层与有机溶剂层分离,4 000 r·min-1离心2 min并弃去离心管盖。将一体化下压式QuEChERS净化柱垂直安装于离心管口,缓慢按压净化柱,使上层有机溶剂通过填料区进入净化溶液腔。准确吸取5 mL净化溶液至刻度氮吹管中,于40 ℃条件下氮吹至近干,使用初始流动相定容至2 mL,待测。整个提取净化流程见图1。
1.3.2 标准物质溶液的配制
准确吸取100 μL 27种吡咯里西啶生物碱混合标准溶液至10 mL容量瓶中,用甲醇定容至刻度,摇匀得到27种吡咯里西啶生物碱质量浓度均为1 μg·mL-1的混合标准中间溶液。
称取多份阴性茶叶样品,参照1.3.1章节所述方法制备空白基质溶液,分别吸取不同体积的混合标准中间溶液,用空白基质溶液进行稀释,配制基质匹配工作曲线溶液。
1.3.3 液相色谱-串联质谱条件
色谱柱为ACQUITY UPLC HSS C18柱(3.0×150 mm,1.7 μm);流动相A为5 mmol·L-1乙酸铵溶液(含0.1%甲酸),流动相B为甲醇溶液;流速0.3 mL·min-1;柱温40 ℃;进样量2 μL。梯度洗脱程序:0~2.0 min,85%流动相A;2.0~13.0 min,85%~60%流动相A;13.0~15.0 min,60%~5%流动相A;15.0~18.0 min,5%流动相A;18.0~18.5 min,5%~95%流动相A;18.5~20.0 min,95% 流动相A。
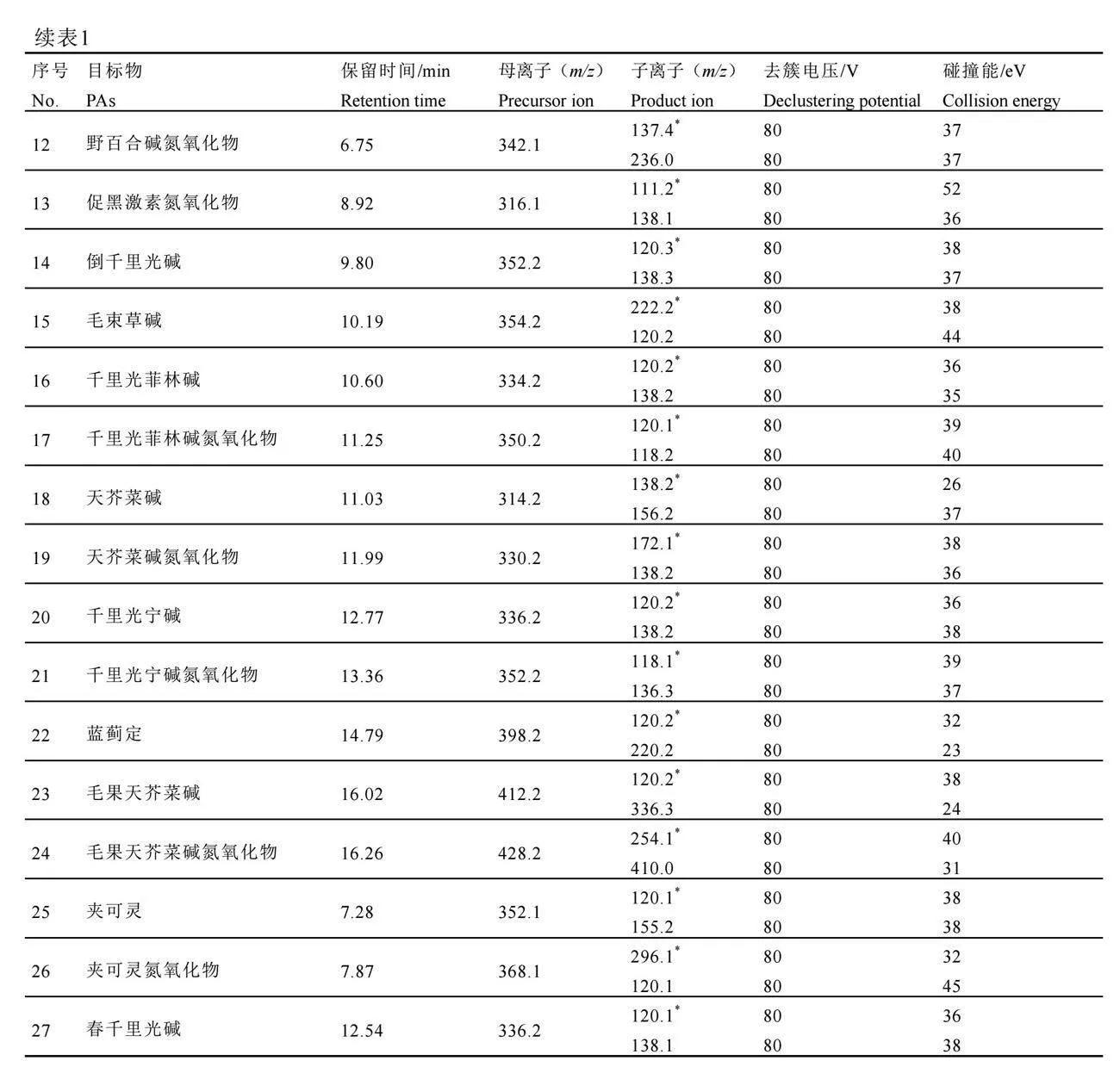
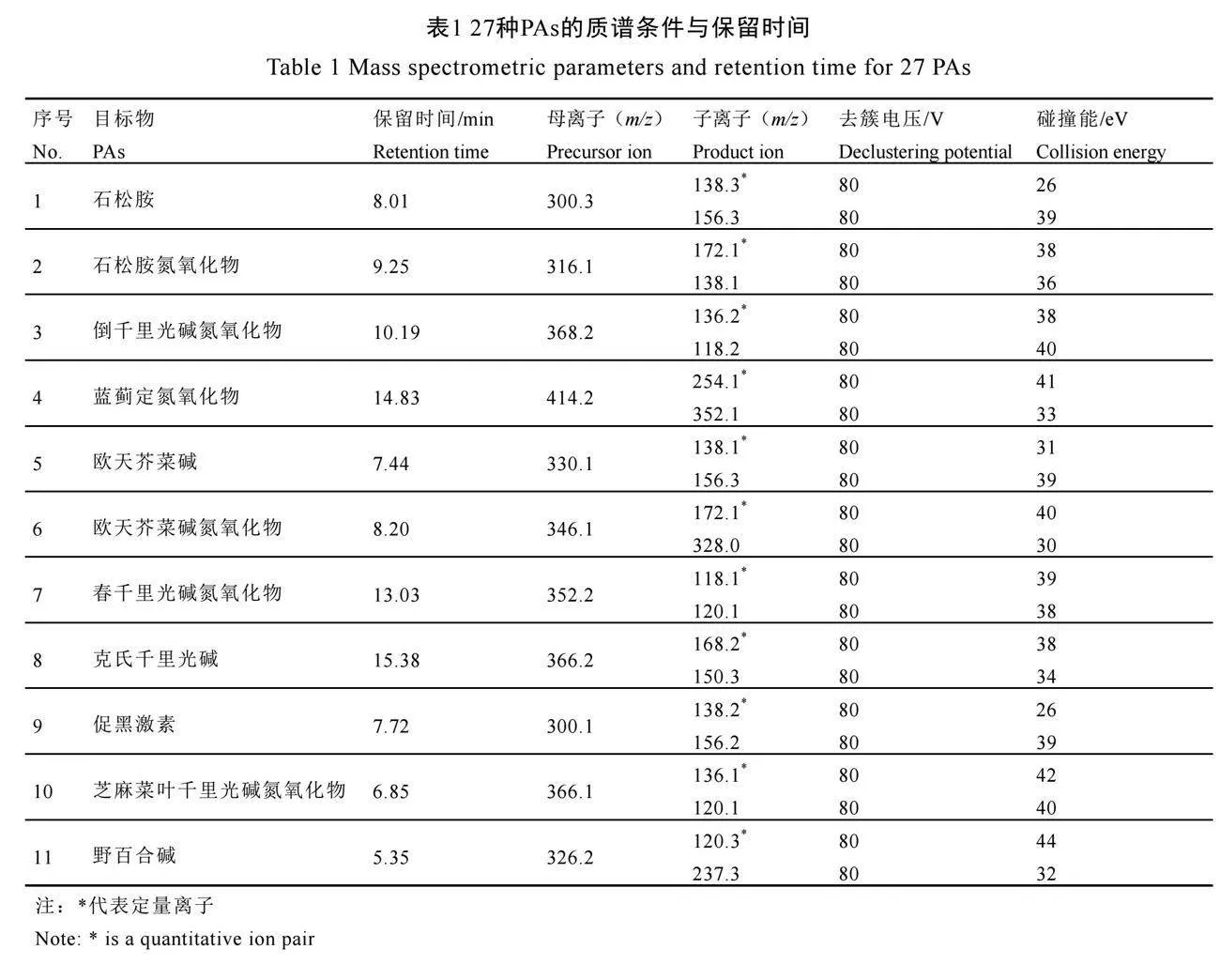
离子源类型为ESI源,气帘气(氮气)流速35 psi;喷雾气(氮气)流速55 psi;辅助加热气(氮气)流速55 psi;离子源温度400 ℃;离子化电压5 000 V;扫描模式为多反应监测模式,监测离子对和质谱参数见表1。
1.3.4 基质效应计算方法
考察检测茶叶中27种PAs时基质效应强弱,以曲线斜率计算基质效应(ME),具体方法见公式(1)。
式中:k1为基质匹配标准曲线斜率;k2为溶剂标准曲线斜率。
2 结果与分析
2.1 质谱条件优化
在流动注射方式下,分别对27种PAs化合物进行一级全扫描,确定各化合物的正负离子采集模式和离子加和模式。结果表明,所有化合物在正离子模式下均具有较为良好的响应,且[M+H]+母离子的响应最高。在确定各化合物最佳母离子的情况下,对其进行产物离子扫描,选择响应相对较高、专属性较强的2个子离子建立多反应监测通道(MRM)并完成去簇电压和碰撞电压优化。同时在接入流动相后继续优化气帘气、喷雾气、辅助加热气、离子源温度、离子化电压等离子源条件。
2.2 色谱条件优化
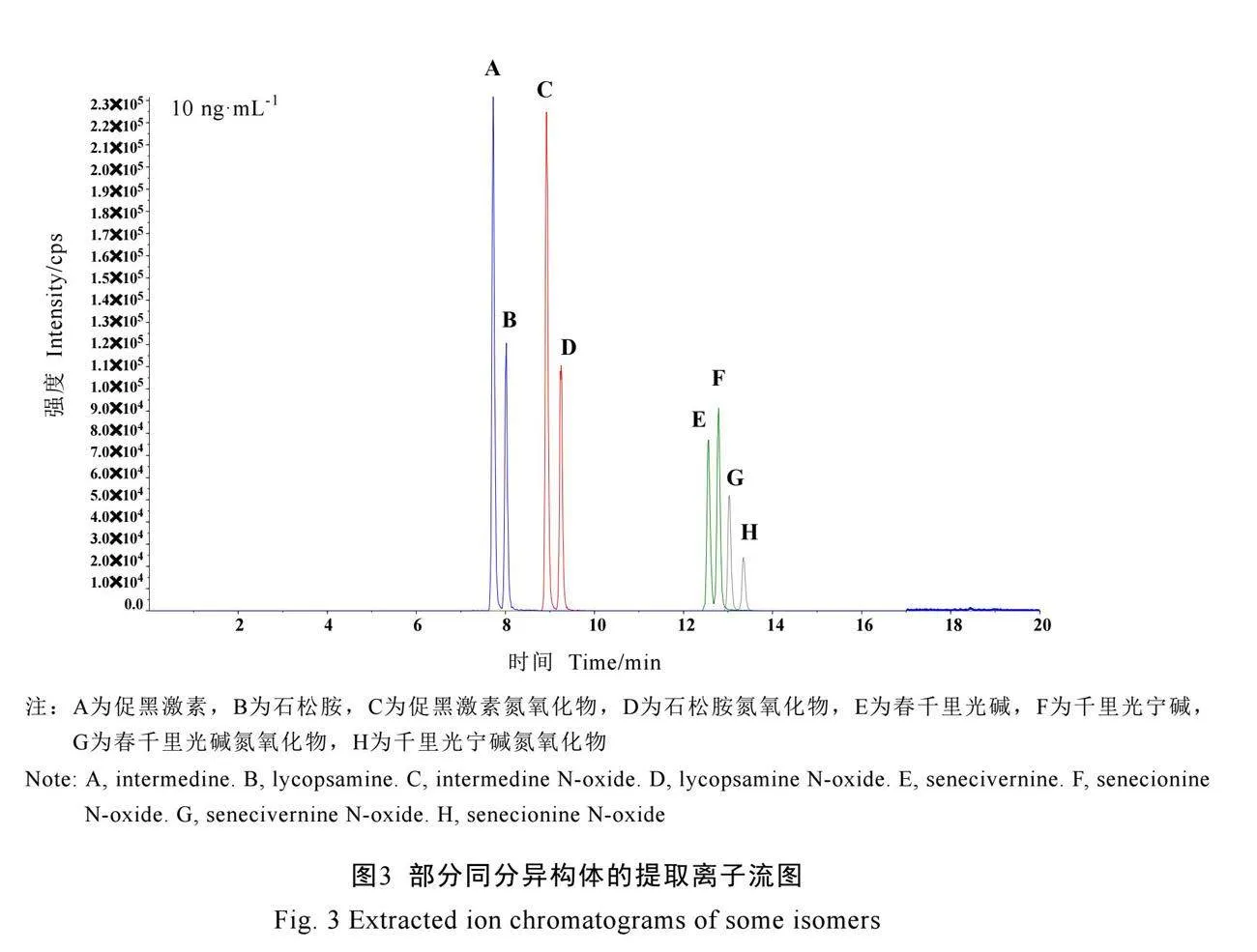
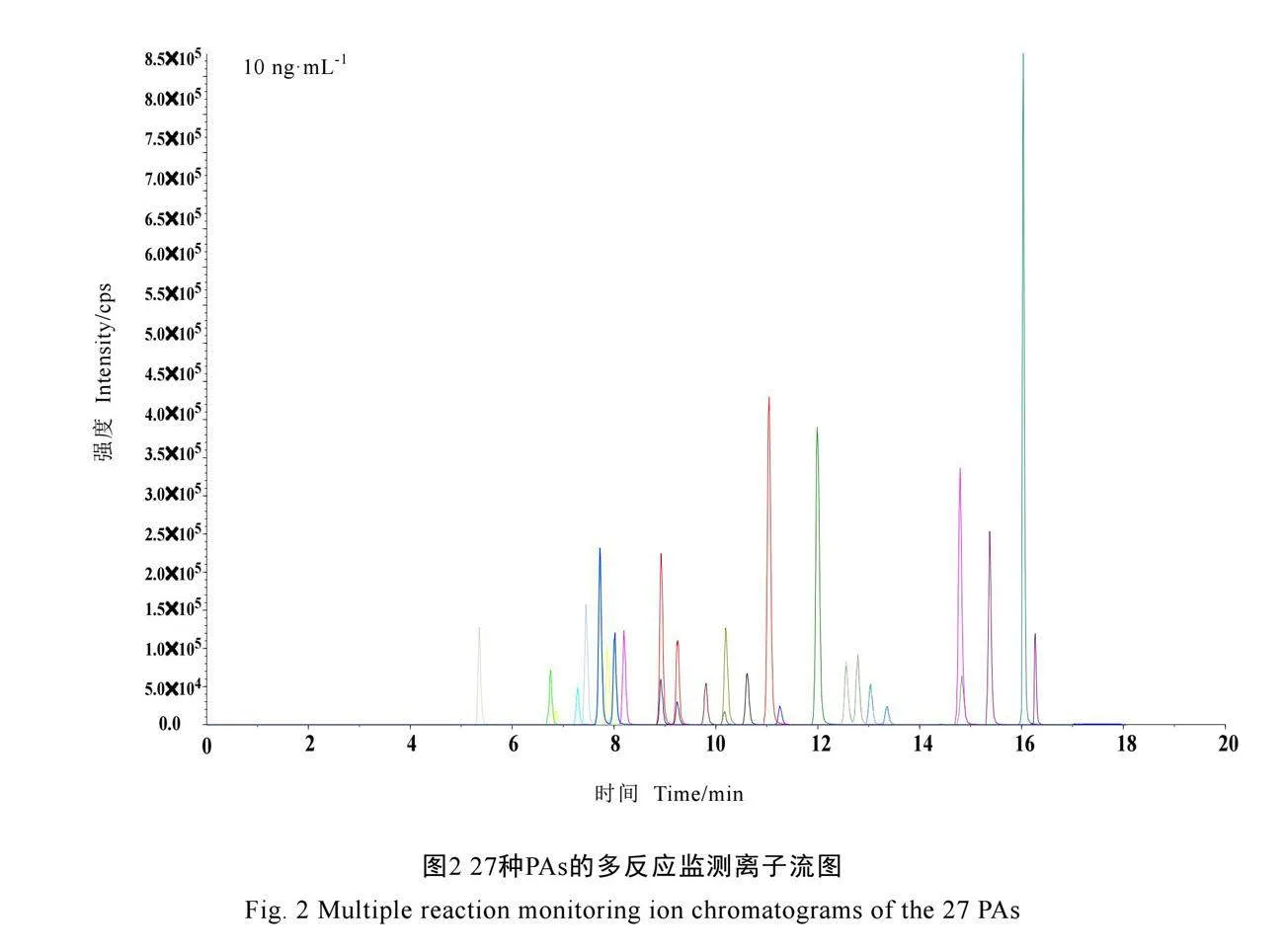
由于本研究中27种PAs和氮氧化物中存在多组同分异构体,特别是石松胺和促黑激素、石松胺氮氧化物和促黑激素氮氧化物、千里光宁碱和春千里光碱、春千里光碱氮氧化物和千里光宁碱氮氧化物化学结构和性质相似,且子离子相同,在使用ACQUITY UPLC BEH C18(3.0 mm×100 mm,1.7 μm)和ACQUITY UPLC HSS T3(3.0 mm×100 mm,1.7 μm)色谱柱时,需要较严苛的色谱条件和梯度才能将化合物完全分离。因此,本次研究中选择ACQUITY UPLC HSS C18(3.0 mm×150 mm,1.7 μm)色谱柱进行色谱条件优化,以甲醇、乙腈作为有机相,0.1%甲酸水、5 mmol·L-1乙酸铵(0.1%甲酸)水溶液作为水相进行交叉搭配,以优化流动相种类和梯度。最终选择甲醇作为有机相、5 mmol·L-1乙酸铵(0.1%甲酸)水溶液作为水相进行色谱分离,按照1.3.3章节描述的条件对27种PAs进行扫描监测,总离子流图见图2。如图3所示,通过优化梯度条件,以上同分异构体能够实现完全分离。
2.3 提取条件优化
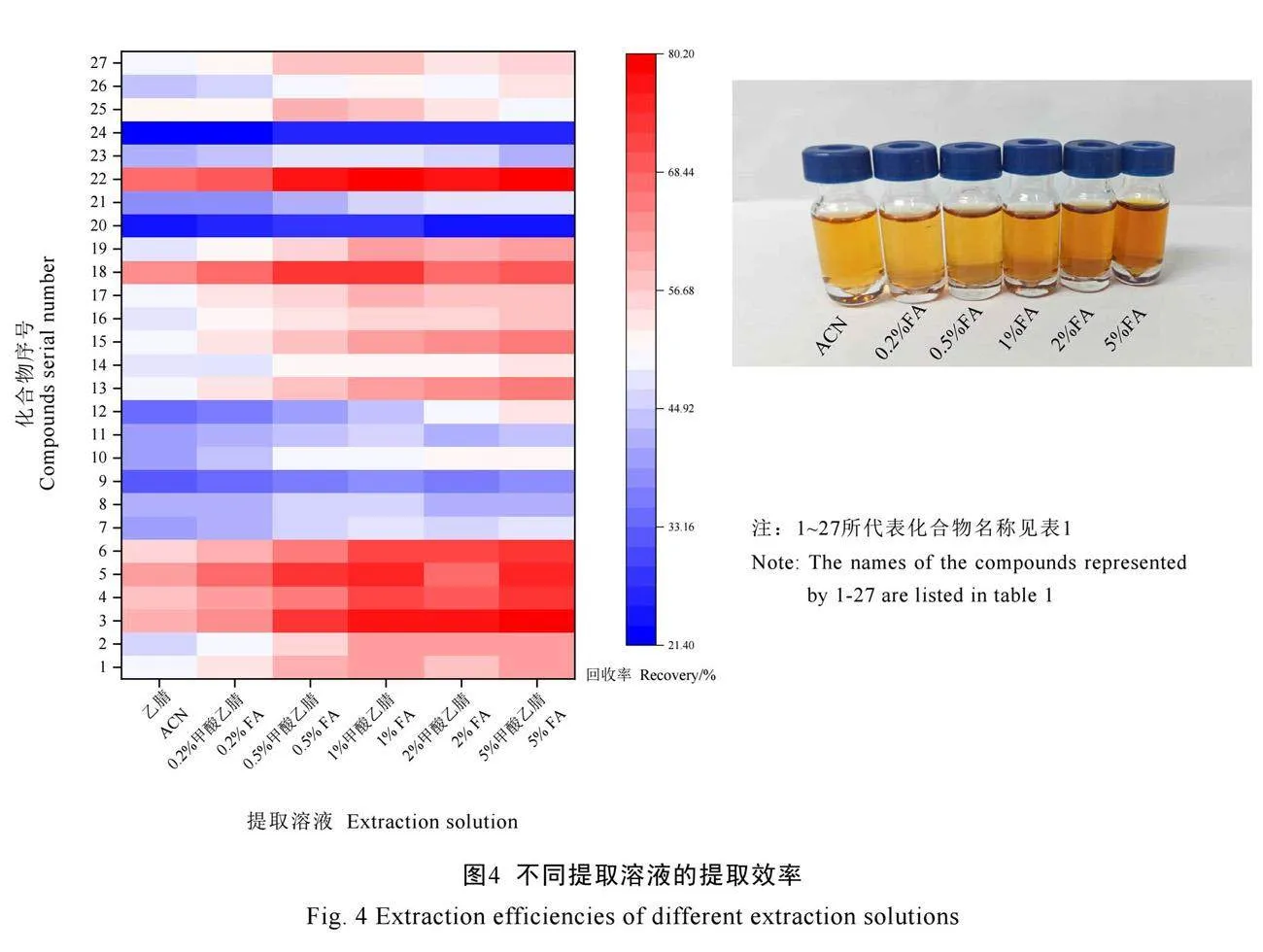
针对茶叶中PAs提取方法,本研究参考文献[16,18-19],结合PAs类化合物多为生物碱类化合物的性质,使用有机溶剂或酸化有机溶剂提取其效果相对较好。因此主要对提取溶液的酸化程度进行考察,通过比较乙腈(Acetonitrile,ACN)、0.2%甲酸乙腈(0.2% Formic acid-acetonitrile,0.2% FA)、0.5%甲酸乙腈(0.5% Formic acid-acetonitrile,0.5% FA)、1%甲酸乙腈(1% Formic acid-acetonitrile,1% FA)、2%甲酸乙腈(2% Formic acid-acetonitrile,2% FA)和5%甲酸乙腈(5% Formic acid-acetonitrile,5% FA)的提取效率,确定最优提取方法。结果显示,随着乙腈的酸度增加,提取溶液颜色加深,可能是酸度提高后增加了更多色素等物质的溶出效率(图4)。如图4所示,27种PAs在不同溶剂下的提取效率差异较大,其中石松胺、石松胺氮氧化物、倒千里光碱氮氧化物、蓝蓟定氮氧化物、欧天芥菜碱、
欧天芥菜碱氮氧化物、春千里光碱氮氧化物等化合物提取效率随着酸度增强而提高,并在1%甲酸乙腈下达到最大提取率,随后酸度增加并未进一步提高提取效率;天芥菜碱、毛果天芥菜碱、夹可灵等化合物其提取效率在1%甲酸乙腈附近达到最高,继续提高酸度则提取效率出现下降;毛果天芥菜碱氮氧化物和千里光宁碱两种化合物其提取效率一直低于30%。该类化合物在不同提取溶剂下展现出的提取效率差异,极有可能与茶叶中被提取出的各种有机酸、色素等导致的基质效应有关。本研究综合27种PAs的提取效率,选取1%甲酸乙腈作为提取溶剂,并对可能的影响因素继续考察。
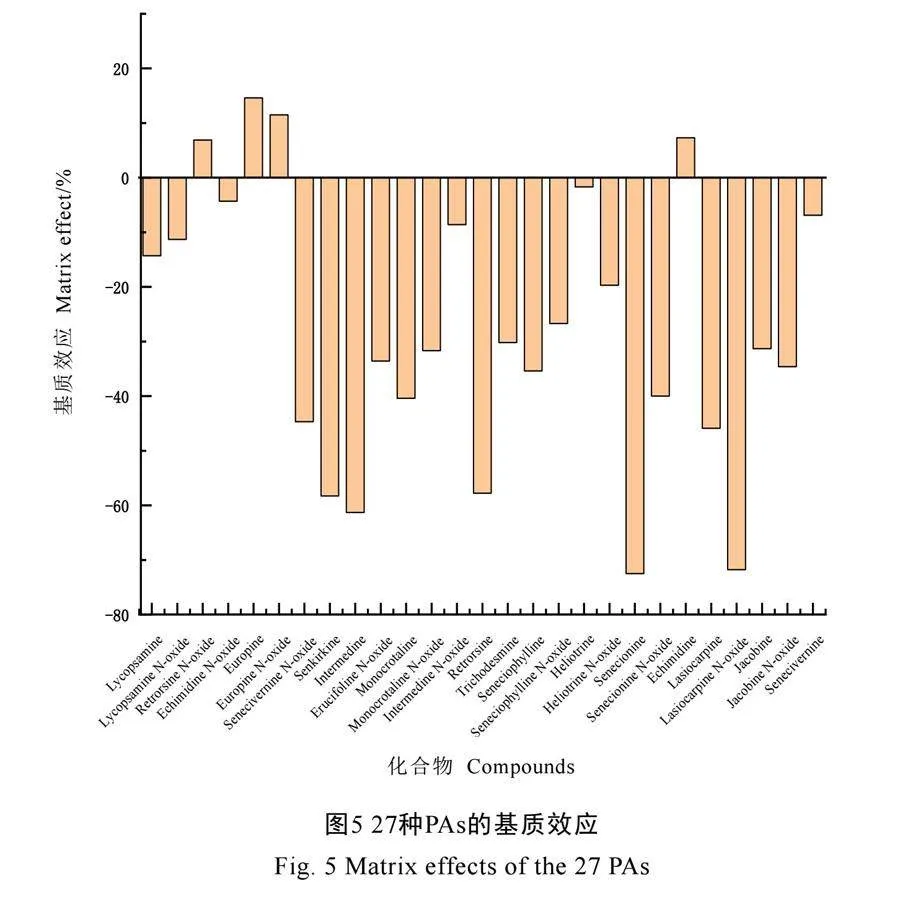
2.4 基质效应考察
由于茶叶中有大量的色素、脂质、有机酸等干扰的存在,使用液相色谱-串联质谱法进行测量时常会产生不同程度的基质效应。为进一步提高测定结果的准确性,本研究对测定过程中的基质效应进行了评估[20-21]。分别称取适量份数的阴性茶叶样品,按照1.3.1章节获取空白基质溶液。分别使用空白基质溶液和甲醇+5 mmol·L-1乙酸铵(含0.1%甲酸)水溶液(1+1)将混合标准中间溶液稀释成标准曲线工作液,按1.3.4章节描述的方法计算27种PAs的基质效应。结果如图5所示,几乎所有的PAs都表现出明显的基质效应,特别是毛果天芥菜碱氮氧化物和千里光宁碱两种化合物,其基质效应均为﹣70%以上,这与在进行提取溶剂优化过程中展现的提取效率关系相符。且在茶叶中部分其他物质的检测过程中所展现的基质效应与PAs所展现的情况相符合[20],因此为提高所测全部化合物的准确性,本研究将采用空白基质匹配外标法进行27种PAs的定量分析。同时由于本研究选取了成品的QuEChERS净化产品,其配方较为固定,后续研究中可继续优化配方,降低基质效应对检测带来的干扰。
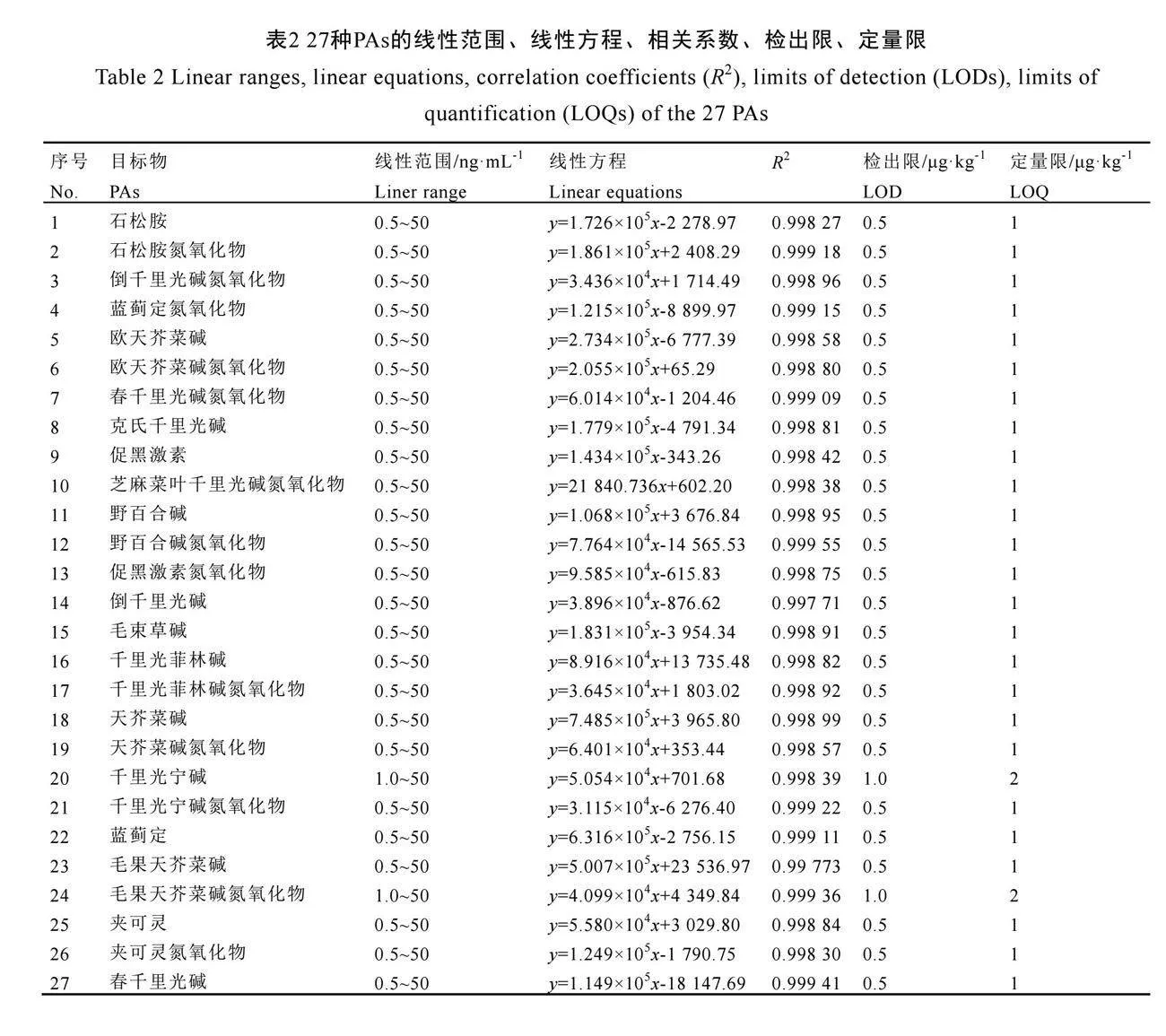
2.5 线性关系、检出限与定量限
分别吸取不同体积的混合标准中间溶液于不同的10 mL容量瓶中,用阴性(未检出27
种PAs)茶叶样品按照1.3.1章节所制备的空白基质溶液定容至刻度,摇匀,得到标准曲线工作溶液,不同化合物的线性范围与相关系数见表2。
采取在阴性茶叶样品中逐级稀释加标浓度的方式确定27种PAs的检出限和定量限。同时在阴性茶叶样品中加入检出限和定量限水平的标准物质,按照1.3.1章节和1.3.3章节的方法进行检测。结果表明,检出限水平的各化合物定性离子对、定量离子对信噪比均大于3;定量限水平的各化合物定性离子对、定量离子对信噪比均大于10,相关结果见表2。该方法具有较高的灵敏度,能够满足所测化合物的检测需求。
2.6 方法回收率与精密度
依据GB/T 27404—2008《实验室质量控制规范食品理化检测》进行本方法的回收率和精密度评价[22],称取阴性茶叶样品,按照定量限、二倍定量限和十倍定量限进行3水平添加试验(n=6),按照1.3.1章节和1.3.3章节描述的方法进行样品处理和检测,考察方法的回收率和精密度。如表3所示,本方法的平均回收率在73.0%~111.8%,相对标准偏差(Relative standard deviation,RSD)在1.6%~13.8%,具有较高的准确度和稳定性。
2.7 实际样品测试
采用本方法对购自成都市场的60份茶叶样
品进行目标物监测。其中A号样品中检出石松胺(1.2 μg·kg-1)、夹可灵氮氧化物(2.4 μg·kg-1)和春千里光碱(0.5 μg·kg-1),B号样品中检出蓝蓟定氮氧化物(0.5 μg·kg-1)、克氏千里光碱(6.8 μg·kg-1)、千里光菲林碱(0.8 μg·kg-1)、千里光菲林碱氮氧化物(5.1 μg·kg-1)、千里光宁碱(6.6 μg·kg-1)和千里光宁碱氮氧化物(18.5 μg·kg-1),B号样品中PAs的总量相对较高。以上监测的含量水平与国内部分区域的监测结果基本相当[14],以欧盟对该类化合物51jJnoSZzvBuImwuwWoj/XhA2DhXm+86neMJrlyVcHw=的限量水平为参考,其依然处于安全的含量水平。有关PAs与地域、时节、工艺等因素的关联还有待进一步研究和跟踪评价。
3 结论
针对茶叶易残留吡咯里西啶类生物碱的食品安全风险,本研究成功开发了灵敏度高、专属性强、检测效率高的分析方法,为持续检测该类物质的残留提供了技术支撑。在该过程中通过优化色谱条件实现了多对同分异构体的有效分离。同时针对传统QuEChERS净化方法在大批量检测过程中反复开盖导致检测效率偏低的技术性难题,通过将离心管盖一体化盐包和下压式QuEChERS净化相结合的方式,明显减少了开关盖次数,优化了前处理的操作步骤,提高了使用QuEChERS应对大批量样品时的检测效率,为QuEChERS方法的持续改进、深入优化提供了新思路。同时实际样品测试表明部分茶叶中确实残留PAs类化合物,建议对该类化合物持续监控,制定我国对茶叶中该类物质的检测标准和限量值标准。
参考文献
[1] 胡晓云, 陈清爽, 魏春丽. 2024中国茶叶企业产品品牌价值评估报告[J]. 中国茶叶, 2024, 46(6): 33-45.
Hu X Y, Chen Q S, Wei C L. 2024 product brand value evaluation report of Chinese tea enterprises [J]. China Tea, 2024, 46(6): 33-45.
[2] 鲁钰婷, 柴云峰, 郝振霞, 等. 2023年茶叶质量安全检测技术研究进展[J]. 中国茶叶, 2024, 46(5): 1-9.
Lu Y T, Chai Y F, Hao Z X, et al. Research progress on tea quality and safety testing technology in 2023 [J]. China Tea, 2024, 46(5): 1-9.
[3] Casado N, Morante-Zarcero S, Sierra I. The concerning food safety issue of pyrrolizidine alkaloids: an overview [J]. Trends in Food Science & Technology, 2022, 120: 123-139.
[4] He Y S, Zhu L, Ma J, et al. Metabolism-mediated cytotoxicity and genotoxicity of pyrrolizidine alkaloids [J]. Archives of Toxicology, 2021, 95(6): 1917-1942.
[5] 韩浩蕾, 姜长岭, 王晨, 等. 茶叶中吡咯里西啶生物碱检测技术、污染水平及健康风险研究进展[J]. 食品科学, 2021, 42(17): 255-266.
Han H L, Jiang C L, Wang C, et al. Pyrrolizidine alkaloids in tea: a review of analytical methods, contamination levels and health risk [J]. Food Science, 2021, 42(17): 255-266.
[6] Zan K, Wang Z, Wang Y, et al. Distribution, determination method, risk assessment, and strategy of exogenous pyrrolizidine alkaloids in tea [J]. Pharmacological Research-Modern Chinese Medicine, 2023, 8: 100277. doi: 10.1016/j.prmcm.2023.100277.
[7] Jiao W T, Zhu L, Shen T T, et al. Simultaneous determination of 15 pyrrolizidine alkaloids and their N-oxides in weeds, soil, fresh tea leaves, and tea: exploring the pollution source of pyrrolizidine alkaloids in tea [J]. Food Chemistry, 2024, 434: 137305. doi: 10.1016/j.foodchem.2023.137305.
[8] Rizzo S, Celano R, Piccinelli A L, et al. Target screening method for the quantitative determination of 118 pyrrolizidine alkaloids in food supplements, herbal infusions, honey and teas by liquid chromatography coupled to quadrupole orbitrap mass spectrometry [J]. Food Chemistry, 2023, 423: 136306. doi: 10.1016/j. foodchem.
2023.136306.
[9] Jiao W T, Zhu L, Li Q X, et al. Pyrrolizidine alkaloids in tea (Camellia sinensis L.) from weeds through weed-soil-tea transfer and risk assessment of tea intake [J]. Journal of Agricultural and Food Chemistry, 2023, 71(48): 19045-19053. doi: 10.1021/acs.jafc.3c04339.
[10] Reinhard H, Zoller O. Pyrrolizidine alkaloids in tea, herbal tea and iced tea beverages- survey and transfer rates [J]. Food additives & Contaminants: Part A, 2021, 38(11): 1914-1933.
[11] Lu Y S, Qiu J, Mu X Y, et al. Levels, toxic effects, and risk assessment of pyrrolizidine alkaloids in foods: a review [J]. Foods, 2024, 13(4): 536. doi: 10.3390/foods13040536.
[12] Kwon Y, Koo Y, Jeong Y. Determination of pyrrolizidine alkaloids in teas using liquid chromatography-tandem mass spectrometry combined with rapid-easy extraction [J]. Foods, 2021, 10(10): 2250. doi: 10.3390/foods10102250.
[13] Wan J Y, Feng C, Chen Y H, et al. Simultaneous determination of 21 pyrrolizidine alkaloids in tea [J]. Journal of Instrumental Analysis, 2023, 42(10): 1351-1356.
[14] 夏珍珍, 彭茂民, 郑丹, 等. 湖北省茶叶中吡咯里西啶生物碱污染概况及健康风险评估[J]. 农产品质量与安全, 2021(4): 23-29.
Xia Z Z, Peng M M, Zhen D, et al. Spatial variation and risk assessment of pyrrolizidine alkaloids (Pas) in tea in Hubei province [J]. Quality and Safety of Agro-Products, 2021(4): 23-29.
[15] 张新娜, 马丽艳. QuEChERS结合高效液相色谱-串联质谱法检测甘草中吡咯里西啶生物碱与风险分析[J]. 食品安全质量检测学报, 2024, 15(8): 314-321.
Zhang X N, Ma L Y. Determination of pyrrolizidine alkaloids in licorice by QuEChERS combined with high performance liquid chromatography-tandem mass spectrometry and risk analysis [J]. Journal of Food Safety and Quality, 2024, 15(8): 314-321.
[16] Yan X X, Tong K X, Zhu Z H, et al. Rapid determination of 88 pesticide residues in Tibetan tea by ultra performance liquid chromatography-tandem mass spectrometry coupled with improved QuEChERS method [J]. Journal of Instrumental Analysis, 2024, 43(4): 590YJLmKapWmcVUfMMZlMscqw==-599.
[17] Tripathy V, Sharma K K, Gupta R, et al. Simultaneous monitoring and dietary risk assessment of 386 pesticides in market samples of black tea [J]. Food Chemistry, 2023, 420: 136103. doi: 10.1016/j.foodchem.2023.136103.
[18] Rollo E, Catellani D, Dall'Asta C, et al. QuEChERS method combined to liquid chromatography high-resolution mass spectrometry for the accurate and sensitive simultaneous determination of pyrrolizidine and tropane alkaloids in cereals and spices [J]. Journal of Mass Spectrometry, 2023, 58(10): e4969. doi: 10.1002/jms.4969.
[19] 谷瑞丽, 刘霞丽, 宁亚萍, 等. 改良QuEChERS-气相色谱-串联质谱法测定茶叶中43种农药残留[J]. 农产品质量与安全, 2023(6): 56-62.
Gu R L, Liu X L, Ning Y P, et al. Determination of 43 pesticide residues in tea by modified QuEChERS coupled with gas chromatography-tandem mass spectrometry [J]. Quality and Safety of Agro-Products, 2023(6): 56-62.
[20] Zhou P, Huang Qian, Ouyang L Q. Determination of nine botanical pesticide residues in tea by UHPLC-MS/MS [J]. Journal of Chinese Mass Spectrometry Society, 2020, 41(5): 490-501.
[21] Ly T K, Ho T D, Benra P, et al. Determination of 400 pesticide residues in green tea leaves by UPLC-MS/MS and GC-MS/MS combined with QuEChERS extraction and mixed-mode SPE clean-up method [J]. Food Chemistry, 2020, 326: 126928. doi: 10.1016/j.foodchem.2020.126928.
[22] 刘川, 李佳佳, 吴雪莹, 等. 通过式固相萃取-超高效液相色谱-串联质谱法测定动物源性食品中30种食源性兴奋剂[J]. 食品科学, 2024, 45(4): 289-299.
Liu C, Li J J, Wu X Y, et al. Simultaneous determination of 30 foodborne stimulant drug residues in animal-derived foods by ultra-high performance liquid chromatography-
tandem mass spectrometry with pass-through solid phase extraction [J]. Food Science, 2024, 45(4): 289-299.
