茶叶成分EGCG与L-theanine联合应用的神经保护作用研究
2024-11-08丁树洽谢昕雅刘助生廖贤军刘仲华蔡淑娴



摘要:分化的神经细胞需要在细胞静息状态下维护轴突的生长和功能。前期研究显示,表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)和L-茶氨酸(L-theanine)能够维持神经细胞的静息状态并具有神经修复作用,但具体的作用机制还不清楚。在Aβ25-35诱导的PC12细胞损伤模型中,EGCG和L-theanine联合处理改善细胞代谢和修复能力,提高了细胞活力,表现显著的协同作用。转录组和网络药理学分析结果表明,EGCG主要通过抑制氧化应激、调节脂肪酸代谢和淀粉样蛋白毒性应激来维持细胞静息态;L-theanine则通过促进轴突生长、调节神经代谢和突触功能发挥作用。两者联合应用对细胞网络的调节更为广泛和温和,减少对细胞的刺激作用。本研究为茶叶的神经保护作用及其在老龄化社会中的饮用价值提供了理论依据。
关键词:表没食子儿茶素没食子酸酯;L-茶氨酸;神经保护;网络药理;转录组;联合分析
中图分类号:S571.1;R972+.6 文献标识码:A 文章编号:1000-369X(2024)05-779-14
A Study on the Neuroprotective Effects of Combined EGCG and L-Theanine from Tea Leaves
DING Shuqia1,3, XIE Xinya1,3, LIU Zhusheng2*, LIAO Xianjun2, LIU Zhonghua1,3, CAI Shuxian1,3*
1. National Research Center of Engineering and Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China; 2. Guangxi Research Institute of Tea Science, Guilin 541004, China; 3. Key Lab of Education Ministry of Hunan Agricultural University for Tea Science, Changsha 410128, China
Abstracts: Differentiated neurons need to maintain axonal growth and function in a quiescent state. Previous studies have shown that epigallocatechin gallate (EGCG) and L-theanine can maintain the quiescent state of neurons and have neurorestorative effects, although the specific mechanisms are still unclear. In the Aβ25-35-induced PC12 cell damage model, combined treatment with EGCG and L-theanine improved cell metabolism and repair capacity, enhanced cell viability and showed a significant synergistic effect. Transcriptomic and network pharmacological analyses indicate that EGCG mainly maintains the quiescent state of cells by inhibiting oxidative stress, regulating fatty acid metabolism, and mitigating amyloid protein toxicity stress. L-theanine promotes axonal growth and regulates neuronal metabolism and synaptic function. The combined application of both compounds results in a broader and milder regulation of cellular networks, reducing cellular stress. This study provided theoretical support for the neuroprotective effects of tea and its value in an aging society.
Keywords: EGCG, L-theanine, neuroprotection, network pharmacology, transcriptome, joint analysis
淀粉样蛋白病(Amyloidosis)是由内源性蛋白的异常聚集所形成的淀粉样蛋白沉积于组织中,引发细胞毒性,最终导致组织损伤和病变[1-2]。目前有超过36种淀粉样蛋白可沉积于心脏、肾脏、神经系统、脑组织、眼球、皮肤、血管等组织,且具有特异性[3]。研究发现,除了致病蛋白Aβ42、IAPP、α-突触核蛋白等外,所有的蛋白质、核酸和脂肪等生物大分子均有集聚化倾向,可引发和促进大部分与衰老相关的疾病,如动脉粥样硬化、肿瘤、2型糖尿病和阿尔茨海默病(Alzheimer's disease,AD)等。致病蛋白质聚集体的毒性可能源自其固有的错误折叠性质和结构异质性。这些特性导致大量异常相互作用,引起细胞损伤与死亡[4-5]。Aβ在高浓度时形成沉淀斑块,无分解代谢途径,因此抑制Aβ结构的形成对于预防老年性疾病至关重要。
AD及其他神经退行性疾病(Neurodegene-
rative diseases,NDs)的主要病理机制包括细胞外Aβ斑块的形成、异常磷酸化的tau蛋白在细胞内积累、神经元突触功能障碍以及神经元损失[6-8]。现有疗法主要缓解症状,无法阻止疾病进程,并可能有副作用[9]。因此,开发能作用于多个生物靶点的天然产品具有重要治疗潜力。
有研究认为,日常饮用适量的绿茶可显著降低认知障碍的风险[10]。绿茶中的儿茶素,尤其是EGCG,具有多重健康益处,可通过抗炎、抗氧化等途径对ND有防治作用[11]。EGCG能阻断淀粉样蛋白的聚集并分解原纤维,改善中枢记忆缺陷[12-14]。口服EGCG后,其代谢物EGC和GA促进神经轴突生长,减少脑部氧化损伤[15-16]。网络药理学研究已分析了EGCG及其代谢物对疾病靶点的影响[17-18]。L-茶氨酸(L-theanine)作为安全添加剂,在脑部、胃部和肝脏的炎症损伤中显示出其抗凋亡和保护作用[19-20]。口服L-theanine后大鼠肝脏中的乙胺和谷氨酸水平显著提高[21],这种变化与其直接代谢和谷氨酰胺酶的作用有关[22]。L-
theanine通过抑制氧化损伤和tau蛋白过度磷酸化减轻神经毒性,降低镉诱导的神经元死亡[23]。
本研究采用细胞试验、转录组分析和网络药理学方法,进一步探索了EGCG和L-theanine及其主要代谢物在神经保护方面的协同效应和作用机制,通过转录组和网络药理的交集靶点分析,为揭示茶叶的神经保护机制提供重要的理论依据。
1 材料与方法
1.1 试验材料与试剂
表没食子儿茶素没食子酸酯(Epigallocat-
echin Gallate,EGCG)和L-theanine(纯度均为99%以上)均购自Sigma-Aldrich公司(美国密苏里州圣路易斯市)。大鼠嗜铬细胞瘤细胞系(PC12细胞)由北京协和医学院细胞库(北京)提供。Dulbecco改良Eagle培养基(DMEM)、胎牛血清(FBS)和胰蛋白酶均由美国Biological Industries提供。β淀粉样蛋白25-35(Aβ25-35)购自美国Sigma公司。氟硼二吡咯类荧光染料(BODIPY)购自美国Invitrogen公司。
1.2 不同Aβ25-35蛋白样品制备
将EGCG、L-theanine及其组合与Aβ25-35按等浓度混合,并在37 ℃的培养箱中孵育。孵育后,对混合液进行稀释并加入至细胞中,以探索最佳协同浓度。在后续结果描述中,这些处理组分别标记为Aβ25-35、Aβ25-35/EGCG、Aβ25-35/L-theanine及Aβ25-35/EGCG+L-theanine。
1.3 细胞培养
PC12细胞在含10%胎牛血清、100 U·mL-1青霉素和100 µg·mL-1链霉素的Dulbecco改良Eagle培养基中培养,置于含5% CO2的37 ℃恒温培养箱内。
1.4 细胞活力检测
将PC12细胞接种于96孔板中,密度为每孔1×104个,培养24 h。然后用不同的Aβ25-35蛋白样品(Aβ25-35、Aβ25-35/EGCG、Aβ25-35/L-
theanine和Aβ25-35/EGCG+L-theanine)处理细胞24 h,对照组加入等量的无菌水。去除上清液后,加入含0.5 g·mL-1 MTT的培养基,孵育4 h。随后除去上清液,每孔加入150 μL DMSO。在多功能酶标仪上,以570 nm波长测量吸光度。细胞活力以处理组与对照组吸光度的平均百分比表示,对照组活力设定为100%。
1.5 荧光染色分析
将细胞以每孔5×104个的密度接种到含有盖玻片的24孔细胞培养板中,并按1.3章节所述的方法培养。培养24 h后,用PBS在避光条件下洗涤细胞3次。然后,将盖玻片倒置于含有DAPI的载玻片上封片,使用Zeiss公司的Axio Scope.A1荧光显微镜进行观察和拍摄。
1.6 RNA测序和基因表达分析
试验结束后,立即将收集的细胞样品在液氮中预冻2 min,随后在干冰上快速冷冻并送至深圳华大基因股份有限公司进行转录组测序(RNA-seq)。对每个基因的表达水平进行标准化处理后,使用每千碱基转录物的片段数(Fragments per kilobase of transcript per million mapped reads,FPKM)来计算基因表达水平。为了在转录组水平上全面探索作用机制,以|Fold Change|≥1.2和Q值≤0.05为条件,筛选差异表达基因(Differentially expressed genes,DEGs)进行GO生物过程(Biological process,BP)富集分析。
1.7 EGCG和L-theanine及其主要代谢物药理学信息收集
采用Lipinski的五法则来评估所设计化合物的体内吸收潜力[24],包括分子量(MW)<500,氢键供体数量(Hdon)≤5,氢键受体数量(Hacc)≤10,脂水分配系数(LogP)≤5,以及可旋转键数(Rbon)≤10。使用SwissADME网络工具(www.swissadme.ch)评估化合物的药物代谢动力学(Absorption,distribution,metabolism,and excretion,ADME)[25],同时测定拓扑极性表面积(Topological polar surface area,TPSA)、脂水分布系数(LogS)和皮肤渗透率(LogKp)。
1.8 EGCG和L-theanine及其主要代谢物相关靶标的收集
将主要代谢物的化学结构导入SwissTar-
getPrediction(www.swisstargetprediction.ch)和TCMSP(https://old.tcmsp-e.com/tcmsp.php)数据库,以获取各自的作用靶点。
1.9 筛选神经退行性疾病(NDs)靶标
使用GeneCards数据库(www.genecards.
org)[26],以“神经退行性疾病”作为关键词,筛选与NDs相关的疾病靶标。使用Venny 2.1.0软件评估EGCG和L-theanine及其主要代谢物相关靶点与NDs相关靶点的交集,从而定义抗NDs相关靶点。在文中,EGCG组、L-theanine组和EGCG+L-theanine组的抗NDs相关靶点分别标记为EGCG/ND、L-theanine/ND和EGCG+L-theanine/ND。
1.10 蛋白质-蛋白质相互作用(PPI)网络与聚类分析
使用STRING数据库(https://string-db.org)构建PPI网络,选定的生物体为智人(Homo sapiens)。PPI网络由代表目标蛋白的节点和表示蛋白质-蛋白质相互作用的边组成。使用Cytoscape软件(v.3.8.2)确定核心目标,其插件MCODE用于分析网络中的聚类模块[27]。
1.11 转录组学与网络药理学联合分析
使用Draw Venn Diagram在线程序,由网络药理学筛选出的EGCG和L-theanine协同治疗神经退行性疾病的潜在靶点,以及转录组学数据中协同组与模型组相比较的差异表达mRNA基因取交集,此分析帮助识别了两种方法共同支持的关键靶基因,其中弦图和热图分析由微生信(www.bioinformatics.com.cn)在线平台完成。
1.12 数据处理方法
所有数据均以平均值±标准差(Mean±SD)表示,取自3次重复的独立试验。不同组间的统计比较采用单因素方差分析(ANOVA)和多重对比后检验。
2 结果与分析
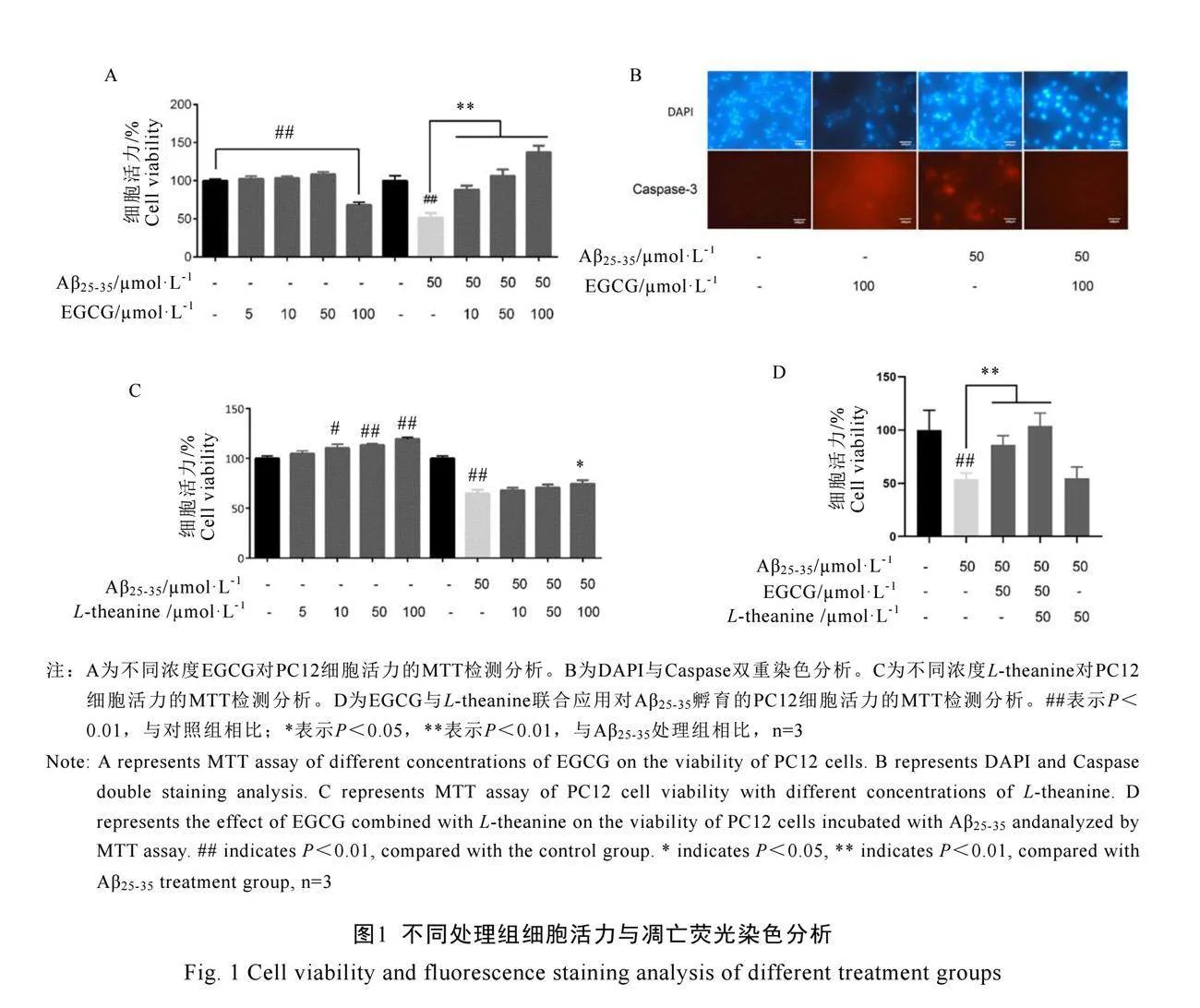
2.1 不同处理组的PC12细胞比较分析
2.1.1 EGCG与Aβ25-35/EGCG处理的PC12细胞比较分析
不同浓度EGCG分别孵育PC12细胞24 h,结果显示在50 µmol·L-1浓度范围内,EGCG对细胞活力影响不显著;而在100 µmol·L-1浓度时,EGCG显著降低细胞活力(图1A)。相比之下,Aβ25-35/EGCG孵育PC12细胞24 h后,与Control组相比,50 µmol·L-1 Aβ25-35细胞活力下降约50%。随着EGCG浓度增加,Aβ25-35/EGCG处理组的细胞活力显著增加,尤其在EGCG浓度为100 µmol·L-1时,细胞活力超过Control组,表明Aβ25-35/EGCG处理组在EGCG高浓度时具有促进细胞生长的作用(图1A)。
细胞凋亡荧光染色结果表明,EGCG单独孵育PC12细胞24 h,与Control组相比,100 µmol·L-1 EGCG处理的细胞核结构不完整,caspase-3染色强烈,表现出促凋亡活性(图1B)。50 µmol·L-1 Aβ25-35处理组的DAPI染色显示细胞异染色质集聚,caspase-3染色增强,细胞核集聚,早期凋亡增加;而50 µmol·L-1 Aβ25-35/100 µmol·L-1 EGCG处理组细胞核增大,caspase-3几乎没有阳性染色,细胞未表现凋亡性,这与100 µmol·L-1 EGCG单独处理的促凋亡作用相反(图1B)。
2.1.2 L-theanine与Aβ25-35/L-theanine处理的PC12细胞比较分析
MTT试验结果表明,不同浓度的L-theanine孵育PC12细胞,L-theanine浓度低于100 µmol·L-1时,细胞活力随其浓度增加而提高(图1C)。PC12细胞用50 µmol·L-1 Aβ25-35孵育处理7 d,再分别采用不同浓度的L-theanine处理后发现,与未加L-theanine相比,加L-theanine浓度低于100 µmol·L-1时对Aβ25-35没有表现显著的保护作用(图1C)。
2.1.3 EGCG与L-theanine的协同作用分析
通过MTT检测可得,模型组显著抑制细胞活力(P<0.05),在添加了EGCG和L-theanine之后,细胞的活力得到了显著提高,其中L-theanine的效果更为显著(图1D)。当同时添加这两种药物时,细胞活力达到了最高水平。因此,我们推测EGCG和L-theanine可能具有协同作用,在同时使用时可以显著提高细胞活力。
2.2 转录组测序结果与差异基因分析
基于图1D的细胞协同试验结果,进行了转录组测序分析。从15个转录组cDNA文库中获得了69 987万个原始读数,过滤后有效读数占比超过91.23%。将这些读数与小鼠基因组进行比对,总比对率超过81.7%,唯一比对率超过76.65%,表明测序质量高,适用于后续分析。韦恩图显示,所有处理组中共有15 760个共表达基因(图2A)。根据|Fold Change|≥1.2和Q值≤0.05筛选差异表达基因(DEGs),与对照组相比,Aβ25-35建模组鉴定出1 344个DEGs(上调588个,下调756个);Aβ25-35/EGCG组鉴定出1 320个DEGs(上调718个,下调602个);Aβ25-35/L-theanine组鉴定出221个DEGs(上调50个,下调171个);Aβ25-35/EGCG+L-theanine组鉴定出1 187个DEGs(上调691个,下调496个)(图2B)。结果表明,与Aβ25-35相比,Aβ25-35/EGCG对细胞转录组的影响最为显著,约是Aβ25-35/L-theanine的6倍。
图2D至2G展示了不同组别差异基因的KEGG富集分析结果,揭示了Aβ25-35处理、EGCG处理、L-theanine处理及其联合处理对细胞的多方面影响。Aβ25-35处理显著干扰了血管发育、染色质重塑、细胞对生长因子反应和细胞迁移等多个关键生物过程,表明Aβ25-35通过影响细胞信号传导、代谢调节、发育和免疫应答,可能导致神经退行性改变和组织损伤(图2D)。EGCG处理显著影响了酶联受体蛋白信号通路、磷酸代谢和胆固醇生物合成等关键通路,通过促进细胞增殖和修复、调节代谢平衡,
提高组织修复能力和抗逆性(图2E)。L-theanine处理调控了染色质重塑、DNA代谢和免疫过程,显著影响了基因表达、细胞周期和低氧反应,表明其在基因调控和免疫增强方面具有重要作用(图2F)。EGCG和L-theanine联合处理扩展了单独处理的作用范围,显著调控了血管发育、胆固醇和次级醇代谢、氧化还原过程等通路,展现出显著的协同效应,可能通过多机制、多途径的联合作用,增强神经保护,改善细胞代谢和修复能力,显示出在神经退行性疾病防治中的潜在应用价值(图2G)。
KEGG分析结果表明,P值越低,通路越显著,富集因子反映了通路中差异基因的数量。与EGCG相比,L-theanine对细胞转录组的影响相对较弱,但联合处理展示了更强的调控能力,为神经保护机制及临床应用研究提供了重要依据。
2.3 EGCG和L-theanine及其主要代谢物的网络药理学分析
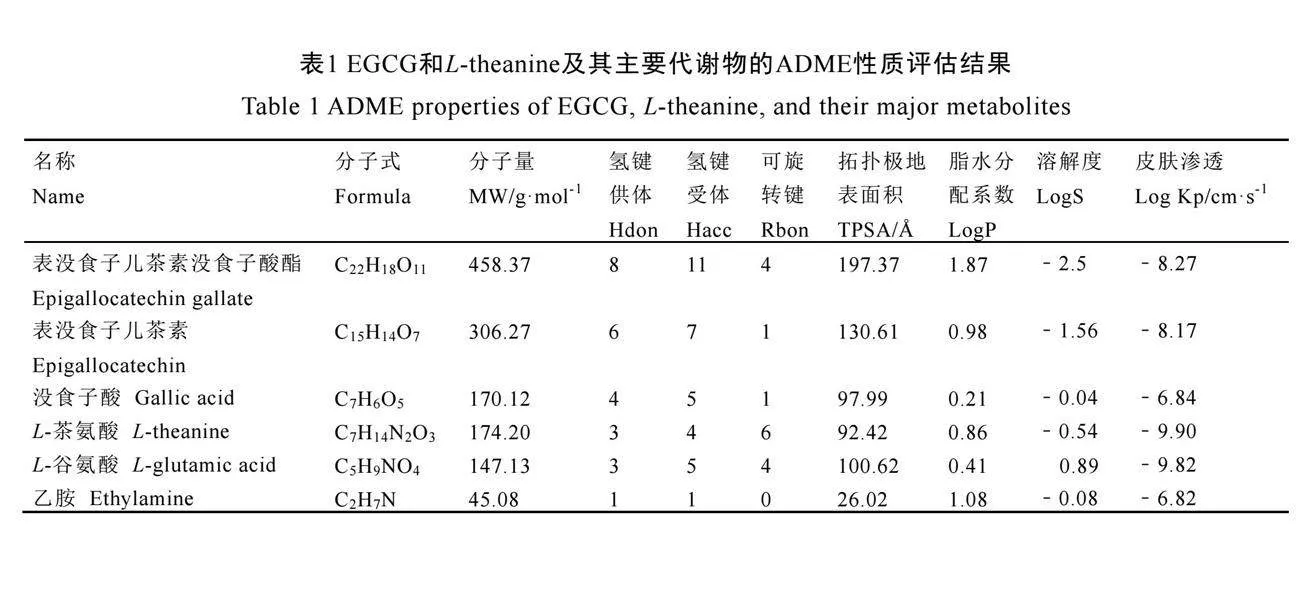
2.3.1 EGCG和L-theanine及其主要代谢物ADME性质
EGCG和L-theanine及其主要代谢物的化学结构从PubChem数据库中获得(图3)。随后,使用在线工具SwissADME对这些代谢产物的吸收、分布、代谢和排泄(ADME)性质进行了深入评估(表1)。分析结果显示,拓扑极地表面积(Topological polar surface area,TPSA)和膜渗透性具有良好的相关性。一般来说,较大的TPSA值可能会导致较低的膜渗
透性。脂溶性是药物化学中小分子的重要参数,脂水分配系数(logP)大于零时化合物亲脂性比较强,反之则表明亲水性较强。溶解度(LogS)则决定了EGCG等物质在肠道中的吸收与口服利用度。表1的数据表明,EGCG和L-theanine的代谢物在跨细胞膜渗透性方面表现良好。这些特性有助于它们在体内的有效吸收和利用,支持其在神经保护中的潜在应用。
2.3.2 EGCG与L-theanine及其主要代谢物抗NDs靶标筛选和PPI分析
通过SwissTargetPrediction数据库对EGCG及其主要代谢物EGC和GA的潜在靶点进行了预测,共获得了176个靶点。对于L-theanine及其主要代谢物谷氨酸和乙胺的潜在靶点进行预测,共获得了170个靶点。EGCG与L-theanine及其主要代谢物的共有潜在靶点320个。同时,从GeneCards数据库中确定了7 341个与NDs相关的靶点。使用维恩图展现EGCG和L-theanine主要代谢物与NDs相关的交集靶点(图4A、图4B与图4E)。
为了探究交集靶点之间的关系,使用STRING数据库进行了蛋白质-蛋白质相互作用(Protein-protein interaction,PPI)分析。EGCG/ND的靶点生成了包含127个节点和
1 010条边的PPI网络,平均节点度值为15.5(图4C)。L-theanine/ND的靶点生成了包含122个节点和602条边的PPI网络,平均节点度值为9.79(图4D)。EGCG+L-theanine/ND靶点生成了229个节点和2 372条边的PPI网络(图4F)。靶点之间连线越多,表示该靶点与其他靶点的关系越密切,度值越大,被确定为核心靶点。核心靶点可能在NDs治疗中发挥重要作
用。EGCG和L-theanine共有潜在靶点之间的连接更为紧密。
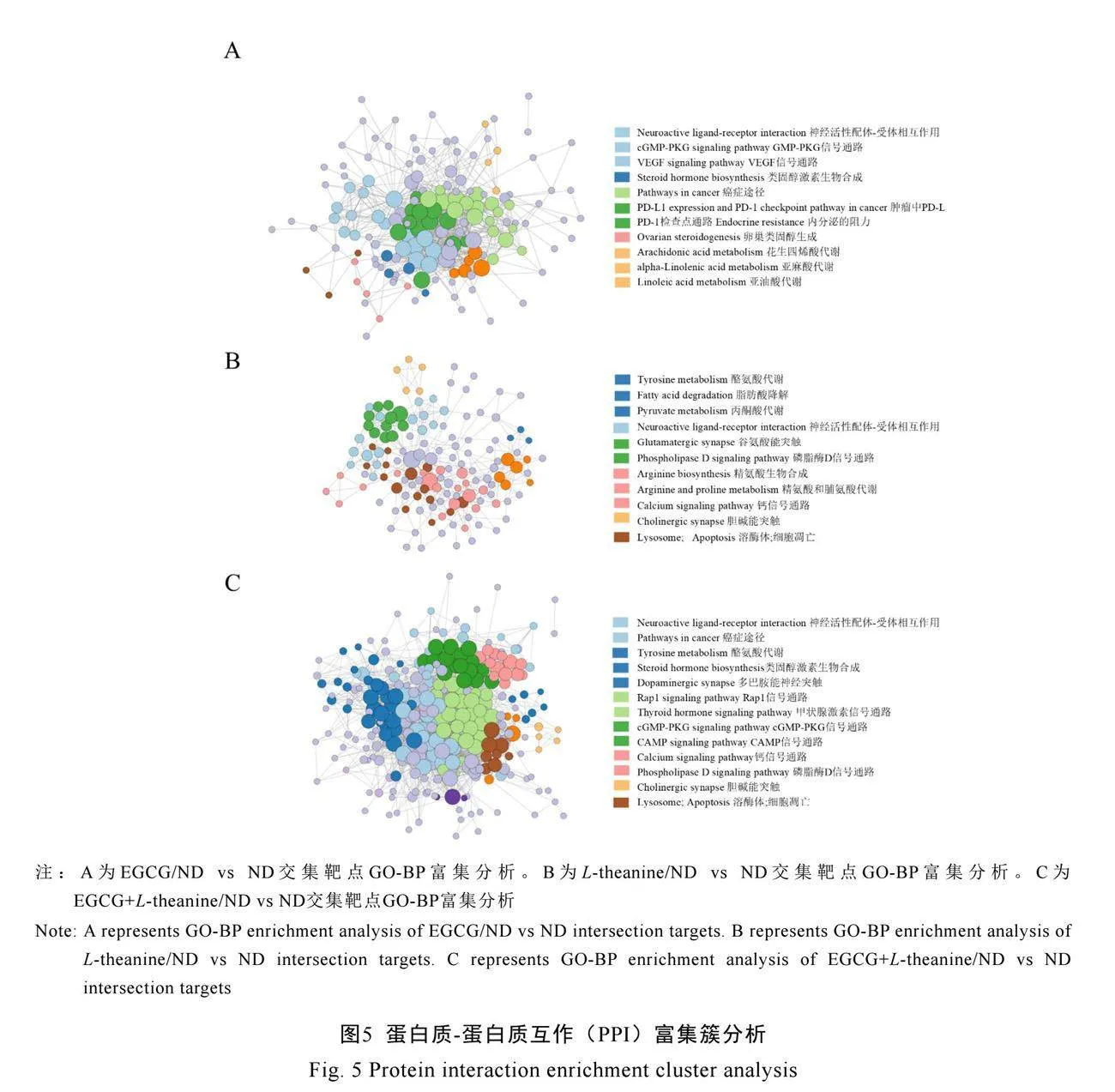
2.3.3 EGCG与L-theanine及其主要代谢物抗NDs的蛋白质互作富集簇分析
蛋白质互作富集簇分析结果表明,EGCG/ND组的交集靶点主要富集在表皮生长因子受体(EGFR)酪氨酸激酶抑制剂、黏附功能、神经配体-受体相互作用和PI3K-Akt信号通路(图5A)。L-theanine/ND组的交集靶点主要富集在松弛素信号通路、精氨酸和脯氨酸代谢、神经活性配体受体相互作用和脂肪酸代谢途径(图5B)。EGCG+L-theanine/ND交集靶点主要富集在上述簇中,其中神经配体-受体相互作用、磷脂酶D信号通路、DNA结合转录因子(Rap1)信号通路、环磷腺苷(cAMP)信号通路、细胞凋亡和溶酶体相关富集DE靶点数量和连接紧密度明显增加(图5C)。
EGCG及其代谢物可能通过调节细胞稳态
并减轻细胞凋亡途径的损伤,从而发挥治疗NDs的作用。L-theanine及其代谢物则具有调节代谢和促进生长的作用,能够产生兴奋性神经递质,作用于中枢神经系统。EGCG与L-theanine协同作用,能够增强EGCG和L-theanine各自的效果。
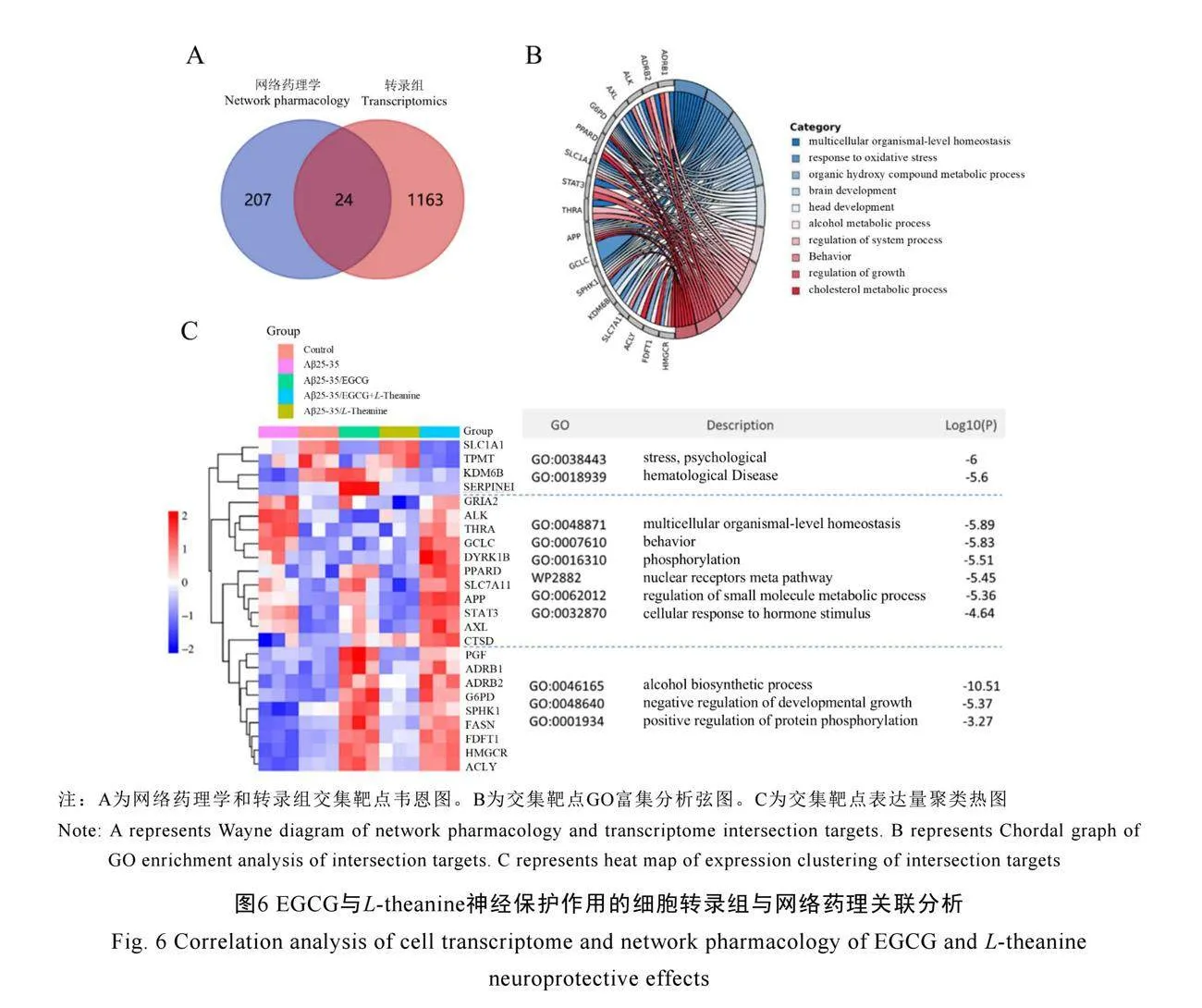
2.4 转录组学和网络药理学联合分析
本研究通过细胞转录组测序和网络药理学方法,对Aβ25-35/EGCG+L-theanine协同处理组的差异基因进行交互分析,识别出24个关键交互靶基因(图6A),这些基因在Aβ25-35处理组与Aβ25-35/EGCG+L-theanine联合处理组之间显示出显著的表达差异。GO分析显示,这些基因主要富集在胆固醇代谢、生长调节、多细胞有机体水平的稳态、氧化应激反应、脑发育和酒精代谢过程等关键生物通路中(图6B、图6C)。
同时,EGCG+L-theanine联合处理上调了AXL、APP、CTSD、GCLC等基因的表达,这些基因主要富集在多细胞有机体稳态、行为调控、磷酸化反应、核受体元途径和小分子代谢调节等生物过程中。AXL和APP是已知的神经保护因子,参与调节神经元的存活和信号传导,
表明EGCG和L-theanine可能通过这些基因促进神经元的修复和功能恢复。GCLC编码谷胱甘肽合成酶,在抗氧化应激反应中起重要作用,其上调可能增强细胞的抗氧化能力,减轻Aβ25-35诱导的氧化损伤。
此外,研究发现,这些基因还富集在酒精生物合成过程、发育生长的负向调节和蛋白质磷酸化的正向调节等通路中,这些过程主要受到EGCG的影响。EGCG通过调控这些通路,维持细胞的静息状态和代谢平衡,减少异常细胞生长和增殖[30]。联合L-theanine的应用,则进一步促进细胞的能量代谢和生长修复,增强了神经保护的效果。表明EGCG和L-theanine在协同减轻细胞应激、维持细胞稳态方面发挥了显著作用[31-32]。这种协同作用为进一步探索EGCG和L-theanine在神经退行性疾病中的治疗机制及其临床应用提供了重要的理论依据。
3 讨论
NDs是老年人的常见疾病,随着人口老龄化的加剧,其患病率迅速上升[33]。迫切需要更有效的治疗策略来遏制NDs的进展,同时深入了解每种治疗策略的原因和机制。网络药理学的进展为阐明某些药物治疗复杂疾病提供了全新的机会[34]。基于前期研究结果[35],本研究分析了EGCG和L-theanine协同抑制神经退行性改变的作用,并通过网络药理与细胞转录组的交集靶点分析,揭示了茶叶中的EGCG与L-theanine联合应用在神经退行性改变中的协同作用。
细胞试验验证了EGCG和L-theanine能有效抑制由Aβ25-35诱导的PC12细胞损伤,且联合应用时表现出明显的协同效应。EGCG主要通过抑制淀粉样蛋白的毒性应激和维持细胞静息状态来发挥作用,而L-theanine则通过抑制DNA损伤和调节谷氨酸代谢来提供神经保护(图1和图2)。这些结果与之前的研究一致[35-38],进一步证实了EGCG和L-theanine在防治NDs中的潜在价值。
细胞试验显示,EGCG和L-theanine联合应用能够显著提高细胞活力。转录组分析表明,协同组上调的基因与胆固醇和脂质代谢相关,这些基因可能作为神经退行性疾病中的治疗靶点。下调基因与蛋白质合成相关(图2)。在NDs中,蛋白质稳态失衡可能导致错误折叠蛋白积累,形成有毒聚集体,导致神经细胞损伤和死亡[39]。因此,通过静息态效应减少蛋白质的合成可能具有脑保护效果。
EGCG和L-theanine联合应用展现了显著的神经保护作用。EGCG在高浓度下(100 µmol·L-1)显示出促凋亡活性,而在与Aβ25-35联合处理时却表现出相反的结果(图1)。这种现象可能是由于EGCG在高浓度下具有双重作用:既可以引发氧化应激导致细胞凋亡,又能在Aβ25-35存在情况下通过抗氧化和抗炎机制缓解细胞毒性,从而对细胞产生保护作用。转录组分析结果进一步支持这一观点,显示EGCG能调控多条与抗氧化应激和脂质代谢相关的信号通路,减轻Aβ25-35的毒性作用,保护细胞免受凋亡(图2)。这进一步强调了EGCG在神经退行性疾病防治中的复杂作用机制,为其临床应用提供了重要理论依据。
L-theanine单独处理未能显著改善Aβ25-35诱导的PC12细胞损伤(图1C和图1D),转录组分析也支持这一点,显示L-theanine处理组的DEGs数量较少,对细胞整体基因表达影响较弱(图2F)。L-theanine主要通过调节染色质重塑、DNA代谢和免疫过程发挥作用,但在抵抗Aβ25-35诱导的急性毒性应激方面作用有限。相比之下,EGCG处理显著影响了氧化应激反应、脂质代谢和细胞凋亡路径(图2E),增强了细胞的抗逆性。当EGCG与L-theanine联合应用时,显著扩展了单独处理的作用范围,调控多个关键生物过程(图2G),增强神经保护效果,提高细胞活力(图1D)。因此,L-theanine单独应用在神经代谢和突触功能调控方面有潜力,但在急性细胞毒性应激抵抗方面作用有限,联合EGCG应用则显著增强了细胞的抗逆性和修复能力,体现出更强的神经保护效果。这一发现为进一步探索EGCG与L-theanine在神经退行性疾病中的协同机制提供了理论依据。
网络药理学分析显示,EGCG在调节细胞网络中起着显著作用,其潜在靶点主要涉及氧化应激、β-淀粉样蛋白的处理以及细胞凋亡路径。L-theanine通过参与神经元的突触信号传递,有助于恢复功能失调的谷氨酸稳态。当EGCG和L-theanine联合应用时,它们在NDs相关的细胞网络中展示了更广泛且温和的调控作用(图4~图5)。这种协同效应可能提高了它们在治疗NDs中的潜在效果,支持了进一步的临床研究与应用。
此外,转录组学和网络药理学的交互分析进一步揭示了EGCG和L-theanine在NDs中的潜在协同机制(图6)。本研究共识别出24个关键交互靶基因,这些基因主要富集在胆固醇代谢、生长调节、细胞稳态、氧化应激反应和脑发育等通路。EGCG通过调节这些通路,维持细胞静息状态,减少异常细胞生长和增殖。联合L-theanine的应用则进一步促进了细胞的能量代谢和生长修复,表明EGCG和L-theanine在减轻细胞应激、维持细胞稳态方面发挥了显著作用。
本研究通过体外Aβ25-35诱导的PC12细胞AD模型和利用人类疾病靶点数据库进行的网络药理分析,发现EGCG与L-theanine协同抑制淀粉样蛋白应激、调节代谢并促进神经细胞轴突功能,通过多途径多靶点抑制神经退行性改变。这项研究首次揭示了EGCG与L-theanine协同作用,通过维护细胞稳态来促进神经细胞修复和再生,为茶叶的神经保护的分子机制提供了基础研究数据。
然而,本研究还存在一定的局限性,后续的研究可以进一步探索如何优化EGCG和L-theanine的联合治疗策略,以提高其疗效和应用范围。另外,需要进一步聚焦EGCG与L-theanine联合应用对神经细胞代谢的具体调节机制,并利用神经退行性改变的动物模型,深入研究EGCG和L-theanine在体内的协同作用机制。
参考文献
[1] Powers E T, Morimoto R I, Dillin A, et al. Biological and chemical approaches to diseases of proteostasis deficiency [J]. Annual Review of Biochemistry, 2009, 78(1): 959-991.
[2] Taylor R C, Dillin A. Aging as an event of proteostasis collapse [J]. Cold Spring Harbor Perspectives in Biology, 2011, 3(5): 328-342. doi: 10.1101/cshperspect.a004440.
[3] Mok K H, Pettersson J, Orrenius S, et al. HAMLET, protein folding, and tumor cell death [J]. Biochemical & Biophysical Research Communications, 2007, 354(1): 1-7.
[4] Chiti F, Dobson C M. Protein misfolding, functional amyloid, and human disease [J]. Annual Review of Biochemistry, 2006, 75(1): 333-366.
[5] Soto C. Alzheimer's and prion disease as disorders of protein conformation: implications for the design of novel therapeutic approaches [J]. Journal of Molecular Medicine, 1999, 77(5): 412-418.
[6] Wallace R A, Dalton A J. What can we learn from study of Alzheimer's disease in patients with down syndrome for early-onset Alzheimer's disease in the general population? [J]. Alzheimer's Reseach &Therapy, 2011, 3(2): 13. doi: 10.1186/alzrt72.
[7] Asaad M, Lee J H. A guide to using functional magnetic resonance imaging to study Alzheimer's disease in animal models [J]. Disease Models and Mechanisms, 2018, 11(5): dmm031724. doi: 10.1242/dmm.031724.
[8] Sheng J G, Zhou X Q, Mrak R E, et al. Progressive neuronal injury associated with amyloid plaque formation in Alzheimer disease [J]. Journal of Neuropathology and Experimental Neurology, 1998(7): 714-717.
[9] Inglis F. The tolerability and safety of cholinesterase inhibitors in the treatment of dementia [J]. International Journal of Clinical Practice Supplement, 2002, 127(127): 45. doi: .1016/S0924-8579(02)00114-0.
[10] Pervin M, Unno K, Takagaki A, et al. Function of green tea catechins in the brain: epigallocatechin gallate and its metabolites [J]. International Journal of Molecular Sciences, 2019, 20(15): 3630. doi: 10.3390/ijms20153630.
[11] Afzal O, Dalhat M H, Altamimi A S A, et al. Green tea catechins attenuate neurodegenerative diseases and cognitive deficits [J]. Molecules, 2022, 27(21): 7604. doi: 10.3390/molecules27217604.
[12] Youn K, Ho C T, Jun M. Multifaceted neuroprotective effects of (-)-epigallocatechin-3-gallate (EGCG) in Alzheimer's disease: an overview of pre-clinical studies focused onβ-amyloid peptide [J]. Food Science and Human Wellness, 2022, 11(3): 11. doi:10.1016/j.fshw.2021.12.006.
[13] Miren E, Amanda C, Patricia R M, et al. Epigallocatechin-3-gallate (EGCG) improves cognitive deficits aggravated by an obesogenic diet through modulation of unfolded protein response in APPswe/PS1dE9 mice [J]. Molecular Neurobiology, 2020, 57(4): 1814-1827.
[14] Walker J M, Klakotskaia D, Ajit D, et al. Beneficial effects of dietary EGCG and voluntary exercise on behavior in an Alzheimer's disease mouse model [J]. Journal of Alzheimers Disease, 2015, 44(2): 561-572.
[15] Unno K, Pervin M, Nakagawa A, et al. Blood-brain barrier permeability of green tea catechin metabolites and their neuritogenic activity in human neuroblastoma SH-SY5Y cells [J]. Molecular Nutrition & Food Research, 2017, 61(12): 1700294. doi:10.1002/mnfr.201700294.
[16] Pervin M, Unno K, Nakagawa A, et al. Blood brain barrier permeability of (-)-epigallocatechin gallate, its proliferation-enhancing activity of human neuroblastoma SH-SY5Y cells, and its preventive effect on age-related cognitive dysfunction in mice [J]. Biochemistry and Biophysics Reports, 2017, 9: 180-186.
[17] Du A Z, Rong D, Cyrollah L, et al. Epigallocatechin-3-gallate, an active ingredient of traditional Chinese medicines, inhibits the 3CLpro activity of SARS-CoV-2 [J]. International Journal of Biological Macromolecules, 2021, 176(1): 1-12.
[18] Wu Z, Yu W, Ni W, et al. Improvement of obesity by Liupao tea is through the IRS-1/PI3K/AKT/GLUT4 signaling pathway according to network pharmacology and experimental verification [J]. Phytomedicine, 2023, 110: 154633. doi:10.1016/j.phymed.2022.154633
[19] Gong Z, Liu Q, Lin L, et al. L-Theanine prevents ETEC-induced liver damage by reducing intrinsic apoptotic response and inhibiting ERK1/2 and JNK1/2 signaling pathways [J]. European Journal of Pharmacology, 2017, 818: 184-190.
[20] Tsai, Wen H, Chung H, et al. L-Theanine inhibits proinflammatory PKC/ERK/ICAM-1/IL-33 signaling, apoptosis, and autophagy formation in substance P-Induced hyperactive bladder in rats [J]. Neurourology and Urodynamics, 2017, 36(2): 297-307.
[21] Unno T, Suzuki Y, Kakuda T, et al. Metabolism of theanine, gamma-glutamylethylamide, in rats [J]. Journal of Agricultural and Food Chemistry, 1999, 47(4): 1593-1596.
[22] Nedergaard M, Takano T, Hansen A J. Beyond the role of glutamate as a neurotransmitter [J]. Nature Reviews Neuroscience, 2002, 3(9): 748-755.
[23] Ben P, Zhang Z, Zhu Y, et al. L-Theanine attenuates cadmium-induced neurotoxicity through the inhibition of oxidative damage and tau hyperphosphorylation [J]. NeuroToxicology, 2016, 57: 95-103.
[24] Lipinski C A, Lombardo F, Dominy B W, et al. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings [J]. Advanced Drug Delivery Reviews, 2001, 46(1/2/3): 3-26.
[25] Daina A, Michielin O, Zoete V. SwissADME: a free web tool to evaluate pharmacokinetics, drug-likeness and medicinal chemistry friendliness of small molecules [J]. Scientific Reports. 2017, 7: 42717. doi: 10.1038/srep42717.
[26] Wang Y X, Zhang S, Li F C, et al. Therapeutic target database 2020: enriched resource for facilitating research and early development of targeted therapeutics [J]. Nucleic Acids Research, 2020, 48(D1): 1031-1041.
[27] Bader G D, Hogue C W V. An automated method for finding molecular complexes in large protein interaction networks [J]. BMC Bioinformatics, 2003, 4: 2. doi: 10.1186/1471-2105-4-2.
[28] Zhou Y, Zhou B, Pache L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets [J]. Nature Communications, 2019, 10(1): 1523. doi: 10.1038/s41467-019-09234-6.
[29] Papassotiropoulos A, Gerhards C, Heck A, et al. Human genome-guided identification of memory-modulating drugs [J]. Proceedings of the National Academy of Sciences, 2013, 110(46): 4369-4374.
[30] Gonçalves P B, Sodero A C R, Cordeiro Y. Green tea epigallocatechin-3-gallate (EGCG) targeting protein misfolding in drug discovery for neurodegenerative diseases [J]. Biomolecules, 2021, 11(5): 767. doi: 10.3390/biom11050767.
[31] 刘宝贵, 陈致印, 张杨玲, 等. L-茶氨酸与表没食子儿茶素没食子酸酯预防肥胖及高胆固醇血症的协同调节作用[J]. 食品工业科技, 2022, 43(3): 341-350.
Liu B G, Chen Z Y, Zhang Y L,et al. Synergistic moderating effects of L-theanine and EGCG for the prevention of obesity and Hypercholesterolemia [J]. Science and Technology of Food Industry, 2022, 43(3): 341-350.
[32] 彭影琦, 袁冬寅, 林玲, 等. 表没食子儿茶素没食子酸酯对L-茶氨酸调节小鼠血清及肠道游离氨基酸的影响[J]. 食品科学, 2020, 41(19): 154-160.
Peng Y Q, Yuan D Y, Lin L, et al. Influence of epigallocatechin gallate on the regulation effect of L-theanine on eerum and intestinal free amino acids in mice [J]. Food Science, 2020, 41(19): 154-160.
[33] Bianchi V E, Herrera P F, Laura R. Effect of nutrition on neurodegenerative diseases. A systematic review [J]. Nutr Neurosci, 2021, 24(10): 810-834.
[34] Zhang W, Bai Y, Wang Y, et al. Polypharmacology in drug discovery: a review from systems pharmacology perspective [J]. Current Pharmaceutical Design, 2016, 22(21): 3171-3181.
[35] Xie X, Wan J, Zheng X, et al. Synergistic effects of epigallocatechin gallate and L-theanine in nerve repair and regeneration by anti-amyloid damage, promoting metabolism, and nourishing nerve cells [J]. Frontiers in Nutrition, 2022, 9: 951415. doi: 10.3389/fnut.2022.951415.
[36] Mandel S, Amit T, Reznichenko L, et al. Green tea catechins as brain-permeable, natural iron chelators-antioxidants for the treatment of neurodegenerative disorders [J]. Molecular Nutrition & Food Research, 2006, 50(2): 229-234.
[37] Unno K, Yamada H, Iguchi K, et al. Anti-stress effect of green tea with lowered caffeine on humans: a pilot study [J]. Biological & Pharmaceutical Bulletin, 2017, 40(6): 902. doi: 10.1248/bpb.b17-00141.
[38] Kim T I, Lee Y K, Park S G, et al. L-Theanine, an amino acid in green tea, attenuates beta-amyloid-induced cognitive dysfunction and neurotoxicity: reduction in oxidative damage and inactivation of ERK/p38 kinase and NF-kappaB pathways [J]. Free Radical Biology and Medicine, 2009, 47(11): 1601-1610.
[39] Morley J E, Armbrecht H J, Farr S A, et al. The senescence accelerated mouse (SAMP8) as a model for oxidative stress and Alzheimer's disease [J]. Biochim Biophys Acta, 2012, 1822(5): 650-656.
