PD-L1和CD8在HER2阳性乳腺癌患者中的表达及其与病理参数相关性分析
2024-11-07赵甜甜段超赵序雯满其荣王祥阁
[摘要]目的通过评估程序性死亡受体配体1(programmedcelldeath-ligand1,PD-L1)和分化群8(clusterofdifferentiation8,CD8)在肿瘤微环境中的表达情况及其与患者临床病理特征的相关性,明确PD-L1和CD8在判断人表皮生长因子受体2(humanepidermalgrowthfactorreceptor2,HER2)阳性乳腺癌患者预后方面的作用。方法选取2016年10月至2018年10月山东省滕州市中心人民医院收治的HER2阳性乳腺癌患者65例,所有患者均为女性。癌组织切片经免疫组织化学方法标记PD-L1和CD8;收集患者的临床病理资料,包括年龄、组织学分级、P53、KI-67、雌激素受体、孕激索受体、肿瘤淋巴结转移分类(tumornodemetastasisclassification,TNM)分期在内的7项与预后相关的临床病理参数。分别分析PD-L1和CD8的表达是否和上述临床病理参数相关。结果PD-L1阳性表达率为21.5%,PD-L1阳性表达与组织学分级和TNM分期相关,差异有统计学意义(χ²=6.250,P=0.044;χ²=13.730,P=0.001);CD8阳性表达率为21.5%,CD8表达与组织学分级和TNM分期相关,差异有统计学意义(χ²=8.023,P=0.018;χ²=6.117,P=0.047)。结论PD-L1和CD8表达与乳腺癌组织学分级和TNM分期相关,可能是HER2阳性乳腺癌患者重要的预后标志物。
[关键词]程序性死亡受体配体1;分化群8;人表皮生长因子受体2;乳腺癌;预后
[中图分类号]R737.9;R730.7[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.29.011
ExpressionofPD-L1andCD8inHER2positivebreastcanceranditsclinicopathologicalsignificance
ZHAOTiantian1,DUANChao1,ZHAOXuwen1,MANQirong2,WANGXiangge1
1.PathologyDepartment,TengzhouCentralPeople’sHospital,Tengzhou277500,Shandong,China;2.OncologyDepartment,TengzhouCentralPeople’sHospital,Tengzhou277500,Shandong,China
[Abstract]ObjectiveTodeterminetheroleofprogrammedcelldeath-ligand1(PD-L1)andclusterofdifferentiation8(CD8)injudgingtheprognosisofhumanepidermalgrowthfactorreceptor2(HER2)positivebreastcancerpatients,throughevaluatingtheexpressionofPD-L1andCD8inthetumormicroenvironment,andtheircorrelationwithclinicopathologicaldata.MethodsAtotalof65HER2positivebreastcancerpatientswerecollectedadmittedtoTengzhouCentralPeople’sHospitalinShandongProvincefromOctober2016toOctober2018,allofwhomwerewomen.TheparaffinslicesofcancertissuewerelabeledwithPD-L1andCD8usingimmunohistochemicalmethods.Collectclinicopathologicaldataofpatients,including7prognosticparameters,suchasage,histologicalgrade,P53,KI-67,estrogenreceptor,progesteronereceptorandtumornodemetastasisclassification(TNM)staging.StatisticalanalysiswasconductedtodeterminewhethertheexpressionofPD-L1andCD8werecorrelatedwiththeaboveclinicopathologicaldata.ResultsPD-L1positiveratewas21.5%,thepositiveexpressionofPD-L1wascorrelatedwithhistologicalgradingandTNMstaging,andthedifferenceinresultswasstatisticallysignificant(χ²=6.250,P=0.044;χ²=13.730,P=0.001);CD8positiveratewas32.3%,theexpressionofCD8cellswascorrelatedwithhistologicalgradingandTNMstaging,andthedifferenceinresultswasstatisticallysignificant(χ²=8.023,P=0.018;χ²=6.117,P=0.047).ConclusionPD-L1andCD8expressionarecorrelatedwithbreastcancerhistologicalgradeandTNMstage.PD-L1andCD8expressionmaybeimportantprognosticmarkersforHER2positivebreastcancerpatients.
[Keywords]Programmedcelldeath-ligand1;Clusterofdifferentiation8;Humanepidermalgrowthfactorreceptor2;Breastcancer;Prognosis
人表皮生长因子受体2(humanepidermalgrowthfactorreceptor2,HER2)阳性乳腺癌占乳腺癌患者总数的15%~20%,且HER2阳性肿瘤恶性程度高,侵袭性强,患者预后差。临床研究已证实HER2阳性乳腺癌的发生、发展与机体的免疫状态密切相关[1]。在免疫系统中,T细胞通过识别外来和内在抗原,协调有效的免疫反应。T细胞可识别肿瘤相关抗原,分化群8(clusterofdifferentiation8,CD8)表达阳性的T细胞又称细胞毒性T细胞,具有杀伤靶细胞的功能,在T细胞介导的免疫应答过程中发挥重要作用。有关程序性死亡受体(programmedcelldeath,PD)-1和程序性死亡受体配体1(programmedcelldeath-ligand1,PD-L1)研究是免疫治疗领域的热点,在生理状态下PD-1/PD-L1通路的激活可发挥负性免疫调节作用,维持机体的免疫耐受。在肿瘤微环境中,PD-L1可表达于肿瘤细胞和免疫细胞表面,PD-1在肿瘤浸润CD8阳性T表面表达[2]。PD-L1与PD-1相结合可导致大量CD8阳性T细胞耗竭,导致免疫系统无法有效清除肿瘤发生肿瘤免疫逃逸[3]。乳腺癌组织中PD-L1阳性表达与肿瘤临床分期、组织学分级、雌激素受体(estrogenreceptor,ER)/孕激索受体(progesteronereceptor,PR)阴性、HER2阳性等预后不良的指标相关[4-5]。在三阴型乳腺癌患者中,PD-L1和CD8的表达与患者肿瘤的临床分期、组织学分级、生存预后密切相关[6]。本研究通过评估PD-L1和CD8在肿瘤微环境中的表达情况,分析其与患者临床病理参数间的相关性,以明确PD-L1和CD8在判断HER2阳性乳腺癌患者预后方面的作用。
1对象与方法
1.1研究对象
选取2016年10月至2018年10月山东省滕州市中心人民医院收治的HER2阳性乳腺癌患者65例,所有患者均为女性,年龄32~69岁。入选标准:①患者肿瘤标本石蜡组织学切片经免疫组织化学方法检测HER2结果为(+++)或经荧光原位杂交方法检测HER2扩增状态为阳性;②患者术后常规病理结果为乳腺非特殊型浸润性癌;③女性原发单侧乳腺癌;④患者临床病理资料完整,同时有明确的肿瘤临床分期。排除标准:①术前曾接受过放化疗;②伴有严重的全身性疾病;③就诊时已发生癌转移。本研究经山东省滕州市中心人民医院伦理委员会批准(伦理审批号:2024-伦理审查-35)。
1.2试剂与仪器
全自动免疫组化染色机(美国罗氏公司);一抗CD8(兔抗人单克隆抗体,迈新生物技术有限公司)、一抗PD-L1(兔抗人单克隆抗体,瑞士罗氏公司);OptiViewDAB二抗系统(美国Ventana公司);BenchMark全自动染色平台(美国罗氏公司)。
1.3方法
1.3.1免疫组织化学染色肿瘤标本采用10%中性缓冲甲醛溶液固定24h,经脱水、透明、包埋等程序,将肿瘤标本蜡块做连续切片,切片厚度4μm米,裱贴在防脱载玻片上,然后将玻片置于60℃烤箱30min。将烤好的玻片放置于全自动免疫组化染色机上机染色,染色程序结束后,脱水透明封片,光学显微镜下观察CD8、PD-L1的表达情况。
1.3.2PD-L1阳性结果判定首先计算任意强度的部分或完全膜染色的肿瘤细胞数目与肿瘤区域内任何强度染色的免疫细胞数目之和,然后计算与肿瘤细胞总数的比值,>1%即可判定为阳性。肿瘤区域包含肿瘤细胞、肿瘤内间质及肿瘤周围连续性间质,不包含坏死区域[4]。
1.3.3CD8阳性结果判定CD8阳性棕褐色染色颗粒主要定位于细胞膜表面,在上述肿瘤区域内随机选取5个高倍视野(×400),明确观察到阳性淋巴细胞即为阳性。
1.4统计学方法
采用Graphpad6.0统计学软件对数据进行处理分析,计数资料用例数(百分率)[n(%)]表示,组间比较采用χ²检验。P<0.05为差异有统计学意义。
2结果
2.1PD-L1表达与HER2阳性乳腺癌病理参数的关系
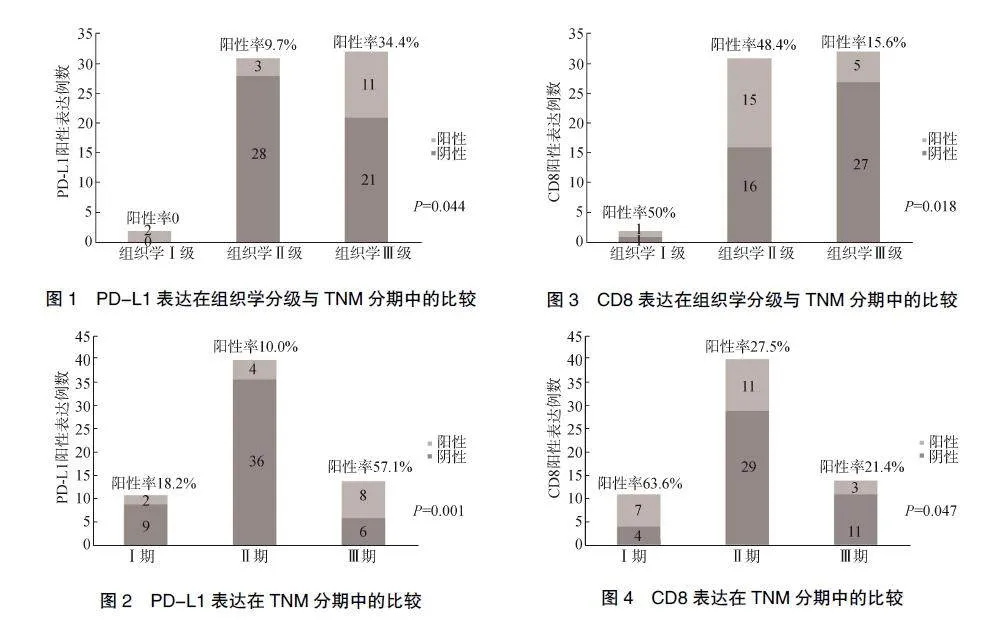
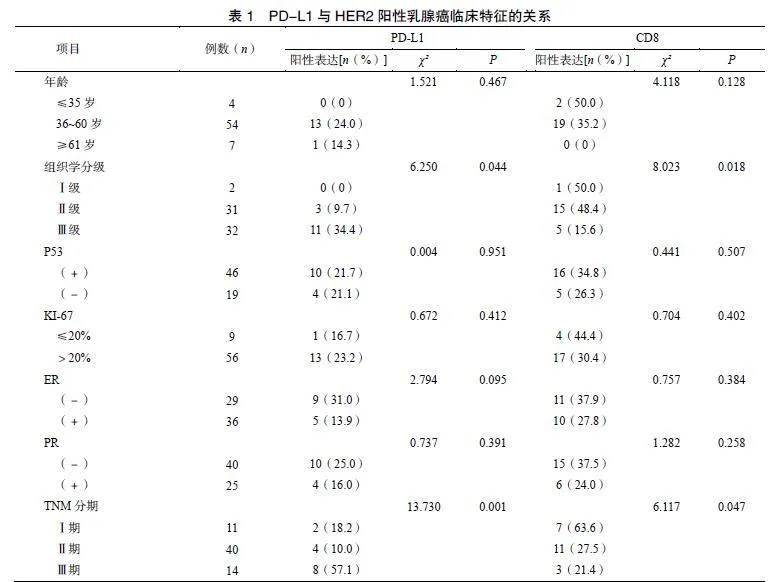
65例HER2阳性乳腺癌患者中有14例患者PD-L1表达呈阳性,阳性表达率为21.5%。组织学分级Ⅲ级病例中的PD-L1阳性表达率明显高于Ⅰ级和Ⅱ级(P=0.044),见图1。TNM分期Ⅲ期病例中的PD-L1阳性表达率明显高于Ⅰ期和Ⅱ期(P=0.001),见图2。PD-L1阳性表达与组织学分级和TNM分期相关,差异有统计学意义。
2.2CD8表达与HER2阳性乳腺癌临床参数的关系
65例HER2阳性乳腺癌患者中,21例患者CD8表达呈阳性,阳性表达率32.3%。组织学分级Ⅲ级病例中的CD8阳性表达率明显低于Ⅰ级和Ⅱ级(P=0.018),见图3。TNM分期Ⅲ期病例中的CD8阳性表达率明显低于Ⅰ期和Ⅱ期(P=0.047),见图4。CD8阳性表达与组织学分级和TNM分期相关,差异有统计学意义,见表1。
3讨论
中国女性乳腺癌发病率(51.17/10万)仅低于肺癌(58.18/10万)[7]。依据分子分型,乳腺癌分为4种类型:LuminalA、LuminalB、三阴性和HER2阳性。LuminalA型和LuminalB型乳腺癌预后较好;HER2阳性乳腺癌易复发或转移,预后较差;三阴性乳腺癌转移速度快,癌细胞扩散范围广,预后最差。乳腺癌中三阴性乳腺癌免疫原性最强,其次是HER2阳性乳腺癌[8-10]。
本研究选取65例HER2阳性乳腺癌患者,PD-L1阳性表达率为21.5%。本研究组织学分级Ⅲ级病例中的PD-L1阳性表达率明显高于Ⅰ级和Ⅱ级;TNM分期Ⅲ期病例中的PD-L1阳性表达率明显高于Ⅰ期和Ⅱ期,由此推断PD-L1阳性表达与HER2阳性乳腺癌患者预后差有相关性。Mondal等[11]对50例乳腺浸润性导管癌患者的研究表明PD-L1阳性表达与肿瘤细胞分化差、ER表达阴性、HER2表达阳性、Ki-67高表达相关。Soliman等[12]用流式细胞学方法检测6种乳腺癌细胞系中PD-L1表达,结果显示PD-L1在基底样癌亚型细胞系中表达最高,且预后最差。
肿瘤微环境中浸润的淋巴细胞多被认为是一种局部免疫反应的组织学表现,间接反映宿主的免疫状态和对肿瘤的抗御能力。乳腺癌中肿瘤浸润淋巴细胞(tumor-infiltrationlymphocyte,TILs)以相互对抗的两方面力量为主,一方面是以抗肿瘤作用为主的CD4+Th1细胞、CD8阳性T细胞、NK细胞、M1巨噬细胞等,另一方面则是促进肿瘤生长的FOXP3+T细胞、CD4+Th2细胞、M2巨噬细胞等[13]。Denkert等[14]对三阴性乳腺癌患者接受新辅助化疗前、后病理切片中的TILs含量比较发现TILs百分比高的患者总生存期更长。一项Meta分析研究结果表明,TILs中的CD8阳性亚群与患者无疾病生存期延长呈正相关[15]。研究者对乳腺癌中分离出的6311个T细胞进行单细胞测序后发现乳腺癌TILs中含有大量的CD8阳性细胞,且在早期三阴性乳腺癌患者中,CD8阳性细胞含量越高预示患者生存越好[16]。本研究组织学分级Ⅲ级病例中的CD8阳性表达率明显低于Ⅰ级和Ⅱ级;TNM分期Ⅲ期病例中的CD8阳性表达率明显低于Ⅰ期和Ⅱ期,由此推测CD8阳性T细胞是TILs抗肿瘤作用的重要细胞,且表达率越高,HER2阳性乳腺癌患者预后越好。
也有研究结果与上述研究结果不一致。Huang等[17]的Meta分析纳入47项研究,结果显示表达于肿瘤细胞表面的PD-L1与高危临床病理参数相关,患者预后不良,而当TILs表面表达大量PD-L1时,这种类型的患者常预后较好。Schalper等[18]发现在乳腺癌患者的组织中PD-1和PD-L1的mRNA表达量较正常组织都明显增加,PD-L1mRNA高表达患者预后较好,复发转移发生率较低。Bae等[19]研究发现PD-L1蛋白在乳腺癌中表达与更好的无病生存期和总生存期相关,但不是独立预后指标。
综上所述,本研究证实PD-L1阳性表达与HER2阳性乳腺癌患者预后差相关,CD8阳性表达则与患者预后好相关。本研究结果虽有一定意义,但样本量较小。后续研究应增大样本量,进一步证实本研究结果。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] YULY,TANGJ,ZHANGCM,etal.Newimmunotherapystrategiesinbreastcancer[J].IntJEnvironResPublicHealth,2017,14(1):68–86.
[2] FLIESDB,SANDLERBJ,SZNOLM,etal.BlockadeoftheB7-H1/PD-1pathwayforcancerimmunotherapy[J].YaleJBiolMed,2011,84(4):409–421.
[3] IWAIY,ISHIDAM,TANAKAY,etal.InvolvementofPD-L1ontumorcellsintheescapefromhostimmunesystemandtumorimmunotherapybyPD-L1blockade[J].ProcNatlAcadSciUSA,2002,99(19):12293–12297.
[4] 李丽煌.乳腺癌组织PD-1、PD-L1表达变化及其与患者临床病理参数、预后的关系探究[J].中外医疗,2020,39(23):39–41.
[5] MUENSTS,SCHAERLIAR,GAOF,etal.Expressionofprogrammeddeathligand1(PD-L1)isassociatedwithpoorprognosisinhumanbreastcancer[J].BreastCancerResTreat,2014,146(1):15–24.
[6] 钟恋君,王进京,郑洪.三阴型乳腺癌间质肿瘤浸润淋巴细胞CD4、CD8、Foxp3和PD-L1表达的临床病理意义[J].临床与实验病理学杂志,2022,38(3):278–283.
[7] 国家病理质控中心中华医学会病理学分会.实体肿瘤PD-L1免疫组织化学检测专家共识(2021版)[J].中华病理学杂志,2021,50(7):710–718
[8] SHIJ,LIUF,SONGY.Progresstargetedtherapyimmunotherapyandnewchemotherapystrategiesinadvancedtriple-negativebreastcancer[J].CancerManagRes,2020,30(12):9375–9387.
xTrouK4WZjoytxlGOlBWAy88D8IbWDmJmWqNp6YDRpE=[9] ONKARSS,CARLETONNM,LUCASPC,etal.Thegreatimmuneescape:Understandingthedivergentimmuneresponseinbreastcancersubtypes[J].CancerDiscov,2023,13(1):23–40.
[10] ZHOUT,XUD,TANGB,etal.Expressionofprogrammeddeathligand-1andprogrammeddeath-1insamplesofinvasiveductalcarcinomaofthebreastanditscorrelationwithprognosis[J].AnticancerDrugs,2018,29(9):904–910.
[11] MONDALSK,BHATTACHARYAS,SARKARAP,etal.Expressionofprogrammeddeathligand-1(PD-L1)andtumorinfiltratinglymphocytes(TILs)inbreastcarcinomaandtheirclinicalsignificance[J].JCancerResTher,2023,19(Supplement):81–86.
[12] SOLIMANH,KHALILF,ANTONIAS.PD-L1expressionisincreasedinasubsetofbasaltypebreastcancercells[J].PLoSOne,2014,9(2):e88557.
[13] EMENSLA.Breastcancerimmunobiologydrivingimmunotherapy:vaccinesandimmunecheckpointblockade[J].ExpertRevAnticancerTher,2012,12(12):1597–1611.
[14] DENKERTC,MINCKWITZG,DARB-ESFAHANIS,etal.Tumour-infiltratinglymphocytesandprognosisindifferentsubtypesofbreastcancer:apooledanalysisof3771patientstreatedwithneoadjuvanttherapy[J].LancetOncol,2018,19(1):40–50.
[15] MAOY,QUQ,CHENX,etal.Theprognosticvalueoftumor-infiltratinglymphocytesinbreastcancer:AsystematicreviewandMeta-analysis[J].PLoSOne,2016,11(4):e0152500.
[16] SAVASP,VIRASSAMYB,YEC,etal.Single-cellprofilingofbreastcancerTcellsrevealsatissue-residentmemorysubsetassociatedwithimprovedprognosis[J].NatMed,2018,24(7):986–993.
[17] HUANGW,RANR, SHAOB,etal.PrognosticandclinicopathologicalvalueofPD-L1expressioninprimarybreastcancer:AMeta-analysis[J].BreastCancerResTreat,2019,178(1):17–33.
[18] SCHALPERKA,VELCHETIV,CARVAJALD,etal.InsitutumorPD-L1mRNAexpressionisassociatedwithincreasedTILsandbetteroutcomeinbreastcarcinomas[J].ClinCancerRes,2014,20(10):2773–2782.
[19] BAESB,CHOHD,OHMH,etal.Expressionofprogrammeddeathreceptorligand1withhightumor-infiltratinglymphocytesisassociatedwithbetterprognosisinbreastcancer[J].JBreastCancer,2016,19(3):242–251.
(收稿日期:2024–07–03)
(修回日期:2024–10–05)
