免疫检查点抑制剂相关性肺炎CT表现与临床特点分析
2024-11-07李颖王晓妃陆圣威董丹妮张景峰郑建军
[摘要]目的探讨免疫检查点抑制剂相关性肺炎(checkpointinhibitor-relatedpneumonitis,CIP)的CT表现及临床特点。方法回顾性分析宁波市第二医院34例CIP患者的胸部CT图像及临床资料,总结CIP的胸部CT表现及临床特点,按肿瘤发生部位分为肺癌组22例,其他恶性肿瘤组12例,比较两组患者的CT表现差异。结果CIP临床症状以咳嗽(70.59%)及呼吸困难(52.94%)多见,肺癌组CIP发生时间114.5(41.50,281.50)d比其他恶性肿瘤组144(55.75,226.25)d更早,时间跨度更大。嗜酸性粒细胞计数仅在其他恶性肿瘤组中有明显升高(P=0.009)。激素治疗后18例患者好转,8例稳定,8例进展或死亡。CT征象以磨玻璃影(70.59%)及实变影(76.47%)多见,影像学模式以机化性肺炎(47.6%)为主,与原发肿瘤类型无关,部分可出现结节样肉芽肿性反应。与肺癌组比较,其他恶性肿瘤组更易表现为对称性浸润(58.33%)分布。结论CIP患者的临床症状无特异性,相对于其他原发恶性肿瘤患者,肺癌患者更易发生CIP且治疗后难缓解,易发展为重症。
[关键词]免疫检查点抑制剂;肺炎;CT表现
[中图分类号]R563[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.29.009
CTfindingsandclinicalfeaturesofcheckpointinhibitor-relatedpneumonitis
LIYing,WANGXiaofei,LUShengwei,DONGDanni,ZHANGJingfeng,ZHENGJianjun
DepartmentofRadiology,NingboNo.2Hospital,Ningbo315000,Zhejiang,China
[Abstract]ObjectiveToexploretheCTmanifestationsandclinicalfeaturesofcheckpointinhibitor-relatedpneumonitis(CIP).MethodsChestCTimagesandclinicaldataof34patientswithCIPinNingboNo.2Hospitaelwerecollectedtoretrospectivelyanalysis.Accordingtothesiteoftumoroccurrence,22patientsweredividedintolungcancergroupand12patientsinothermalignanttumorgroup,andthedifferencesinCTmanifestationsbetweentwogroupswerecompared.ResultsCough(70.59%)anddyspnea(52.94%)werethecommonclinicalsymptoms.CIPoccurredearlierandoveragreatertimespaninlungcancergroup114.5(41.50,281.50)dthaninothermaligmenttumorgroup144(55.75,226.25)d.Eosinophilcountwassignificantlyhigheronlyinothermaligmenttumorgroup(P=0.009).Afterhormonaltherapy18patientsimproved,8werestableand8progressedorevendied.CTsignswereprevalentingroundglassshadow(70.59%)andsolidshadow(76.47%),andtheimagingpatternwasdominatedbyorganicpneumoniapattern(47.6%),whichwasnotrelatedtotypeofprimarytumor,andsomeofthemcouldshownodulargranulomatousreaction.Comparedtolungcancergroup,theothermaligmenttumorgroupwasmorelikelytoexhibitsymmetricalinfiltration(58.33%)distribution.ConclusionTheclinicalfeaturesofCIParenonspecific,comparedwithotherpatientswithprimarymalignancies,lungcancerpatientsaremorelikelytodevelopCIP,whichisdifficulttorelieveaftertreatment,andareeasytodevelopseveredisease.
[Keywords]Immunecheckpointinhibitors;pneumonia;CTmanifestations
免疫检查点抑制剂(immunecheckpointinhibitors,ICIs)可针对特定分子,如细胞毒性T淋巴细胞抗原-4(cytotoxicTlymphocyte-associatedantigen-4,CTLA-4)、程序性细胞死亡蛋白(programmedcelldeath,PD)-1或程序性细胞死亡配体1(programmedcelldeathligand,PD-L)-1,阻断抑制T细胞介导的肿瘤破坏的信号通路,逆转免疫逃逸,促进肿瘤细胞死亡[1]。但免疫系统过度激活可对正常组织进行攻击而引起各种免疫相关不良反应[2],其中免疫检查点抑制剂相关性肺炎(checkpointinhibitor-relatedpneumonitis,CIP)发病率及死亡率较高[3]。部分患者需要暂停免疫治疗,使用类固醇激素冲击治疗CIP。胸部CT具有无创性和可重复性,对CIP的诊断、评估起着重要作用。肺癌是发生CIP风险最高的原发肿瘤类型,受肺部肿瘤负荷影响,肺癌患者的CIP特征不同于其他恶性肿瘤患者[4-6]。本研究回顾性分析宁波市第二医院收治的34例CIP患者相关资料,总结其胸部CT表现及临床特点,旨在为CIP早期诊断和临床治疗方案的调整提供依据。
1对象与方法
1.1研究对象
选择2022年1月至12月于宁波市第二医院经ICIs治疗恶性肿瘤并确诊的CIP患者34例作为回顾性分析对象。按肿瘤发生部位分为肺癌组22例,其他恶性肿瘤组12例。纳入标准:①符合中国及美国Fleischner学会提出的CIP诊断标准[7-8];②CT或胸片新发现浸润影,排除其他已知原因引起的肺炎(如肺部感染、肺部肿瘤进展、其他原因引起的肺间质性疾病、肺血管炎、肺栓塞及肺水肿等);③有完整的随诊临床资料及治疗前和随访的胸部CT资料。排除标准:①合并其他已知原因引起的肺部病变;②无后续随访资料或复查的胸部CT资料;③放疗或化疗后出现的肺炎。本研究经宁波市第二医院伦理委员会批准(伦理审批号NBEY-2023-064)。
1.2设备与仪器
采用96排双源双探测器CT(德国西门子公司)进行检查。扫描时嘱患者全身放松,于深吸气末屏气,以胸廓入口处至双膈面水平为扫描范围。扫描参数:管电压100~130kV,自动管电流,螺距1.2,球管旋转时间2.88s,准直0.6mm×192mm,扫描层厚5mm,图像重建层厚1mm。
1.3资料搜集
临床资料包括患者的性别、年龄、吸烟史、临床表现(咳嗽、胸痛、呼吸困难、热型)、原发肿瘤类型、ICIs种类(CIP出现前)、其他治疗方式、相关实验室检查、CIP发病时间及随访预后。生存时间计算从首次使用ICIs起至任何原因死亡,截止日期为2022年12月31日。CT特征分析由1名低年资(5年)和1名高年资(10年)影像学医师独立进行评估,回顾性分析层厚为1mm的肺部CT图像,记录新发病灶情况。评估意见不一致时由第3名高年资医师(18年)审核确定。CT影像学特征:①肺部基础病变:肺气肿、间质性疾病及细支气管炎;②CT征象:磨玻璃、实变影、反晕征、支气管扩张、结节影及网状影;③CIP影像模式:机化性肺炎(organizingpneumonia,OP)、非特异性间质性肺炎(nonspecificinterstitialpneumonia,NSIP)、过敏性肺炎(hypersensitivitypneumonitis,HP)、弥漫性肺泡损伤(diffusealveolardamage,DAD)、细支气管炎等[1,6];④累及肺叶数目、病灶分布及伴随征象。所有患者在ICIs开始前(基线)和CIP发生后均进行胸部CT检查评估。评估新发肺部病灶范围及分布,不包括阻塞性肺炎及阻塞性肺不张。
1.4统计学方法
采用SPSS26.0统计学软件对数据进行处理分析,符合正态分布的计量资料以均数±标准差()表示,两组间比较采用t检验,不符合正态分布的数据以中位数(四分位间距)[M(Q1,Q3)]表示,两组间比较采用Mann-WhitneyU检验。计数资料以例数(百分率)[n(%))]表示,采用Fisher精确检验分析相关性。P<0.05为差异有统计学意义。
2结果
2.1两组患者的临床特征及随访预后比较
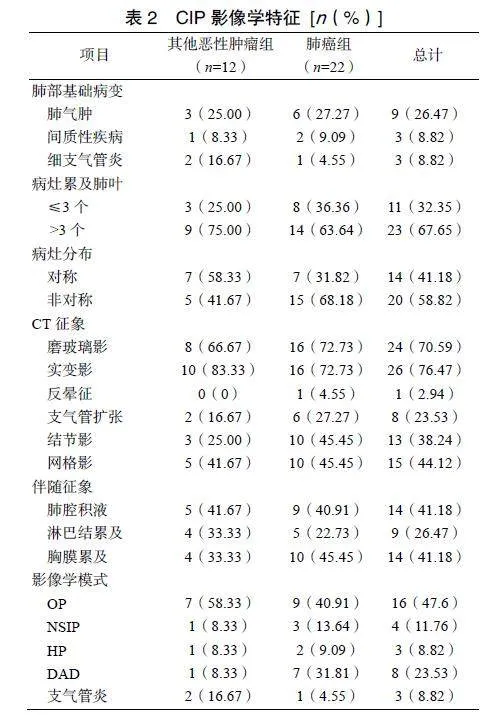
34例CIP患者中原发肿瘤为肺癌22例(肺鳞癌8例、肺腺癌10例、肺淋巴上皮癌2例、小细胞肺癌2例)和其他恶性肿瘤类型12例(肝癌3例、食管癌1例、胃肠道肿瘤5例、胸腺肉瘤1例、淋巴瘤1例、肾癌1例)。ICIs为PD-1或PDL-1。患者初诊临床特征及随访预后见表1。与肺癌组比较,其他恶性肿瘤组患者的嗜酸性粒细胞计数显著升高(P=0.009),其余指标比较,两组患者差异无统计学意义(P>0.05)。
2.2CIP影像学特征
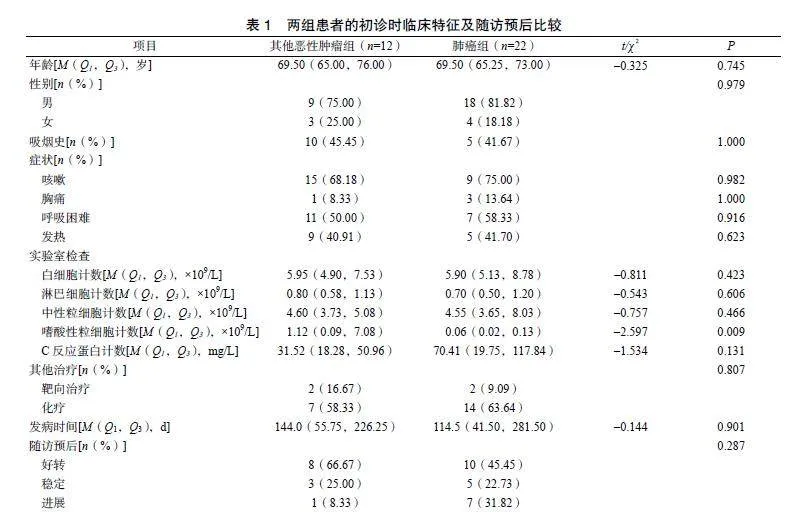
两组患者的CT特征比较,差异无统计学意义(P>0.05)。基线CT检查结果显示合并肺气肿9例、间质性疾病3例及细支气管炎3例,且肺癌组患者更常见。23例患者病灶浸润范围超过3个肺叶;在其他恶性肿瘤组中病灶更易呈对称性分布。CT征象以磨玻璃影(70.59%)及实变影(76.47%)为主,大部分实变病灶周围可见斑片状模糊影;15例患者病灶周围可见少许网格影,多位于胸膜下;13例患者病灶出现炎性结节影,表现为两肺散在小斑片影,包括小叶中心结节;8例患者病灶出现牵拉性支气管扩张;仅1例患者表现为典型反晕征,病灶呈中心密度减低的磨玻璃影伴周边新月形或环状实变。14例患者出现胸腔积液,另有1例患者合并心包积液;9例患者出现纵隔或肺门淋巴结肿大;14例患者的病灶引起胸膜增厚、粘连。影像学模式包括OP16例、NSIP4例、HP3例、DAD8例及支气管炎3例。上述CT特征在肺癌组及其他恶性肿瘤组患者中比较差异无统计学意义(P>0.05),见表2。
3讨论
CIP患者临床症状常表现为呼吸困难、咳嗽、发热、胸痛和运动耐量进行性下降等。本组病例以咳嗽最常见(70.59%),可作为肺部病变的首发症状。近半数患者3个月内发生CIP,最迟于ICIs治疗后691d发生,时间跨度大,对接受ICIs治疗的肿瘤患者进行长时间纵向随访是有意义的[9]。CIP临床症状无特异性,临床应密切关注接受ICIs的患者新发或加重呼吸道症状,如咳嗽等。
CIP患者CT征象以磨玻璃影及实变影最常见,轻症患者在早期难以发现,而CIP发展较迅速,发现肺部CT征象时,病灶浸润已较明显。本研究中仅1例患者CT征象表现典型“反晕征”。既往研究报道CIP影像学模式以OP最多见,其次为NSIP和HP[10],本研究病例以OP(47.6%)为主,其次是DAD(23.53%)。
多数CIP患者予以激素治疗后明显好转,仅少数患者预后不良。在本研究随访过程中,有5例患者在肺炎治疗过程中病情恶化死亡,死因为重症肺炎并呼吸衰竭(n=4)和进展性癌症(n=1),其中OP(n=3)及DAD(n=1)均引起3级及以上的重症肺炎。研究表明,CIP患者为OP时可能需要药物控制以外的治疗措施[9],且CIP患者为DAD时提示高死亡率[9,11],因此临床需要高度重视CIP患者的影像模式,必要时永久停用ICIs并尽早开始全身大剂量激素冲击治疗,可联合无创/有创机械通气等支持疗法。
除肺炎表现外,结节样肉芽肿性反应(包括胸膜下结节性模糊影、肺门和/或纵隔淋巴结肿大)及胸腔积液也与ICIs治疗有关[12]。本研究中近50%患者出现该反应。接受ICIs治疗的患者一旦胸部CT出现新的浸润影,临床应警惕CIP的可能,并重视CIP影像学模式,及时调整治疗方案。
本研究中,与其他恶性肿瘤组患者比较,肺癌组患者CIP更多见(64.7%),这与既往研究结果一致[4]。此外,肺癌患者CIP发生的中位时间更短,这与Nishino等[10]研究结果相符,可能与肺癌患者的肺部基础病变(肺气肿、间质性疾病、细支气管炎)有关[13]。肺部原发肿瘤本身加重肺部负荷,也可能导致CIP更容易、更早出现。
嗜酸性粒细胞计数仅在其他恶性肿瘤组患者中明显升高,这与Li等[14]研究结果一致。重症、治疗后未缓解患者的嗜酸性粒细胞百分比下降,而缓解患者的嗜酸性粒细胞百分比升高。超过一半病例的病灶累及>3个肺叶,且肺癌组病灶多为不对称分布,其他恶性肿瘤组多为对称性;CT征象、伴随征象及影像学模式上,两组比较差异无统计学意义。肺癌组患者预后更差,5例死亡患者中4例为肺癌组患者,定期复查包括胸部CT及实验室检查,有助于原发灶的评估、CIP的发现及预后的改善。
综上所述,CIP在ICIs治疗后各个时段均可出现,且以3个月内为主,CT表现特征以磨玻璃影及实变影多见,影像学模式以OP多见。相对于其他原发恶性肿瘤患者,肺癌患者更易发生CIP且治疗后难缓解,易发展为重症,且影像模式以DAD为主。一旦怀疑CIP发生,临床应尽早使用类固醇激素进行冲击治疗。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] KALISZK R,RAMAIYANH,LAUKAMPKR,etal.Immunecheckpointinhibitortherapy–relatedpneumonitis:Patternsandmanagement[J].RadioGraphics,2019,39(7):1923–1937.
[2] 呼甜.免疫检查点抑制剂相关肺炎影像学特点及进展[J].实用放射学杂志,2022,38(10):1712–1715.
[3] ZHAOB,ZHAOH,ZHAOJ.Fataladverseeventsassociatedwithprogrammedcelldeathprotein1orprogrammedcelldeath-ligand1monotherapyincancer[J].TherapeutAdvMedOncol,2020,12(1):1–14.
[4] 崔少华,葛晓晓,李向阳.免疫相关不良事件在肺癌中发生和结局的真实世界研究[J].中国肺癌杂志,2023,26(4):257–264.
[5] 杜永浩,张丹丹.肺癌免疫检查点抑制剂相关性肺炎的临床特征及CT征象分析[J].实用放射学杂志,2022,38(10):1590–1593.
[6] TOMOMIW,NISHIMOTOY,KAWATAY,etal.Clinicalandradiologicalfeaturesofimmunecheckpointinhibitor-relatedpneumonitisinlungcancerandnon-lungcancers[J].BrJRadiol,2020,93(1115):20200409.
[7] JOHKOHT,LEEKS,NISHINOM,etal.ChestCTdiagnosisandclinicalmanagementofdrug-relatedpneumonitisinpatientsreceivingmoleculartargetingagentsandimmunecheckpointinhibitors:Apositionpaperfromthefleischnersociety[J].Radiology,2021,298(3):550–566.
[8] 中华医学会呼吸病学分会肺癌学组.免疫检查点抑制剂相关肺炎诊治专家共识[J].中华结核和呼吸杂志,2019,42(11):820–825.
[9] NAIDOOJ,WANGX,WOO KM,etal.Pneumonitisinpatientstreatedwithanti–programmeddeath-1/programmeddeathligand1therapy[J].JClinOncol,2017,35(7):709–717.
[10] NISHINOM,RAMAIYANH,AWADMM,etal.PD-1inhibitor-relatedpneumonitisinadvancedcancerpatients:Radiographicpatternsandclinicalcourse[J].ClinCancerRes2016,22(24):6051–6060.
[11] SHIBAKIR,MURAKAMIS,MATSUMOTOY,etal.Associationofimmune-relatedpneumonitiswiththepresenceofpreexistinginterstitiallungdiseaseinpatientswithnon-smalllungcancerreceivinganti-programmedcelldeath1antibody[J].CancerImmunolImmunoth,2020,69(1):15–22.
[12] SCHNEIDERBJ,NAIDOOJ,SANTOMASSOBD,etal.Managementofimmune-relatedadverseeventsinpatientstreatedwithimmunecheckpointinhibitortherapy:Ascoguidelineupdate[J].JClinOncol,2021,39(36):4073–4126.
[13] ATCHLEYWT,ALVAREZC,SAXENA-BEEMS,etal.Immunecheckpointinhibitor-relatedpneumonitisinlungcancer[J].Chest,2021,160(2):731–742.
[14] LIY,JIAX,DUY,etal.Eosinophilasabiomarkerfordiagnosis,prediction,andprognosisevaluationofseverecheckpointinhibitorpneumonitis[J].FrontOncol,2022,12:827199.
(收稿日期:2024–05–12)
(修回日期:2024–08–30)
