含碱氧化铝吸附分离丙二醇中的乙二醇
2024-11-05黄振华艾硕玉万国黄承都











摘 要:乙二醇是生物质基1,2-丙二醇的主要杂质。通过浸渍法将质量分数为20%的NaOH溶液分散于介孔Al2O3中,真空干燥后制得吸附剂,通过吸附方法分离、纯化含质量分数为10%乙二醇的1,2-丙二醇。发现碱性位点对乙二醇有优先吸附的特性,且多孔Al2O3负载的NaOH具有较高的吸附容量。在负载过程中,Al2O3的比表面积大幅下降,且因NaOH沉积而形成新的介孔。CO2-TPD测试结果表明:氧化铝载体的碱量远低于其负载的NaOH的碱量,因此,24.7NaOH-Al2O3对乙二醇的强吸附能力应归因于NaOH而非氧化铝载体。在NaOH负载质量分数为24.7%、吸附剂质量分数为20%、吸附温度为20 ℃、吸附时间为4 min的较优条件下,1,2-丙二醇的质量分数从90%提高到92%,乙二醇吸附量高达69.2 mg/g。乙二醇移除率约为丙二醇损失率的10倍,表现出较高的分离选择性。Gaussian 03分子模拟软件的计算结果表明:乙二醇的羟基氢原子带有明显的正电性,而1,2-丙二醇的羟基氢原子显示负电性或电中性,故只有乙二醇的羟基有显著的Lewis酸性,这种独特的酸-碱相互作用是分离选择性的根本原因。
关键词:吸附;1,2-丙二醇;乙二醇;氢氧化钠(NaOH);氧化铝载体
中图分类号:TQ028.15 DOI:10.16375/j.cnki.cn45-1395/t.2024.04.017
0 引言
1,2-丙二醇是生产涂料和不饱和聚酯树脂的重要原料,且广泛用于食品、医药、烟草和化妆品工业。传统工艺主要通过催化丙烯氧化生成环氧丙烷,再将环氧丙烷水合制备1,2-丙二醇[1]。近几十年煤制丙二醇技术在我国占据了一定的市场份额[2]。为减少不可再生资源的消耗量和二氧化碳的排放量,生物质基丙二醇合成工艺迅速发展,该技术主要以甘油、木糖醇、纤维素等廉价的可再生资源为原料,通过催化加氢反应合成1,2-丙二醇,具有很大的发展潜力。然而,在生物质催化加氢生产丙二醇的过程中会产生副产物乙二醇。例如,He等[3-6]通过甘油氢解生成主产物1,2-丙二醇,但同时会得到副产物乙二醇。此外,Sun等[7-8pItco9stDc27XjAjaJ2/paRhtEGzX1dkRQxh59/dWDE=]通过木糖醇的氢解反应合成1,2-丙二醇,反应选择性为32%,同时乙二醇的反应选择性低于32%。Liu等[9]通过纤维素加氢制得1,2-丙二醇、乙二醇,二者的选择性分别为31%和17%。可见,乙二醇是生物质加氢制备丙二醇产品中常见的主要杂质。目前用于分离生物质基二元醇混合物的方法主要有减压精馏[10]、萃取精馏[10]、共沸精馏[11]、反应精馏[12]等。由于乙二醇与1,2-丙二醇沸点接近,导致精馏分离过程的能耗很高,且精馏塔的理论板数很大、固定投资高。虽然Dhale等[12-13]分别采用反应-精馏、选择性的酸催化反应来分离二元醇混合物,但这些方法都不适用于富丙二醇体系,因为丙二醇的反应活性比乙二醇更强,所以在反应中首先被除去的是丙二醇而非乙二醇。因此,需研发更为高效节能的新型分离技术才能实现生物质基丙二醇的工业化生产。
NaOH是一种常见的廉价碱,其含有的OH−可提供孤对电子及负电荷,可与二元醇的羟基发生酸-碱相互作用,且碱性位点与分子结构不同的二元醇的相互作用强度或有所不同。然而,NaOH晶体表面积极小,需要加以分散才能充分发挥作用。因此,本研究采用方便、经济的等体积浸渍法将NaOH分散到多孔载体上,并使用碱性吸附剂处理二元醇混合物,以期实现乙二醇与丙二醇的高效、快速、低成本分离。本研究可为与碱-二元醇相互作用及生物质基化学品的品质提升相关的研究提供理论基础。
1 材料与方法
1.1 实验材料和仪器
1.1.1 试剂与材料
实验所用试剂及材料如表1所示。
1.1.2 主要仪器
实验所用仪器与设备如表2所示。
1.2 负载NaOH
以等体积浸渍方式将质量分数为20%的NaOH水溶液分别与8种载体(活性炭、二氧化钛、氧化镁、镁铝水滑石、氧化铝、MCC、脱脂棉、甘蔗渣,各1 g)混合,置于120 ℃减压烘箱中真空干燥24 h,密封保存。其中,镁铝水滑石依据文献介绍的方法合成[14]。为考察NaOH负载量对吸附的影响,将质量分数为10%~35%的NaOH水溶液与Al2O3混合,类似地制备了一系列吸附剂,记为xNaOH-Al2O3,x为NaOH负载量(质量分数),例如,24.7NaOH-Al2O3代表该吸附剂的NaOH负载量为24.7%。
1.3 吸附剂表征
用物理吸附仪测试Al2O3及NaOH-Al2O3吸附剂的比表面积及孔径分布,吸附质为氮气。用化学吸附仪(CO2-TPD)测试氧化铝载体的碱量及位点的碱性强弱,探针分子为CO2,吸附温度为100 ℃。
1.4 静态吸附实验
1.4.1 载体的选择
分别取5 g原料(含质量分数为10%乙二醇的1,2-丙二醇)与1.00 g不同载体的吸附剂混合,在20 ℃、300 r/min的条件下静态吸附4 min,取样,用孔径为0.45 μm的有机滤器过滤样品,用气相色谱分析滤液的组成,平行测定3次,取其平均值,并计算误差。通过式(1)—式(3)计算乙二醇的吸附量Q(mg/g)、乙二醇去除率[ηE](%)、丙二醇损失率[SP](%)。
[Q=(ρ1−ρ2)×mLmA], (1)
[ηE=(mE1−mE2)mE1×100%], (2)
[SP=(mP1−mP2)mP1×100%], (3)
式中:[ρ1]和[ρ2]分别为吸附前和吸附后的乙二醇质量浓度(g/mL);[mL]为液相质量(g);[mA]为吸附剂质量(g);[mE1]为原料中乙二醇质量(g);[mE2]为吸附后液相中的乙二醇质量(g);[mP1]为原料中丙二醇质量(g);[mP2]为吸附后液相中的丙二醇质量(g)。
1.4.2 氢氧化钠负载量的优化实验
取5 g原料(含质量分数为10%乙二醇的1,2-丙二醇)与1.00 g 24.7NaOH-Al2O3吸附剂混合,在20 ℃、300 r/min的条件下静态吸附4 min,取样,用孔径为0.45 μm的有机滤器过滤样品,用气相色谱分析滤液组成,平行测定3次,取其平均值,并计算误差。通过式(1)计算吸附剂对乙二醇的吸附量。
1.4.3 吸附温度的优化实验
取5 g原料(含质量分数为10%乙二醇的1,2-丙二醇)与1.00 g 24.7NaOH-Al2O3吸附剂混合,分别在20、40、60、80、100 ℃的条件下实施静态吸附实验,各组均在300 r/min的速率下搅拌。4 min后取样,用孔径为0.45 μm的有机滤器过滤样品,用气相色谱分析滤液组成,平行测定3次,取其平均值,并估计误差。使用旋转黏度计测量20、60 ℃下二元醇原料的动力黏度。
1.4.4 吸附剂用量的优化实验
将5 g原料(含质量分数为10%乙二醇的1,2-丙二醇)与0.25、0.50、0.75、1.00、1.25 g 24.7NaOH-Al2O3吸附剂分别混合,在300 r/min、20 ℃的条件下实施静态吸附实验,4 min后取样,用孔径为0.45 μm的有机滤器过滤样品,用气相色谱分析滤液组成。
1.4.5 吸附时间的优化实验
取5 g原料(含质量分数为10%乙二醇的1,2-丙二醇)与1.25 g 24.7NaOH-Al2O3吸附剂混合,在20 ℃、300 r/min的条件下实施静态吸附实验,于4、6、8、12、16、18、20 min后取样,并用孔径为0.45 μm的有机滤器过滤样品,用气相色谱仪分析滤液组成,平行测定3次,取其平均值,并估计误差。
1.5 蒸馏实验
将5 g原料(含质量分数为10%乙二醇的1,2-丙二醇)加入烧瓶,置于130 ℃油浴中加热,并使用循环水式真空泵将物系减压至15.199 kPa(绝对压力),通过减压蒸馏分离二元醇混合物。将二元醇蒸气引入冷凝器,收集凝液。由于间歇精馏的沸点逐渐升高,需相应地升高油浴温度,直至140 ℃。当凝液中1,2-丙二醇的质量分数达到92%时,停止加热。当液相不沸腾时,停止真空泵,使用气相色谱仪分析馏出物的组成,计算产品得率(馏出物质量占原料质量的百分比)。
1.6 模拟计算
采用Gaussian 03分子模拟软件计算乙二醇、1,2-丙二醇能量最低的稳定分子结构,输出CHK文件;接着使用Gaussian View 5.0软件处理该类型的文件,以便将乙二醇、1,2-丙二醇的电子云密度数值可视化,即绘制电子云分布示意图。通过比较图中相关基团的电子云密度,分析此2种分子所含羟基的Lewis酸碱性的差异及吸附分离选择性的成因。
1.7 吸附剂的再生
取5 g原料(含质量分数为10%乙二醇的1,2-丙二醇)与1.25 g 24.7NaOH-Al2O3吸附剂混合,在300 r/min、20 ℃的条件下实施静态吸附实验,4 min后,在8 000 r/min下离心8 min,取样,用气相色谱仪分析滤液的组成,平行测定3次,取其平均值,并估计误差。滤液称重,加上吸附剂内部残液(1 g,由重复使用实验之滤液重量推算),计算产品得率(滤液及残液总质量占原料质量的比例,单位为%)。倒出全部液体,加入等体积水,用质量分数为1%的硫酸滴定,测定NaOH的流失量。然后,补加5 g原料,重复上述吸附、离心、检测过程,吸附剂共重复使用4次,测定产品组成并计算吸附量。另外,取5 g原料(含质量分数为10%乙二醇的1,2-丙二醇)与1.25 g 新鲜的24.7NaOH-Al2O3吸附剂混合,在上述吸附、离心、检测过程后,将废吸附剂放入160 ℃烘箱,真空干燥12 h。然后,加入5 g原料,在同上条件下测试重复使用性能。
2 结果与讨论
2.1 载体对分离效果的影响
将NaOH分散于8种载体之后,其对1,2-丙二醇中乙二醇的吸附量如图1所示,在4 min内,各吸附剂对乙二醇的吸附量差别很大。其中,分散于Al2O3和镁铝水滑石的NaOH表现出优异的吸附能力。基于Al2O3的低成本及稳定性,本文均采用Al2O3负载NaOH。氧化铝载体本身对乙二醇的吸附能力极弱,而在负载质量分数为14.1%的NaOH后,吸附量显著提高,如图2所示。此外,为了探索吸附过程中的表面活性物种的类型,制备了负载质量分数为14.1%的NaCl的NaCl-Al2O3材料,并使用此吸附剂在相同条件下处理二元醇混合物。结果发现,NaCl-Al2O3对乙二醇没有选择性吸附效果,这表明只有吸附剂表面的OH−才能结合乙二醇分子,而Na+、Al2O3与乙二醇分子之间基本没有相互作用。
2.2 NaOH负载量对分离效果的影响
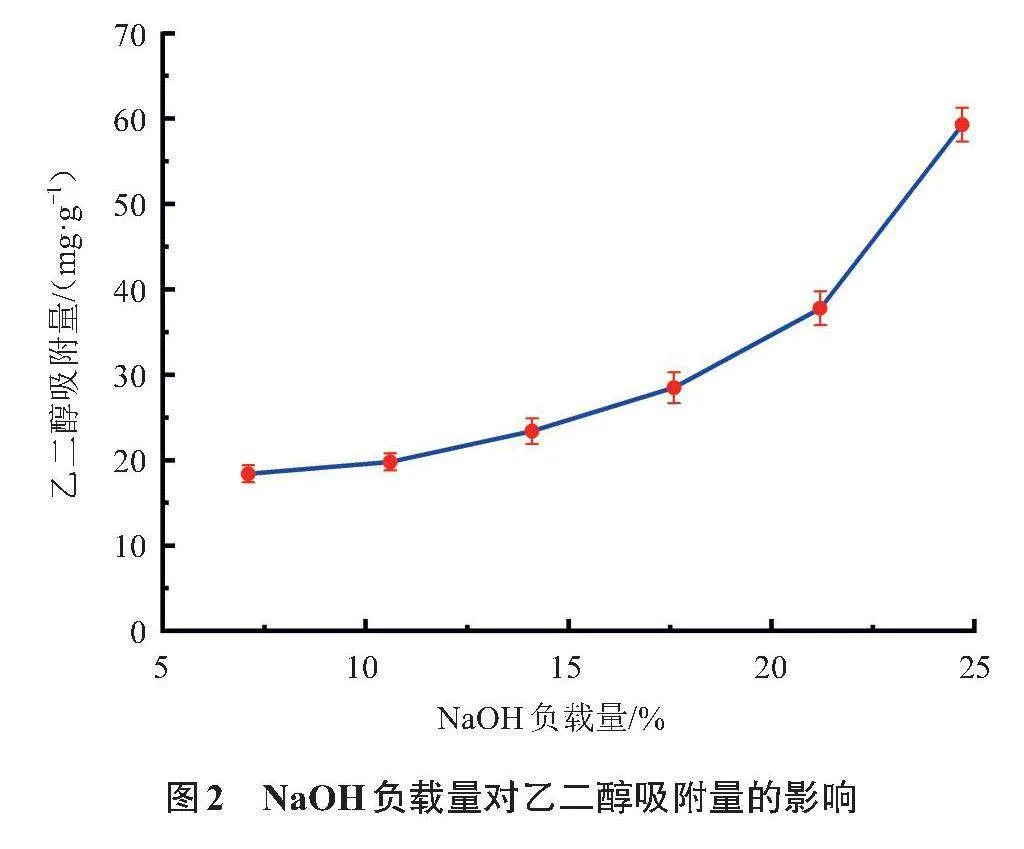
NaOH负载量对乙二醇吸附量的影响如图2所示,随着NaOH负载量的提高,乙二醇吸附量上升,这进一步证实了NaOH在吸附过程中所起到的关键作用。在负载量为24.7%的条件下,吸附量达到59.3 mg/g的较高水平。然而,受浸渍步骤中NaOH在水中溶解度的限制,负载量不能进一步提高。因此,本文采用24.7NaOH-Al2O3作为吸附材料。
2.3 吸附温度对分离效果的影响
不同温度下,24.7NaOH-Al2O3吸附剂对乙二醇的吸附量和NaOH流失率的影响如图3所示,随着吸附温度升高,吸附量增加,说明升温促进了NaOH与乙二醇之间的相互作用。过滤去除吸附剂后,对滤液进行酸碱滴定,以测定流失到滤液中的碱量。结果表明:温度升高时,NaOH的流失显著加快,这与升温降低了二元醇黏度、增大了局部流速、提高了NaOH溶解度有关。测量发现,室温下二元醇原料的动力黏度为22.8 mPa·s,60 ℃下降为4.7 mPa·s。黏度降低虽减少了流动阻力及流体输送的动力损耗,但大量NaOH流失会导致更为严重的后果,如二元醇被污染,吸附剂不耐久。因此,本文采用20 ℃作为操作条件。需要指出的是,虽然流失的NaOH会暂时污染产品,但由于NaOH不挥发,易于通过减压蒸发将其与富含丙二醇的二元醇产品分离。
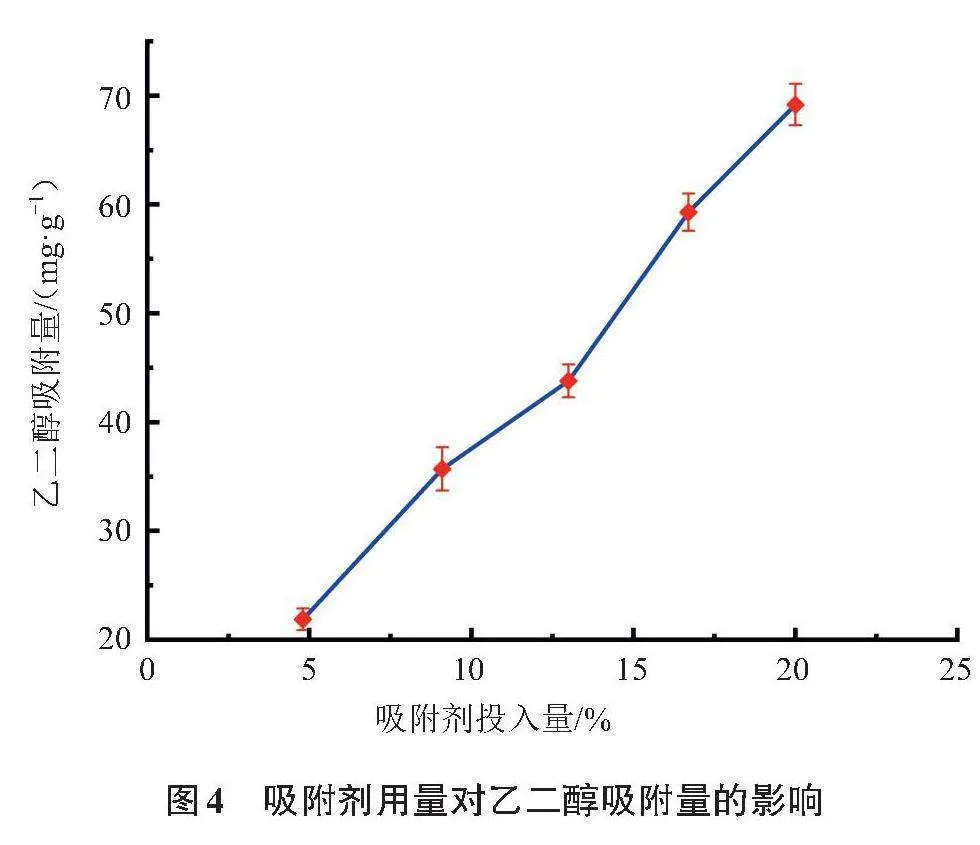
2.4 吸附剂用量对分离效果的影响
吸附剂用量对乙二醇吸附量的影响如图4所示,随着吸附剂用量的增加,乙二醇吸附量显著增加,分离效果得到改善。当吸附剂质量分数增至总体系的20%时,乙二醇吸附量达到69.2 mg/g的较高水平。若进一步增加吸附剂用量,仍可继续小幅提高吸附量,但由于此时固体含量太高,搅拌及固液分离操作困难,且吸附剂成本增加,故宜选择20%作为较优的吸附剂用量。
2.5 吸附时间对吸附分离效果的影响
经24.7NaOH-Al2O3吸附剂不同时间处理后,吸附时间对乙二醇的吸附量和NaOH流失率的影响如图5所示,随着吸附时间的延长,吸附量变化不大,这反映了乙二醇与NaOH之间的作用(即吸附过程)极为迅速,4 min内即可达到或接近平衡状态。然而,酸碱滴定结果表明,随着吸附剂在二元醇中浸泡时间的延长,NaOH的溶解量增加。因此,若吸附时间过长,吸附量甚至略有下降。即使将吸附时间设定在8 min,也有接近20%的NaOH流失。因此,必须使吸附过程在短时间内结束,这样不但能缩短乙二醇的分离时间、提高生产效率,而且避免了NaOH的明显流失(4 min条件下的流失量为9.7%)。经过计算,仅通过吸附处理4 min后,二元醇混合物中的1,2-丙二醇质量分数即可从90%提高到92%。
2.6 蒸馏与吸附方法分离二元醇的对比
为了探究本文所用吸附方法的优劣性,与简单蒸馏的分离效果进行了对比,结果如表3所示。吸附及蒸馏所得产品中1,2-丙二醇质量分数均达到92%,但吸附方法的操作条件更加温和,无需加热及真空环境。更重要的是,吸附方法的产品得率是蒸馏方法的4倍,物料损失极少。若为了获得更多产品而继续简单地蒸馏,则馏出物中1,2-丙二醇的含量会逐步下降,不能满足产品纯度为92%的比较基准。总之,就二元醇混合物的分离技术而言,吸附较蒸馏具有条件温和、物料损失少的优势。
2.7 物理吸附测试
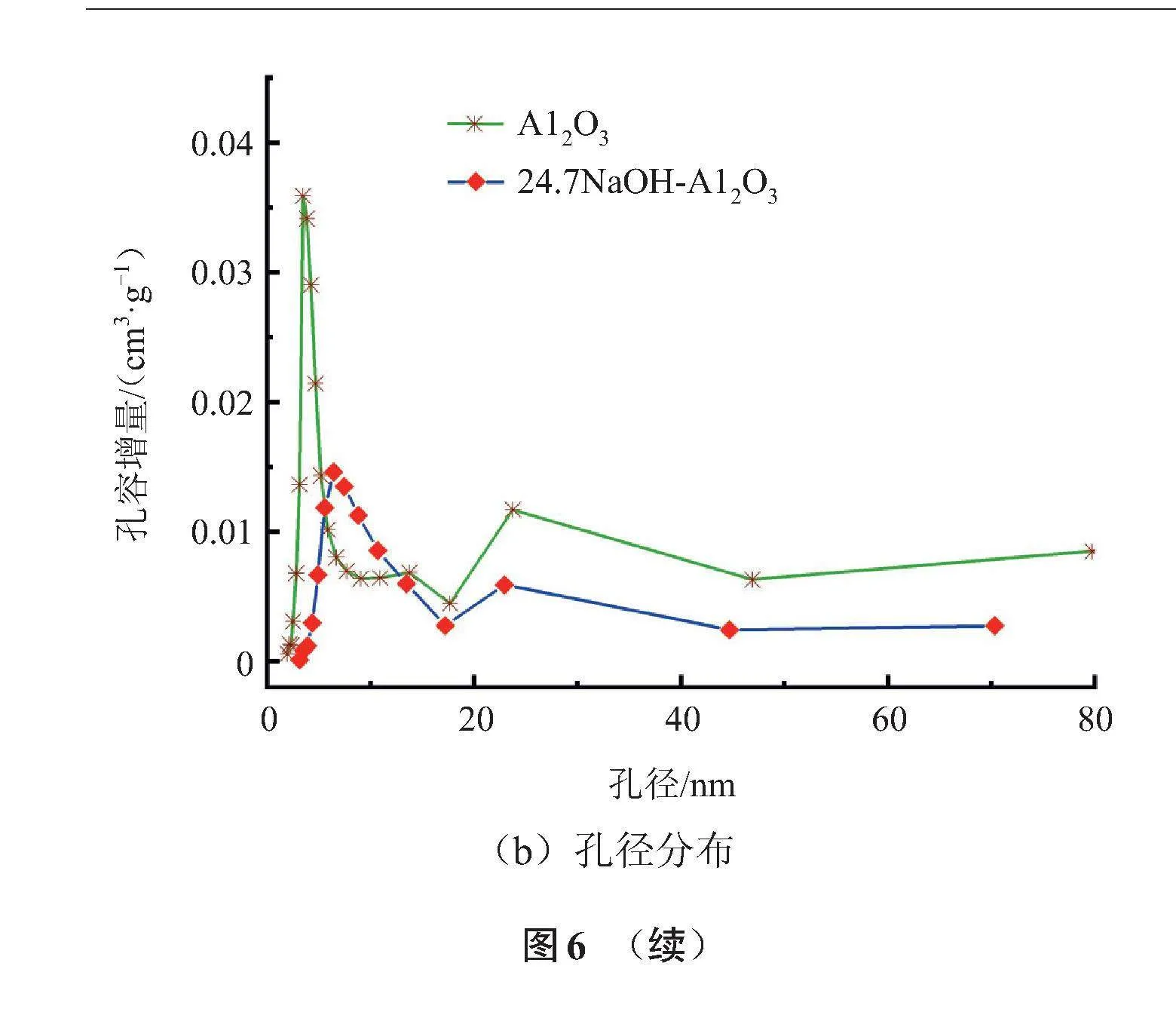
为了探寻氧化铝载体性能优异的原因,首先通过物理吸附测量材料的比表面积,N2吸附等温线结果如图6(a)所示。Al2O3比表面积高达141.8 m2/g(BET),含有大量介孔,且直径为3.5 nm的孔较多,见图6(b)。由T-plot方法估算其微孔面积,为133.4 m2/g。负载质量分数为24.7%的NaOH后,24.7NaOH-Al2O3的比表面积大幅下降到28.7 m2/g(BET),微孔面积下降到2.6 m2/g(T-plot),且直径为6.4 nm的孔居多。以上结果表明在负载过程中,Al2O3的部分微孔、介孔被NaOH堵塞,直径较大的介孔、大孔因NaOH的沉积而形成新的介孔。
2.8 化学吸附测试
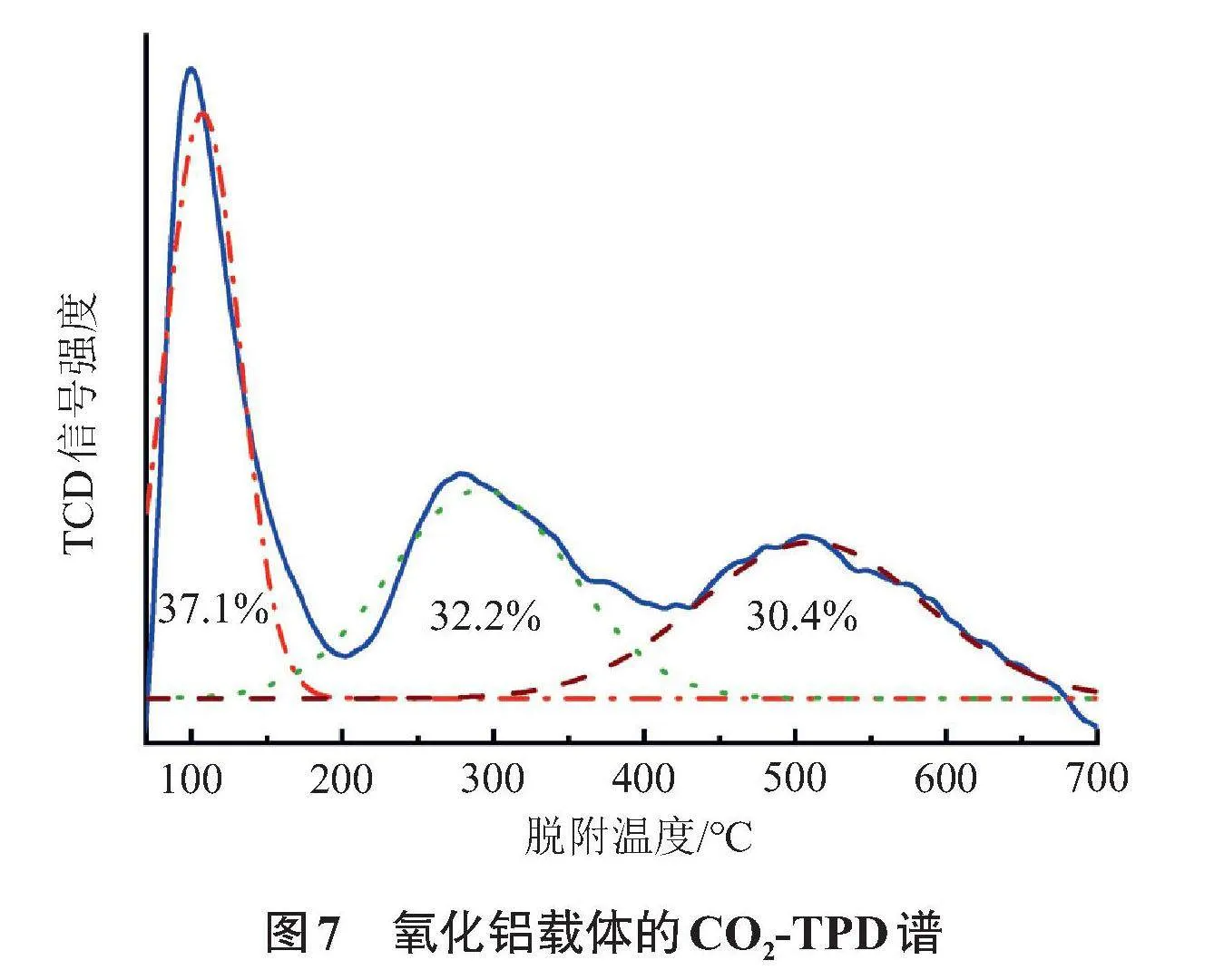
为了评价氧化铝载体对吸附过程的贡献,通过CO2-TPD测试了氧化铝载体的碱性。载体所含总碱量为0.88 mmol/g,氧化铝表面位点的碱性强度分布如图7所示。由于脱附峰之间相互重叠,为了了解不同强度酸性位点所占的比例,需要进行分峰处理。使用Origin 8软件,选择多峰拟合(fit multiple peaks),再选择Guassian peak function峰函数,将峰的数量定为3,由此拟合出峰如图7(虚线)所示。通过拟合分峰发现,强碱位的数量为0.27 mmol/g,约占氧化铝总碱量的30%。相较而言,1.00 g 24.7NaOH-Al2O3吸附剂含有6.17 mmol的NaOH,是氧化铝本身所含强碱量的22.8倍,虽然NaOH未完全暴露在吸附剂表面,但如此大的NaOH储量可以提供足够的碱性位点。此外,图1所示的吸附实验结果表明氧化铝本身对乙二醇的吸附能力极弱,只有负载NaOH之后,吸附量才急剧上升,故NaOH与乙二醇分子之间的相互作用是选择性吸附的原因,而氧化铝载体对吸附的贡献可忽略,这与2.1节的对照实验(负载NaCl的Al2O3不吸附乙二醇)结果一致。
2.9 二元醇-碱位相互作用机理
基于图1数据所体现的NaOH对乙二醇的强吸附能力,以及图5所示因NaOH流失而导致的吸附能力急剧下降的现象,可推测吸附机理是OH−和乙二醇的羟基氢之间形成了Lewis酸-碱相互作用。使用软件计算了乙二醇、1,2-丙二醇分子的电子云密度,其电子云分布情况见图8。乙二醇的羟基氢原子带有明显的正电性(蓝或蓝绿色),而1,2-丙二醇的羟基氢原子显示负电性或电中性(以黄色为主,略带绿色或红色),表明只有乙二醇的羟基有强烈吸引电子的能力,即Lewis酸性。相比之下,1,2-丙二醇的甲基具有供电子效应,通过诱导效应[15-16]增加了相应羟基氢的电子云密度,降低了羟基氢的正电荷数或Lewis酸性,因此吸附剂表面的OH−与1,2-丙二醇的羟基氢之间的作用很弱,对1,2-丙二醇的吸附作用不强[17-18]。因为乙二醇与24.7NaOH-Al2O3吸附剂之间存在独特的酸-碱相互作用,所以该吸附材料能从1,2-丙二醇中选择性地吸附乙二醇。
2.10 吸附剂的再生
为测试24.7NaOH-Al2O3吸附剂的重复使用性能,使用24.7NaOH-Al2O3连续处理同样的二元醇混合物5次,每次吸附后,过滤分离吸附剂并用于下次吸附实验。另设对照组,每次吸附后,真空干燥再生吸附剂,然后用于下次吸附实验,即吸附、再生交替进行。每次处理过程中的乙二醇吸附量见图9。随着吸附剂使用次数的增加,乙二醇吸附量急剧下降,这与表面碱性位点逐渐被乙二醇饱和、NaOH逐渐流失有关。第5次处理后,吸附能力基本消失。若每次吸附结束后都采用真空干燥的方式再生吸附剂,则吸附剂的重复使用性能明显变好,即使再生4次后,乙二醇吸附量也保持为首次处理过程中吸附量的60%左右,表明真空干燥后24.7NaOH-Al2O3吸附剂对乙二醇的吸附能力明显恢复,通过不断再生可实现吸附剂的重复使用,从而降低吸附剂的制备成本。
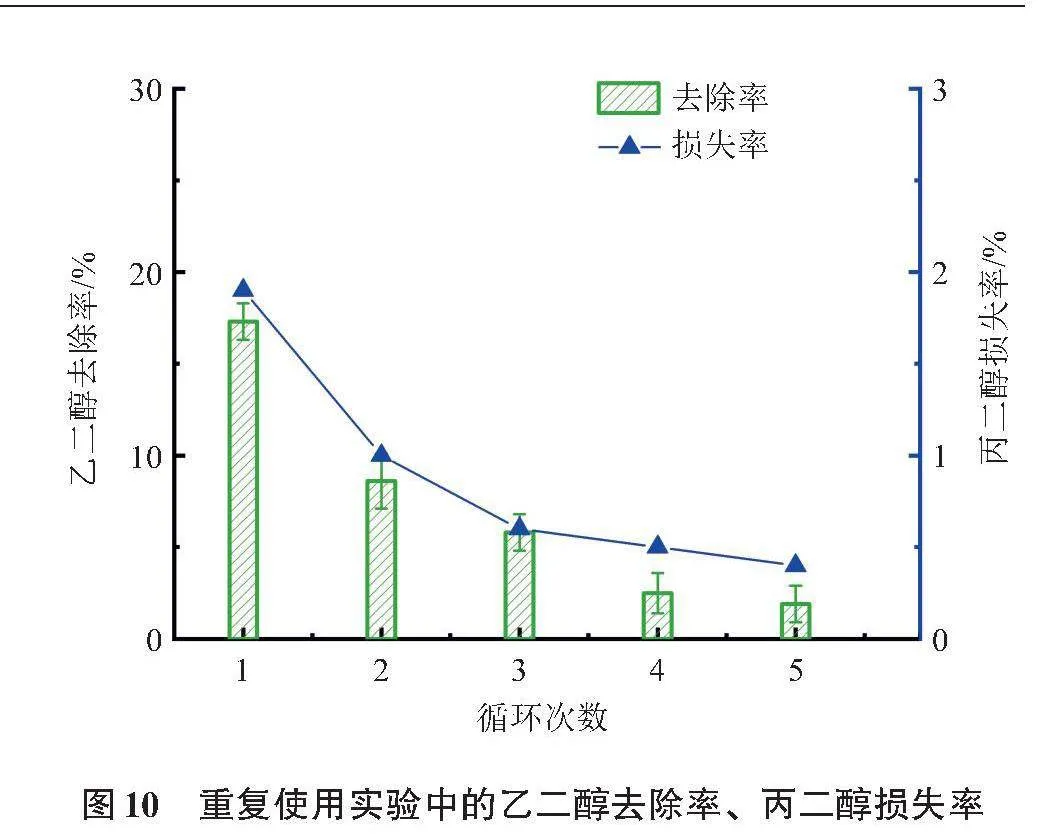
图10为较优条件下重复使用(真空干燥再生)实验中的乙二醇去除率、丙二醇损失率,前者是后者的10倍左右,表明该吸附材料对乙二醇具有较高的选择性,这也是吸附分离后丙二醇浓度提高的原因。每次吸附操作中的丙二醇损失不多(<2%),故可采用多次吸附的策略,以将丙二醇纯度提升到更高水平,但这会消耗更多的吸附材料,在实际操作中需合理权衡分离成本与分离效果之间的利弊。
3 结论
本文成功地将NaOH分散于多孔氧化铝载体上,所制备的负载型吸附剂可选择性地吸附1,2-丙二醇中的乙二醇,且吸附过程可在极短时间(4 min)内完成,发现了低碳数的邻位二元醇与吸附剂表面碱性位点的相互作用更强,在分子水平上阐明了吸附选择性的原因。在NaOH负载量为24.7%、吸附剂质量分数为20%、温度为20 ℃、时间为4 min的条件下,乙二醇吸附量较高。然而,在高温、长时间的操作条件下,吸附剂负载的NaOH容易流失,需通过控制吸附剂温度、时间来抑制NaOH的流失。在较优操作条件下,可将1,2-丙二醇质量分数从90%提高到92%,且NaOH流失量低于10%。与蒸馏相比,吸附方法在二元醇分离方面具有过程温和、物料损失少的优势。物理吸附测试结果表明在负载过程中,氧化铝的部分微孔、介孔被NaOH堵塞,直径较大的介孔、大孔因NaOH的沉积而形成新的介孔;化学吸附结果表明,NaOH与乙二醇分子之间的相互作用是选择性吸附的原因,而氧化铝载体对吸附的影响可忽略。可通过真空干燥方法除去吸附剂表面的乙二醇,从而实现失活吸附剂的快速再生。使用负载NaOH的Al2O3材料来吸附分离二元醇混合物具有简便、快速、经济、节能、环保等诸多优势。本文针对生物质基二元醇混合物的分离难题提出了一个切实可行的新思路,将来的研究需着重解决NaOH高温易流失的问题,以进一步提高乙二醇吸附量及分离效率。
参考文献
[1] 雷丽晶,欧兆爽. 环氧丙烷产业现状及发展趋势[J]. 化学工业,2020,38(1):26-30.
[2] 兰淑惠,叶德钧,杨俊,等. 气相色谱法测定煤制乙二醇粗产品的纯度及10种有机杂质[J]. 化学分析计量,2022,31(7):13-17.
[3] HE X,WEN X,WU K,et al. Sustainable synthesis of vinyl methyl ether from biomass-derived ethylene glycol dimethyl ether over solid base catalysts[J]. Green Chemistry,2021, 23(17):6625-6631.
[4] PODDAR M K,PANDEY A,JHA M K,et al. Aqueous phase hydrogenolysis of renewable glycerol to 1,2-propanediol over bimetallic highly stable and efficient Ni-Cu/Al2O3 catalyst[J]. Molecular Catalysis,2021,515:111943.
[5] GATTI M N,CERIONI J L,POMPEO F,et al. High yield to 1-propanol from crude glycerol using two reaction steps with Ni catalysts[J]. Catalysts,2020,10(6):615.
[6] SUN P H,ZHANG W X,YU X,et al. Hydrogenolysis of glycerol to propylene glycol:energy,tech-economic,and environmental studies[J]. Frontiers in Chemistry,2022,9:778579.
[7] SUN J Y,LIU H C. Selective hydrogenolysis of biomass-derived xylitol to ethylene glycol and propylene glycol on supported Ru catalysts[J]. Green Chemistry,2011,13(1):135-142.
[8] JIA Y Q,SUN Q H,LIU H C. Selective hydrogenolysis of biomass-derived sorbitol to propylene glycol and ethylene glycol on in-situ formed PdZn alloy catalysts[J]. Applied Catalysis A:General,2020,603:117770.
[9] LIU Y,LUO C,LIU H C. Tungsten trioxide promoted selective conversion of cellulose into propylene glycol and ethylene glycol on a ruthenium catalyst[J]. Angewandte Chemie,2012,51(13):3249-3253.
[10] CHEN Y C,HUNG S K,LEE H Y,et al. Energy-saving designs for separation of a close-boiling 1,2-propanediol and ethylene glycol mixture[J]. Industrial & Engineering Chemistry Research,2015,54(15):3828-3843.
[11] 艾硕,郑明远,庞纪峰,等. 新型乙二醇合成工艺的产品精制与节能技术[J]. 化工进展,2017,36(7):2344-2352.
[12] DHALE A D,MYRANT L K,CHOPADE S P,et al. Propylene glycol and ethylene glycol recovery from aqueous solution via reactive distillation[J]. Chemical Engineering Science,2004,59(14):2881-2890.
[13] AI S,QIN Y,LIU L H,et al. Ion-exchange modification of zeolite for the controllable catalytic transformation of diols and selective conversion of 1,2-butanediol to butanal[J]. Materials Chemistry and Physics,2022,292:126836.
[14] OLSZÓWKA J E,KARCZ R,MICHALIK-ZYM A,et al. Effect of grinding on the physico-chemical properties of Mg-Al hydrotalcite and its performance as a catalyst for Baeyer-Villiger oxidation of cyclohexanone[J]. Catalysis Today,2019,333:147-153.
[15] ALKORTA I,LEGON A. Nucleophilicity of the boron atom in compounds R-B,(R=F,Cl,Br,I,CN,NC,CH3,SiH3,CF3,H):a new look at the inductive effects of the group R[J]. Physical Chemistry Chemical Physics,2022,24(21):12804-12807.
[16] 叶蔚甄,任强,赵毅,等. Al原子分布对Y型分子筛酸强度的影响[J]. 石油学报(石油加工),2021,37(3):566-571.
[17] 闫共芹,王康,徐天齐. 锂离子电池石墨基负极材料储锂性能的第一性原理研究[J]. 广西科技大学学报,2022,33(2):100-106.
[18] 邓佑林,冉思妍,苏慧仁,等. 大孔树脂分离火棘果总多酚工艺条件优化[J]. 广西科技大学学报,2021,32(2):94-99.
Isolation of ethylene glycol in propylene glycol via adsorption with
alkali-containing alumina
HUANG Zhenhua, AI Shuo*, YU Wanguo, HUANG Chengdu
(School of Biological and Chemical Engineering, Guangxi University of Science and Technology, Liuzhou 545006, China)
Abstract: Ethylene glycol is the primary impurity in bio-based propylene glycol. In this paper, 20% sodium hydroxide was dispersed on mesoporous alumina by impregnation to prepare an adsorbent for the separation of 10% ethylene glycol in 1,2-propanediol. Ethylene glycol could be selectively adsorbed on the basic sites, and sodium hydroxide dispersed on porous alumina had relatively high adsorption capacity. During the loading procedure, the specific surface area of alumina support was decreased to a large extent, and new mesopores were generated. The number of basic sites in the alumina support measured by CO2-TPD was much lower than the contribution from NaOH. Therefore, the high adsorption capacity of 24.7NaOH-Al2O3 adsorbent for ethylene glycol should be attributed to NaOH rather than the Al2O3 support. Under the preferable conditions including NaOH loading of 24.7%, adsorbent dosage of 20%, adsorption temperature of 20 ℃, and adsorption time of 4 min, the content of 1,2-propanediol was increased from 90% to 92%. The adsorption capacity for ethylene glycol reached 69.2 mg/g. The removal rate of ethylene glycol was approximately 10 times the loss of propylene glycol, exhibiting high separation selectivity. The calculation results of Gaussian 03 molecular simulation software indicated that the hydrogen atoms of hydroxyl groups in ethylene glycol were significantly positively charged, while those in 1,2-propanediol were negatively charged or neutral. Therefore, only the hydroxyl groups of ethylene glycol exhibited obvious Lewis acidity, and this unique acid-base interaction is the rationale of separation selectivity.
Keywords: adsorption; 1,2-propanediol; ethylene glycol; sodium hydroxide(NaOH); alumina support
(责任编辑:罗小芬)
收稿日期:2023-10-15;修回日期:2024-03-07
基金项目:国家自然科学基金地区科学基金项目(22268011)资助
第一作者:黄振华,在读硕士研究生
*通信作者:艾硕,博士,研究员,研究方向:化工分离技术及工业催化,E-mail:100001928@gxust.edu.cn
