超声辐射对悬浮体系中壳聚糖降解的研究
2024-11-05陈丽珊黄永春张昆明





摘 要:为探究超声辐射对悬浮体系中壳聚糖降解的影响。以降解后壳聚糖溶液的相对黏度和还原糖质量浓度为评价指标,研究悬浮液pH值、壳聚糖粒径、超声温度、超声功率比和超声时间对壳聚糖降解的影响,并分别对原料及降解产物进行结构表征。结果表明:在悬浮液pH值为5.0、壳聚糖粒径为116 μm、超声温度为25 ℃、超声功率比为80%、超声时间为5 h的实验条件下,降解后溶液还原糖质量浓度从9.98 mg/L增加到188.43 mg/L,相对黏度从1.95降低至1.46;结构表征分析发现,降解后固态壳聚糖结晶度有所提升,推测原因是超声辐射优先作用于壳聚糖的非晶区域;超声辐射处理非均相壳聚糖悬浮液体系,有利于促进固相壳聚糖分子的溶解和降解。
关键词:悬浮体系;壳聚糖降解;超声空化;相对黏度;还原糖
中图分类号:O636.1 DOI:10.16375/j.cnki.cn45-1395/t.2024.04.018
0 引言
甲壳素是自然界中存在的第二大高分子多糖,源于节肢动物的外壳、霉菌等真菌的细胞壁上[1]。壳聚糖是甲壳素通过脱乙酰化反应(脱乙酰度高于55%)的产物,是天然多糖中唯一的阳离子聚合物[2]。由于从甲壳素中脱乙酰得到的壳聚糖拥有伸展的长链结构,长链分子之间容易形成高密度的氢键,相对分子质量高。与大分子壳聚糖相比,降解后的低分子量壳聚糖氢键作用减弱,游离的氨基和羟基增多,从而表现出一些独特的功能特性,如抗菌性、 降胆固醇作用、抗肿瘤作用等,广泛应用于食品、日用化学、农业、医药、轻工业、环保等多个领域[3]。Sun等[4]利用氨基和羟基可以与Fe3+形成稳定的螯合作用,制备出一种四氧化三铁-壳聚糖复合吸附剂作为去除工业废水中铅离子的潜在吸附剂;刘流等[5]在酱油生产中添加O-羧甲基壳聚糖限制酵母菌群的生长,防止霉变。因此,通过降解来制备低分子量壳聚糖受到越来越多的关注。
壳聚糖可以通过物理法、化学法、生物酶法进行降解,这些降解方法各有优缺点。物理法降解速率快、没有副产物、对环境无污染,但收率低、生产成本过高;化学法成本低廉、工业成熟,但需使用大量化学试剂导致环境污染;生物酶法无副反应、容易控制相对分子量分布,但酶价格昂贵并且容易失去活性[6-8]。以上壳聚糖降解方法均是先用酸性溶液对壳聚糖进行溶解预处理,在该过程中,反应时间比较长,降解过程不受控制,导致制备得到的壳聚糖分子量分布宽,同时反应过程中加入的酸对生态环境有一定的污染。相比之下超声辐射能够产生机械效应和自由基效应,机械效应能够促进壳聚糖固体颗粒分散、粉碎和溶解,自由基效应能够随机切断溶液中壳聚糖主链上的β-(1,4)糖苷键,从而导致壳聚糖降解。超声辐射操作简单、能量集中、空化作用剧烈,并且后处理简易、对环境无污染、易于提取和回收,具有广阔的发展前景[9-11]。因此,本文提出通过超声辐射降解悬浮体系中的壳聚糖,即壳聚糖非均相降解,该方法相较于传统均相降解,超声直接作用于壳聚糖颗粒表面,省略了壳聚糖的长时间溶解预处理过程,并WjIPx5u8Uj1DyEDtMObR9w==且在超声促溶条件下,在水相中加入的酸性溶剂的用量还可进一步减少,起到降低酸性溶剂用量的作用。
1 材料方法
1.1 材料与试剂
壳聚糖,工业级,购于深圳市中发源生物科技有限公司;乙酸、乙酸钠、铁氰化钾、无水碳酸钠,分析纯,购于西陇科学股份有限公司;N-乙酰氨基葡萄糖,分析纯,购于北京索莱宝科技有限公司。
1.2 仪器与设备
SL-2010N智能控温多频超声波细胞破碎仪(变幅杆为Φ15,功率为1 500 W,功率比在0~80%可调,南京顺流仪器有限公司);DHG-9055A鼓风干燥箱(上海一恒科学仪器有限公司);D/MAX-3A X射线衍射仪(XRD)(日本理学株式会社);UV-2006 紫外可见分光光度计(岛津企业管理(中国)有限公司);NICOLET 6700红外光谱仪(美国赛默飞世尔公司)。
1.3 壳聚糖悬浮液的制备及其单因素实验
1.3.1 超声辐射降解壳聚糖
过100目(0.150 mm)、200目(0.075 mm)、300目(0.050 mm)及400目(0.038 mm)的标准筛筛分壳聚糖原料,经过分级过筛得到0~100、100<~200、200<~300、300<~400目筛范围的原料壳聚糖,使用激光颗粒分布仪器测得其体积,平均粒径分别为151、116、84、69 μm。向双层夹套烧杯中添加1.0 g壳聚糖,加入200 mL乙酸-乙酸钠缓冲溶液稍加搅拌,直接置于超声波细胞破碎仪中反应,设定超声时间(1、2、3、4、5、6 h)、超声功率比(15%、30%、45%、60%、75%、80%)及超声温度(20、25、30、35、40 ℃),反应结束后离心,测定降解后壳聚糖溶液的相对黏度和还原糖质量浓度。
1.3.2 壳聚糖悬浮液中固体颗粒的分离
将反应后样液在25 ℃和8 000 r/min条件下离心8 min,保留沉淀;加入适量的蒸馏水,离心后置于XW-80A型旋涡混合器上混合2 min,重复操作至溶液接近无色;抽滤出沉淀,在50 ℃鼓风干燥箱中烘干、研磨成粉末。
1.3.3 悬浮液pH值对壳聚糖悬浮液降解的影响
准确称取1.0 g粒径为116 μm的原料壳聚糖,加入200 mL不同pH值(4.0、4.5、5.0、5.5)的乙酸-乙酸钠缓冲液,控制功率比为45%、超声温度为40 ℃,反应5 h后离心,测定降解后壳聚糖溶液的相对黏度和还原糖质量浓度,并分析悬浮液pH值对壳聚糖悬浮液降解性能的影响。
1.3.4 壳聚糖粒径对壳聚糖降解的影响
准确称取1.0 g不同粒径(151、116、84、69 μm)的壳聚糖原料,加入200 mL pH值为5.0的乙酸-乙酸钠缓冲液,控制功率比为45%、超声温度为40 ℃、超声时间为5 h,反应结束后离心,测定降解后壳聚糖溶液的相对黏度和还原糖质量浓度,并分析粒径对壳聚糖悬浮液降解性能的影响。
1.3.5 超声温度对壳聚糖降解的影响
准确称取1.0 g粒径为116 μm的壳聚糖原料,加入200 mL pH值为5.0的乙酸-乙酸钠缓冲液,调节不同的温度(20、25、30、35、40 ℃),控制功率比为45%,超声时间为5 h,反应结束后离心,测定降解后壳聚糖溶液的相对黏度和还原糖质量浓度,并分析超声温度对壳聚糖悬浮液降解性能的影响。
1.3.6 超声功率比对壳聚糖降解的影响
准确称取1.0 g粒径为116 μm的壳聚糖原料,加入200 mL pH值为5.0的乙酸-乙酸钠缓冲液,调节不同超声功率比(15%、30%、45%、60%、75%、80%),控制温度为25 ℃,超声时间为5 h,反应结束后离心,测定降解后壳聚糖溶液的相对黏度和还原糖质量浓度,并分析超声功率对壳聚糖悬浮液降解性能的影响。
1.3.7 超声时间对壳聚糖降解的影响
准确称取1.0 g粒径为116 μm的壳聚糖原料,加入200 mL pH值为5.0的乙酸-乙酸钠缓冲液,调节不同的超声时间(1、2、3、4、5、6 h),控制超声功率比为80%、超声温度为25 ℃,反应结束后离心,测定降解后壳聚糖溶液的相对黏度和还原糖质量浓度,并分析超声时间对壳聚糖悬浮液降解性能的影响。
1.4 测定方法
1.4.1 还原糖质量浓度测定[12]
准确称取0.5 g干燥的铁氰化钾,定容于1 L浓度为0.5 mol/L的碳酸钠容量瓶中并置于棕色试剂瓶中储存;准确吸取0、0.2、0.4、0.6、0.8、1.0 mL浓度为200 μg/mL的N-乙酰-D-氨基葡萄糖标准液于各试管中,用蒸馏水补至2.0 mL,随后加入3 mL碱性铁氰化钾试剂,摇匀后进行沸水浴20 min,立即冷却;以蒸馏水为空白对照,在420 nm波长下,测定其吸光度值。以吸光度值为纵坐标,N-乙酰-D-氨基葡萄糖质量浓度为横坐标,得出回归方程为y=-0.007 6x+0.891,相关系数R2=0.996 6。
采用上述方法,将壳聚糖上清液稀释到合适倍数,取出2 mL的稀释液,加入3 mL碱性铁氰化钾试剂,沸水浴20 min,立即冷却后离心,以蒸馏水为空白对照,在420 nm波长下,测定其吸光度值。根据标准曲线回归方程,计算出还原糖质量浓度。
1.4.2 相对黏度的测定
采用黏度法测定壳聚糖的相对黏度[13]。准确移取降解后的壳聚糖溶液50 mL,并定容于100 mL容量瓶中(pH值为5.0的乙酸-乙酸钠缓冲液作为稀释液),取20 mL稀释后的壳聚糖溶液于乌氏粘度计中,在30 ℃的温度条件下,用乌式粘度计测定溶液的流出时间t和缓冲液流出时间t0,重复测定3次,取平均值,误差控制在0.2 s内,计算出相对黏度(ηr),计算公式为ηr=t/t0。
1.4.3 FTIR测定
采用红外光谱仪(FTIR)对壳聚糖原料及在粒径为116 μm、超声时间为5 h、超声功率比为45%、超声温度为25 ℃的实验条件下得到的降解产物进行检测分析。用溴化钾压片法制备样品:将溴化钾与壳聚糖样品干燥后以100∶1的比例放入研钵内研磨混匀且无颗粒感,进行压片,以溴化钾为空白检测背景,置于仪器中进行测试,测定的范围为400~4 000 cm-1。
1.4.4 XRD测定
采用XRD(X-ray diffraction, XRD)对壳聚糖原料及在粒径为116 μm、超声时间为5 h、超声功率比为45%、超声温度为25 ℃的实验条件下得到的降解产物进行检测分析。测定条件:Cu靶Ka1射线,电压为40 kV,电流为40 mA,发散狭缝为(1/8)°,防发散狭缝为(1/4)°,防散射狭缝为7.5 mm,2θ范围为5°~60°。
1.5 数据处理
使用Origin 2021、Jade6.5、Omnic软件处理实验数据并绘图。
2 结果与讨论
2.1 单因素实验结果
2.1.1 悬浮液pH值对壳聚糖降解的影响
本实验考察了不同悬浮液pH值对壳聚糖降解的影响,实验结果如图1所示。由图1可以看出,悬浮液pH值为4.0~4.5时,随着悬浮液pH值的升高,降解后壳聚糖溶液相对黏度从1.73降低到1.31。一般来说,壳聚糖可以在酸性溶剂下溶解,酸性越强,越容易溶解;随着pH值的升高,悬浮液中的氢离子含量减少,导致固相壳聚糖分子的溶解受限,因此,降解后壳聚糖溶液的相对黏度降低。
另外,当悬浮液pH值为4.0~4.5时,还原糖质量浓度随着pH值的升高从155.87 mg/L增至175.10 mg/L,这是因为pH值的升高即氢离子浓度的降低,减少了壳聚糖分子形成的盐键,从而导致糖苷键断裂的位阻减弱,还原糖质量浓度增多[13]。当悬浮液pH值为4.5[<~]5.5时,随着pH值升高,还原糖质量浓度从175.10 mg/L降至121.31 mg/L,这是由于悬浮液酸性减弱,固相壳聚糖溶解缓慢,溶解的壳聚糖分子减少,壳聚糖分子链上接受超声辐射的作用位点减少,降低了反应速率,还原糖质量浓度降低[13]。同时,由于在pH值为4.5和5.0条件下降解的壳聚糖溶液中还原糖质量浓度和相对黏度相差不大,从减少酸性溶剂使用的角度考虑,选择pH值为5.0最好。
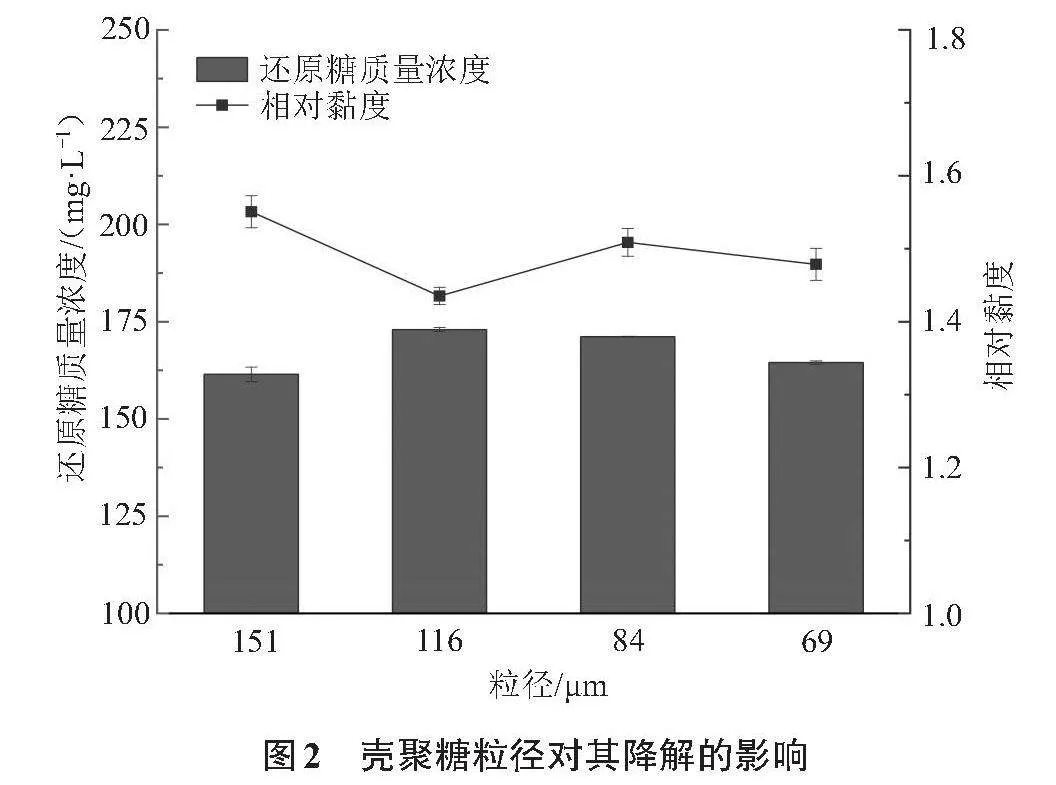
2.1.2 壳聚糖粒径对其降解的影响
本实验考察了不同壳聚糖粒径对其降解的影响,实验结果如图2所示。由图2可知,壳聚糖粒径在116~151 μm范围内,降解后溶液随着粒径的细化,还原糖质量浓度从161.45 mg/L增至172.96 mg/L,相对黏度从1.55降至1.47,主要原因是在相同的质量条件下,固相壳聚糖颗粒越细,其比表面积越大,能够提供较多的起核位来促进空化泡的生成,进而有效空泡的数量增多,导致超声空化作用增大,从而提高了壳聚糖的降解效率[10]。粒径在69~116 μm范围内时,随着颗粒的继续细化,壳聚糖降解后溶液还原糖质量浓度降低至164.47 mg/L,相对黏度升高至1.48,这是因为固相壳聚糖的超声降解是由表面到内部缓慢进行的,壳聚糖细化后有利于其溶解,导致整个悬浮体系黏度增大,不利于超声的机械作用和空化作用[14]。因此本实验中最佳粒径为116 μm。
2.1.3 超声温度对壳聚糖降解的影响
本实验考察了不同超声温度对壳聚糖降解的影响,实验结果如图3所示,在其他条件相同的情况下,当超声温度为20~25 ℃时,随着超声温度的升高,降解后壳聚糖溶液的相对黏度基本不变,但还原糖质量浓度从168.15 mg/L增至173.10 mg/L,这可能是随着温度的升高,会增大悬浮体系中的饱和蒸汽压,同时会降低悬浮体系的黏度和表面张力,因此减小了悬浮体系中的分子间作用力,从而有利于提高空化效应[11]。但当超声温度从25 ℃继续升高至45 ℃时,降解后壳聚糖溶液的相对黏度从1.69升高到1.75,还原糖质量浓度从173.10 mg/L降至157.70 mg/L。一般来说,温度越高,越有利于壳聚糖溶解,即温度升高,加快分子之间的运动,促进壳聚糖溶解,导致整个悬浮体系黏度增大,降低了空化效应[14]。因此本实验最佳超声温度为25 ℃。
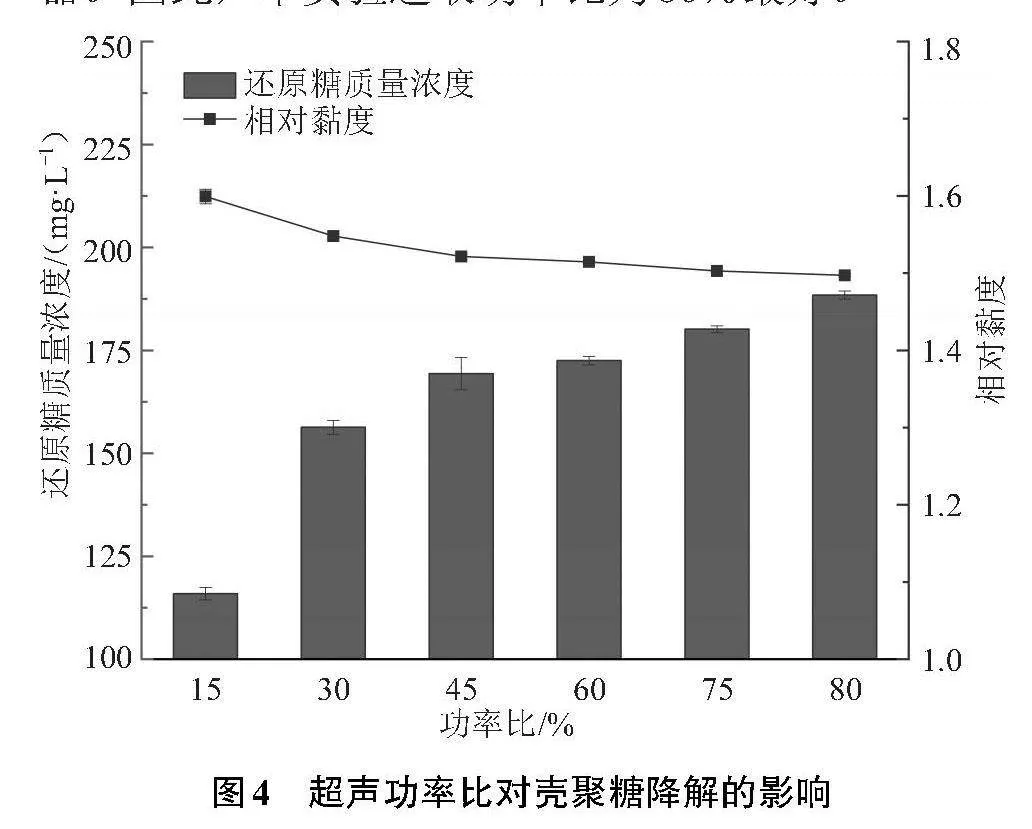
2.1.4 超声功率比对壳聚糖降解的影响
本实验考察了不同超声功率比对壳聚糖降解的影响,实验结果如图4所示,超声功率增强有利于悬浮体系中壳聚糖的降解。在超声功率比为15%~80%时,降解后壳聚糖溶液的相对黏度从1.60降到1.49,还原糖质量浓度从115.92 mg/L增至188.42 mg/L。由此可见,在不同的功率比下,功率比越大,降解后溶液的相对黏度就越低,还原糖质量浓度就越高,壳聚糖降解得越多。主要原因是超声辐射处理悬浮液会使壳聚糖分子进行振动,加快位移速度和分子碰撞速度,同时施加较大的冲击力从而引起分子链的断裂[14];超声功率的增大可以提高壳聚糖溶解速率,增多壳聚糖分子链接受的切点,从而加快降解反应;也可以使羟基自由基获得更多的能量,进攻壳聚糖的能量随之变大[15]。由于超声设备配置的变幅杆为Φ15 mm,当功率比高于80%容易损坏仪器。因此,本实验选取功率比为80%最好。
2.1.5 超声时间对壳聚糖降解的影响
本实验考察了不同超声时间对壳聚糖降解的影响,实验结果如图5所示,在超声时间为0~1 h范围内,随着时间的延长,降解后壳聚糖溶液的相对黏度从1.12升高至1.96,还原糖质量浓度从9.98 mg/L增至65.53 mg/L,说明在降解的初始阶段,相对黏度升高,还原糖质量浓度增大,这主要是超声时间延长,不断产生的空化作用和机械作用,破坏壳聚糖分子之间的作用力,加速氢离子向固相壳聚糖内部渗透,并将固相壳聚糖表面的壳聚糖分子剥离开来并分散到缓冲液中,从而导致固相壳聚糖的快速溶解,导致其相对黏度急剧升高;同时,由于超声空化效应作用于溶解后的壳聚糖分子,促使壳聚糖大分子降解成小分子量的壳聚糖,因此,还原糖质量浓度逐渐增大。在超声时间为1~5 h范围内,随着超声时间的延长,相对黏度从1.96降至1.46后平缓,还原糖质量浓度从65.53 mg/L增至188.43 mg/L后平缓,即在后期降解过程中,进一步延长超声时间,由于可接受超声辐射的大分子壳聚糖的作用位点增多,壳聚糖大分子发生降解不断产生小分子量的壳聚糖,因此,降解后的溶液体系相对黏度持续降低,还原糖质量浓度持续升高 [12-13]。随后,从5 h继续延长时间至6 h,降解后的溶液体系相对黏度和还原糖质量浓度变化趋于平稳。因此,本实验中选取最佳超声时间为5 h。
2.2 结构分析
2.2.1 XRD分析2yB9YOlBd+OCpbe5JoqAN7A0HsExkKpPU1qYoc67D7M=
壳聚糖原料和降解产物的X射线衍射(XRD)谱如图6所示,原料壳聚糖在2θ为12.53°和20.32°时有特征衍射峰。与壳聚糖原料相比,降解产物在2θ=12.00°左右的特征峰变宽,峰强度减小;在2θ=20.00°附近的特征峰变尖锐,峰强度增强,均向小角度偏移。这些结果表明超声辐射破坏了壳聚糖的晶体结构。通过Jade6.5和Origin软件计算得到原料壳聚糖和降解产物的相对结晶度分别为13.51%、23.30%,超声处理后的壳聚糖结晶度增大,分子间的氢键作用力增强,推测可能是因为超声优先作用于非晶区域,非晶区域中链的断裂使得一些断裂链在重新排序后会产生更加紧密的结晶结构[16]。
2.2.2 FTIR分析
壳聚糖原料和降解产物的红外光谱如图7所示,3 366 cm-1处的宽峰为N-H与O-H伸缩振动的重叠;2 879 cm-1处峰为壳聚糖链上-CH2-和-CH3的振动;1 597 cm-1和1 423 cm-1处的峰分别对应为酰胺Ⅱ谱带和酰胺Ⅲ谱带中的N-H弯曲振动;1 651 cm-1处的峰为酰胺Ⅰ谱带中C =O的伸缩振动;1 378 cm-1处的弱峰是-CH3的对称变形振动;1 031 cm-1的强峰对应为分子中一级醇羟基的C-O伸缩振动;在894 cm-1处的峰是与相邻糖环发生的伸缩振动[17]。降解产物与壳聚糖原料的谱图基本一致,没有吸收峰的增加和消失,说明超声辐射没有破坏固相壳聚糖的糖环结构。此外,N-H拉伸振动向较高的波数移动,表明壳聚糖超声后分子间和分子内氢键增强,结晶度升高[18]。
3 结论
本研究利用超声辐射对悬浮液中的壳聚糖进行降解,考察了悬浮液pH值、粒径、超声温度、超声功率比和超声时间对悬浮体系中壳聚糖降解性能的影响,并对壳聚糖原料及降解产物进行结构分析,所得结论如下:
在悬浮液pH值为5.0、壳聚糖粒径为116 μm、超声温度为25 ℃、超声功率比为80%、超声时间为5 h的实验条件下,降解后壳聚糖溶液还原糖质量浓度从9.98 mg/L增至188.43 mg/L,相对黏度从1.95降低至1.46,降解效果最明显。经XRD和FTIR分析发现超声辐射没有破坏壳聚糖的糖环结构,超声辐射后结晶度升高,推测可能是超声辐射优先作用于壳聚糖的非晶区域。超声辐射处理非均相壳聚糖悬浮液体系,减少了传统的酸溶解预处理过程及酸性溶剂用量,并且促进固相壳聚糖分子的溶解和降解,有助于提高降解效率。后续将对壳聚糖进行分子量及分子量分布测定或者联合其他降解方式比如生物酶降解等进一步降解进行研究。
参考文献
[1] TAGHIZADEH M T,BAHADORI A. Ultrasonic degradation of N-di and trihydroxy benzoyl chitosans and its effects on antioxidant activity[J]. Ultrasonics Sonochemistry,2014,21(3):1140-1149.
[2] 徐云,张昆明,黄永春,等. 孔板空化强化制备京尼平-壳聚糖载药纳米微球的工艺研究[J]. 广西科技大学学报,2021,32(4):9-16.
[3] SHAO Y,WU C H,WU T T,et al. Eugenol-chitosan nanoemulsions by ultrasound-mediated emulsification:formulation,characterization and antimicrobial activity[J]. Carbohydrate Polymers,2018,193:144-152.
[4] SUN S F,YAN Z. A novel process to prepare chitosan macrospheres without shrinkage and its application to immobilize β-galactosidase[J]. E-Journal of Chemistry,2009,6(4):1211-1220.
[5] 刘流,郭红英. O-羧甲基壳聚糖对酱油抑菌防腐研究[J]. 食品科学,2002,23(5):130-132.
[6] 张昆明,陆小菊,黄永春,等. 水力空化及其在生物资源领域中的应用研究进展 [J]. 广西科技大学学报,2018,29(2):8-14.
[7] TSAIH M L,CHEN R H. Effect of degree of deacetylation of chitosan on the kinetics of ultrasonic degradation of chitosan[J]. Journal of Applied Polymer Science,2003,90(13):3526-3531.
[8] 李军立,张波,马力. 壳聚糖的超声波降解及最佳工艺研究[J]. 西华大学学报(自然科学版),2011,30(5):100-103.
[9] 张传杰. 低聚壳聚糖的制备、溶解及其包覆海藻纤维的结构与性能[D]. 无锡:江南大学,2018.
[10] 许佳丽,黄永春,袁媛,等. 基于文丘里管的水力空化降解壳聚糖的研究[J].食品工业科技,2016,37(2):244-248.
[11] 张翠玲,贲爱玲,张凤. 超声波辅助木瓜蛋白酶降解壳聚糖研究[J]. 化工时刊,2018,32(7):6-8.
[12] 章斌,侯小桢,丁心,等. 超声处理对壳聚糖脱乙酰度及其澄清柠檬汁的影响研究[J]. 食品工业,2016,37(10):172-175.
[13] YUE W,YAO P J,WEI Y N,et al. Synergetic effect of ozone and ultrasonic radiation on degradation of chitosan[J]. Polymer Degradation and Stability,2008,93(10):1814-1821.
[14] TSAIH M L,TSENG L Z,CHEN R H. Effects of removing small fragments with ultrafiltration treatment and ultrasonic conditions on the degradation kinetHgowaM70m2nq2/r1Dyfs8cnMkx5/Xon2KzAEwiu236E=ics of chitosan[J]. Polymer Degradation and Stability,2004,86(1):25-32.
[15] 刘燕. 电化学降解壳聚糖的研究[D]. 南京:南京理工大学,2010.
[16] EL-SAWY N M,ABD EL-REHIM H A,ELBARBARY A M,et al. Radiation-induced degradation of chitosan for possible use as a growth promoter in agricultural purposes[J]. Carbohydrate Polymers,2010,79(3):555-562.
[17] PINJARI D V,PANDIT A B. Cavitation milling of natural cellulose to nanofibrils[J]. Ultrasonics Sonochemistry,2010,17(5):845-852.
Study on the degradation of chitosan in suspension systems by
ultrasonic radiation
CHEN Lishan1, 2, HUANG Yongchun*1, 2, ZHANG Kunming1, 2
(1. School of Bioiogical and Chemical Engineering, Guangxi University of Science and Technology, Liuzhou 545006, China; 2. Guangxi Key Laboratory of Green Processing of Sugar Resources, Liuzhou 545006, China)
Abstract: For exploring the effect of ultrasonic radiation on chitosan degradation in suspension systems, with the relative viscosity of degraded chitosan solution and the content of reducing sugar as evaluation indicators, the effects of pH of suspension, chitosan particle size, ultrasonic temperature, ultrasonic power and ultrasonic time on the degradation performance of chitosan in suspension system were studied, and the structure of raw materials and degradation products were characterized respectively. The results showed that under the experimental conditions of suspension pH 5.0, chitosan particle size 116 μm, ultrasound temperature 25 ℃, ultrasound power ratio 80%, and ultrasound time 5 h, the reduced sugar content of the degraded solution increased from 9.98 mg/L to 188.43 mg/L, relative viscosity decreased from 1.95 to 1.46; Structural characterization analysis found that the crystallinity of solid chitosan slightly increased after degradation, suggesting that ultrasound radiation preferentially acted on the amorphous region of chitosan. The research results indicate that ultrasonic radiation treatment of heterogeneous chitosan suspension system is beneficial for promoting the dissolution and degradation of solid-state chitosan molecules.
Keywords: suspension system; chitosan degradation; ultrasonic cavitation; relative viscosity; reduced sugar
(责任编辑:罗小芬,于艳霞)
收稿日期:2023-03-15;修回日期:2024-02-26
基金项目:国家自然科学基金项目(31660472)资助
第一作者:陈丽珊,在读硕士研究生
*通信作者:黄永春,博士,教授,研究方向:生物资源加工及过程强化,E-mail:huangyc@yeah.net
