基于16S rRNA全长高通量测序分析桶子鸡中细菌多样性
2024-11-05许妍妍董宇





摘要 [目的]研究不同加工过程桶子鸡所携带的微生物多样性及菌落组成。[方法]采用PacBio三代全长高通量测序技术,对桶子鸡样本所携带细菌的16S rRNA的V1-V9区进行测序后进行统计分析。[结果]共获得67 287条有效序列,2 300个OTU数目,不同加工环节的桶子鸡中细菌群落存在差异。在门水平上,共获得15个细菌门,优势菌主要为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、异常球菌-栖热菌门(Deinococcus-Thermus)、疣微菌门(Verrucomicrobia);在属水平上,共获得250个细菌属,优势菌属为假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、葡萄球菌属(Staphylococcus)、环丝菌属(Brochothrix)、中慢生根瘤菌属(Mesorhizobium)、Janthinobacterium、黄杆菌属(Flavobacterium)、希万氏菌属(Shewanella)、Kaistella、冷杆菌属(Psychrobacter);在种水平上,共获得621个细菌种,优势菌种为Sediminibacterium magnilacihabitans、慢生根瘤菌sp011516665、Bradyrhizobium sp011516665、Pseudomonas fragi、干酪巨球菌(Macrococcus caseolyticus)、希瓦氏菌(Shewanella baltica)等。[结论]同一加工环境中获得的老汤复煮桶子鸡、放置12 h桶子鸡和老汤3个样本中携带的优势菌群组成存在一定相似性,但相对丰度存在一定差异。生鲜鸡及另一加工场所制作的刚出锅桶子鸡的优势菌组成与其他样本有很大差异。
关键词 桶子鸡;细菌;16S rRNA;三代全长;高通量测序;微生物多样性
中图分类号 TS 251.6 文献标识码 A
文章编号 0517-6611(2024)20-0148-07
doi:10.3969/j.issn.0517-6611.2024.20.037
开放科学(资源服务)标识码(OSID):
High-Throughput Sequencing AnalysismqNTATb0YdfQTXiPGGpCj2e6+zk3dpHe0VZScsZqX50= by 16S rRNA of Bacterial Diversity in Bucket Chicken
XU Yan-yan,DONG Yu
(Kaifeng Center for Food and Drug Quality and Safety,Kaifeng,Henan 475000)
Abstract [Objective]To study the microbial diversity and the microbial community composition of bucket chicken at different processing.[Method]The V1-V9 region of 16S rRNA of the bacteria in the bucket chicken samples were sequenced by the PacBio full-length high-throughput sequencing technology.[Result]The 67 287 effective sequences and 2 300 OTU were obtained.There were some differences in the bacterial communities of the bucket chicken in different processing stages.A total of 15 bacterial phylum were obtained and the dominant bacteria are Proteobacteria,Bacteroidetes and Actinobacteria,Firmicutes,Deinococcus-Thermus,Verrucomicrobia;at the genus level,a total of 250 bacterial genus were obtained,the dominant bacteria genus were Pseudomonas,Acinetobacter,Staphylococcus,Brochothrix,Mesorhizobium,Janthinobact erium,Flavobacterium,Shewanella,Kaistella,Psychrobacter;at the species level,a total of 621 bacterial species were obtained,and the dominant species were Sediminibacterium magnilacihabitans,Bradyrhizobium sp 011516665,Pseudomonas fragi,Macrococcus caseolyticus,Shewanella baltica.[Conclusion]The microbial communities in the three samples of recooked bucket chicken,12-hour bucket chicken and soup obtained in the same processing environment were similar,but there are some differences in relative abundance.The dominant bacterial composition of fresh bucket chicken produced at another processing site and fresh chicken was different from other samples.
Key words Bucket chicken;Bacterium;16S rRNA;Full-length;High-throughput sequencing;Microbial diversity
桶子鸡是古都开封的一道特色名菜,是我国传统卤禽肉制品的典型代表,因其形似圆桶而得名。桶子鸡颜色鲜黄,口感咸香嫩脆,肥而不腻,越嚼越香,通常现做现食,深受消费者的喜爱[1]。鸡肉本身富含蛋白质、脂肪等营养成分,水分活度较高,虽然桶子鸡在煮制过程中采用高浓度盐卤,但煮制温度较低,仅能杀死耐热性较低的腐败菌及致病菌的营养体,而芽孢和耐热性微生物仍可存在。在产品贮存、运输和销售过程中,当条件适宜时,极易因微生物的大量增殖而导致产品的腐败变质,因此常温下其货架期较短,货架期问题成为制约其跨地域发展的重要因素。食品安全国家标准熟肉制品GB 2726—2016中对熟肉制品的菌落总数、大肠菌群及致病菌等有明确的限量规定。刘欣等[2](2019年)利用抗菌肽(乳酸链球菌素)对桶子鸡的保鲜效果进行研究,结果表明,不同温度下贮藏的桶子鸡随着贮藏时间的延长,菌落总数、pH、TVB-N值、TBA值等指标均呈上升趋势,可通过抑制桶子鸡中微生物的繁殖进而延长桶子鸡的贮藏时间。因此,桶子鸡加工过程中细菌多样性的研究对于从源头把控细菌污染、繁殖及延长桶子鸡货架期,进而保障桶子鸡的食品安全具有一定的理论指导意义。
高通量测序技术在短时间内可测序大量核酸分子,不仅可检测出普通微生物还能检测出不易培养、丰度低和一些难以分离的微生物[3-4],能够更好地解释微生物菌群的组成和多样性,具有检测快速、通量高、灵敏度高等优点[5]。二代、三代高通量测序技术被应用于食品领域,其研究对象包括肉制品、水产品及发酵类食品。16S rRNA普遍存在于原核生物中,共有10个保守区和9个高可变区,因此兼具特异性和保守性的16S rRNA被广泛应用于细菌高通量测序研究。基于电信号而不是光信号的三代高通量测序技术采用的是纳米孔单分子技术,不需要 PCR 扩增,测序读长比一代、二代测序技术长[6]。通过多重比对方法获取环形一致序列(circular consensus sequence,CCS)弥补了自身容易出现单个碱基错误的缺陷,将其错误率降低至可接受的范围内,选择99%的相似度作为预聚类阈值可以排除错误碱基的影响[7]。因三代测序技术可以覆盖16S rRNA的9个高变区域,避免了仅选取V4、V3-V4、V4-V5、V1-V3、V3和V4-V6单个或多个可变区分段扩增所带来的局限性。基于SMRT测序技术的微生物16S rRNA基因全长测序可以有效提高环境微生物研究的分辨率[8],将更多微生物注释到种水平,并提高物种丰度预测的准确性。
目前,国内外利用高通量测序技术对桶子鸡加工过程中细菌多样性的研究较为少见。笔者利用三代全长高通量测序技术分析不同加工环节中桶子鸡所携带的细菌菌群组成情况,为后期生产加工中关键控制点的制订,选择有针对性的抑菌防腐剂,进而延长产品货架期提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品。桶子鸡的制作选用生长期1~3年的健康母鸡,经开小口取内脏、老汤浸煮等传统工艺制作而成。为研究不同加工环节中桶子鸡表面菌群多样性,选取5个代表性样本。刚出锅桶子鸡来源于河南省开封某地区某桶子鸡熟食店,为0号样本,老汤复煮5 min桶子鸡为1号样本,于加工场所冷库内放置12 h桶子鸡为2号样本,煮制桶子鸡专用老汤为3号样本,用于加工桶子鸡的冷鲜鸡为4号样本,4个样本均来源于河南省开封某地区某桶子鸡加工厂,其中老汤复煮5 min桶子鸡为研究专用样本。
1.1.2 试剂。DNA抽提试剂盒(美国Omega Bio-Tek公司);琼脂糖(法国Biowest公司);PCR试剂盒(北京TransGen AP221-02:TransStart Fastpfu DNA Polymerase);凝胶回收试剂盒(美国Axygen);建库试剂盒(美国Pacific Biosciences)。
1.1.3 仪器。微量冷冻离心机(美国Thermo);台式高速离心机(德国Eppendorf);超微量分光光度计(美国Thermo Fisher Scientific);质谱仪(美国Thermo);磁力架(美国Invitrogen);蛋白电泳仪(美国 Bio-Rad);超声波核酸打断仪(美国 Covaris);凝胶成像仪(中国Tanon);核酸电泳仪(中国Tanon);PCR仪(美国ABI GeneAmp 9700型);测序仪(美国Pacific Biosciences)。
1.2 方法
1.2.1 样品处理。于某桶子鸡熟食店选取刚出锅桶子鸡(0号样本),于某桶子鸡加工厂选取冷库放置12 h桶子鸡(2号样本),冷库放置12 h桶子鸡再经老汤复煮5 min后制得老汤复煮桶子鸡(1号样本),制作桶子鸡的冷鲜鸡(4号样本)数只,分别用无菌棉签擦拭其表面,后用无菌棉签蘸取适量制作桶子鸡的老汤(3号样本),共5个样本分别置于无菌袋中常温运输,于4 ℃保存。
1.2.2 样品DNA的提取和扩增子的制备。 参照E.Z.N.A. Soil DNA Kit (Omega Bio-tek,Norcross,GA,U.S.) 试剂盒说明书,提取5个样本中的微生物组总DNA。采用16S rRNA全长通用引物,27F(上游引物) 5′-barcode-AGAGTTTGATCMTGGCTCAG)-3′和1492R(下游引物) 5′-CRGYTACCTTGTTACGACTT-3′进行PCR扩增,每个样本的扩增引物含有8碱基标签序列,用以区分样本。PCR反应体系总体积为20 μL∶4.0 μL的5×FastPfu Buffer,2.0 μL 2.5 mmol/L dNTPs,上、下游引物各0.8 μL(5 μmol/L),0.4 μL FastPfu Polymerase,以及10 ng模板 DNA。 PCR扩增试验程序如下:95 ℃下进行5 min;在95 ℃下进行30 s,在58 ℃下进行30 s,在72 ℃下进行45 s,上述步骤进行30个循环,最后 72 ℃保持10 min,临用前置于10 ℃。每个样本3次重复,后将同一样本的3个PCR扩增产物混合后经2%琼脂糖凝胶电泳检测,用DNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris HCl洗脱;后采用 AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,U.S.) 试剂盒参照说明书操作流程进行纯化。参照电泳初步定量结果,将PCR产物用QuantiFluorTM -ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求进行相应比例的混合。
1.2.3 测序和数据处理。根据制造商的说明书(Pacific Biosciences)从扩增的DNA中制备SMRTbell文库。将每个样本连接特定的barcode序列后等质量混合,扩增子混合物使用Pacific Biosciences SMRTbellTM Template Prep kit 1.0试剂盒构建测序文库并在PacBio Sequel Ⅱ上进行测序。所有扩增子测序均由上海凌恩生物科技有限公司(中国上海)承担。
获取环形一致性序列(CCS reads)及OTU聚类分析:使用SMRT Link Analysis软件V9版处理PacBio原始序列reads,以获得环形一致性序列:参数设置最小通过次数为3,最小预测准确度达到99%。使用UPARSE(7.1版,http://drive5.com/uparse/)将OTU按照98.65%的相似性阈值聚类[9],并使用UCHIME鉴定并去除嵌合序列。
采用uclust algorithm(v1.2.22q版本),置信度阈值为0.8,对OTU代表序列按照domain(域)、phylum(门)、class(纲)、order(目)、family(科)、genus(属)、species(种)共7个分类水平进行分类,进而分析各样本的细菌群落组成,比对Silva 16S rRNA数据库(Release138.1 http://www.arb-silva.de),分析桶子鸡不同加工环节中细菌的群落组成。基于Mothur版本v.1.35.1[10]软件进行的稀释曲线分析,以揭示Alpha多样性指数,包括Chao、Richness、Simpson和Shannon多样性指数。Beta多样性分析使用主成分分析PCA[11]比较群落差异,主要分析软件为R版本3.6.3。
2 结果与分析
2.1 测序数据统计 将样本测序后所得细菌群落的原始序列数据进行筛选,去除不合格的序列后,5个样本的有效序列主要集中在1 301~1 500 bp,共67 287条,占全部序列的98.47%,大于1 500 bp的非有效序列占全部序列的1.5%。不同加工环节桶子鸡的微生物群落有效序列有较大差异。有效序列见表1。
2.2 OTU聚类分析 通过UPARSE软件对5个样本的序列进行归类操作(cluster)及聚类分析,将全长序列相似水平达到98.65%归为一个操作分类单元(OTU),对所得的OTU进行生物信息统计分析,共获得2 300个OTU,其中放置12 h 桶子鸡中获得的OTU数量最多,为741个,老汤中获得的OTU数最少,为443个。为了得到每个OTU对应的物种分类信息,采用uclust算法对OTU代表序列进行分类学分析,分别在各个分类水平:domain(域),phylum(门),class(纲),order(目),family(科),genus(属),species(种)统计各样本的群落组成,通过Silva数据库(Release138.1 http://www.arb-silva.de)进行比对。由图1可知,5个样本的稀释曲线均呈先增加后趋于相对平稳趋势,继续增大数据量只会产生较为少量新的OTU,说明5个样本的测序数据量均较为合理,测序数据量能够将样本中绝大部分的物种覆盖[6,12]。
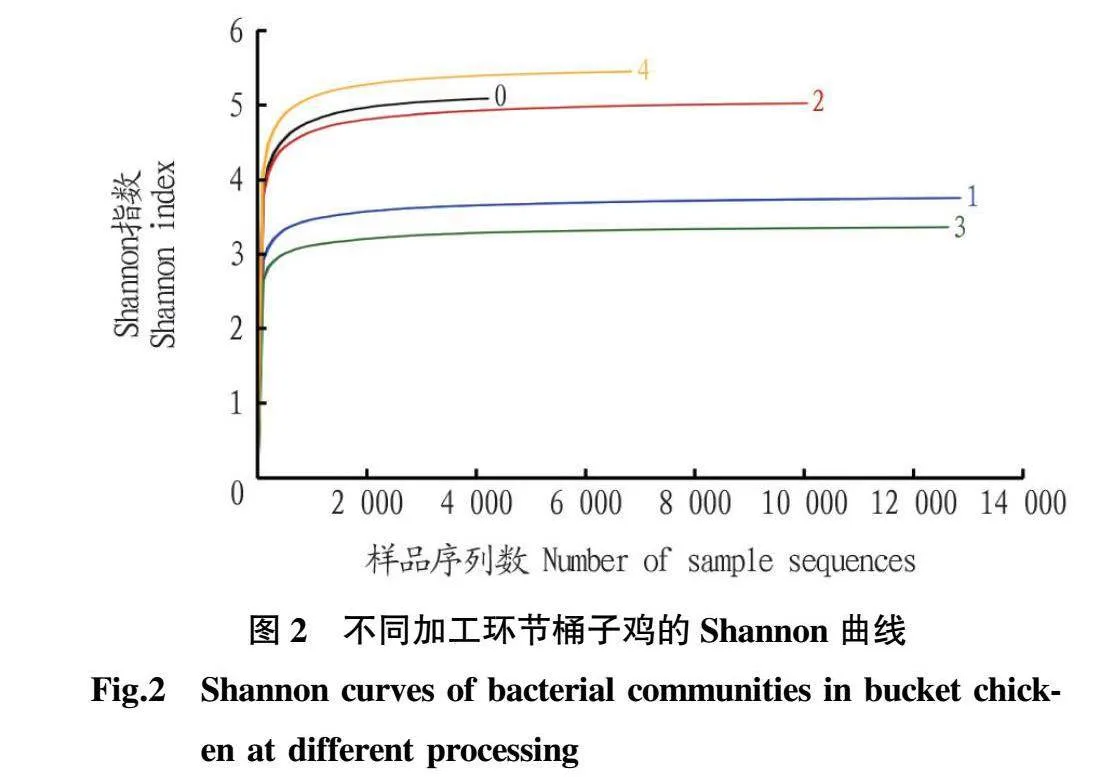
由图2可知,5个样本的Shannon曲线[13]略有差异,但均趋于平坦,说明5个样本的测序数据量足够大,可以反映样本中绝大多数的微生物信息。
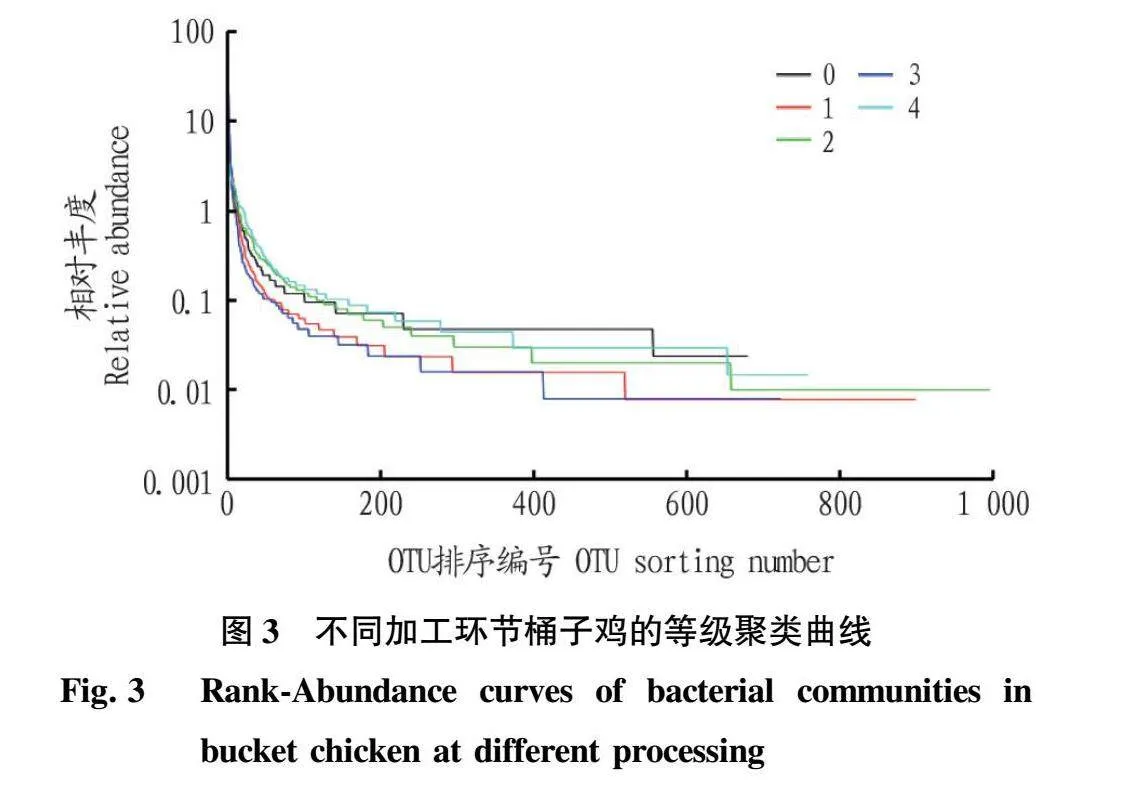
等级聚类曲线图(Rank-abundance)中横坐标的宽度反映物种的丰富性,纵坐标的平滑程度代表物种的均匀分布情况。由图3可知,5个样本的等级聚类曲线均呈较平缓趋势,说明5个样本所带细菌种类都较为均匀。冷库放置12 h桶子鸡在横轴上的范围最大,其次是复煮5 min桶子鸡、生鲜鸡、老汤及刚出锅桶子鸡,说明放置12 h桶子鸡中微生物的物种丰度最高,其次是复煮5 min桶子鸡,而老汤和刚出锅桶子鸡的物种丰度均较低。在冷库放置12 h桶子鸡经过复煮5 min桶子鸡宽度明显低于放置12 h桶子鸡,说明老汤煮制可部分降低该样本中微生物的物种丰度,但复煮5 min桶子鸡的宽度明显宽于老汤,可见,经老汤煮制5 min桶子鸡表面的微生物仍具有较高的物种丰度,高盐的老汤难以将放置12 h 桶子鸡表面的微生物杀灭。刚出锅桶子鸡的宽度最低,表明刚出锅桶子鸡的微生物物种丰度最低。
2.3 Alpha 多样性分析 采用Alpha多样性分析评估5个样本中细菌群落的物种丰度和多样性,其中Chao指数和Richness指数用来反映物种丰富度,Shannon指数和Simpson指数可以反映物种多样性。
由表2可知,放置12 h桶子鸡的Chao指数和Richness指数均最高,复煮5 min桶子鸡的Chao指数和Richness指数处于第2位,刚出锅桶子鸡的Chao指数和Richness指数均为最低。放置12 h桶子鸡中携带的细菌丰富度最高,所含的物种种类多,这可能是由于放置12 h的桶子鸡表面已引入部分外源细菌。加工桶子鸡所用的老汤,其Chao指数高于生鲜鸡,老汤中所含的细菌种类总数高于生鲜鸡中的物种总数。桶子鸡在加工过程中采用反复使用的老汤及煮制过程中加入的食用盐、八角、花椒、丁香、葱和姜等调味料,使生鲜鸡在煮制过程引入了其他种类的细菌,导致桶子鸡老汤中细菌物种丰富度指数升高。
由表2可知,生鲜鸡的Shannon指数最高,达7.86,而Simpson指数最低,仅0.010,表明生鲜鸡中所携带的细菌群落多样性最高;老汤的Shannon指数最低,仅4.85,而Simpson指数最高,为0.120,表明老汤中的细菌群落多样性最低。放置12 h桶子鸡的Shannon指数高于复煮桶子鸡,而其Simpson指数低于复煮桶子鸡,表明将放置12 h的桶子鸡再次放入老汤复煮会降低桶子鸡表面所携带的部分细菌群落多样性。刚出锅桶子鸡的Shannon指数低于生鲜鸡,且其Simpson指数高于生鲜鸡,表明刚出锅桶子鸡表面携带的细菌群落多样性低于生鲜鸡,但高于其他3个样本,可见不同加工场所,桶子鸡表面携带的细菌群落有较大差异。
Coverage值是指测的序列对样本的覆盖率,其值越高,表明测出的样本序列概率越高,可以准确地反映样品中微生物多样性的情况。由表2可知,Coverage值均达到0.96以上,其中生鲜鸡的Coverage值最大,达0.983 6,而放置12 h桶子鸡的Coverage值最小,为0.963 7,表明该测序结果基本可以代表样本中微生物的真实情况。
结合5个样本的 Coverage值、稀释曲线图、Shannon曲线图及等级聚类曲线图来看,该测序结果已覆盖到样本中绝大多数微生物,5个样本的OTU分类基本能够真实反映样品中微生物的群落多样性,但各样本的OTU存在一定差异,表明不同加工环节桶子鸡细菌群落存在一定差异。
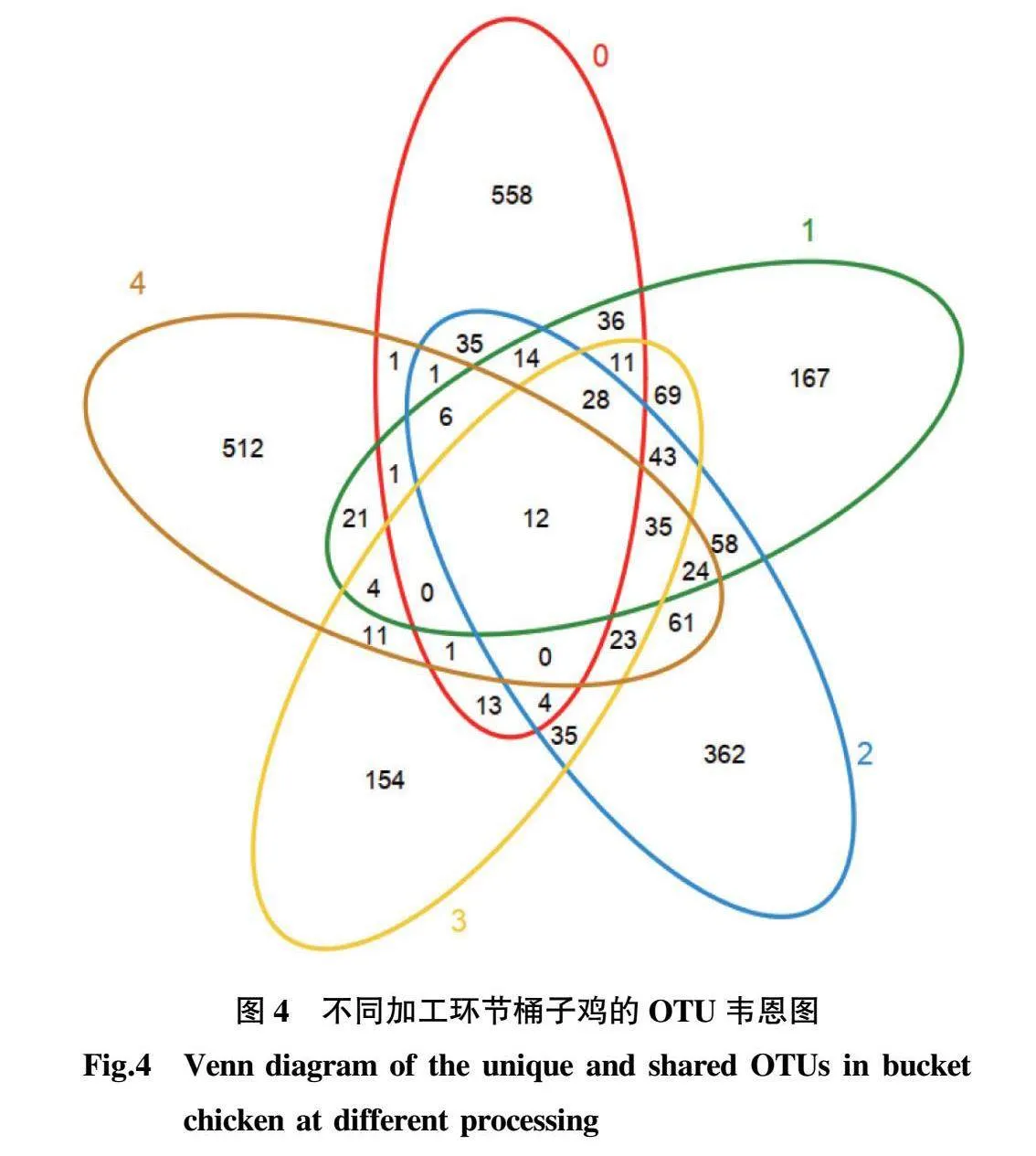
2.4 细菌OTU分布 由图4可知,5个样本共有12个OTU,其中刚出锅桶子鸡独有的OTU数量最多,达558个,其次是生鲜鸡中独有的OTU数量,为512个,放置12 h桶子鸡独有的OTU数量为362个,复煮5 min桶子鸡独有的OTU数量为167个,老汤独有的OTU数量为154个,表明各样本之间菌群结构具有明显差异。
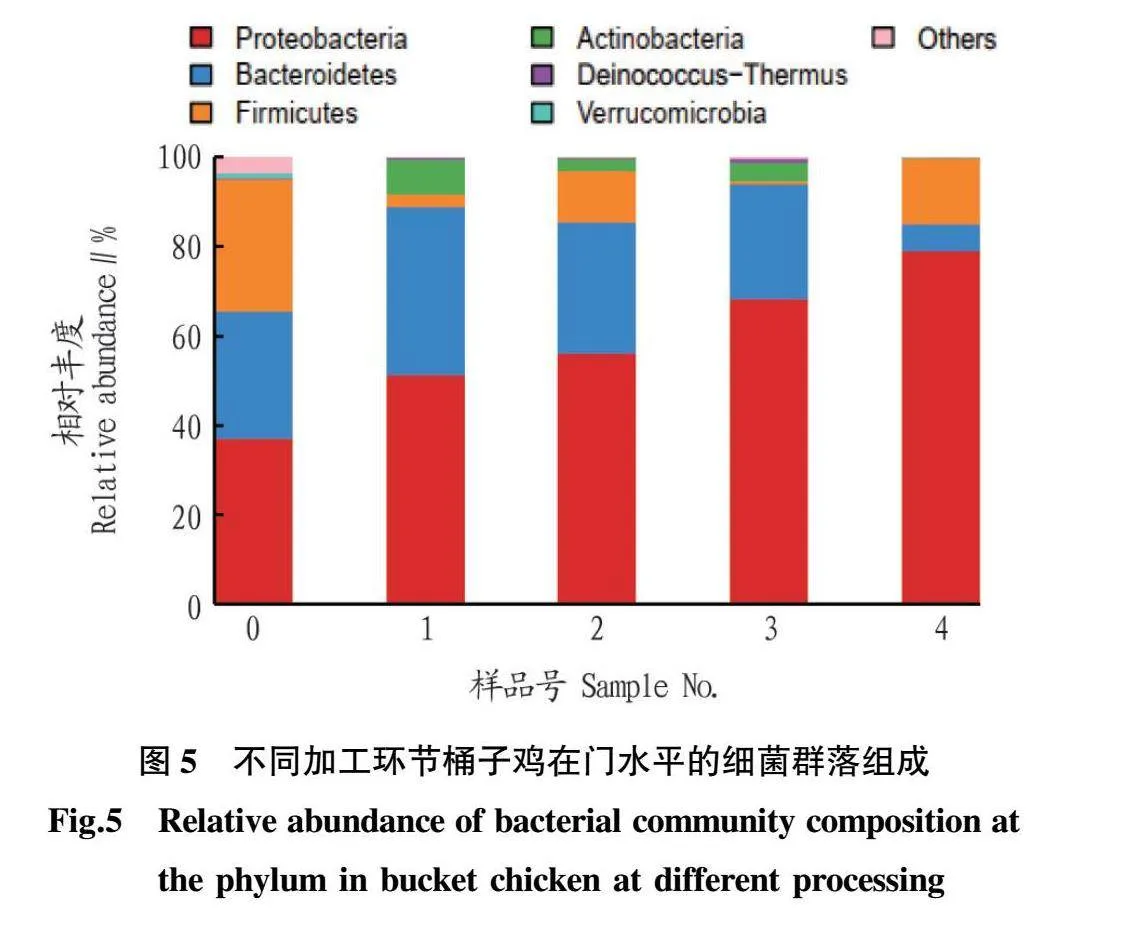
2.5 不同加工环节桶子鸡中细菌群落结构组成 在门水平上,5个样本共获得15个细菌门,单个样本获得的细菌门数量依次为13、6、6、7、4个。如图5所示,在不同加工过程中,5个样本在门水平上优势菌主要为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、异常球菌-栖热菌门(Deinococcus-Thermus)、疣微菌门(Verrucomicrobia)。其中,变形菌门(Proteobacteria)在生鲜鸡中相对丰度最高,达79.32%,在刚出锅桶子鸡中相对丰度最低,仅36.98%。拟杆菌门(Bacteroidetes)在刚出锅桶子鸡、复煮5 min桶子鸡、放置12 h桶子鸡和老汤中相对丰度均大于20%,在生鲜鸡中相对丰度最低,仅5.80%。厚壁菌门(Firmicutes)在刚出锅桶子鸡和生鲜鸡中均为前2位优势菌门,相对丰度分别为29.74%和14.75%,而在老汤中未达到1%,放置12 h桶子鸡达到11.69%,复煮5 min桶子鸡为2.76%,可见放置12 h桶子鸡表面存在较多的厚壁菌门,再次放入锅中复煮可使表面的厚壁菌门菌群降低。放线菌门(Actinobacteria)在复煮5 min桶子鸡、放置12 h桶子鸡和老汤中相对丰度均高于2%,而在生鲜鸡和刚出锅桶子鸡中相对丰度较低,分别为0.38%和0.07%。可见,不同加工环境桶子鸡表面携带的菌群有较大差异。宋相宇等[14](2020年)在研究白切鸡细菌群落时,发现42个样品中均存在上述4个细菌门,海丹等[15]研究发现,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)也是鸭皮表面主要的细菌门。异常球菌-栖热菌门(Deinococcus-Thermus)在刚出锅桶子鸡和生鲜鸡表面未检出,而在老汤中相对丰度高于1%,而在放置12 h桶子鸡中最低,仅0.21%,在复煮5 min桶子鸡提高到0.48%。可见,复煮5 min桶子鸡和放置12 h桶子鸡中的异常球菌-栖热菌门可能是老汤中引入的,而刚出锅桶子鸡表面未携带异常球菌-栖热菌门。疣微菌门(Verrucomicrobia)是刚出锅桶子鸡独有的,相对丰度为1.33%。这表明不同加工环境,桶子鸡表面携带的菌群有一定差异。
在属的水平上,5个样本共获得250个细菌属,单个样本获得的细菌属数量依次为155、97、127、119、82和40个,5个样本的物种丰度如图6所示。由图6可知,生鲜鸡所携带的细菌属与刚出锅桶子鸡、复煮5 min桶子鸡、放置12 h桶子鸡、老汤的菌属差异较大,其优势菌属按相对丰度大小依次为假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、葡萄球菌属(Staphylococcus)、环丝菌属(Brochothrix)、中慢生根瘤菌属(Mesorhizobium)、Janthinobacterium、黄杆菌属(Flavobacterium)、希万氏菌属(Shewanella)、Kaistella、冷杆菌属(Psychrobacter)。
同一加工场所的3个样本复煮5 min桶子鸡、放置12 h桶子鸡、老汤所携带的细菌组成在属水平上较为接近,但相对丰度有一定差距,优势菌属分别为土壤杆菌属(Sediminibacterium)、假单胞菌属(Pseudomonas)、慢生根瘤菌属(Bradyrhizobium)、甲基病毒古菌属(Methylovirgula)、希万氏菌属(Shewanella)、不动杆菌属(Acinetobacter)、副伯克霍尔德菌属(Paraburkholderia)、中慢生根瘤菌属(Mesorhizobium)、巨球菌属(Macrococcus)、分枝杆菌属(Mycobacterium)、Rhodanobacter、冷杆菌属(Psychrobacter)、Chitinophaga、葡萄球菌属(Staphylococcus)、链球菌属(Streptococcus)、环丝菌属(Brochothrix)、普雷沃氏菌属(Prevotella)、乳球菌属(Lactococcus)、肠杆菌属(Enterobacter)、黄杆菌属(Flavobacterium)。
另一加工场所制作的刚出锅桶子鸡所携带的细菌组成在属水平上与其他桶子鸡在菌群组成上有一定差异,其优势菌属为巨球菌属(Macrococcus)、土壤杆菌属(Sediminibacterium)、普雷沃氏菌属(Prevotella)、肠杆菌属(Enterobacter)、克雷伯氏菌属(Klebsiella)、Duncaniella、冷杆菌属(Psychrobacter)、拟杆菌属(Bacteroides)、慢生根瘤菌属(Bradyrhizobium)、肠球菌属(Enterococcus)、嗜胆菌(Bilophila)、中慢生根瘤菌属(Mesorhizobium)、甲基卵古菌属(Methylovirgula)、不动杆菌属 (Acinetobacter)、乳球菌属(Lactococcus)、链球菌属(Streptococcus)、柠檬酸杆菌属(Citrobacter)、埃希氏菌属(Escherichia)、阿克曼菌(Akkermansia)。
土壤杆菌属(Sediminibacterium)在刚出锅桶子鸡、复煮5 min桶子鸡、放置12 h桶子鸡和老汤中为优势菌属,相对丰度分别为8.17%、32.09%、17.53%、21.52%,而在生鲜鸡中相对丰度仅为0.16%。假单胞菌属(Pseudomonas)是生鲜鸡的优势菌属,相对丰度达到57.74%,在其他样本中相对丰度均低于3%。慢生根瘤菌属(Bradyrhizobium)是复煮5 min桶子鸡、放置12 h桶子鸡、老汤的优势菌属,相对丰度分别为19.52%、8.10%、29.17%,而在刚出锅桶子鸡及生鲜鸡中相对丰度仅为3.59%和0.07%。甲基病毒古菌属(Methylovirgula)是复煮5 min桶子鸡、放置12 h桶子鸡、老汤的优势菌属,相对丰度分别为6.91%、3.28%、9.92%,而在刚出锅桶子鸡中相对丰度较低,仅为1.76%,在生鲜鸡中未检出。希万氏菌属(Shewanella)是放置12 h桶子鸡的优势菌属,相对丰度达到15.15%,在复煮5 min桶子鸡中相对丰度仅为0.33%,在老汤中相对丰度为0.40%,在刚出锅桶子鸡中未检出。不动杆菌属(Acinetobacter)是生鲜鸡的优势菌属,相对丰度达到8.46%,在刚出锅桶子鸡、复煮5 min桶子鸡、放置12 h桶子鸡和老汤中相对丰度较低,分别为1.50%、2.21%、3.78%和0.69%。副伯克霍尔德菌属(Paraburkholderia)是老汤的是优势菌属,相对丰度达到10.12%,在刚出锅桶子鸡、复煮5 min桶子鸡、放置12 h桶子鸡和生鲜鸡中相对丰度较低,分别为0.38%、2.07%、2.76%和0.02%。可推测采用老汤煮制可引入副伯克霍尔德菌属。中慢生根瘤菌属(Mesorhizobium)在5个样本中均有检出,相对丰度差异不大,在1.95%~4.11%。巨球菌属(Macrococcus)是刚出锅桶子鸡独有的优势菌属,相对丰度达到14.42%,而在其他4个样本中其相对丰度均仅0.03%。分枝杆菌属(Mycobacterium)在复煮5 min桶子鸡和老汤中的相对丰度为7.60%和3.85%,而在放置12 h桶子鸡中相对丰度较低,仅2.19%,在刚出锅桶子鸡中相对丰度仅为0.07%,而在生鲜鸡中未检出。
在种的水平上,5个样本共获得621个细菌种,单个样本获得的细菌种数量依次为273、210、285、174和148个。由图7可知,相同加工环境中获得的复煮5 min桶子鸡、放置12 h桶子鸡和老汤3个样本中携带的优势菌种存在一定相似性,但相对丰度存在一定差异,与另一加工场所制作的刚出锅桶子鸡及生鲜鸡的优势菌种组成有较大差异。Sediminibacterium magnilacihabitans菌由LPSN原核生物标准命名列表(https://www.bacterio.net/)中查询显示,是一种需氧、中温(28 ℃最适)、革兰氏阴性杆状细菌。Sediminibacterium magnilacihabitans在4个样本中均为优势菌种,同一加工场所的复煮5 min桶子鸡、放置12 h桶子鸡和老汤中均存在大量Sediminibacterium magnilacihabitans,冷库中放置12 h的桶子鸡表面携带的Sediminibacterium magnilacihabitans相对丰度低于复煮5 min和老汤,可推测低温环境及其他细菌的竞争生长,导致Sediminibacterium magnilacihabitans的丰度降低。慢生根瘤菌sp011516665 (Bradyrhizobium sp011516665)的相对丰度在老汤中最高,而在生鲜鸡中并未检出,冷库放置12 h后经老汤复煮,该种菌的相对丰度升高,结合慢生根瘤菌的生活特性推测是在老汤中添加香辛料的过程中引入的。草莓假单胞菌(Pseudomonas fragi)也是一种嗜温菌,在有氧条件下可加速食品腐败变质[16],在生鲜鸡中所占丰度比最高,达27.98%,而在复煮5 min桶子鸡和老汤中的相对丰度均低于1%,在放置12 h桶子鸡中的相对丰度达到1.3%。可见,老汤煮制过程可将草莓假单胞菌(Pseudomonas fragi)控制在较低水平,但放置12 h后草莓假单胞菌(Pseudomonas fragi)的比例在桶子鸡样本中有所升高。生鲜鸡的其余16个优势菌在其他3个样本中所占比例均未达到0.6%,属于生鲜鸡中特有菌种。可见,桶子鸡采用老汤浸煮工艺可以将生鲜鸡中大部分优势菌种降低到较低水平。干酪巨球菌(Macrococcus caseolyticus)是革兰氏阳性葡萄球菌科中的嗜中温菌,是刚出锅桶子鸡独有的优势菌种,在其他4个样本中的相对丰度均低于0.02%。刚出锅桶子鸡的其他优势菌种佛里德兰德氏杆菌(Klebsiella pneumoniae)又称肺炎克雷伯菌,Duncaniella freteri,Psychrobacter sp.YP14,Enterobacter hormaechei_A,Bacteroides congonensis,Enterococcus cecorum,Prevotella ruminicola在其他4个样本中相对丰度均较低,可见不同加工场所桶子鸡所携带的优势菌种有一定差异。优势菌种希瓦氏菌(Shewanella baltica)在放置12 h桶子鸡中相对丰度达到9.52%,在其他3个样本中所占比例均少于1%。希瓦氏菌是革兰氏阴性杆菌中的兼性厌氧且耐低温细菌,可在不同的温度、大气压强及盐浓度等环境条件中生存和繁殖,可导致食品腐败。Shewanella sp002966515也属于希瓦氏菌属,其在放置12 h 桶子鸡中相对丰度达到3.94%,在其他样本中所占比例也均少于1%。
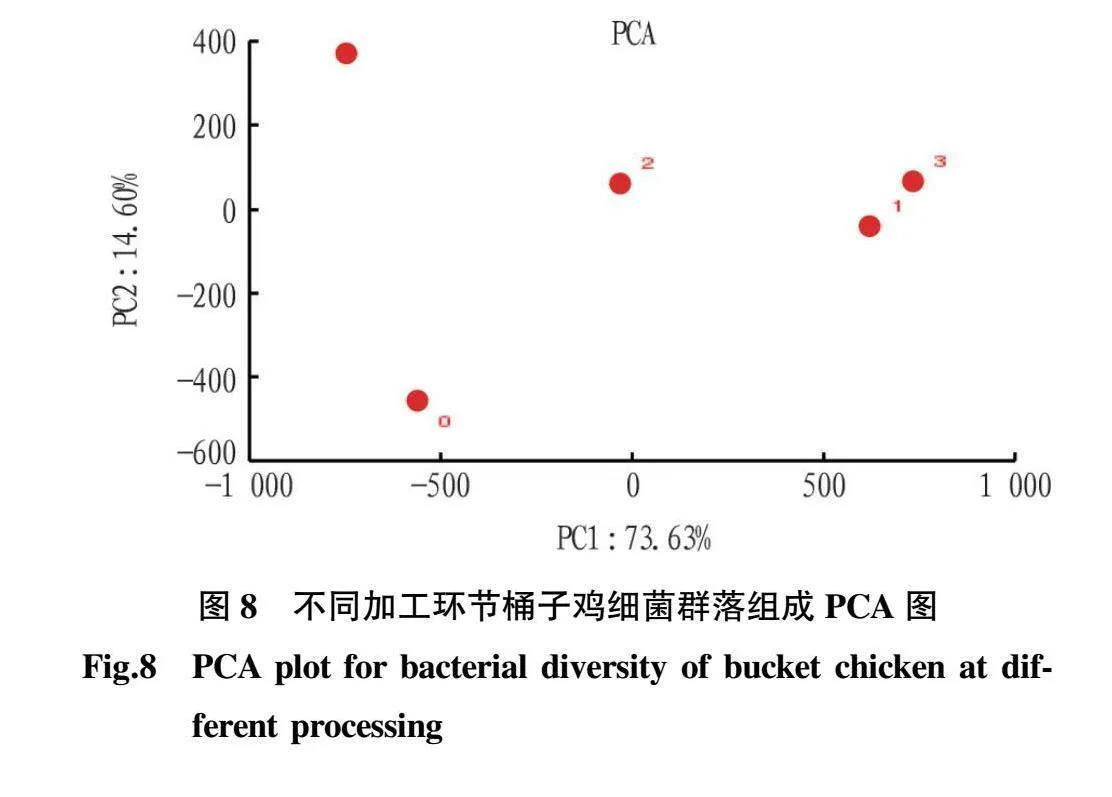
2.6 多样本PCA分析 为比较不同加工环节桶子鸡的菌群多样性差异,对5个样本携带微生物的OTU(98.65%相似性)进行Beta多样性分析。5个样本表现出分散和聚集的分布情况如图8所示,复煮5 min桶子鸡和老汤所在区域最近,表明二者的菌群组成最为接近,刚出锅桶子鸡、生鲜鸡分别在另外2个区域,冷库放置12 h桶子鸡样本点位于中心位置,与其他4个样本点相差较远,说明其菌群组成与其他样本相差较大。煮制桶子鸡用的老汤中含有大量的油脂、盐、香辛料,较为浓稠,在煮制过程中均匀地包裹在桶子鸡表面,使得复煮5 min桶子鸡的菌群组成与老汤中的菌群最为接近。可推测,另一加工场所制作的刚出锅桶子鸡,因其制作时使用的老汤不同,因此携带的菌群多样性有较大差异。
3 结论
桶子鸡的制作工艺:屠宰→煺毛(65~70 ℃)→开口整形→浸煮(80~90 ℃,2 h)[1],采用的杀菌工艺属于低温长时消毒法(巴氏杀菌),可使食品中的酶失活,并破坏食品中热敏性的微生物和致病菌,浸煮时采用的老汤,其中高浓度的盐不利于细菌的生长繁殖,进而较高程度地保留食物的营养及色香味;但鸡肉本身营养丰富且杀菌工艺难以将耐热细菌及芽孢杀灭,导致桶子鸡货架期短,销售范围受限。该研究采用3代全长高通量测序技术,对不同加工环境及不同加工环节对桶子鸡所携带的细菌多样性进行研究,发现生鲜鸡的菌群组成与其他样本差异较大,表明桶子鸡的制作工艺可将生鲜鸡中携带的大多数细菌杀灭,但由于制作过程中老汤、辅料(葱、姜、花椒、八角、桂皮等)的添加、人员操作、环境等因素可引入部分嗜中温菌、耐热菌,导致桶子鸡表面携带一定的微生物群落。同一加工环境下获得的老汤复煮桶子鸡与老汤中的菌群组成非常相似,因此,老汤中微生物的控制对成品桶子鸡有重要影响。刚出锅桶子鸡表面携带的细菌菌群在门和属的分类水平上均多于其他样本,可见,加工环境对桶子鸡表面携带的细菌群落组成有一定影响。该研究采用三代测序技术,可将桶子鸡表面携带的细菌群落鉴定到种,但由于OTU聚类分析阈值较低,可能导致物种数量被低估[7]。
参考文献
[1] 董宇,葛敏敏,李健,等.开封市传统食品制作技艺 桶子鸡:DB4102/T 020—2021[S].开封:开封市市场监督管理局,2021:1-3.
[2] 刘欣,王文艳,王娟,等.乳酸链球菌素对桶子鸡的保鲜效果[J].食品工业,2019,40(7):6-10.
[3] LABRIE S J,EL HADDAD L,TREMBLAY D M,et al.First complete genome sequence of Staphylococcus xylosus,a meat starter culture and a host to propagate Staphylococcus aureus phages[J].Genome announcements,2014,2(4):1-2.
[4] FIORE-DONNO A M,RIXEN C,RIPPIN M,et al.New barcoded primers for efficient retrieval of cercozoan sequences in high-throughput environmental diversity surveys,with emphasis on worldwide biological soil crusts[J].Molecular ecology resources,2018,18(2):229-239.
[5] DIAS M F,REIS M P,ACURCIO L B,et al.Changes in mouse gut bacterial community in response to different types of drinking water[J].Water research,2018,132:79-89.
[6] 黄志强,邱景璇,李杰,等.基于16S rRNA基因测序分析微生物群落多样性[J].微生物学报,202 61(5):1044-1063.
[7] 唐勇,刘旭.基于SMRT测序技术的16S rRNA基因全长测序及其分析方法[J].生物技术通报,2017,33(8):34-39.
[8] SCHLOSS P D,JENIOR M L,KOUMPOURAS C C,et al.Sequencing 16S rRNA gene fragments using the PacBio SMRT DNA sequencing system[J].PeerJ,2016,4:1-16.
[9] KIM M,OH H S,PARK S C,et al.Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes[J].International journal of systematic and evolutionary microbiology,2014,64(2):346-351.
[10] SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mothur:Open-source,platform-independent,community-supported software for describing and comparing microbial communities[J].Appl Environ Microbiol,2009,75(23):7537-7541.
[11] LOZUPONE C,LLADSER M E,KNIGHTS D,et al.UniFrac:An effective distance metric for microbial community comparison[J].ISME J,201 5(2):169-172.
[12] 郝卓莉.酸菜发酵期间细菌群落结构动态变化分析[J].中国酿造,2020,39(7):56-61.
[13] AMATO K R,YEOMAN C J,KENT A,et al.Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes[J].The ISME journal,2013,7(7):1344-1353.
[14] 宋相宇,李鸣,王虎虎,等.高通量测序分析白切鸡菌群多样性[J].食品科学,2020,41(17):246-252.
[15] 海丹,乔明武,宋莲军,等.高通量测序技术分析鸭皮中耐热菌群[J].肉类研究,2022,36(5):1-6.
[16] NYCHAS G J E,SKANDAMIS P N,TASSOU C C,et al.Meat spoilage during distribution[J].Meat science,2008,78(1/2):77-89.
