锰氧化细菌定殖对漂浮植物大薸去除水中锰和氨氮的影响
2024-11-05陈学敏唐艳葵尹涓涓蒋齐明黄锦孙姚秋艳张超兰




摘要 将2株具有植物促生长潜力的锰氧化细菌(manganese oxidizing bacteria,MOB)——微小杆菌属(Exiguobacterium)OS和松鼠葡萄球菌(Staphylococcus sciuri)WLS01分别定殖到漂浮植物大薸根部,通过观察和测定水培14 d前后植物的生长和生理响应、水中锰和氨氮含量、植物对锰的转运的变化来研究MOB定殖对植物的影响。结果表明:定殖OS和WLS01后大薸生物量增长比例分别达到31.29%和25.81%,远高于未定殖组,同时增强了其光合作用。但定殖MOB后的大薸根部出现损伤。
关键词 锰氧化细菌;植物促生长潜力;漂浮植物;大薸;锰污染;氨氮;微生物-植物修复
中图分类号 X 53 文献标识码 A
文章编号 0517-6611(2024)20-0059-06
doi:10.3969/j.issn.0517-6611.2024.20.014
开放科学(资源服务)标识码(OSID):
Effect of Colonization of Manganese Oxidizing Bacteria on the Removal of Manganese and Ammonia Nitrogen from Water by Floating Plant Pistia stratiotes
CHEN Xue-min,TANG Yan-kui,YIN Juan-juan et al
(School of Resources,Environment and Materials,Guangxi University,Nanning,Guangxi 530004)
Abstract Exiguobacterium sp.(OS) and Staphylococcus sciuri (WLS01),which were two strains of manganese oxidizing bacteria (MOB) with plant growth promoting potential,were inoculated in the roots of the floating plant Pistia stratiotes,respectively,the effects of MOB colonization on plants were studied by observing and measuring the growth and physiological response of plants before and after 14 days of water cultivation,changes in manganese and ammonia nitrogen content in water,and changes in manganese transport by plants.The results showed that colonization of OS and WLS01 led to an increase in P.stratiotes biomass by 31.29% and 25.81%,respectively compared to the uncolonized group,and the colonization also improved the plant photosynthesis.But after colonization MOB,damage appeared in the roots of P.stratiotes.
Key words Manganese oxidizing bacteria;Plant growth-promoting potential;Floating plant;Pistia stratiotes;Manganese pollution;Ammonia nitrogen;Microbial plant remediation
锰是国民经济不可或缺的金属材料,但在锰冶炼过程会产生电解锰渣,若处置不当,进入环境的锰和氨氮会对水体造成污染。水生植物具有良好的污染物去除能力且生态友好、成本低廉,已广泛应用于水环境生态修复中[1-5]。已有报道漂浮植物大薸可以有效去除水中包括锰在内的重金属[5],且植物易于收获[6],但高浓度锰暴露会对植物生长产生不利影响[7]。近年来,锰氧化细菌 (manganese oxidizing bacteria,MOB) 具有固定水中游离锰的能力不断被报道[8-9],不少学者已经在尝试利用水生植物发达的根系为微生物提供的良好栖息场所(根际泌氧),将具有植物促生长能力的MOB定殖到锰富集植物组织如沉水植物狐尾藻[10]中,不仅解决了高浓度锰的存在影响植物生长(降低生物量),进而降低植物修复效率的问题,实现更高效的细菌-植物联合修复。植物促生菌(Plant growth-promoting bacteria,PGPB)是指生存在植物根际范围内,对植物生长有促进或对病原菌有拮抗作用的有益的细菌统称。与植物伴生的PGPB可以通过产生一系列的化感物质,如抗生素、氰化氢、裂解酶和铁载体等来促进植物生长[11],PGPB还通过合成抗生素,如硝基吡咯、非那嗪、间苯三酚、环脂肽和脂肽等物质来防止植物被其他细菌和真菌侵染[12]。通过人为定殖同时兼具锰氧化能力和植物促生长潜力的菌株来促进漂浮植物生长并提高其锰富集能力以实现更高效的植物修复效率,是一个值得探索的研究领域。该研究将具有锰氧化和植物促生长能力的菌株OS(革兰氏染色阴性) 和 WLS01(革兰氏染色阳性)定殖到大薸根系,考察菌株对大薸生长生理响应以及氨氮去除和锰富集能力的影响。
1 材料与方法
1.1 试验材料
从广西大新县某锰矿区受锰污染溪流不同基质中筛选到2株锰氧化细菌(MOB),分别为松鼠葡萄球菌(Staphylococcus sciuri)WLS01菌株、微小杆菌属(Exiguobacterium)OS菌株,其来源和促生长能力见表1。大薸(Pistia stratiotes)为广西本土生长。
1.2 试验方法
1.2.1 微生物的扩培。
取出于-80 ℃甘油管中保存的菌株OS和WLS0 分别划线定殖至LB固体培养基,于35 ℃无菌培养箱中培养12 h。挑取固体培养基上生长的单菌落,定殖于LB液体培养基中过夜培养,使用无菌生理盐水调节菌悬液在600 nm下的光密度(OD)为1.000 ± 0.00 待用。
1.2.2 植物的培养。
采集长势良好的大薸植株,用自来水多次冲洗,去除植物表面的泥沙等杂质,并使用10% Hoagland营养液在光照培养箱(昼/夜温度25 ℃∶22 ℃,光/暗比12 h∶12 h,光照强度为15 000 lx)中浮水预培养10 d,从中挑选长势一致的植物,去除腐叶并使用超纯水冲洗表面后,称取约50 g鲜重的植物,测定其初始生长指标(重量、根长),并观察其初始生长情况。
1.2.3 细菌定殖。
将植物根部浸泡于1∶100(V/V)菌液中30 s,连同菌液一起放入含有Mn2+(30 mg/L)和氨氮(20 mg/L)的Hoagland营养液的水中培养(MnCl2和NH4NO3作为锰及氨氮来源),以未定殖菌液的植物作为对照组。期间以陈放8 h以上的自来水补充以维持水量不变。培养14 d后,取出植物,测定生长指标,记录生长情况变化后,用吸水纸吸干表面水分,将植物组织杀青(105 ℃至恒重)、研磨粉碎,得到植物组织干样品,保存待测。
1.3 分析方法
1.3.1 水质参数。采用精密pHS-3C型pH计、DDS-307型电导率仪和水质分析仪分别测定培养前后培养液的pH、电导率、溶解氧。采用纳氏试剂分光光度法(HJ 535—2009)测定氨氮含量。
1.3.2 锰含量。水中:采用火焰原子吸收分光光度法测定锰含量。植物组织:用陶瓷剪刀分别剪下培养桶中每一株植物的根和叶,用吸水纸吸干表面水分,剪碎,105 ℃烘干至恒重。称取0.1 g样品置于PTFE管中,加入9 mL HNO3、3 mL HCl和1 mL HF,在170 ℃下消解至溶液澄清透明,无可见固体。将消解液定容至50 mL,接着用0.45 μm水系针式滤膜进行过滤,使用火焰原子吸收分光光度法测定锰含量,每个样品测定3次。
1.3.3 植物生长指标。
1.3.3.1 根长。植物培养前以及植物培养结束后,进行称重及清洗,用吸水纸吸干表面水分后,用直尺(精度 0.1 cm)测量植物的根长,取最大值。
1.3.3.2 生物量。用吸水纸吸干收获的大薸表面水分后,立刻称重测定生物量。
1.3.4 植物生理指标的测定。
1.3.4.1 光合色素。
取0.5 g大薸叶片,剪碎后加入95%以上的乙醇,避光提取12 h,离心后取上清液,使用分光光度计分别于665、649和470 nm波长下测定样品的吸光度,计算叶绿素a、叶绿素b、类胡萝卜素的含量[15]。
1.3.4.2 丙二醛(MDA)含量。
称取0.5 g新鲜根部组织,加入5 mL预冷PBS缓冲液(pH=7.5)与适量100目石英砂,冰浴研磨成匀浆,将匀浆在8 000 r/min离心15 min,上清液即为提取液,使用南京建成生物工程研究所的MDA测定试剂盒(A003-1-1)测定MDA含量。
1.3.5 生物富集系数和生物转运系数。生物富集系数(BCF)反映植物对环境中重金属的蓄积能力,生物转运系数(TF)反映重金属从植物根部向叶部转移的能力,计算公式如下[16]:
BCF=CP/CS(1)
TF=CSL/CR(2)
式中:CP为整株植物重金属含量(mg/kg);CS为水中重金属含量(mg/L);CSL为植物茎叶中重金属含量(mg/kg);CR为植物根部重金属含量(mg/kg)。
1.4 数据处理与质量保证
为保证试验数据的准确性,试验结果用3个平行的均值表示。使用IBM SPSS Statistics 27对试验数据进行显著性分析和Pearson相关性分析;使用Excel 2019和Origin 2022对处理后的数据进行作图。试验过程所用试剂与药品均为分析纯或优于分析纯,试验过程中用水根据需要使用去离子水或超纯水。试验前所有玻璃仪器均经稀硝酸浸泡,并依次用清水和超纯水清洗、烘干待用。
2 结果与分析
2.1 生长指标变化
2.1.1
植物生物量。从图1a可以看出,在模拟废水中培养14 d后,大薸生物量均明显增加。在未定殖MOB组(PS)、定殖OS组(PS-OS)、定殖WLS01组(PS-WLS01)中,大薸生物量增长量分别为13.74%、31.29%和25.81%,与未定殖MOB的试验组相比,定殖组的生物量增长比例提升了1倍,由此推断定殖OS和 WLS01均可促进大薸生长。
2.1.2 植物根长。
从图1b可以看出,在培养14 d后,虽然PS-OS 组、PS-WLS01组根长有所增加(分别由7.1和8.1 cm生长至12.2和13.5 cm),但PS组根伸长比(62.9%)大于PS-OS组(50.9%)和PS-WLS01组(53.9%),且在PS-OS组和PS-WLS01组沉积物中可观察到一些脱落的根部组织,说明定殖OS和 WLS01可能使大薸根部小部分产生解离。
2.2 生理指标变化
2.2.1 光合色素。
从图2可以看出,在同一时间受相同程度的锰胁迫下,定殖OS和WLS01菌株能够显著提高叶绿素含量,叶绿素a含量分别增加了18.7%和26.4%,叶绿素b含量分别增加了16.9%和27.8%,类胡萝卜素含量分别增加了7.5%和26.5%,说明定殖OS和WLS01菌株能够促进大薸的光合作用。
2.2.2 MDA含量。
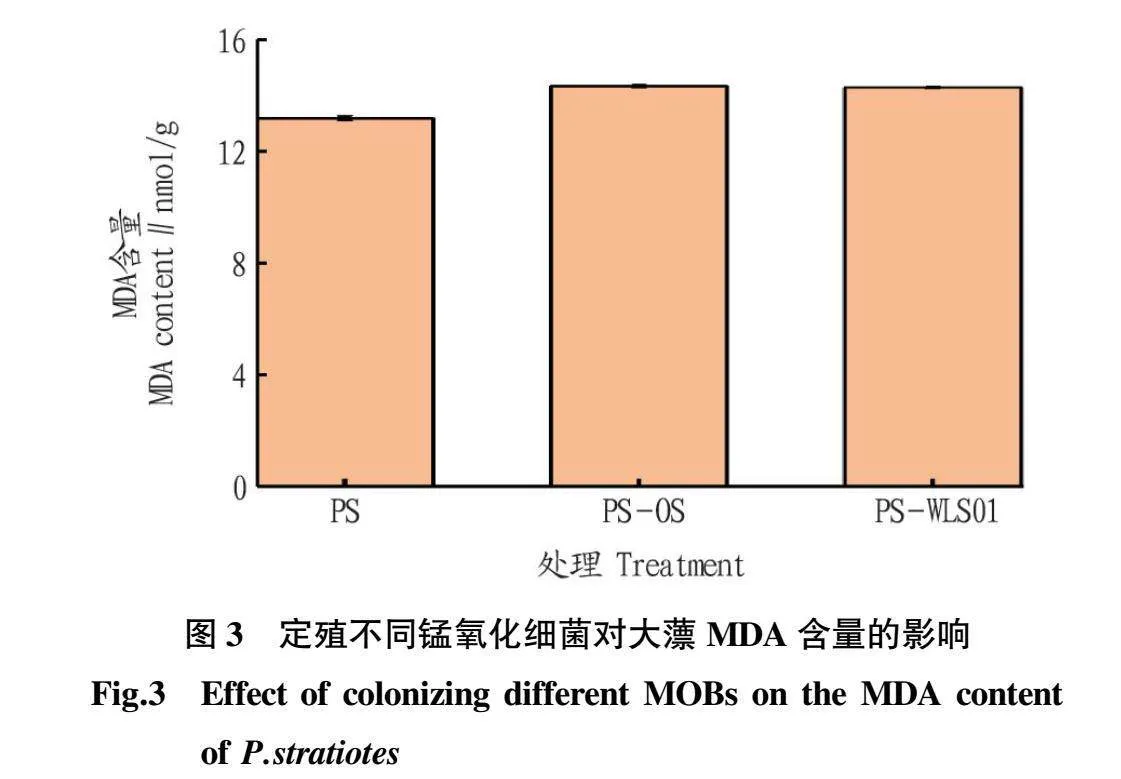
从图3可以看出,未定殖锰氧化菌组(PS组)根部MDA含量为13.09 nmol/g,而定殖MOB的PS-OS组和 PS-WLS01组的MDA含量分别为14.33和14.28 nmol/g,略高于PS组。MDA是脂质过氧化的最终产物,对植物体有害,是衡量细胞膜受损程度的重要指标。由此可见2株MOB虽有促植物生长能力,但未能缓解高浓度锰对大薸根部的胁迫。
2.3 细菌定殖对漂浮植物去除锰和氨氮的影响
2.3.1 对锰去除的影响。
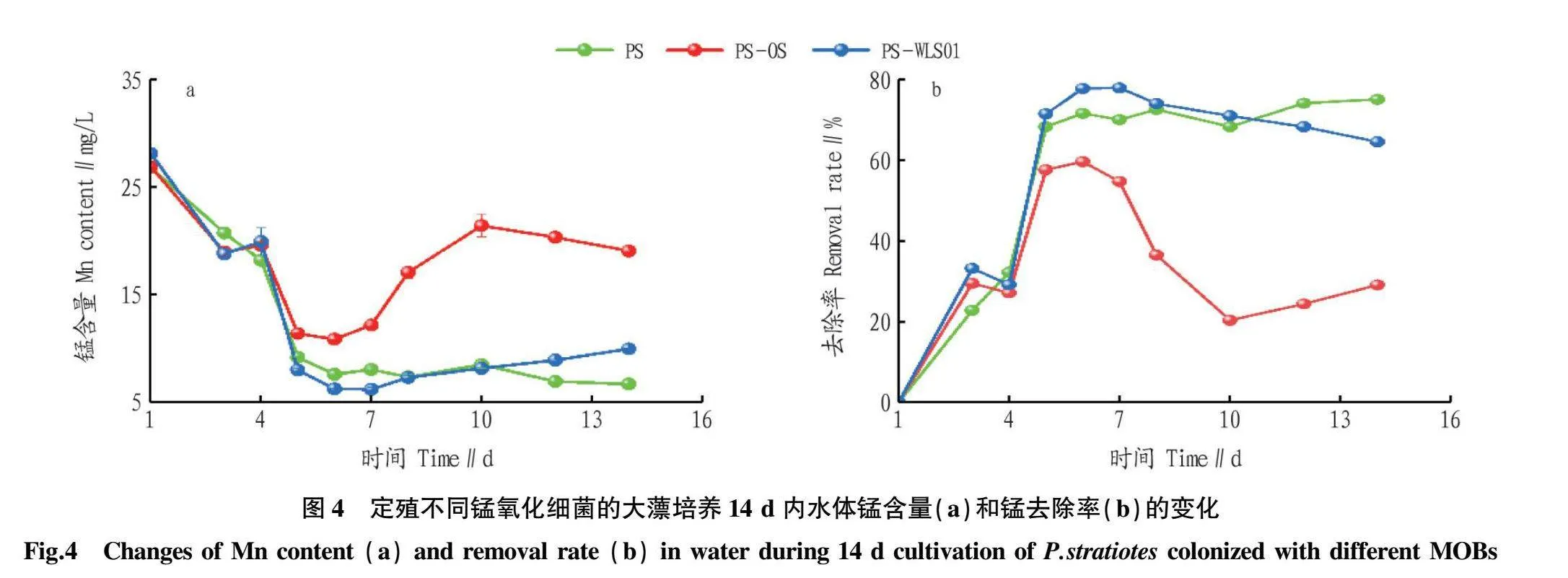
2.3.1.1 对水中锰含量的影响。
由图4可知,在初始锰含量为30 mg/L条件下,前3 d内水中锰含量在所有试验组中呈现相似趋势,但4 d后,定殖OS(PS-OS组)减弱了大薸对水中锰的去除,而PS-WLS01组水中锰含量开始加速下降,直到 7 d 时定殖MOB组水中锰含量均升高,并在培养桶底部观察到一些沉积的大薸根部,推测大薸在高浓度的锰胁迫下一部分吸收的锰随着根部的脱落再次释放到水中,在6~14 d,PS-OS组和PS-WLS01组培养桶底部均发现脱落的根部和凋落的叶片,但是PS-OS组和PS-WLS01组大薸叶片生长状况仍好于PS组。最终(14 d时)PS-OS组、PS-WLS01组和PS组水中锰含量分别为19.03、9.96和6.68 mg/L。
2.3.1.2 对植物叶和茎组织内锰富集的影响。
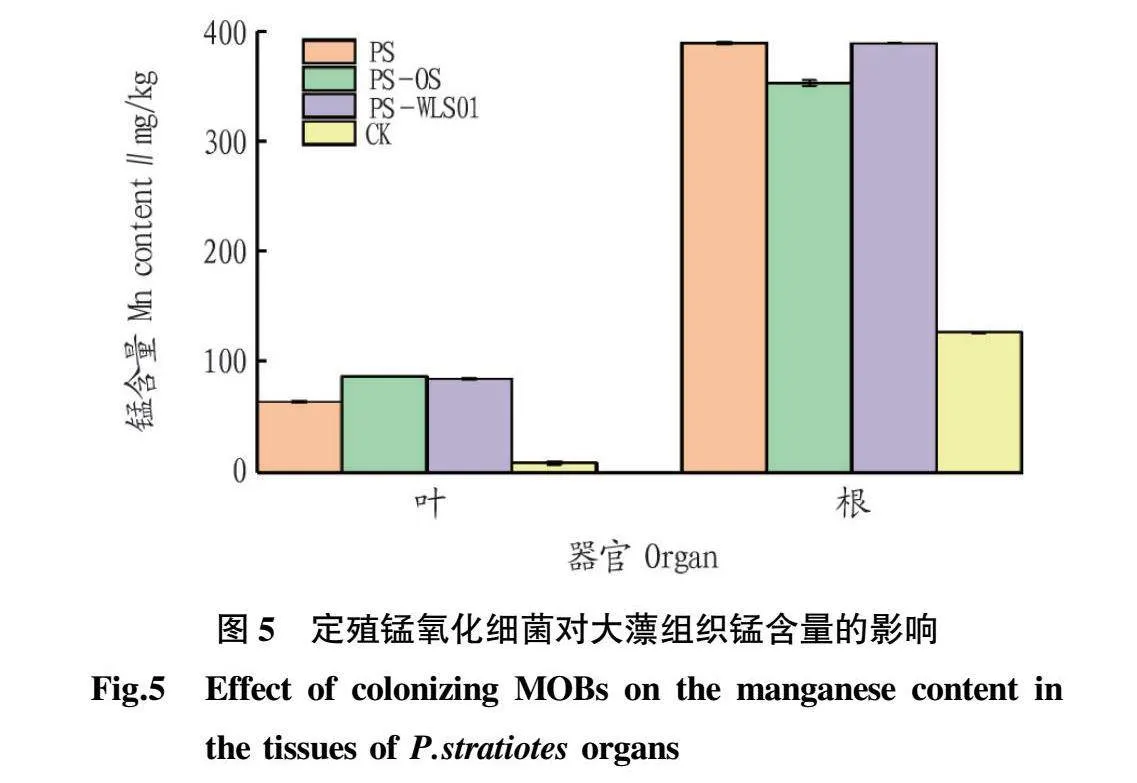
对各组大薸的根和叶中锰含量进行测定,结果发现(图5),即使是在清水中培养的植株(CK)根和叶中也含有少量的锰(预培养营养液中锰作为微量元素之一),分别为128.31和10.09 mg/kg,经过14 d在锰胁迫环境下培养,大薸各器官中的锰含量显著增加,其中,相较于未定殖MOB的试验组(PS组),PS-OS组和PS-WLS01组大薸的叶中锰含量分别显著增加了34.87%和31.93%,根中的锰含量变化则有所不同,定殖OS后的大薸根中锰含量低于未定殖的PS组,而定殖WLS01的试验组则与未定殖的结果相似。
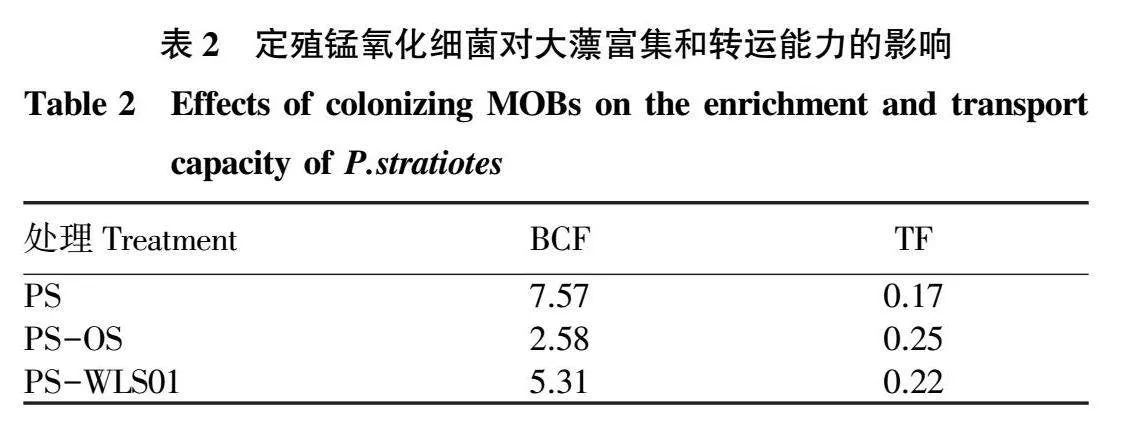
各试验组中大薸在锰胁迫条件下培养14 d后的锰富集系数(BCF)和转运系数(TF)如表2所示。所有试验组的富集系数都大于 说明大薸有较好的锰富集能力;TF小于 说明被富集的锰主要集中在根部。值得注意的是PS-OS组和PS-WLS01组TF分别为0.25和0.22,相较于PS组均有所提高,并不说明定殖OS和WLS01促进了大薸根部的锰向叶片的转运,而是因主要根部组织腐解导致被富集的锰向水中释放。
2.3.2 对氨氮去除的影响。
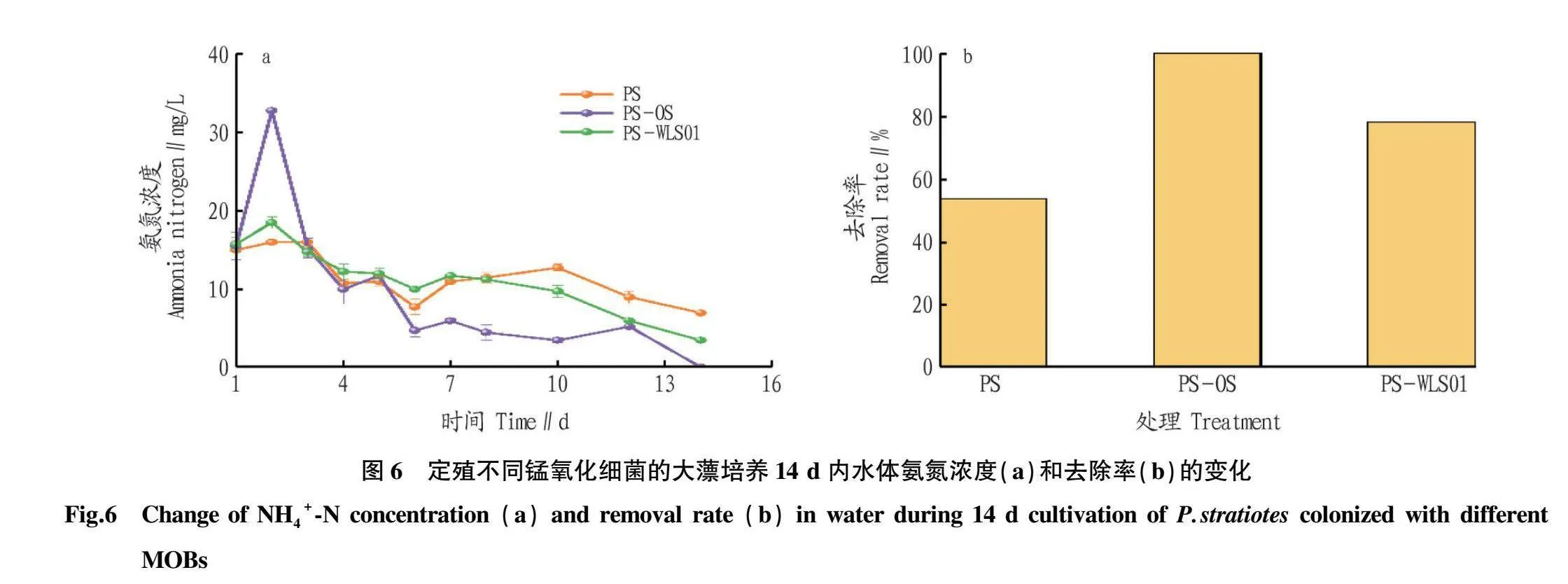
从图6可以看出,各试验组中氨氮经过大薸的吸收后浓度均大幅下降,7 d后定殖MOB的试验组氨氮浓度开始加速下降,最终PS-OS组和PS-WLS01组氨氮浓度分别降低了15和12 mg/L,去除率分别高达100%和78.15%,远高于PS组(53.60%),表明定殖OS和WLS01增强了大薸对氨氮的去除能力。
2.3.3 水体理化因子变化。
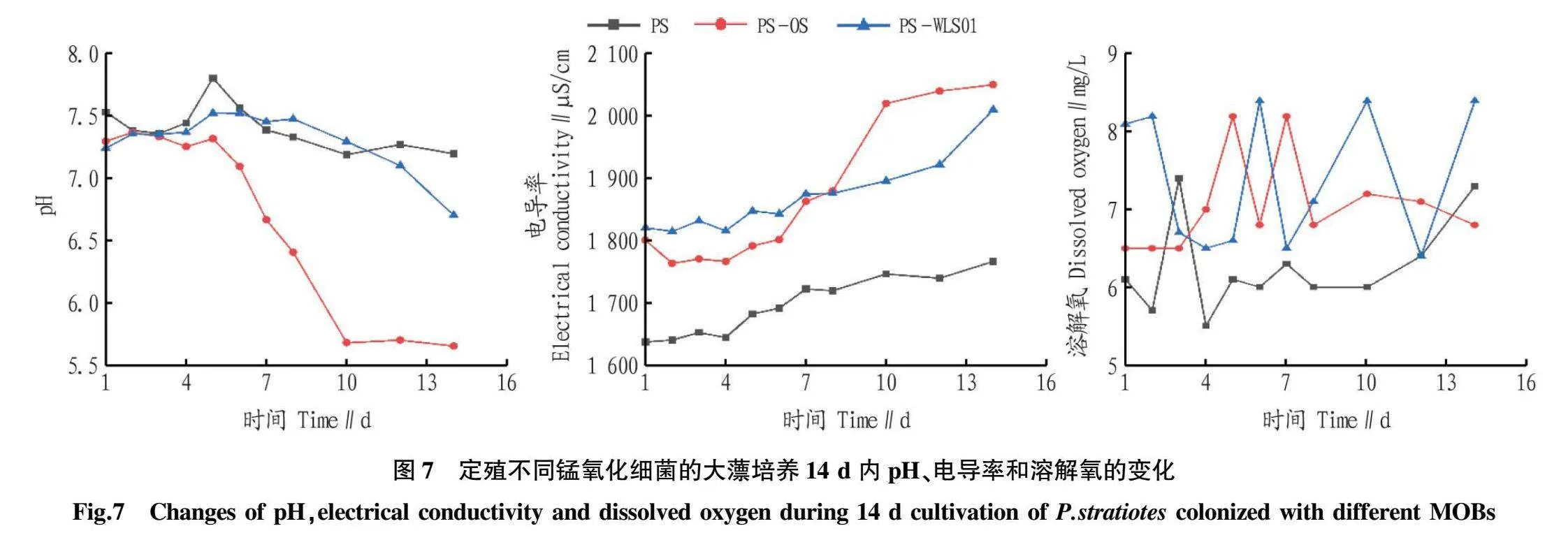
在锰胁迫下,对水中各项指标进行测定,结果发现(图7),14 d时,PS-OS组和PS-WLS01组的pH分别降为5.659和6.704,低于PS组(7.197),而电导率分别达到2050和2010 μS/cm,均高于PS组,其原因一方面可能是OS和WLS01释放了某种酸性物质直接导致pH下降,另一方面或许是由于定殖2株MOB使大薸根部微生物群落释放酸性物质间接导致pH下降。
3 讨论
目前水体重金属污染受到社会的普遍关注,生物修复技术相比于物理化学修复,具有成本低、环境友好等特点,利用植物-微生物联合修复重金属污染成为一种新途径[17]。定殖PGPB可以通过多种机制促进植物生长并增强植物修复能力[18]。PGPB分为革兰氏阳性菌和阴性菌,可以通过细胞壁上肽聚糖的薄厚区分。其中,许多阳性菌在与植物的相互作用中,可以分泌抗生素、植物激素和酶以促进植物生长,增强植物在逆境下的抗性和养分吸收能力;如Emmert等[19]研究发现蜡样芽孢杆菌(Bacillus cereus)和链霉菌(Streptomyces albus)产生的抗生素可作为生物农药以防治植物疾病;Luo等[20]将能够产生IAA、铁载体和ACC脱氨酶的革兰氏阳性菌SLS18定殖到甜高粱上,提高其生物量和对镉的吸收;Karlidag等[21]从印度勒克瑙的碱性土壤中分离出的芽孢杆菌(Bacillunbh31O0yKUV/zlpcjKmxsPN8VKtoXJK3BBIsp1LaRzY=s)菌株NBRI-SN13表现出几种植物促生特性,定殖后能更有效地诱导磷酸三钙的溶解。虽然已被商业化使用的PGPB大多为阳性细菌,许多阴性菌也同样具有促进植物修复的潜力,包括铜绿假单胞菌(Pseudomonas aeruginosa)和慢性球菌(Azotobacter chroococcum)等[22],但是定殖后对植物影响的稳定性还有待深入研究,由于在植物-微生物系统中用于疾病控制/植物生长促进和化学吸收的整合取决于菌株的有效选择[23],因此这些阴性菌不像根瘤菌属(Rhizobium Frank)和慢生根瘤菌属(Bradyrhizobium Jordan)等的一些革兰氏阴性菌因其稳定及高效的固氮能力而被熟知[24]。
在该研究中,定殖OS(阴性)和WLS01(阳性)均促进了大薸的生长,生物量明显提高,其中定殖OS的大薸生物量增幅超过未定殖组的1倍,这可能与其能额外产生ACC脱氨酶的特性有关。周益帆等[25]研究表明从植物根系渗出的ACC可被产ACC脱氨酶细菌分解为碳源、氮源、α-丁酮酸,并减少ACC的积累,促进植物的生长。该研究表明PS-OS组和PS-WLS01组大薸的叶绿素a、叶绿素b和类胡萝卜素含量均高于PS组,前人的研究也有类似的结果,例如Castanheira等[26]研究发现定殖的革兰氏阴性菌Pseudomonas sp.G1DC10 和Sphingomonas azotifigens DSMZ 18530 提高了黑麦草叶绿素含量。Essalimi等[27]从欧洲李根际分离的PGPB能够显著促进番茄生长,提高叶绿素含量。刘婕等[28]研究发现定殖了产ACC脱氨酶的促生菌可以提高重瓣百合的叶绿素含量,还可以增加其花苞数,提前开花期。在该研究中,叶绿素的增加或许还与类胡萝卜素含量增加有关,其作为单线氧猝灭剂对保护叶绿素的合成起到了一定作用[15]。PS-OS组和PS-WLS01组的大薸在高浓度锰胁迫下叶绿素还能稳定合成并多于PS组,这可能与其重金属转运能力改变有关。锰是光合作用中必不可少的元素[29],Ijaz等[30]从玉米根际分离出的芽孢杆菌(阳性)可以增强锰的迁移能力,使锰更容易被植物吸收,这种能力不仅提高了植物对锰的吸收,也可能有助于维持植物所需的锰水平以支持光合作用过程,定殖OS和WLS01提高了大薸将锰由根向叶转运的含量,这可能与其叶绿素含量升高相关。
定殖OS和WLS01均对大薸根部产生损伤,一方面可能是由于培养液中缺少有机碳,而植物根系的分泌物如糖类和氨基酸是根际微生物生长和活动的重要有机碳来源[31],高浓度锰胁迫减弱了大薸根系分泌物的释放。微生物利用损伤的根部进行碳源补充,改变根部细胞壁的渗透压,导致部分根毛腐解脱落,将富集的锰重新释放到水中。但是,相较于PS组,即便根系受到更大损伤,在2株MOB的促生长下大薸仍然长势良好,氨氮作为可直接吸收利用的氮素[32]被大薸快速吸收,水中氨氮含量也顺势降低。另一方面,还有可能是定殖MOB后改变了大薸根系水体环境,金属耐受微生物可以通过改变pH、释放螯合剂(如有机酸、铁载体)、氧化/还原反应来改变金属的生物利用度[33],定殖组的pH和电导率发生了较大变化可能加重了锰胁迫下的根部损伤甚至导致根部脱落。
观察到的根系损伤和脱落是较少报道的植物促生菌(PGPB)效应,虽然 PGPB 通常被认为是有益的,但它们与植物根系的相互作用会因细菌菌株、植物种类、环境条件和细菌接种物浓度的不同而变化[34]。该研究结果表明,虽然定殖OS和WLS01促进了大薸生长,但它们也可能诱发了根系的应激反应,其中也许涉及乙烯的信号传递失衡[35],而乙烯是已知的植物应激反应介导因子[36-37]。根系受损也有可能是由于细菌(即使是有益细菌)的存在引发了过度活跃的免疫反应,Ji等[38]研究发现植物根系有时会将有益微生物的相互作用误解为病原体的攻击,从而激活防御机制,进而造成根系损伤。
4 结论与展望
该研究结果表明,在锰胁迫下,定殖阴性菌OS可以明显增加大薸的生物量和氨氮去除率,定殖阳性菌WLS01在前7 d 内可以促进大薸对水中锰的吸收,2株菌都促进了大薸对氨氮的吸收,提高了大薸的生物量和光合色素含量,但是定殖阴性菌OS后大薸的根部产生了更严重的损伤。未来的研究可从如何减轻微生物对根部的损伤入手,如补充外加碳源、细菌固定化(避免直接与植物根部接触)等手段,既保证了细菌对水中锰的固定,同时实现植物促生长。该研究为将兼具植物促生长和锰氧化能力的细菌应用于锰污染水环境的植物修复提供了参考。
参考文献
[1] PARK J B K,SUKIAS J P S,TANNER C C.Floating treatment wetlands supplemented with aeration and biofilm attachment surfaces for efficient domestic wastewater treatment[J].Ecological engineering,2019,139:1-11.
[2] HUYNH A T,CHEN Y C,TRAN B N T.A Small-scale study on removal of heavy metals from contaminated water using water hyacinth[J].Processes,202 9(10):1-9.
[3] POLECHON′SKA L,SZCZE‘S′NIAK E,KLINK A.Comparative analysis of trace and macro-element bioaccumulation in four free-floating macrophytes in area contaminated by copper smelter[J].International journal of phytoremediation,2022,24(3):324-333.
[4] KUMAR V,SINGH J,SAINI A,et al.Phytoremediation of copper,iron and mercury from aqueous solution by water lettuce (Pistia stratiotes L.)[J].Environmental sustainability,2019,2(1):55-65.
[5] 郭昕晔.锰污染溪流附生硅藻:基于基质的种群分布特征及单一藻株锰暴露响应特性[D].南宁:广西大学,2022.
[6] 王奇杰,马旭洲.大薸及其附着物对网箱养殖水域氮磷去除效果的初步研究[J].渔业现代化,2018,45(2):59-63.
[7] ARYA S K,ROY B K.Manganese induced changes in growth,chlorophyll content and antioxidants activity in seedlings of broad bean (Vicia faba L.)[J].Journal of environmental biology,201 32(6):707-711.
[8] LI H L,TANG Y K,WU Y,et al.Bio-immobilization of soluble Mn(II) in aqueous solution with co-occurred Mn(II)-oxidizing bacteria: Facilitation or inhibition?[J].Journal of environmental chemical engineering,202 9(6):1-9.
[9] 陈明珠,张林义,岳正波,等.酸性矿山废水中锰氧化菌的分离鉴定及其对Mn2+的去除作用[J].环境科学学报,2022,42(9):30-39.
[10] TANG Y K,KANG H Y,QIN Z Y,et al.Significance of manganese resistant bacillus cereus strain WSE01 as a bioinoculant for promotion of plant growth and manganese accumulation in Myriophyllum verticillatum[J].Science of the total environment,2020,707:1-8.
[11] GLICK B R.Plant growth-promoting bacteria: Mechanisms and applications[J].Scientifica (Cairo),2012,2012:1-15.
[12] SARAF M,PANDYA U,THAKKAR A.Role of allelochemicals in plant growth promoting rhizobacteria for biocontrol of phytopathogens[J].Microbiological research,2014,169(1):18-29.
[13] 李旖曦,陈涵冰,王耀强,等.耐砷促生菌对超富集植物蜈蚣草砷吸收及根际微生物群落的调控作用[J].微生物学报,2023,63(6):2401-2414.
[14] 李明源,王继莲,姚拓,等.祁连山高寒草地扁蓿豆和黄花棘豆耐冷PGPB的筛选及促生特性研究[J].农业生物技术学报,202 29(11):2074-2086.
[15] 刘家华,陈克诚,程娟,等.铜胁迫下大薸对铜的吸收特征与生理响应[J].环境科学与技术,2022,45(8):61-68.
[16] 范拴喜,张楠,孙旻涵,等.Pb、Zn和Cd复合重金属潜在超富集植物的筛选与胁迫响应特征[J].环境科学,2024,45(8):4870-4882.
[17] DANYAL Y,MAHMOOD K,ULLAH S,et al.Phytoremediation of industrial effluents assisted by plant growth promoting bacteria[J].Environmental Science and Pollution Research,2023,30(3):5296-5311.
[18] AKRAM A,TARA N,KHAN M A,et al.Enhanced remediation of Cr6+ in bacterial-assisted floating wetlands[J].Water and environment journal,2020,34(S1):970-978.
[19] EMMERT E A B,HANDELSMAN J.Biocontrol of plant disease:A(Gram-) positive perspective[J].FEMS microbiology letters,1999,171(1):1-9.
[20] LUO S L,XU T Y,CHEN L,et al.Endophyte-assisted promotion of biomass production and metal-uptake of energy crop sweet sorghum by plant-growth-promoting endophyte Bacillus sp.SLS18[J].Applied microbiology and biotechnology,2012,93(4):1745-1753.
[21] KARLIDAG H,ESITKEN A,YILDIRIM E,et al.Effects of plant growth promoting bacteria on yield,growth,leaf water content,membrane permeability,and ionic composition of strawberry under saline conditions[J].Journal of plant nutrition,2010,34(1):34-45.
[22] RAHNAMA S,GHEHSAREH A E,EBRAHIMI A,et al.Seed priming with plant growth-promoting bacteria (PGPB) improves growth and water stress tolerance of Secale montanum[J].Heliyon,2023,9(4):1-11.
[23] TABASSUM B,KHAN A,TARIQ M,et al.Bottlenecks in commercialisation and future prospects of PGPR[J].Applied soil ecology,2017,121:102-117.
[24] HAYAT R,ALI S,AMARA U,et al.Soil beneficial bacteria and their role in plant growth promotion:A review[J].Annals of microbiology,2010,60(4):579-598.
[25] 周益帆,白寅霜,岳童,等.植物根际促生菌促生特性研究进展[J].微生物学通报,2023,50(2):644-666.
[26] CASTANHEIRA N L,DOURADO A C,PAIS I,et al.Colonization and beneficial effects on annual ryegrass by mixed inoculation with plant growth promoting bacteria[J].Microbiological research,2017,198:47-55.
[27] ESSALIMI B,ESSERTI S,RIFAI L A,et al.Enhancement of plant growth,acclimatization,salt stress tolerance and verticillium wilt disease resistance using plant growth-promoting rhizobacteria (PGPR) associated with plum trees (Prunus domestica)[J].Scientia horticulturae,2022,291:1-10.
[28] 刘婕,徐俊,张颖,等.含ACC脱氨酶的植物根际促生菌对重瓣百合生长及生理特性的影响[J].西南农业学报,2022,35(11):2520-2526.
[29] KHOSHRU B,MITRA D,NOSRATABAD A F,et al.Enhancing manganese availability for plants through microbial potential: a sustainable approach for improving soil health and food security[J].Bacteria,2023,2(3):129-141.
[30] IJAZ A,MUMTAZ M Z,WANG X K,et al.Insights into manganese solubilizing Bacillus spp.for improving plant growth and manganese uptake in maize[J].Frontiers in Plant Science,202 12:1-18.
[31] 刘京伟,李香真,姚敏杰.植物根际微生物群落构建的研究进展[J].微生物学报,202 61(2):231-248.
[32] 钟开新,王亚琴.植物氮素吸收与转运的研究进展[J].广西植物,201 31(3):414-417.
[33] RAJKUMAR M,SANDHYA S,PRASAD M N,et al.Perspectives of plant-associated microbes in heavy metal phytoremediation[J].Biotechnology advances,2012,30(6):1562-1574.
[34] KATSENIOS N,ANDREOU V,SPARANGIS P,et al.Assessment of plant growth promoting bacteria strains on growth,yield and quality of sweet corn[J].Scientific reports,2022,12:1-13.
[35] IQBAL N,TRIVELLINI A,MASOOD A,et al.Current understanding on ethylene signaling in plants: The influence of nutrient availability[J].Plant physiology and biochemistry,2013,73:128-138.
[36] HUANG J,ZHAO X,BRGER M,et al.The role of ethylene in plant temperature stress response[J].Trends in plant science,2023,28(7):808-824.
[37] WANG F F,CUI X K,SUN Y,et al.Ethylene signaling and regulation in plant growth and stress responses[J].Plant cell reports,2013,32(7):1099-1109.
[38] JI S H,KIM J S,LEE C H,et al.Enhancement of vitality and activity of a plant growth-promoting bacteria (PGPB) by atmospheric pressure non-thermal plasma[J].Scientific reports,2019,9:1-13.
