基于WGCNA鉴定阿尔茨海默病的衰老关键基因
2024-11-04李筱琳隋欣满子腾程甜甜宋娟包亚男林宇杨宏艳
[摘要]目的采用加权基因共表达网络分析(weightedgeneco-expressionnetworkanalysis,WGCNA)方法筛选并鉴定阿尔茨海默病(Alzheimer’sdisease,AD)相关的衰老基因。方法从GEO数据库中选择GSE132903作为分析数据集,筛选AD差异表达基因(differentialexpressedgene,DEG),采用火山图和热图进行差异基因可视化分析;从MsigDB、AgingAltas、CellAge三个数据库中下载衰老和衰老相关基因(agingandsenescence-associatedgene,ASAG);WGCNA筛选与AD临床特征相关性最高的基因模块,并采用基因本体(geneontology,GO)、京都基因与基因组百科全书(KyotoEncyclopediaofGenesandGenomes,KEGG)对模块内基因进行富集分析;取DEG、WGCNA关键模块基因及ASAG的交集基因得到AD衰老相关差异表达基因(ADage-relateddifferentialexpressedgene,ARDEG),使用STRING数据库进行蛋白质-蛋白质相互作用(protein-proteininteraction,PPI)网络分析寻找关键节点基因;使用GeneMANIA数据库分析ARDEG的共表达网络和相关功能;最后将筛选到的关键基因在已知AD患者数据库Alzdata中进行验证。结果共筛选出226个DEG,611个ASAG,8个ARDEG。PPI筛选出排名前5位的关键基因分别为SYP、STXBP1、VAMP2、CPLX1和STX1A。Alzdata数据库验证发现除海马区VAMP2和额叶皮层STXBP1无明显改变、额叶皮层CPLX1无表达外,5个关键基因在AD其余脑区中表达均下调,且VAMP2、STXBP1和STX1A已在AD早期出现差异表达,CPLX1与Tau病理过程有关,SYP、STXBP1与β-淀粉样蛋白和Tau病理过程均有关。结论SYP、STXBP1、VAMP2、CPLX1和STX1A均为ARDEG,有望成为AD潜在的诊断和治疗靶点。
[关键词]阿尔茨海默病;加权基因共表达网络分析;衰老基因;生物信息学
[中图分类号]R749.16[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.28.004
ScreeningofagingkeygenesinAlzheimer’sdiseasebasedonWGCNA
LIXiaolin1,SUIXin2,MANZiteng1,CHENGTiantian1,SONGJuan1,BAOYanan1,LINYu1,YANGHongyan1
1.SchoolofPharmacyofQiqiharMedicalUniversity,Qiqihar161006,Heilongjiang,China;2.DepartmentofNeurology,theThirdAffiliatedHospitalofQiqiharMedicalUniversity,Qiqihar161000,Heilongjiang,China
[Abstract]ObjectiveUsingtheweightedgeneco-expressionnetworkanalysis(WGCNA)toexplorethekeygenesofagingassociatedwithAlzheimer’sdisease(AD).MethodsGSE132903wasselectedfromGEOdatabaseastheanalysisdataset.Thedifferentialexpressedgenes(DEGs)ofADwerescreened,andvisualizedwithvolcanoandheatmap.Agingandsenescence-associatedgenes(ASAGs)weredownloadedfromMsigDB,AgingAltasandCellAgedatabases.WGCNAscreenedthegenemoduleswiththehighestcorrelationwithAD,andgenesofkeymodulessubsequentlyperformedwithgeneontology(GO),KyotoEncyclopediaofGenesandGenomes(KEGG)enrichmentanalysis.ADage-relateddifferentialexpressedgenes(ARDEGs)wereobtainedbytakingintersectiongenesofDEGs,keymodulegenesofWGCNAandASAGs.Protein-proteininteraction(PPI)networkanalysiswasperformedusingtheSTRINGdatabasetofindkeynodegenes.Theco-expressionnetworksandassociatedfunctionsofkeygeneswereanalyzedusingtheGeneMANIAdatabase.ThekeygeneswerevalidatedinAlzdatadatabase.Results226DEGs,606ASAGsand8ARDEGswereobtained.Thetop5keygenesselectedbyPPIwereSYP,STXBP1,VAMP2,CPLX1andSTX1A.Alzdatadatabaseverifiedthattheexpressionsof5keygenesinotherbrainregionsofADweredown-regulated,exceptfornosignificantchangesofVAMP2inhippocampusandSTXBP1infrontalcortex,aswellasnoexpressionofCPLX1infrontalcortex.ThedifferentialexpressionofVAMP2,STXBP1andSTX1AappearedintheearlystageofAD,andCPLX1wasrelatedtothepathologicalprocessofTau.SYPandSTXBP1wererelatedtothepathologicalprocessesofamyloidβ-proteinandTau.ConclusionSYP,STXBP1,VAMP2,CPLX1andSTX1AareARDEGs,whichareexpectedtobepotentialdiagnosticandtherapeutictargetsforAD.
[Keywords]Alzheimer’sdisease;Weightedgeneco-expressionnetworkanalysis;Aginggene;Bioinformatics
阿尔茨海默病(Alzheimer’sdisease,AD)是一种起病隐匿且进行性发展的神经系统退行性疾病,临床上以记忆减退、失语、失认为主要特征[1-2]。AD的发病机制迄今未明,且患者的病理生理改变早于临床症状出现,现有的治疗手段只能延缓AD的进程[3]。随着社会步入老龄化时代,AD的发病率呈现逐年递增的趋势,严重影响老年人的身心健康和日常生活质量,加重患者及其家庭的经济负担,已成为严重的社会问题,深入研究AD的发病机制和治疗策略迫在眉睫。衰老是AD的关键危险因素,衰老细胞在组织中积累,通过释放炎症因子,导致与年龄相关的病理改变。临床证据表明,神经炎症在AD患者出现轻度认知障碍前即已发生,说明早期神经炎症可能由大脑中衰老细胞积累所驱动;而AD病理改变又促进衰老进程,进一步增加衰老细胞的负担和衰老大脑中的炎症。β-淀粉样蛋白(amyloidβ-protein,Aβ)的积聚和Tau病理驱动的衰老也是导致AD进程加重的原因[4]。因此,抗衰老靶向药物可预防或减轻AD的发生和发展。本研究采用加权基因共表达网络分析(weightedgeneco-expressionnetworkanalysis,WGCNA)筛选与AD相关的衰老基因,并在AD患者中进行验证,寻找AD衰老生物标志物,为AD的诊断和治疗提供新的靶点。
1资料与方法
1.1数据收集和处理
从GEO公共数据库(http://www.ncbi.nlm.nih.gov/geo)中以关键词“Alzheimer’sdisease”搜索并筛选微列阵数据集,本研究选取来源于GPL10558平台的GSE132903数据集进行分析,该数据集包含AD患者97例和非痴呆对照者98例。
1.2差异表达基因筛选
使用limmaR包对数据集进行标准化和规范化处理,输出同时满足|log2foldchange(log2FC)|>1且P<0.05的基因作为差异表达基因(differentialexpressiongene,DEG)。使用R软件ggplot2绘制火山图,ComplexHeatmap工具包绘制热图,进行可视化分析。
1.3衰老相关基因筛选
从MsigDB(https://www.gsea-msigdb.org/gsea/msigdb)、AgingAltas(https//ngdc.cncb.ac.cn/aging/index)、CellAge(https://genomics.senescence.info/cells/)3个衰老数据库中,依次以“Senescencegene”为关键词搜索、下载衰老相关基因集,对3个衰老数据库得到的基因集取并集,重复的基因只计一次,最终得到衰老和衰老相关基因(agingandsenescence-associatedgene,ASAG)合集。
1.4WGCNA
利用WGCNA方法选择适当的软阈值β构建无标度网络,采用动态剪切树法进行层次聚类;计算基因显著性(genesignificance,GS)及模块显著性(modulesignificance,MS),选取相关系数最高的模块为关键模块,模块中的基因作为候选基因。
1.5AD衰老相关差异表达基因的筛选
取DEG、ASAG及WGCNA关键模块基因的交集基因作为AD衰老相关差异表达基因(ADage-relateddifferentialexpressedgene,ARDEG),即AD和衰老共同的差异表达基因,进行后续分析。
1.6差异基因功能富集分析
利用David数据库(https://david.ncifcrf.gov)进行基因本体(geneontology,GO)功能分析和京都基因与基因组百科全书(KyotoEncyclopediaofGenesandGenomes,KEGG)通路富集分析。GO分析包括生物过程(biologicalprocess,BP)、细胞组分(cellularcomponent,CC)和分子功能(molecularfunction,MF)三部分,KEGG主要分析基因相关的代谢通路。
1.7蛋白质-蛋白质相互作用网络构建及关键基因筛选
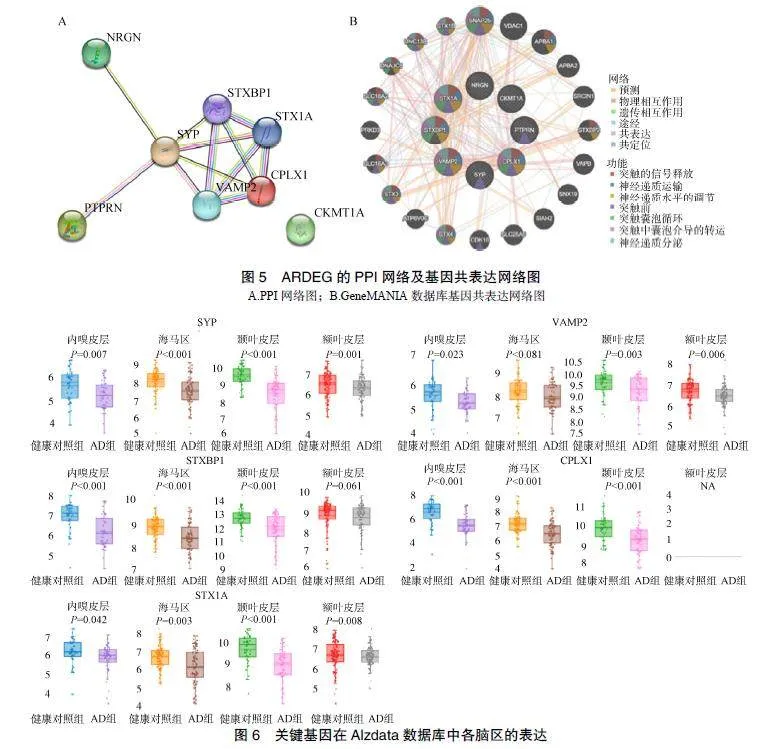
通过STRING在线分析软件(http://www.string-db.org)构建蛋白质-蛋白质相互作用(protein-proteininteraction,PPI)网络。利用Cytoscapes软件中的Cytohubba插件,综合多种算法筛选出评分较高的ARDEG作为关键基因。GeneMANIA数据库(http://genemania.org/)分析ARDEG关键基因的共表达网络和相关功能。
1.8关键基因在已知AD患者数据库中的验证
为进一步验证关键基因在AD中的表达情况,借助已有的AD患者数据库(www.Alzdata.org)对筛选出的ARDEG关键基因进行验证。关键基因表达改变以log2FC形式展示,P值为调整后的P值。同时采用趋同功能基因组(convergentfunctionalgenomics,CFG)方法对关键基因进行评估,以进一步筛选在AD中发挥关键作用的核心基因。CFG评分范围0~5分,分值越高说明该基因与AD相关性越强。
2结果
2.1DEG筛选结果
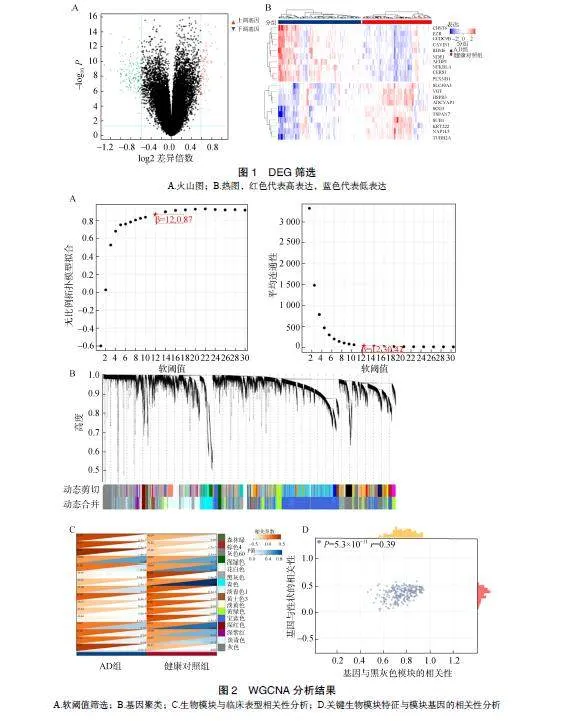
共筛选出226个DEG,其中78个基因表达上调,148个基因表达下调。图1为DEG的火山图和热图。
2.2WGCNA分析结果
根据无尺度网络拟合指数和平均连接度,计算并选取相关系数为0.87,软阈值为12,构建无尺度网络。动态剪切树法进行基因聚类。通过计算分析各基因模块与临床表型之间的关系,绘制共表达模块与临床表型的相关性热图,共获得16个基因共表达模块。选择与AD表型相关性最强的黑灰色模块(cor=-0.45,P<0.01)对其进行散点图分析,GS与MS在黑灰色模块中呈正相关(r=0.39,P=5.3×10-11)。设置筛选条件为GS>0.1,MS>0.8,校正后P<0.01,进一步筛选黑灰色模块中的关键枢纽基因。剔除非编码基因后,共筛选出105个基因作为候选关键基因,见图2。
A.软阈值筛选;B.基因聚类;C.生物模块与临床表型相关性分析;D.关键生物模块特征与模块基因的相关性分析
2.3GO和KEGG富集分析结果
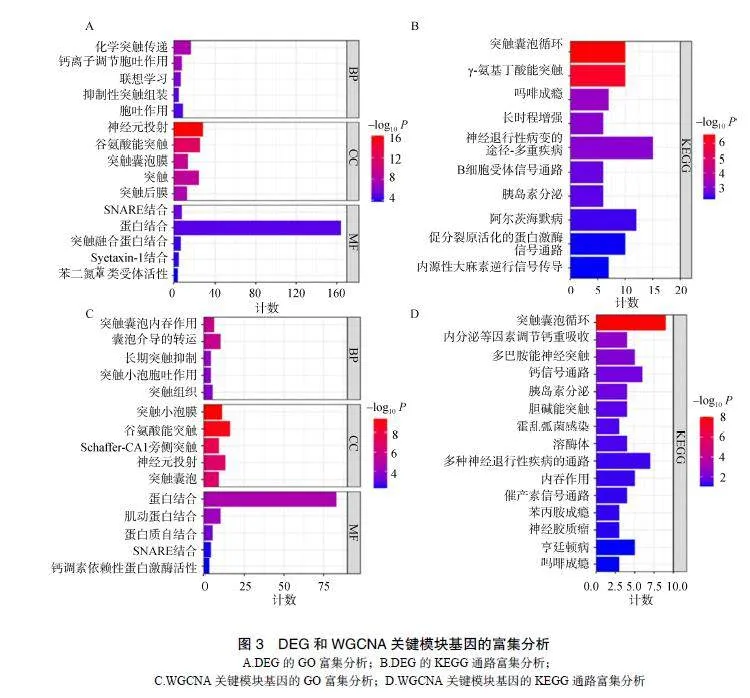
对DEG及WGCNA关键模块内的基因进行GO功能注释和KEGG信号通路富集分析,结果显示DEG主要富集在化学突触传递等生物学过程、神经元投射等细胞成分、可溶性N-乙基马来酰亚胺敏感因子附着受体(solubleN-ethylmaleimidesensitivefactorattachmentreceptors,SNARE)绑定等分子功能及突触囊泡周期等信号通路。WGCNA关键模块基因主要参与突触囊泡内吞等生物学过程、突触囊泡膜等细胞成分、蛋白结合等分子功能及突触囊泡周期等信号通路富集,见图3。
2.4ARDEG的筛选及鉴定结果
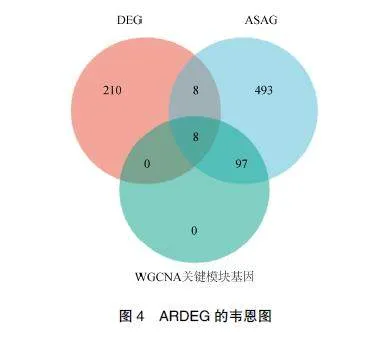
从MsigDB、AgingAltas、CellAge三个衰老数据库中检索ASAG,取并集,共得到611个ASAG。对DEG、ASAG及WGCNA关键模块基因取交集,得到8个ARDEG,分别为SYP、VAMP2、STXBP1、CPLX1、STX1A、PTPRN、NRGN和CKMT1A,见图4。
A.DEG的GO富集分析;B.DEG的KEGG通路富集分析;
C.WGCNA关键模块基因的GO富集分析;D.WGCNA关键模块基因的KEGG通路富集分析
2.5PPI网络构建及关键基因筛选结果
通过STRING在线分析软件构建ARDEG的PPI网络,见图5A。除去一个孤立的节点(CKMT1A),采用Cytohubba插件,使用最大集团中心性、最大相邻成分、节点连接度和边缘渗滤分量等算法筛选出评分较高的前5位关键基因,分别为SYP、STXBP1、VAMP2、CPLX1和STX1A。通过GeneMANIA数据库构建关键基因共表达网络,筛选出与关键基因存在相互作用的基因20个,见图5B。
2.6关键基因验证
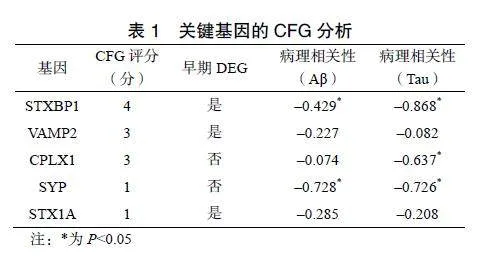
将筛选到的关键基因输入Alzdata数据库进行验证,除VAMP2在海马区、STXBP1在额叶皮层无明显改变和CPLX1在额叶皮层无表达外,5个关键基因在AD其余脑区中表达均下调,见图6。CFG评分由高到低分别为:STXBP1(4分)、VAMP2(3分)、CPLX1(3分)、SYP(1分)、STX1A(1分)。其中STXBP1、VAMP2、STX1A在AD早期已存在差异表达,CPLX1与Tau蛋白有关,STXBP1、SYP与Aβ和Tau形成均具有相关性,见表1。
3讨论
本研究通过WGCNA对GSE132903数据集进行分析,筛选出与AD临床特征高度相关的黑灰色模块,进一步将该模块内的基因与AD的DEG、ASAG取交集,得到8个ARDEG,构建PPI网络,最终筛选出排名前5位的关键基因:SYP、STXBP1、VAMP2、CPLX1和STX1A。
SYP(synaptophysin,突触生长蛋白)是一种钙结合糖蛋白,广泛分布于神经突触前膜的囊泡膜,释放Ca2+依赖性神经递质,参与突触小泡的进入和再循环,是突触前末梢的特异性标志蛋白[5]。SYP表达水平可反映突触的密度、分布面积和功能状态,从而反映突触的可塑性[6]。SYP被天冬酰胺内肽酶剪切后,可影响突触囊泡的再循环,导致突触功能障碍和认知障碍,促进AD发病[7]。研究发现AD模型小鼠脑组织及AD患者脑海马区域的SYP表达均下调[5,8];临床尸检已证实AD患者前额叶和海马等脑区SYP表达下调,且其表达水平与临床症状呈负相关[9]。突触蛋白丢失是散发性AD的早期发病机制之一[10]。本研究发现SYP在AD患者各脑区表达显著下调,与上述研究结果一致,提示SYP可能通过影响突触可塑性参与AD的发生发展,可成为AD潜在的治疗靶点。
STXBP1(syntaxin-bindingprotein1,突触结合蛋白1)可与突触素1的N端结合,促进整合膜蛋白受体复合物的形成和神经递质的释放[11-12]。研究发现STXBP1缺失可导致转录和翻译的广泛失调,影响突触的发育,进而使神经元细胞在突触形成前的未成熟阶段死亡[13]。STXBP1在大鼠大脑中形成淀粉样原纤维聚集体,并在大鼠脑和细菌表达系统中表现出淀粉样蛋白特性,参与淀粉样蛋白聚集[14]。本研究发现STXBP1在AD早期已出现表达下调,且与Aβ及Tau形成密切相关,提示STXBP1可作为AD诊断和治疗的靶点。
VAMP2(vesicle-associatedmembraneprotein2,囊泡相关膜蛋白2)是SNARE复合体的重要组成部分,分布于囊泡膜上,参与神经递质释放[15]。VAMP2可作为轻度认知障碍患者向AD转变的标志物[16]。研究发现散发性AD患者早期脑脊液中VAMP2水平降低[17]。糖原合酶激酶3是一种在神经元的发育和成熟过程中非常重要的蛋白激酶。研究发现糖原合酶激酶3的激活可抑制VAMP2顺向轴突转运,导致VAMP2在胞体的聚集和轴突远端含量的降低,进一步加剧轴突转运障碍,影响突触可塑性[18]。本研究发现VAMP2在AD患者各脑区表达下调,且在AD早期就已经出现,提示VAMP2可作为AD认知功能下降的标志物,进行早期筛查。
CPLX1(complexin-1,复合素1)是突触前结构中重要的神经递质释放调节蛋白,可与钙感受器一起调控钙依赖性神经递质的快速释放,加速突触囊泡胞吐作用[19]。补益脾胃的方药可提高SAMP8小鼠海马CPLX1水平,调节突触功能,促进神经递质释放,改善小鼠学习记忆能力[20]。逍遥散可通过上调CPLX1改善大鼠的焦虑抑郁症状,说明CPLX1可能是药物发挥抗焦虑抑郁作用的关键靶点[21]。AD患者常伴焦虑、失眠、抑郁等症状;本研究发现CPLX1在AD患者脑区下调,提示可通过上调CPLX1水平缓解AD患者的失眠、抑郁等精神状况。
STX1A(syntaxin-1A,突触融合蛋白-1A)是突触蛋白家族的一种突触前质膜蛋白,与其他蛋白共同组成SNARE复合物,对调节神经递质的突触前释放至关重要[22]。STX1A位于突触前膜的囊泡里,是重要的离子通道调节蛋白,可调节神经递质的释放,影响大脑神经系统的发育[23]。研究发现STX1A基因敲除小鼠表现出异常行为,可能与破坏5-羟色胺能神经系统有关[24]。STX1A基因变异与儿童多动症易感性有关[25]。STX1A与AD相关的研究较少,本研究发现STX1A在AD早期各脑区中的表达水平下调,提示STX1A可作为AD早期检测的生物标志物。
综上,本研究通过WGCNA分析得到5个AD与衰老共同的关键基因SYP、STXBP1、VAMP2、CPLX1和STX1A,均在突触通路上富集,具有成为AD早期诊断和治疗靶点的潜力,值得进一步深入研究。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] TIWARIS,ATLURIV,KAUSHIKA,etal.Alzheimer’sdisease:Pathogenesis,diagnostics,andtherapeutics[J].IntJNanomedicine,2019,14: 5541–5554.
[2] ZHANGC.EtiologyofAlzheimer’sdisease[J].DiscovMed,2023,35(178):757–776.
[3] ZHANGY,CHENH,LIR,etal.Amyloidβ-basedtherapyforAlzheimer’sdisease:Challenges,successesandfuture[J].SignalTransductTargetTher,2023,8(1):248.
[4] GUERREROA,DESTROOPERB,ARANCIBIA-CÁRCAMOIL.CellularsenescenceatthecrossroadsofinflammationandAlzheimer’sdisease[J].TrendsNeurosci,2021,44(9):714–727.
[5] 阙然.miR-671介导γ-氨基丁酸对突触素的调节在低聚果糖改善AD模型小鼠认知功能中的作用[D].沈阳:中国医科大学,2021.
[6] ZHUXK,WANGP,LIUHJ,etal.ChangesandsignificanceofSYPandGAP-43expressioninthehippocampusofCIHrats[J].IntJMedSci,2019,16(3):394–402.
[7] MENGLX,ZOUL,XIONGM,etal.AsynapsinIcleavagefragmentcontributestosynapticdysfunctioninAlzheimer’sdisease[J].AgingCell,2022,21(5):e13619.
[8] QINS,HUXY,XUH,etal.RegionalalterationofsynapsinIinthehippocampalformationofAlzheimer’sdiseasepatients[J].ActaNeuropathol,2004,107(3):209–215.
[9] MAD17gZh1eFIcShldsDvliTVvw4YN6R0YpOYaRSpiKQVk=RTINSB,DOWLINGAL,LIANEKHAMMYJ,etal.Synaptophysinandsynaptojanin-1indownsyndromearedifferentiallyaffectedbyAlzheimer’sdisease[J].JAlzheimersDis,2014,42(3):767–775.
[10] ANSARIMA,RAOMS,AL-JARALLAHA.InsightsintoearlypathogenesisofsporadicAlzheimer’sdisease:Roleofoxidativestressandlossofsynapticproteins[J].FrontNeurosci,2024,17:1273626.
[11] LAMMERTSEHCA,VANBERKELAA,IACOMINOM,etal.HomozygousSTXBP1variantcausesencephalopathyandgain-of-functioninsynaptictransmission[J].Brain,2020,143(2):441–451.
[12] ABRAMOVD,GUIBERSONNGL,BURRÉJ.STXBP1encephalopathies:Clinicalspectrum,diseasemechanisms,andtherapeuticstrategies[J].JNeurochem,2021,157(2):165–178.
[13] VANBERKELAA,KOOPMANSF,GONZALEZ-LOZANOMA,etal.Dysregulationofsynapticanddevelopmentaltranscriptomic/proteomicprofilesupondepletionofMUNC18-1[J].eNeuro,2022,9(6):1–14.
[14] CHIRINSKAITEAV,SINIUKOVAVA,VELIZHANINAME,etal.STXBP1formsamyloid-likeaggregatesinratbrainanddemonstratesamyloidpropertiesinbacterialexpressionsystem[J].Prion,2021,15(1):29–36.
[15] 康蓓佩.miR-34b/VAMP2通路在铅暴露影响突触囊泡形成中的作用及机制研究[D].西安:第四军医大学,2015.
[16] COSTAAS,FERRIE,GUERINIFR,etal.VAMP2expressionandgenotypearepossiblediscriminatorsindifferentformsofdementia[J].FrontAgingNeurosci,2022,14:858162.
[17] GOOSSENSJ,CERVANTESGONZÁLEZA,DEWITN,etal.Evaluationofcerebrospinalfluidlevelsofsynapticvesicleprotein,VAMP-2,acrossthesporadicAlzheimer’sdiseasecontinuum[J].AlzheimersResTher,2023,15(1):186.
[18] 朱铃强.糖原合酶激酶3在阿尔茨海默病发病中的作用及干预措施探讨[D].武汉:华中科技大学,2007.
[19] MOHRMANNR,DHARAM,BRUNSD.Complexins:Smallbutcapable[J].CellMolLifeSci,2015,72(22):4221-4235.
[20] 雷筱菁,第五永长,屈夏夏,等.补益脾胃元气方药对SAMP8小鼠海马突触活性带蛋白cplx1/2及stx1表达的影响[J].中华中医药杂志,2020,35(11):5811–5815.
[21] 高耀,李肖,赵慧亮,等.基于iTRAQ蛋白质组学技术探讨逍遥散对慢性温和不可预知应激大鼠海马组织的影响[J].中华中医药杂志,2021,36(6):3256–3261.
[22] LUPPEJ,STICHT H,LECOQUIERREF,etal.HeterozygousandhomozygousvariantsinSTX1Acauseaneurodevelopmentaldisorderwithorwithoutepilepsy[J].EurJHumGenet,2023,31(3):345–352.
[23] CUPERTINORB,SCHUCHJB,BANDEIRACE,etal.Replicatedassociationofsynaptotagmin(SYT1)withADHDanditsbroaderinfluenceinexternalizingbehaviors[J].EurNeuropsychopharmacol,2017,27(3):239–247.
[24] FUJIWARAT,SNADAM,KOFUJIT,etal.HPC-1/syntaxin1Ageneknockoutmiceshowabnormalbehaviorpossiblyrelatedtoadisruptionin5-HTergicsystems[J].EurJNeurosci,2010,32(1):99–107.
[25] WANGM,GUX,HUANGX,etal.STX1Agenevariationscontributetothesusceptibilityofchildrenattention-deficit/hyperactivitydisorder:Acase-controlassociationstudy[J].EurArchPsychiatryClinNeurosci,2019,269(6):689–699.
(收稿日期:2024–06–16)
(修回日期:2024–09–08)
