医院获得性肺炎和呼吸机相关性肺炎的病原菌与影像学特征的关联性
2024-11-01辛晓坤蒲豆豆江叶海马光明于楠
摘要:目的" 探讨医院获得性肺炎/呼吸机相关性肺炎(HAP/VAP)的病原菌与其胸部CT影像学特征之间的关联,及早识别HAP/VAP病原菌分布并准确评估病变范围。方法" 回顾性分析2020年1月~2022年1月在陕西中医药大学附属医院接受诊治的184例HAP/VAP患者(其中HAP 154例,VAP 30例)的气道分泌物病原菌培养和胸部CT影像资料。采用人工智能软件分割胸部CT图像并定量分析病原菌影像特征,定量指标包括全肺体积、肺气肿定量、病变体积、病变体积百分比、病变质量、病变密度小于-300 HU的体积占病变总体积百分比。结果" 革兰阴性杆菌为主要病原菌(92.72%),其中肺炎克雷伯杆菌、铜绿假单胞菌、鲍曼不动杆菌最为常见。手术史/侵入性操作是主要危险因素,发生率为37%。CT图像上,肺实变为普遍表现,而肺炎克雷伯杆菌肺炎可见胸腔积液及磨玻璃样改变;铜绿假单胞菌肺炎还可见支气管扩张和空洞;鲍曼不动杆菌肺炎还可见到胸腔积液和间质性改变。定量CT分析显示,肺炎克雷伯杆菌肺炎患者的肺气肿百分比数值较低,而混合细菌感染患者则较高;肺炎克雷伯杆菌肺炎患者的肺体积最大,而混合细菌感染患者最小。肺炎体积占全肺体积百分比最大者合并真菌感染(15%),曲线下面积为0.713(P=0.041),敏感度为79%,特异度为70%。结论" 通过分析HAP/VAP的影像学特征及其定量参数,尤其是肺炎体积百分比,有助于推测潜在的病原菌类型,对合并真菌感染或多菌感染的诊断具有重要价值。
关键词:肺炎;感染;CT;定量影像
Correlation between pathogens and imaging characteristics of hospital‑acquired pneumonia and ventilator‑associated pneumonia
XIN Xiaokun1, 2, PU Doudou1, 2, JIANG Yehai1, 2, MA Guangming2, YU Nan1, 2
1College of Medical Technology, Shaanxi University of Chinese Medicine, Xianyang 712046, China; 2Department of Medical Imaging, Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712000, China
Abstract: Objective To investigate the correlation between the pathogenic distribution of hospital-acquired pneumonia (HAP) and ventilator-associated pneumonia (VAP) with their corresponding chest CT imaging characteristics, aiming to promptly identify the distribution of HAP/VAP pathogens and accurately assess the extent of pulmonary lesions. Methods A retrospective analysis was performed for the culture of airway secretion pathogens and chest CT images of 184 patients with HAP/VAP (154 cases of HAP and 30 cases of VAP) who were diagnosed and treated at the Affiliated Hospital of Shaanxi University of Chinese Medicine from January 2020 to January 2022. Artificial intelligence software was used to segment chest CT images and quantitatively analyze pathogenic bacteria image characteristics. The quantitative indicators included whole lung volume, emphysema quantification , lesion volume, lesion volume percentage , lesion mass, and the percentage of lesion density less than -300 HU in total lesion volume. Results Gram-negative bacilli were the dominant pathogens (92.72%), with Klebsiella pneumoniae, Pseudomonas aeruginosa, Acinetobacter baumannii being the most prevalent. Surgical history/invasive procedures emerged as major risk factors in 37% of the patients. On CT images, lung consolidation was a common funding, while Klebsiella pneumoniae pneumonia showed pleural effusion and ground-glass changes; Pseudomonas aeruginosa pneumonia also shows bronchiectasis and cavitation; Acinetobacter baumannii pneumonia may also see pleural effusion and interstitial changes. Quantitative CT analysis revealed that LAA-950% in patients with Klebsiella pneumoniae pneumonia was low, whereas it was higher in patients with mixed bacterial infection. Patients with Klebsiella pneumoniae pneumonia have the biggest lung volume, whereas those with mixed infections caused by bacteria have the least. The highest proportion of LOA% in pneumonia, combined with a fungal infection (15%), was observed in patients. And LOA% was 10.5%, which could indicate the presence of fungal infection or multiple bacterial infections, with an area under the curve of 0.713 (P=0.041), 79% sensitivity, and 70% specificity. Conclusion By analyzing the CT imaging features and quantitative parameters of HAP/VAP, especially LOA%, it is helpful to speculate on potential pathogenic bacterial types, which has important value in the diagnosis of combined fungal or multi bacterial infections.
Keywords: pneumonia; infection; CT; quantitative imaging
医院内发生的肺炎分为医院获得性肺炎(HAP)和呼吸机相关性肺炎(VAP)[1, 2] 。在我国,VAP是HAP的特殊类型[3] 。HAP/VAP是导致医院获得性感染的常见原因[4-6] ,其在住院患者中的总发生率为3.22%~5.22%,其中下呼吸道感染的发生尤其显著,占1.76%~1.94%[3] ,不仅会增加患者时间成本和经济负担,还严重威胁其身体健康和生命安全[7, 8] 。近年来,由于人口老龄化、抗生素的频繁使用和呼吸机的广泛应用等多种因素,导致HAP/VAP的情况变得复杂且难以治愈,其死亡率明显增加[9] ,这使得HAP/VAP的及时诊断和临床治疗变得更加紧迫和更具挑战[10] 。更早、更准确地识别HAP/VAP病原菌,可以减少无效的经验性抗菌药物治疗方案,并降低不必要的广谱抗菌药物使用所带来的相关影响[11] 。 以往评估HAP/VAP病原菌的影像学手段主要是胸部CT[12] ,缺乏更加客观准确的定量评估方法。定量CT技术可以弥补这一缺点,它在常规CT扫描的基础上通过智能化数据分析对图像进行处理[13] ,从而提供相关的定量信息。目前尚未发现基于定量CT分析HAP/VAP影像学特征的相关报道。本研究采用回顾性分析方法,对本院收治的184例HAP/VAP患者的完整临床资料进行梳理,并结合胸部CT图像,运用CT定量技术深入剖析影像特征表现,旨在揭示HAP/VAP的病原菌分布特点与其影像学表征之间的内在联系,从而为提高HAP/VAP诊断的可靠性提供证据支持。
1" 资料与方法
1.1" 一般资料
回顾性分析2020年1月~2022年1月本院收治的184例HAP/VAP患者。其中154例为HAP,30例为VAP;男性131例,年龄33~91(67.6±11.9)岁;女性53例,年龄36~96(69.9±8.1)岁。诊断标准:以《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018版)》为依据[3] 。纳入标准:年龄≥18岁;入院48 h后新发的肺炎,或气管插管/气管切开患者接受机械通气48 h后发生的肺炎;入院时无下呼吸道感染者。排除标准:新出现的肺部阴影不能确定为感染性病变,或不能除外合并有基础疾病的复发、进展的肺内改变,例如肺梗死、药源性肺炎、肺不张、急性呼吸窘迫、肺水肿、结缔组织病相关间质性肺病;合并严重心、肝、肾功能衰竭者。本研究经陕西中医药大学附属医院伦理委员会审查批准(审批号:SZFYIEC-YJ-2024年第[16]号),所有受试者在试验前均签署知情同意书。
收集HAP/VAP患者的病原菌检测结果、性别、年龄、病史(如恶性肿瘤、慢性肺病、肝肾功能损害、脑血管疾病和结缔组织病),以及是否接受机械通气或气管切开,是否有手术史或外伤史,是否长期卧床或活动受限,是否存在留置管路(如胃管、尿管和中心静脉置管等)等资料。
1.2" 胸部CT检查
所有患者取仰卧位,采用64排CT(GE revolution CT, GE medical system, Milwaukee, WI)进行扫描。所有胸部CT扫描均在患者深吸气末或平静吸气末进行屏气扫描,扫描范围自肺底肋膈角水平至胸廓入口,管电压为120 kV,管电流为自动毫安,重建层厚lt;1.25 mm。
1.3" 胸部CT征象分析
所有患者的胸部CT图像由2位具有5年以上胸部影像诊断经验的放射科医生独立进行阅片。记录每个图像中出现的特征表现,包括实变影、广泛磨玻璃影(超过2个肺叶)、空洞、支气管扩张、树芽征、胸腔积液以及间质性改变(小叶间隔增厚或支气管血管束增粗)。当2位医生存在歧义时,将由具有10年以上诊断经验的第3位放射科医生做出决策。
1.4" 胸部CT定量分析
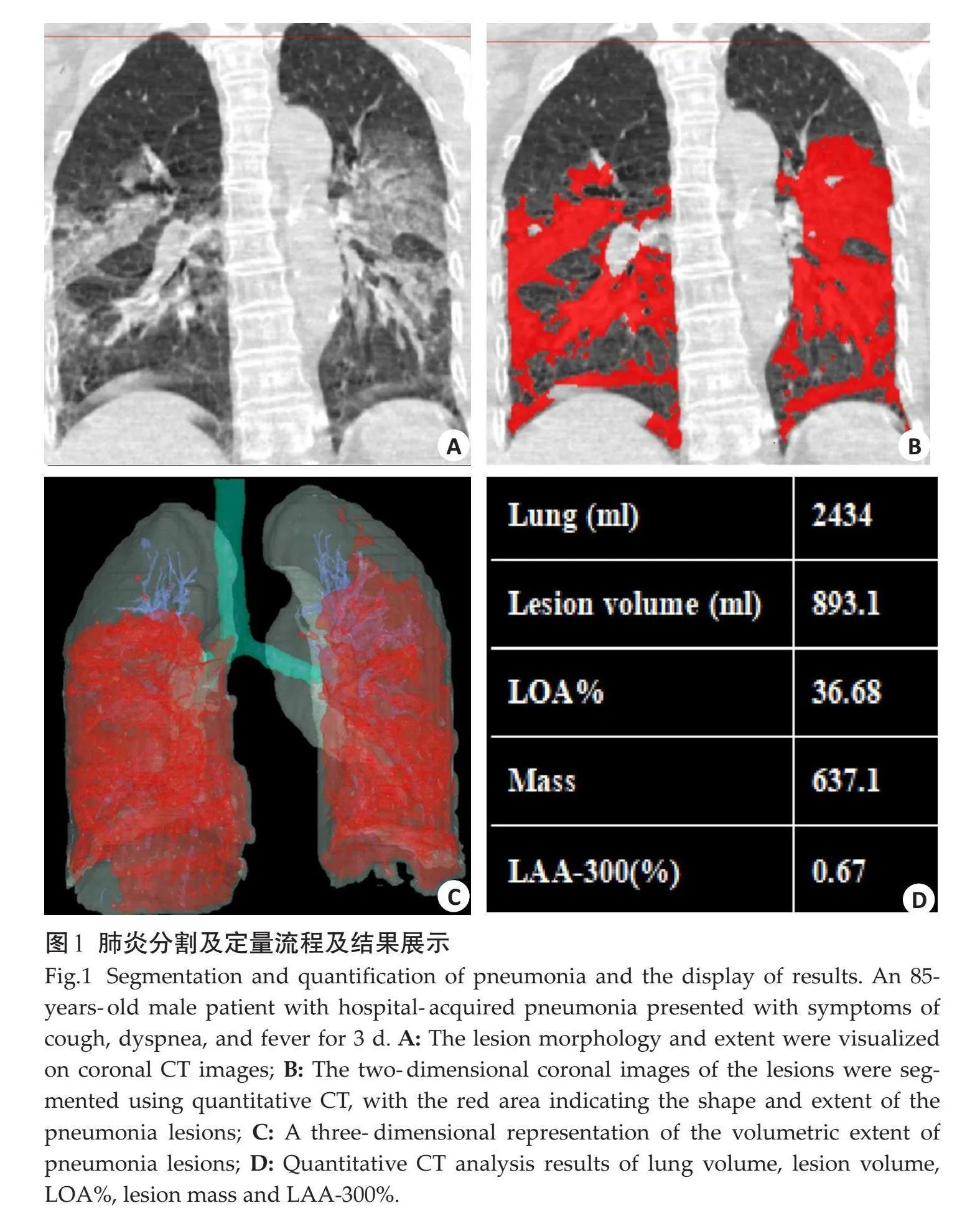
采用计算机定量分析平台(Digital Lung,DEXIN)对所有胸部CT图像进行定量分析(图1)。图像分割采用人工智能定量分析方法,分割简要步骤如下:进行整体肺分割;对病变区域进行分割及定量;采用三维几何分割方法对支气管和肺血管进行分割,并从肺组织总体积中抽取支气管和肺血管体积部分;计算各项定量参数。测量指标包括全肺体积(TV)、肺气肿定量(LAA-950%)、病变体积(LV)、病变体积百分比(LOA%)、病变质量、病变密度小于-300 HU的体积占病变总体积百分比(LAA-300%)。
所有CT图像分割结果由2位具有5年以上胸部影像诊断经验的放射科医生确定。如果存在不准确的区域,会通过手动分割并重新计算定量值。
1.5" 统计学分析
采用SPSS19.0统计软件对数据进行统计学分析。符合正态分布计量资料以均数±标准差表示,采用方差分析进行组间比较,LSD-t检验进行两两比较;计数资料以n(%)表示,组间比较采用卡方检验。使用ROC曲线分析定量影像指标对病原菌特征的区分能力。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 患者资料
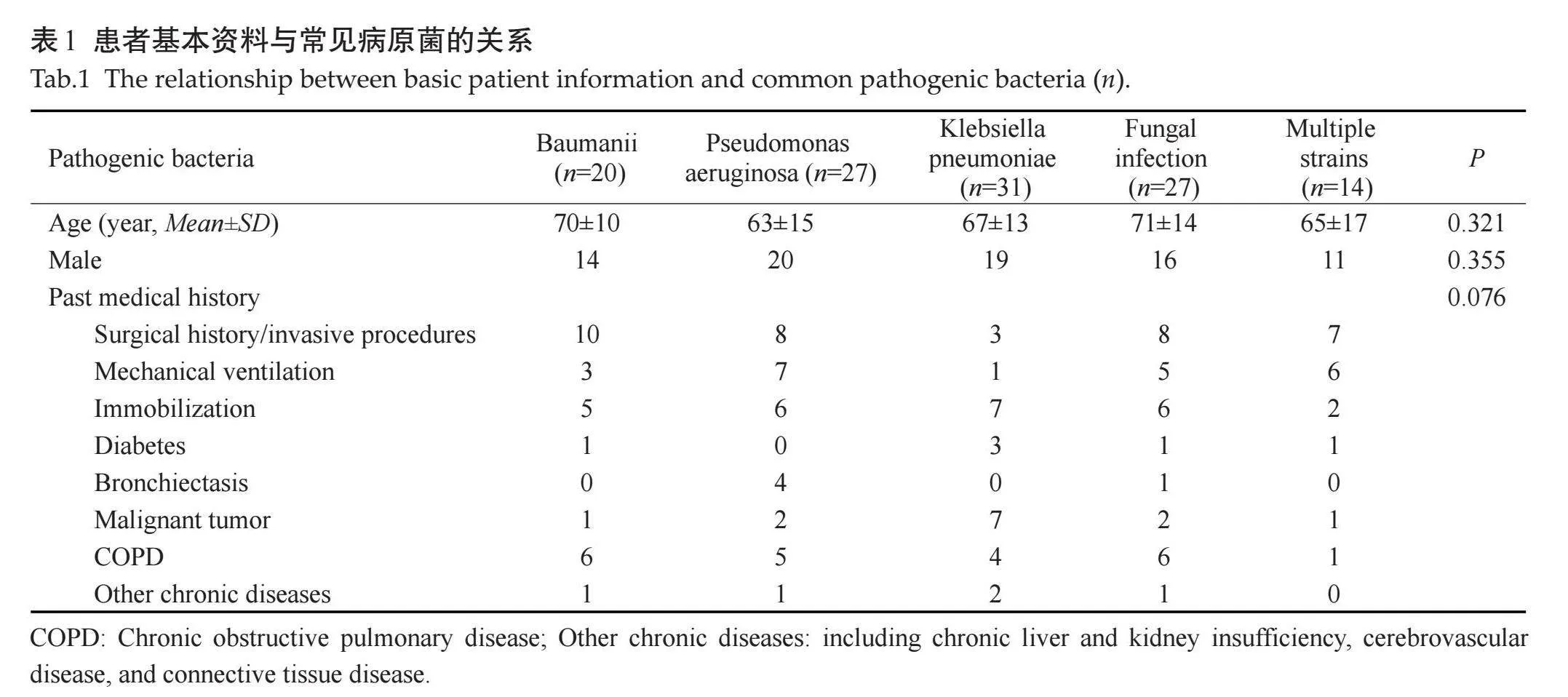
通过痰培养共检出病原菌167株,其中革兰阴性菌126株(75.4%) ,革兰阳性菌14株(8.4%),真菌27株(16.2%)。细菌感染前3位分别为肺炎克雷伯杆菌(n=31,20.13%)、铜绿假单胞菌(n=27,17.35%)、鲍曼不动杆菌(n=20,12.90%)。合并真菌感染最常见为白念珠菌。多重细菌检出14例。VAP患者最常见的菌株为铜绿假单胞菌(7/21,33.3%)。手术史/侵入性操作与各类病原菌分布存在较高相关性,在患者既往史和病原菌分布之间的差异无统计学意义(P=0.076,表1)
2.2" 影像学特点
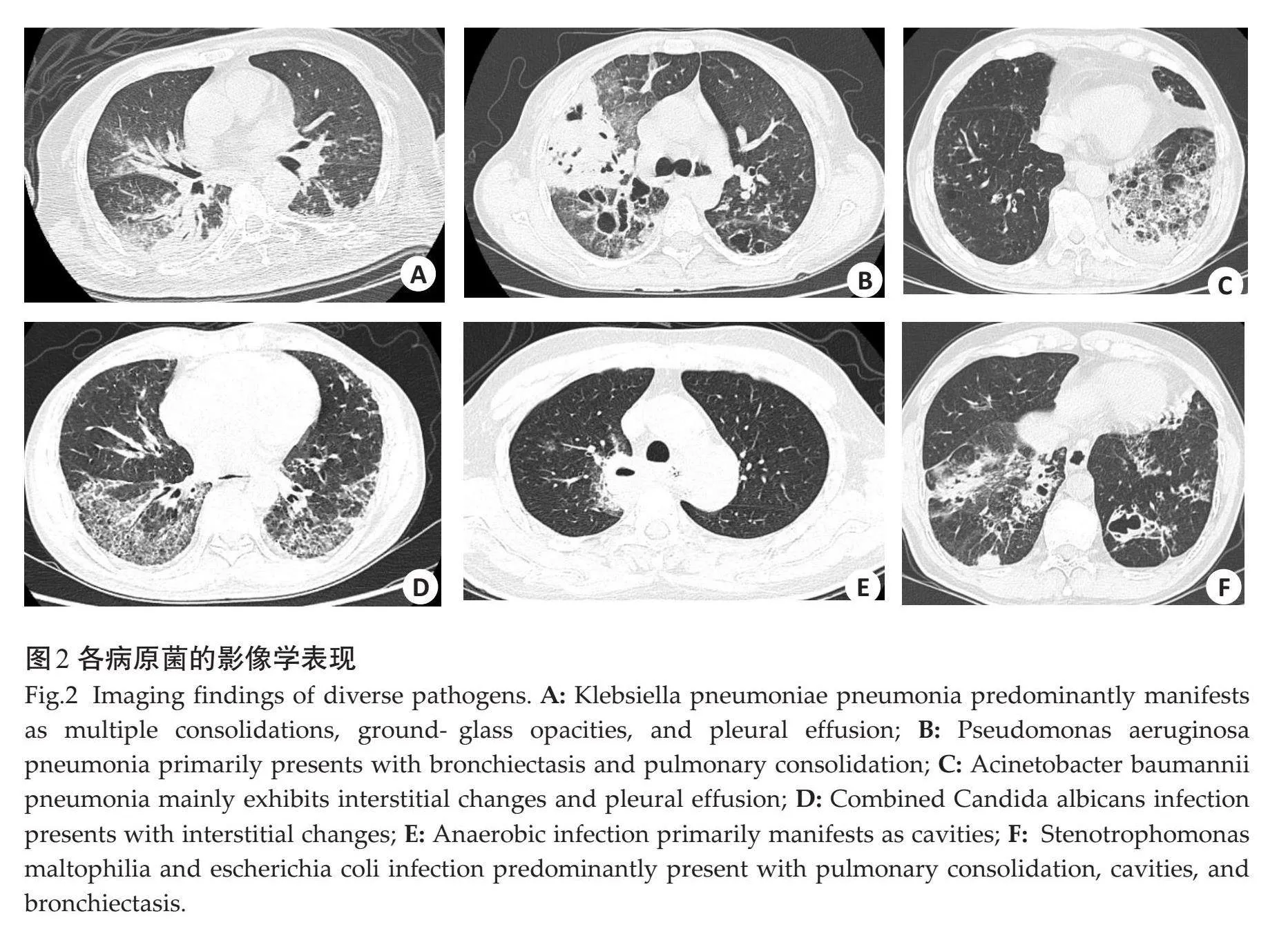
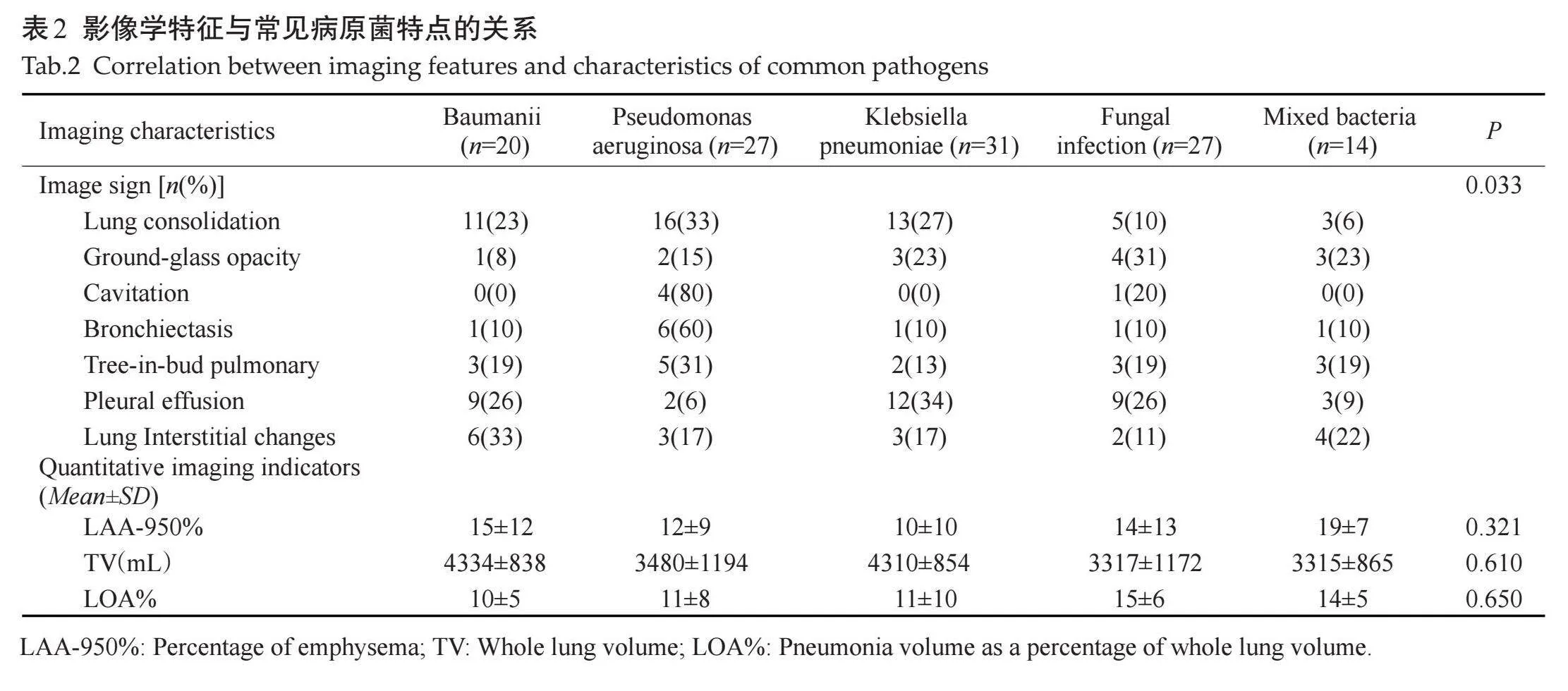
胸部CT图像中HAP/VAP最常见的征象是肺实变。各征象与病原菌的对应关系的差异有统计学意义(P=0.033,表2、图2)。除肺实变外,肺炎克雷伯杆菌肺炎常见的征象为胸腔积液(34%)和磨玻璃影(23%);支气管扩张(60%)和空洞(80%)多见于铜绿假单胞菌肺炎;间质性改变(33%)和胸腔积液(26%)多见于鲍曼不动杆菌肺炎。定量CT分析发现,LAA-950%在肺炎克雷伯杆菌肺炎患者中最低(10%),在混合细菌感染患者中最高(19%);肺体积在肺炎克雷伯杆菌肺炎患者中最大(4310 mL),而在混合细菌感染患者中最小(3315 mL)。LOA%最大者为合并真菌感染(15%),其次是混合细菌感染(14%)。以LOA%=10.5%作为区分有无合并真菌感染或多重细菌感染的截断值,曲线下面积为0.713(P=0.041),敏感度和特异度分别为79%和70%。
3" 讨论
本研究结果显示,导致HAP/VAP的主要病原菌包括肺炎克雷伯杆菌、铜绿假单胞菌和鲍曼不动杆菌。该结果与在一项为期10年的前瞻性观察研究中所得到的成人HAP的临床和微生物学特征结果[14] 基本一致。而近期有国内学者报道HAP多重耐药菌感染以铜绿假单胞菌最常见,其次是鲍曼不动杆菌[12] ;国外相关研究则认为 HAP/VAP主要由金黄色葡萄球菌引起[15, 16] 。这与本研究结果略有差异,表明HAP/VAP患者的病原菌类型可能会受到不同地区和当地流行病学的影响。因此,临床实践指南需要根据当地流行病学进行个性化定制[17, 18] 。
本研究发现,HAP/VAP的发生与患者的基础疾病密切相关。有综述显示,胸腹手术、住院史、心肺疾病以及糖尿病均为HAP/VAP的危险因素,会增加本病的风险[19] 。此外,还存在一些特定的危险因素如神经系统疾病和自身免疫性疾病等[20] 。慢性阻塞性肺疾病被认为是VAP的独立危险因素,统计数据表明,在慢性阻塞性肺疾病中患者超过50%死亡是由于HAP/VAP[10, 19] 。伴有昏迷和糖尿病的HAP/VAP老年患者需要特别监护。这与本研究显示的临床资料特点基本一致。总之,通过综合控制各方面危险因素可以有效预防HAP/VAP[21] 。
对于HAP/VAP的诊断,目前尚无“金标准”,临床满足条件越多,诊断信心越高[15] 。其中影像学检查是诊断HAP/VAP的重要手段,应尽早进行胸部CT检查[12, 22] 。CT图像不仅有助于肺炎的检出和排除,也为病原菌的鉴别诊断提供了可靠依据[23] 。
本研究中各病原菌均有的影像学特征是肺实变,其主要机制是细菌进入肺泡腔产生大量渗出液和坏死组织,导致气体减少以及肺部组织硬化[24] 。然而,其他伴随征象也对病原菌的辨识起到提示作用[25] 。例如肺炎克雷伯杆菌也可见胸腔积液及磨玻璃样改变;铜绿假单胞菌肺炎还可见支气管扩张和空洞;鲍曼不动杆菌肺炎还可见到胸腔积液和小叶间隔增厚。既往研究结果显示肺炎克雷伯菌肺炎CT图像多数病灶内可见小空洞,并且部分病灶内见小低密度影[24, 26] 。此外,在病灶周围还可以观察到具有一定特征性的磨玻璃样影,该征象发生机制是由于细菌通过血行播散引起的,其特点是斑片和空洞性的病灶主要分布在肺部边缘区域,并沿着血管走行分布。有研究显示,铜绿假单胞菌肺炎是支气管扩张症常见的肺部感染,可导致支气管壁结构和纤毛功能受损,从而引起气道破坏[27] 。也有研究显示,鲍曼不动杆菌肺炎以肺实变为主要影像特征,超过一半的患者同时伴有胸腔积液,这两种征象在诊断中保持较高的敏感度和特异度[28, 29] 。
此外,在病情评估方面,定量CT可为HAP/VAP的病变范围提供客观依据,对评估病变严重程度以及比较病变吸收或扩大情况具有重要价值[30] 。本研究采用人工智能模型对HAP/VAP患者肺实质进行定量分割,采用人工智能和区域生长方式相结合,对肺炎范围进行分割,确保了基于密度的区分方法以及对病变范围的后期修正。有学者使用该方法作为辅助新型冠状病毒轻型和重型分析,能够准确评估病变范围和给予定量指标,从而实现准确判断[31] 。本研究发现,病变范围较大的患者常合并真菌或混合细菌感染;同时,这两类感染也多出现在肺气肿定量较高,肺体积缩小的患者中。肺体积缩小常伴有慢性肺部疾病,例如支气管扩张、肺结核、间质性肺炎。
本研究仍存在以下局限性:由于数据受限,未与社区获得性肺炎进行对比;真菌感染常为合并感染,难以与细菌感染区分;缺少多次检查数据,初期的检查未包含CT图像,因此在未来有必要进行前瞻性研究以确保资料收集的完整性;单中心研究,可能限制了本研究结果对全国HAP/VAP患者的适用性,后续应纳入多中心样本来减少结果偏倚。
综上所述, HAP/VAP病原菌和影像学特征存在一定相关性,对于特异性征象的辨识有助于我们早期诊断病原菌,并且定量CT技术可准确评估HAP/VAP病变范围,进而辅助临床及时做出治疗决策。
参考文献:
[1]" "Zilberberg MD, Nathanson BH, Puzniak LA, et al. Descriptive epidemiology and outcomes of nonventilated hospital‑acquired, ventilated hospital-acquired, and ventilator‑associated bacterial pneumonia in the United States, 2012-2019[J]. Crit Care Med, 2022, 50(3): 460-8.
[2]" "Papazian L, Klompas M, Luyt CE. Ventilator-associated pneumonia in adults: a narrative review[J]. Intensive Care Med, 2020, 46(5): 888-906.
[3]" "于翠香, 王西艳. 《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)》解读[J]. 中国医刊, 2021, 56(9): 951-3.
[4]" "Klompas M, Branson R, Cawcutt K, et al. Strategies to prevent ventilator-associated pneumonia, ventilator‑associated events, and nonventilator hospital-acquired pneumonia in acute-care hospitals: 2022 Update[J]. Infect Control Hosp Epidemiol, 2022, 43(6): 687-713.
[5]" "Candel FJ, Salavert M, Estella A, et al. Ten issues to update in nosocomial or hospital-acquired pneumonia: an expert review[J]. J Clin Med, 2023, 12(20): 6526.
[6]" "Russell CD, Koch O, Laurenson IF, et al. Diagnosis and features of hospital-acquired pneumonia: a retrospective cohort study[J]. J Hosp Infect, 2016, 92(3): 273-9.
[7]" " 王" 立, 王亚娟, 邹" 琳, 等. 高龄老年人获得性肺炎的病原菌及其耐药性分析[J]. 现代预防医学, 2011, 38(2): 327-9.
[8]" " 钦晓英, 项小燕, 黄" 培, 等. ICU呼吸机相关肺炎病原菌分布及耐药性分析[J]. 医院管理论坛, 2022, 39(6): 54-7, 5.
[9]" "Modi AR, Kovacs CS. Hospital-acquired and ventilator-associated pneumonia: diagnosis, management, and prevention[J]. Cleve Clin J Med, 2020, 87(10): 633-9.
[10]" Kim BG, Kang M, Lim J, et al. Comprehensive risk assessment for hospital‑acquired pneumonia: sociodemographic, clinical, and hospital environmental factors associated with the incidence of hospital-acquired pneumonia[J]. BMC Pulm Med, 2022, 22(1): 21.
[11]" 曹" 霞, 李" 丹, 杨" 琴, 等. 2019-2021年医院获得性肺炎和呼吸机相关性肺炎的多重耐药菌分布特征及耐药性分析[J]. 临床药物治疗杂志, 2023, 21(5): 45-50.
[12]" 张" 禹, 陈婷婷, 张" 茜, 等. 多重耐药细菌性医院获得性肺炎与呼吸机相关性肺炎的CT征象探讨[J]. 临床放射学杂志, 2020, 39(10): 1967-70.
[13]" 蒲豆豆, 袁" 慧, 马光明, 等. 定量CT在评估类风湿性关节炎相关间质性肺病中的应用[J]. 中国医学物理学杂志, 2022, 39(7): 860-4.
[14] Yin YY, Zhao CJ, Li HN, et al. Clinical and microbiological characteristics of adults with hospital-acquired pneumonia: a 10-year prospective observational study in China[J]. Eur J Clin Microbiol Infect Dis, 2021, 40(4): 683-90.
[15] Heitz M, Levrat A, Lazarevic V, et al. Metagenomics for the microbiological diagnosis of hospital‑acquired pneumonia and ventilator-associated pneumonia (HAP/VAP) in intensive care unit (ICU): a proof-of-concept study[J]. Respir Res, 2023, 24(1): 285.
[16]" Enne VI, Personne Y, Grgic L, et al. Aetiology of hospital-acquired pneumonia and trends in antimicrobial resistance[J]. Curr Opin Pulm Med, 2014, 20(3): 252-8.
[17]" Feng DY, Zhou YQ, Zou XL, et al. Factors influencing mortality in hospital-acquired pneumonia caused by Gram-negative bacteria in China[J]. J Infect Public Health, 2019, 12(5): 630-3.
[18]" Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the infectious diseases society of America and the American thoracic society[J]. Clin Infect Dis, 2016, 63(5): e61-e111.
[19] Bolboli Zade P, Farahani A, Riyahi M, et al. A literature review on hospital‑acquired pneumonia, community‑acquired pneumonia, and ventilator-associated pneumonia[J]. Gene Cell Tissue, 2021, 9(2): e116869.
[20] Torres A, Niederman MS, Chastre J, et al. International ERS/ESICM/ESCMID/ALAT guidelines for the management of hospital-acquired pneumonia and ventilator-associated pneumonia: guidelines for the management of hospital‑acquired pneumonia (HAP)/ventilator-associated pneumonia (VAP) of the European Respiratory Society (ERS), European Society of Intensive Care Medicine (ESICM), European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and Asociación Latinoamericana del Tórax (ALAT)[J]. Eur Respir J, 2017, 50(3): 1700582.
[21] Feng DY, Zhou YQ, Zou XL, et al. Differences in microbial etiology between hospital-acquired pneumonia and ventilator-associated pneumonia: a single-center retrospective study in Guang Zhou[J]. Infect Drug Resist, 2019, 12: 993-1000.
[22] Ericson JE, McGuire J, Michaels MG, et al. Hospital-acquired pneumonia and ventilator‑associated pneumonia in children: a prospective natural history and case-control study[J]. Pediatr Infect Dis J, 2020, 39(8): 658-64.
[23]" 刘士远, 谢丽璇. 影像学在肺部感染诊断中的地位[J]. 中国医学计算机成像杂志, 2010, 16(5): 361-5.
[24]" 邓" 乾, 钱恩国, 吴忠纯, 等. 肺炎克雷伯菌肺炎的CT影像表现[J]. 影像研究与医学应用, 2023, 7(22): 158-60.
[25]" 王丽辉, 张伟俊, 杨思敏, 等. 白念珠菌气道定植对铜绿假单胞菌所致呼吸机相关性肺炎的影响[J]. 首都医科大学学报, 2024, 45(2): 187-93.
[26]Chen SP, Zou DD. Prognosis of hospital‑acquired pneumonia/ventilator‑associated pneumonia with Stenotrophomonas maltophilia versus Klebsiella pneumoniae in intensive care unit: a retrospective cohort study[J]. Clin Respir J, 2022, 16(10): 669-76.
[27]" 刘向前, 韩向前, 孙晓霞, 等. 支气管扩张合并大咯血患者铜绿假单胞菌感染与影像学分析[J]. 中华医院感染学杂志, 2019, 5(11): 1665-8.
[28]" 穆" 婧, 王军大, 杨雅淋, 等. 鲍曼不动杆菌肺炎多种CT征象的多因素分析[J]. 中国CT和MRI杂志, 2023, 21(1): 62-5.
[29]" 信瑞强, 李艳翠, 甄根深, 等. 鲍曼不动杆菌肺感染影像学特征分析[J]. 中国医学影像学杂志, 2017, 25(10): 748-50.
[30]" 陈" 静, 金晨望, 郭佑民, 等. 定量CT评估新型冠状病毒肺炎患者肺部改变的可行性分析[J]. 中国CT和MRI杂志, 2022, 8(10): 28-30.
[31]" 陈" 静, 于" 勇, 段海峰, 等. 基于定量CT对新型冠状病毒肺炎肺部改变的纵向研究[J]. 中国医学物理学杂志, 2020, 37(4): 445-9.
(编辑:林" 萍)
