CT影像特征预测胸腺上皮性肿瘤病理分型
2024-10-31赵静黄晓媚杨俊罗振东曾伟雄张妮秦耿耿文戈


摘要:目的" 探讨基于临床及CT影像特征构建机器学习模型预测胸腺上皮性肿瘤病理分型并评估其预测效能。方法" 回顾性收集2006年1月~2023年6月在南方医科大学南方医院经病理证实的221例胸腺上皮性肿瘤患者资料,包括临床信息、CT影像和病理结果,并根据简化病理分型将患者分为低危型(A、AB、B1型)和高危型(B2、B3、胸腺癌)。以7:3的比例将患者随机划分为训练集(n=159)和验证集(n=62);在训练集中,采用单因素Logistic回归分析低危组和高危组临床及CT特征的差异性,应用逐步回归和LASSO回归进一步降维筛选特征,构建4种机器学习模型(Logistic回归、随机森林、决策树和支持向量机模型)。在验证集中通过ROC曲线分析曲线下面积评价模型预测效能。结果" 221例胸腺上皮性肿瘤患者中105例为低危型(训练集74例,验证集31例),116例为高危型(训练集85例,验证集31例)。单因素分析结果显示,高危组与低危组比较性别、胸痛差异有统计学意义(Plt;0.05);通过逐步回归法选取3个CT影像特征(肿瘤强化程度、心包或大血管侵犯、胸膜侵犯)构建多因素Logistic回归模型,通过LASSO回归分析最终筛选出8个临床及CT影像特征构建随机森林、决策树及支持向量机模型。模型在训练集上的曲线下面积分别为0.793、0.854、0.761、0.816,在验证集上的曲线下面积分别为0.819、0.742、0.710、0.811。结果表明Logistic回归模型泛化性优于其他3个模型。 结论" 基于CT影像特征构建的Logistic回归模型在预测胸腺上皮性肿瘤病理分型上具有良好的诊断效能,有望协助临床早期无创性识别高危型胸腺瘤及胸腺癌。
关键词:胸腺上皮性肿瘤;影像学特征;临床特征;预测模型
Prediction of pathological classification of thymic epithelial tumors based on" CT imaging features
ZHAO Jing1, HUANG Xiaomei2, YANG Jun3, LUO Zhendong4, ZENG Weixiong1, ZHANG Ni1, QIN Genggeng1, WEN Ge1
1Department of Radiology, 2Department of Medical Imaging Education and Research, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China; 3Department of Radiology, The Tenth Affiliated Hospital of Southern Medical University, Dongguan 523050, China; 4Department of Radiology, the University of Hong Kong-Shenzhen Hospital, Shenzhen 518000, China
Abstract: Objective To investigate the construction and predictive performance of machine learning models based on clinical and CT imaging features for predicting pathological subtypes of thymic epithelial tumors (TETs). Methods This retrospective study included data from 221 patients with pathologically confirmed TETs at Nanfang Hospital, Southern Medical University, between January 2006 and June 2023. The data collected included clinical information, CT images, and pathological results. According to simplified pathological classification, the patients were classified into low-risk group (type A, AB, B1) and high-risk group (type B2, B3, thymic carcinoma). The included cases were randomly divided into the training set (n=159) and the validation set (n=62) at a ratio of 7:3. In the training set, univariate logistic regression was used to analyze the differences of clinical and CT characteristics between low-risk group and high-risk group. Feature selection was performed using stepwise regression and LASSO regression to construct four machine learning models, that were logistic regression, random forest, decision tree, and support vector machine. Model performance was evaluated in the validation set by AUC. Results Among 221 cases of thymic epithelial tumors, 105 cases were low-risk type (74 in training set, 31 in validation set) and 116 cases were high-risk type (85 in training set, 31 in validation set). The results of univariate analysis showed that there were significant differences in sex and chest pain between high-risk group and low-risk group (Plt;0.05). Three CT features (tumor enhancement, pericardial or great vessel invasion, and pleural invasion) were selected using stepwise regression to construct a multivariate logistic regression model. Eight clinical and CT imaging features were selected through LASSO regression analysis for constructing random forest, decision tree, and support vector machine models. The AUCs for the models in the training set were 0.793, 0.854, 0.761, and 0.816, and in the validation set, they were 0.819, 0.742, 0.710, and 0.811, respectively. These results indicate that the logistic regression model has better generalization performance than the other three models. Conclusion The logistic regression model based on CT imaging features shows good diagnostic performance in predicting pathological subtypes of TETs and has potential for assisting clinicians in the early non-invasive identification of high-risk thymic tumors and thymic cancer.
Keywords: thymic epithelial tumors; imaging features; clinical features; prediction model
胸腺上皮性肿瘤(TETs)是一种来源于胸腺上皮组织的临床相对罕见的惰性肿瘤。病灶通常位于前纵隔,早期多无体感症状,随着肿瘤的增大,逐渐压迫纵隔局部,出现胸闷、气短等压迫症状,约1/3的患者伴自身免疫性疾病[1]。2021年《WHO胸部肿瘤分类》第五版对TETs组织学分型进行了修订[2];多数研究者根据临床需求将TETs分型简化分为低危型(A、AB、B1型)和高危型(B2、B3、胸腺癌)[3-5];目前TETs的治疗方案选择依病理分型而异,低危患者以手术切除为主,而高危患者通常予以术前辅助放、化疗等综合治疗方案治疗[6-8]。因此提高TETs术前简化病理分型的精准诊断,可为临床治疗方案的决策提供依据。
CT是TETs治疗前影像学评估的首选检查方式,但在TETs简化病理亚组分型中有较多重叠特征,导致CT难以有效区分[9-10]。机器学习作为人工智能的重要分支,可以通过复杂的算法来分析大量数据,识别高维数据特征中的内在联系,并针对特定任务完成分类和预测工作,在医学领域的应用十分广泛。机器学习可以联合临床及影像特征等不同模态的特征信息,基于不同的分类算法构建多种分类模型进行预测,有助于提高预测精度[11]。有研究提出,机器学习有望作为术前评估TETs手术入路的一种重要手段[12]。既往也有学者基于CT影像组学构建机器学习分类模型模型,并将其用于鉴别诊断TETs危险度[13];也有研究利用CT影像组学预测TETs的简化病理分型,其模型也具良好的诊断效能[14]。但上述研究均样本量较小,也未考虑TETs患者临床特征资料是否有助于提高CT影像诊断效能。本研究通过扩大样本量纳入221例TETs患者并收集其临床及CT影像资料,构建临床联合影像特征的TETs简化病理分型机器学习预测模型,并分析其预测效能,以期进一步为临床治疗决策提供依据,协助临床早期无创性识别高危型胸腺瘤及胸腺癌。
1" 资料与方法
1.1" 一般资料
本研究为回顾性研究,已获南方医科大学南方医院伦理委员会审核批准并豁免签患者知情同意书(审批号:NFEC-2021-289)。回顾性收集2006年1月~2023年6月南方医科大学南方医院经手术和穿刺活检病理证实的221例TETs患者的临床及影像学资料。纳入标准:经穿刺活检或手术病理证实为TETs,且简化病理分型为低危型和高危型;患者术前或治疗前均行CT平扫及增强检查,图像清晰,病灶内无明显噪声;手术与CT检查时间间隔小于1月;患者临床资料完整。排除标准:复发性TETs;病理分型不明确者;肿瘤最长直径lt;1 cm者;合并其他胸部肿瘤者或其他恶性肿瘤者。
1.2" 方法
1.2.1" 临床特征资料收集" "参照既往流行病学研究结果[15],收集患者临床特征资料,包括年龄、性别、主要症状或体征(胸闷、气短、咳嗽、胸痛、胸骨痛、背部疼痛、压迫感)以及是否合并重症肌无力。
1.2.2" TETs简化病理分型数据收集" "所有患者均经穿刺活检或手术获取病理标本,并经组织病理学检查取得最终病理诊断分型结果。对患者组织病理检查结果进行分型时,参照2021年WHO病理组织学分类标准重新对患者进行整理分类,将混合病理分型的按恶性程度高的进行划分,如B1/B2型TET按B2型分类。简化病理分型参照文献[16-17]的分类标准分为低危型(A、AB、B1型)和高危型(B2型、B3型和胸腺癌)。纳入病例以7:3的比例随机分为训练集159例(n=159,低危74例,高危85例)和验证集(n=62,低危31例,高危31例)。
1.2.3" TETs患者CT数据收集" "CT数据采集:CT仪器包括GE 64-slice CT、Philips 256-slice CT及Siemens SOMATOM Definition CT和SOMATOM Force CT。扫描时嘱患者仰卧,并指导患者进行呼吸配合。扫描参数设置:范围胸廓入口至膈下水平;电压120 kV,电流200 mAs,层厚5 mm,矩阵 512×512,螺距1.0 mm。增强扫描采用碘海醇(300 mgI/mL),总量60~80 mL。
1.2.4" CT征象评估" "由2位具有10年以上工作经验高年资影像诊断医师对入组病例图像独立阅片,观察者仅被告知肿瘤为TETs,不告知具体病理分型,在CT图像纵隔窗上评估并记录肿块大小(轴位图像上选取肿块最大截面上的长径及与其垂直的短径)、位置(是否跨越中线,以轴位图像上胸骨和胸椎中心连线与纵隔占位的关系来衡量,偏差超过1 cm定义为跨越)、形态(圆形或椭圆形、不规则形)、分叶(有、无)、坏死或囊变(有、无)、钙化(有、无)、平扫密度均匀(是、否)、平扫CT值、强化程度(轻度、中度、明显,肿瘤实质成分强化与平扫CT值相差gt;40 Hu为明显强化,gt;20 Hu为中度强化,lt;20 Hu为轻度强化)、纵隔脂肪线(清楚、模糊、消失)、纵隔肿大淋巴结(淋巴结短径gt;1 cm定义为肿大淋巴结)、远处转移(有、无)、肺内转移(有、无)、心包或大血管侵犯(有、无)、胸膜侵犯(有、无)、肺部侵犯(有、无,肿块-肺界面呈尖角或锯齿状)、胸骨骨质破坏(有、无)、心包积液(有、无)、胸腔积液(有、无);综合两位医师的结果做最终判定,当两位医师意见不一致时通过讨论达成一致。
1.2.5" 模型构建及效能评价" "将低危型和高危型患者的临床特征资料进行比较,筛选出组间存在差异的临床特征资料;通过单因素Logistic回归进行特征筛选,进一步使用逐步回归和LASSO特征选择方法进行降维和筛选,去除冗余的参数,以减少数据过拟合的影响。选取最优的临床及影像学特征基于训练集构建TETs简化病理分型的4种预测模型,分别是逻辑回归(LR)、随机森林(RF)、决策树(DT)和支持向量机模型(SVM),并采用10折交叉验证进行模型内部验证。基于验证集,使用上述通过内部检验的模型预测患者分型,并比较其与真实分型的差异。模型预测效能评价指标包括曲线下面积(AUC)值、准确率、敏感度、特异度、阳性预测值、阴性预测值,其中以AUC值为主要评价指标;采用 Delong 检验比较不同诊断模型的诊断效能;检验水准α为双侧0.05。
1.3" 统计学分析
采用SPSS25.0及R语言软件进行数据分析。计数资料以n(%)表示,组间比较采用χ2检验或Fisher确切概率法;符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本的t检验。以Plt;0.05为差异有统计学意义。2位高年资医师分别完成221例TETs患者CT图像特征分析,在训练集随机抽取30例患者,由另一名高年资对其影像数据进行二次评价,比较数据结果的一致性;使用Kappa系数或ICC值评估影像医师间一致性。Kappa系数0.61~0.8为高度一致性,0.81~1为几乎完全一致;ICC值gt;0.7,认为具有较高一致性。检验水准α为双侧0.05。
2" 结果
2.1" 临床资料
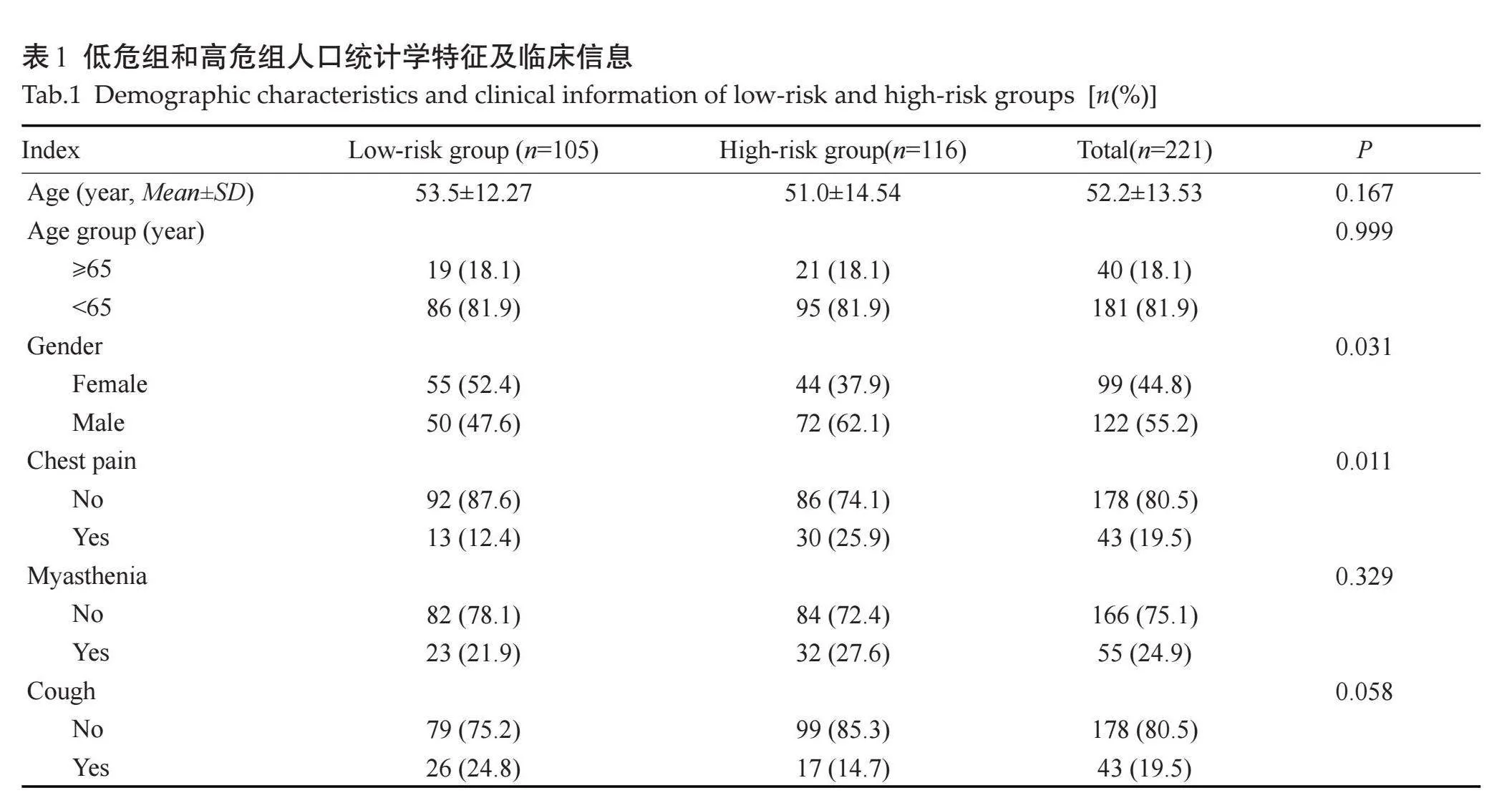
本研究221例TETs患者中,低危组105例(A型31例,AB型39例、B1型35例),高危组116例(B2型40例,B3型42例,胸腺癌34例)。高危组中,男性显著多于女性(Plt;0.05);低危组与高危组年龄的差异无统计学意义(P=0.167);221例中66例患者为查体发现,出现胸闷、胸痛、咳嗽等症状43例,其中胸痛在两组间的差异具有统计学意义(Plt;0.05);共55例患者出现重症肌无力,两组差异无统计学意义(P=0.392,表1)。
2.2" 影像资料
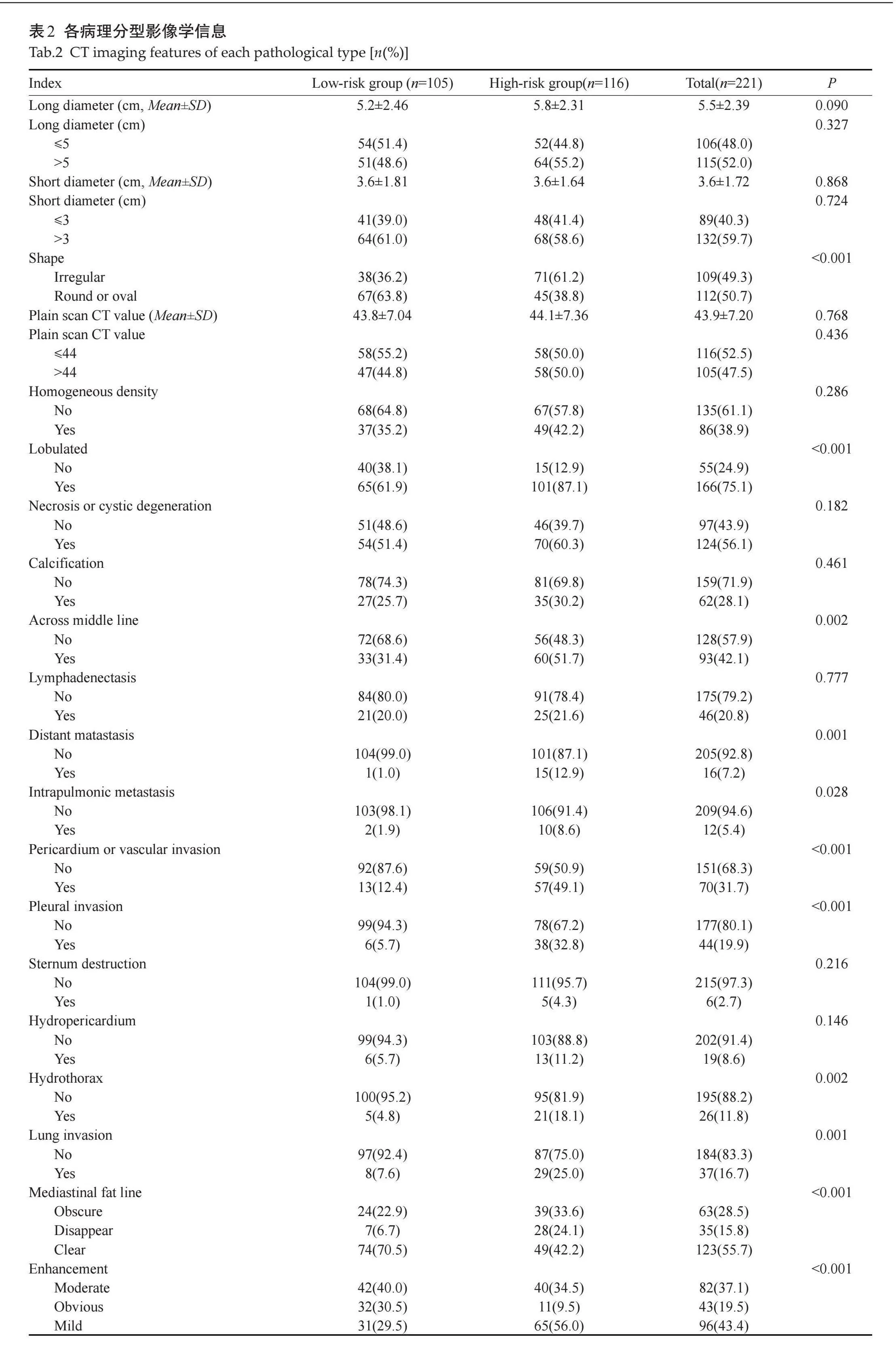
TETs高危组和低危组肿块长径和短径的差异无统计学意义(P=0.090、0.868),但高危组肿块长径和短径的最大值及最小值均大于低危组;肿瘤形态低危组以类圆形或椭圆形居多,67例(63.8%),高危组以形态不规则居多,71例(61.2%);低危组72例(68.6%)偏侧生长,33例(31.4%)跨越中线;高危组56例(48.3%)偏侧生长,60例(51.7%)跨越中线;低危组13例(12.4%)侵犯心包或大血管,1例(1.0%)远处转移;高危组57例(49.1%)侵犯心包或大血管,15例(12.9%)远处转移;肿块分叶、跨越中线、远处转移、肺内转移、心包或大血管侵犯、胸膜侵犯、胸腔积液、肺部侵犯、肿块形态(类圆形或椭圆形、不规则形)及CT增强程度的差异有统计学意义(Plt;0.05,表2)。
2.3" 观察者间一致性评价
观察者间影像学特征Kappa系数、ICC值为0.651~1.000(Plt;0.05),一致性高。
2.4" 临床及CT影像学特征筛选
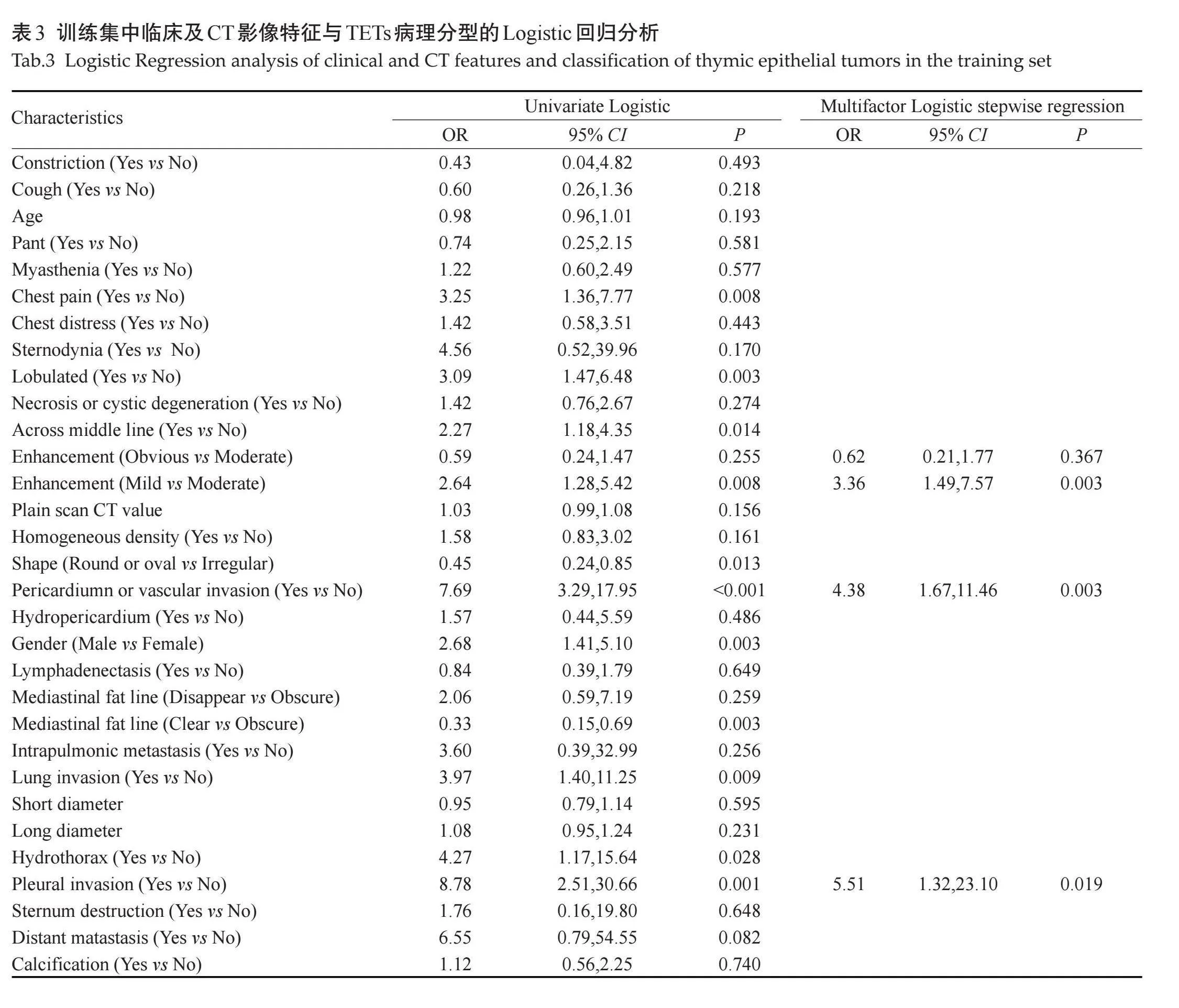
在训练集中,首先通过单因素Logistic筛选出9个特征,进一步采用逐步回归法筛选出3个特征(肿瘤强化程度、心包或大血管侵犯、胸膜侵犯),进而构建多因素Logistic回归模型(表3);采用LASSO筛选出最优的8个特征(性别、胸痛、分叶、纵隔脂肪线、强化程度、心包或大血管侵犯、胸膜侵犯、胸腔积液)构建RF、DT和SVM模型(图1)。单因素Logistic回归分析显示,性别、胸痛、分叶、跨越中线、强化程度、心包或大血管侵犯、肺部侵犯、胸膜侵犯可能是高危组的危险因素,而肿瘤形态(圆形或椭圆形)是潜在的保护因素;多因素Logistic回归结果显示,肿瘤强化程度、心包或大血管侵犯、胸膜侵犯是高危组的独立预测因素,对应的OR值分别为3.36(95%CI:1.49~7.57,P=0.003)、4.38(95%CI:1.67~11.46,P=0.003)、5.51(95% CI:1.32~23.10,P=0.019)。2.5" 基于临床及影像学特征的TETs病理分型诊断模型的预测效能
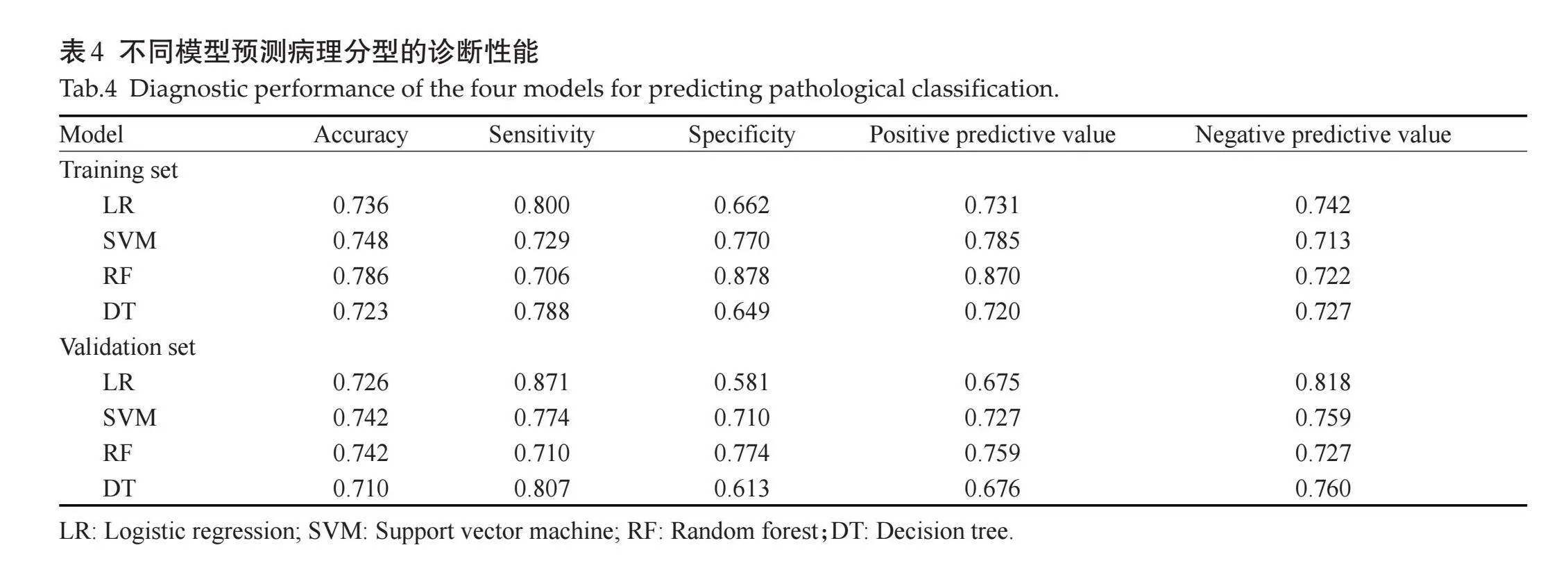
ROC曲线显示,训练集LR模型的AUC为0.793,RF模型为0.854,DT模型为0.761,SVM模型为0.816(图2A);验证集LR模型的AUC值为0.819,RF模型为0.742,DT模型为0.710,SVM模型为0.811(图2B)。各模型预测效能均较好;RF和SVM模型在训练集AUC值优于LR模型,但在验证集RF模型AUC值下降;Delong检验显示训练集中RF与DT、RF与SVM、SVM与DT模型间诊断效能差异有统计学意义;验证集中SVM与DT模型间诊断性能差异有统计学意义;各模型准确率、敏感度、特异度、阳性和阴性预测值(表4)。
3" 讨论
TETs易发生于中老年人,极少数发生在儿童及青少年,男女发病率相等[18-19]。有研究显示儿童发病率仅0.15%[19];本研究20岁以下2例,均为高危型,与文献报道一致。由于胸腺随着年龄增长不断退化,年龄越小,胸腺细胞功能越活跃,越利于高风险肿瘤细胞的生长,因此笔者认为儿童及青少年的TETs高危型发病率更高;肿瘤较小时,通常无症状,患者多为查体发现;部分患者出现胸闷、胸痛、咳嗽等症状,部分合并重症肌无力。本研究中两组间胸痛症状的发生差异有统计学意义(Plt;0.05),而重症肌无力的差异则无统计学意义(P=0.392),这与部分研究结果一致:有研究认为胸腺癌(50.0%)更易出现胸痛[20]。本研究出现胸痛的高危组(30例)患者中16例(53%)为胸腺癌,一方面可能由于高危型TETs肿瘤更大,对纵隔局部的压迫明显,进而导致高危型存在更高胸痛风险,另一方面高危型TETs容易侵犯周围组织结构(肺、胸膜、心包或大血管),继而会出现胸痛症状;文献报道TETs合并重症肌无力的发病率各有不同,有文献显示15%~20%,也有文献显示30%~50%[21-23],本组病例合并重症肌无力55例(24.9%),其中B型43例(78%),以B2(n=15,27.2%)、B3(n=15,27.2%)型最多见,结果与文献基本一致。
CT是临床术前诊断TETs应用最广泛的影像学检查手段,从CT图像中提取影像学特征符合实际临床工作流程,且可以清晰地展示肿瘤的密度和形态特征,能区分TETs不同病理分型特点[24-26]。本研究中低危组TETs肿瘤形态规则,呈类圆形或椭圆形,较少出现分叶;高危组肿瘤形态不规则,可见分叶、棘状突起和锯齿征,与文献报道一致[27];高危组更容易出现对周围结构侵犯及转移,纵隔脂肪线模糊、消失。Jeong等[17]报道,肿瘤的形态、纵隔脂肪线和大血管侵犯是区分病理分型有用的CT特征。肿块大小在本组病例中差异无统计学意义,但高危组肿块长径和短径的最大值及最小值均大于低危组。有研究显示,肿瘤大小和病理学分类是预测TETs局部侵犯的重要因素,gt;6 cm的肿瘤局部侵犯风险更高[28]。本研究中,低危组纵隔脂肪线清晰(n=70)明显多于高危组(n=49);纵隔脂肪线模糊、消失高危组(n=39、28)多于低危组(n=24、7);高危组肿瘤容易侵犯胸膜,继而出现胸腔积液。有学者认为强化程度越高意味着肿瘤侵袭性能可能越低[29],本组高危组TETs更多出现轻中度强化,与文献报道基本一致。
TETs病理分型是目前临床公认影响TETs患者治疗和预后的重要因素[30-31]。因此,治疗前TETs准确的病理分型诊断成为临床治疗决策和预后评估的关键。本研究通过特征筛选降维后,提取了最优的临床影像特征构建4种机器学习模型,结果显示:LR模型的敏感度优于另外3种模型,RF模型特异度最佳;4种模型都显示出较好的预测效能。Delong检验显示,在训练集中,RF与DT、RF与SVM、SVM与DT模型间诊断效能差异有统计学意义;验证集中,SVM与DT模型间诊断性能差异有统计学意义。RF模型在训练集AUC值最高,但在验证集AUC值明显下降,这可能是由于临床特征数据分布不均匀,机器学习模型出现了过拟合现象。LR模型在验证集AUC值较好,显示出良好的泛化能力。SVM模型在训练集AUC值优于LR模型,验证集依然比较稳定。本研究中,多个CT影像特征在组间有统计学意义,但在多因素Logistic回归分析结果中只有3个特征纳入模型;LR模型较其他3个模型更为简单,并且只需CT影像特征就能在预测TETs低危组和高危组方面有较高的准确性和区分力;LR的可解释性强,临床医生对模型输出的结果容易解读。因此本研究推荐的最佳模型是LR预测模型,它具有较高诊断效能。
本研究的局限性:CT图像数据来源于不同的CT机型,不同CT图像参数可能存在一定差异;病例来源于同一中心,将来模型需要在多个中心的数据上得到进一步的外部验证;本研究为回顾性研究,纳入的病例均具备CT图像,在病例纳入时可能存在选择偏倚。
综上所述,本研究通过比较4种机器学习模型的分类性能,评估了基于临床和CT影像特征预测TETs简化病理分型的有效性,证明了基于CT影像特征构建的LR模型在预测病理分型上具有良好的诊断效能,特别是在高危型胸腺瘤及胸腺癌的早期无创性识别中具有重要的临床价值。这一研究为将来在临床实践中推广应用基于机器学习的测胸腺上皮性肿瘤简化病理分型辅助诊断工具提供了重要的理论支持和实践依据。
参考文献:
[1]" "中国医师协会肿瘤多学科诊疗专业委员会. 中国胸腺上皮肿瘤临床诊疗指南(2021版)[J]. 中华肿瘤杂志, 2021, 43(4): 395-404.
[2]" "苏秀芳, 徐坤财, 段晓蓓, 等. 增强CT熵特征联合传统影像征象对胸腺上皮性肿瘤危险程度的鉴别诊断[J]. 国际放射医学核医学杂志, 2023, 47(9): 545-54.
[3]" "任采月, 王升平, 张盛箭, 等. MSCT征象联合纹理分析在预测胸腺上皮性肿瘤WHO简化病理分型中的价值[J]. 中国癌症杂志, 2020, 30(6): 468-74.
[4]" "郑" 璇, 徐加利, 刘" 浩, 等. 基于增强CT影像组学的列线图模型在预测胸腺上皮性肿瘤WHO简化分型中的应用研究[J]. 中国CT和MRI杂志, 2023, 21(10): 102-5.
[5]" "陈" 杰, 洪" 悦, 王" 艳. 基于CT平扫影像组学特征在预测胸腺上皮性肿瘤WHO简化病理分型中的价值[J]. 中国CT和MRI杂志, 2024, 22(1): 71-3.
[6]" "Xu CW, Zhang YC, Wang WX, et al. Chinese expert consensus on the diagnosis and treatment of thymic epithelial tumors[J]. Thorac Cancer, 2023, 14(12): 1102-17.
[7]" Fang WT, Filosso PL, Roden AC, et al. Clinicopathological features and current treatment outcomes of neuroendocrine thymic tumours[J]. Eur J Cardiothorac Surg, 2021, 59(5): 1004-13.
[8]" "Shintani Y, Funaki S, Ose N, et al. Surgical management of thymic epithelial tumors[J]. Surg Today, 2021, 51(3): 331-9.
[9]" Strange CD, Ahuja J, Shroff GS, et al. Imaging evaluation of thymoma and thymic carcinoma[J]. Front Oncol, 2021, 11: 810419.
[10]Strange CD, Truong MT, Ahuja J, et al. Imaging evaluation of thymic tumors[J]. Mediastinum, 2023, 7: 28.
[11]" 潘德润. 基于机器学习模型探讨X线征象在骨肿瘤分类中的价值及其临床应用[D]. 广州: 南方医科大学, 2020.
[12]Kayi Cangir A, Orhan K, Kahya Y, et al. CT imaging-based machine learning model: a potential modality for predicting low-risk and high‑risk groups of thymoma: \"Impact of surgical modality choice\"[J]. World J Surg Oncol, 2021, 19(1): 147.
[13] Hu JP, Zhao YJ, Li MC, et al. Machine-learning-based computed tomography radiomic analysis for histologic subtype classification of thymic epithelial tumours[J]. Eur J Radiol, 2020, 126: 108929.
[14] Zhao WY, Ozawa Y, Hara M, et al. Computed tomography radiomic feature analysis of thymic epithelial tumors: differentiation of thymic epithelial tumors from thymic cysts and prediction of histological subtypes[J]. Jpn J Radiol, 2024, 42(4): 367-73.
[15] Feng XL, Lei XB, Dong WT, et al. Incidence and clinical variable inter-relationships of thymic epithelial tumors in Northwest China[J]. J Thorac Dis, 2018, 10(12): 6794-802.
[16]Jeong YJ, Lee KS, Kim J, et al. Does CT of thymic epithelial tumors enable us to differentiate histologic subtypes and predict prognosis?[J]. AJR Am J Roentgenol, 2004, 183(2): 283-9.
[17]Chen G, Marx A, Chen WH, et al. New WHO histologic classification predicts prognosis of thymic epithelial tumors: a clinicopathologic study of 200 thymoma cases from China[J]. Cancer, 2002, 95(2): 420-9.
[18] 刘运荣, 叶" 俭, 聂" 峰, 等. 胸腺瘤240例临床病理特征及诊断[J]. 诊断病理学杂志, 2020, 27(1): 5-10.
[19] Yalçin B, Demir HA, Ciftçi AO, et al. Thymomas in childhood: 11 cases from a single institution[J]. J Pediatr Hematol Oncol, 2012, 34(8): 601-5.
[20] 国小钰, 施珏倩, 柯淑君, 等. 胸腺上皮肿瘤组织学亚型的临床及CT表现特征[J]. 实用放射学杂志, 2014, 30(3): 411-5.
[21]" von Thüsen J. Thymic epithelial tumours: histopathological classification and differential diagnosis[J]. Histopathology, 2024, 84(1): 196-215.
[22] Fang WT, Yu ZT, Chen C, et al. China Anti-Cancer Association Guidelines for the diagnosis, treatment, and follow-up of thymic epithelial tumors (2023)[J]. Mediastinum, 2024, 8: 27.
[23] Marom EM. Advances in thymoma imaging[J]. J Thorac Imaging, 2013, 28(2): 69-80, 81-3.
[24] Kuriyama S, Imai K, Ishiyama K, et al. Using CT to evaluate mediastinal great vein invasion by thymic epithelial tumors: measurement of the interface between the tumor and neighboring structures[J]. Eur Radiol, 2022, 32(3): 1891-901.
[25] Dai HY, Lan BW, Li SK, et al. Prognostic CT features in patients with untreated thymic epithelial tumors[J]. Sci Rep, 2023, 13(1): 2910.
[26] 冯秀龙. CT影像组学预测胸腺上皮性肿瘤简化病理分型与临床分期的研究[D]. 西安: 空军军医大学, 2019.
[27] 黄金超, 曲方园, 李昉璇, 等. 胸腺上皮性肿瘤CT影像征象与病理危险度分级的对照研究[J]. 实用放射学杂志, 2022, 38(7): 1082-7.
[28] Gao J, Ao YQ, Wang S, et al. WHO histological classification and tumor size are predictors of the locally aggressive behavior of thymic epithelial tumors[J]. Lung Cancer, 2024, 187: 107446.
[29] 金" 晶, 邹立巍, 赵" 红, 等. 胸腺上皮肿瘤CT征象与WHO简化病理分型的相关性[J]. 实用放射学杂志, 2018, 34(9): 1343-7.
[30] Benitez JC, Besse B. Narrative review of immunotherapy in thymic malignancies[J]. Transl Lung Cancer Res, 2021, 10(6): 3001-13.
[31] Miller JW, Faubert BM, Mathews TP, et al. Metabolic signatures of thymomas: potential biomarkers and treatment targetsv[J]. Eur J Cardiothorac Surg, 2024, 65(2): ezad394.
(编辑:林" 萍)
