细胞外容积分数评估胰腺导管腺癌淋巴结转移
2024-10-31高茹茹郑增华覃璇马建兵韩俊丁健朱翔

[摘要] 目的探讨基于多层螺旋CT测量的细胞外容积分数(extracellular volume fraction,fECV)评估胰腺导管腺癌淋巴结转移的诊断效能。方法 回顾性收集2018年3月至2023年3月于嘉兴市第一医院被确诊为胰腺导管腺癌的74例患者的基本资料,所有患者均行多层螺旋CT增强检查,检查前均采集红细胞比容,扫描后测量病灶的平扫、门脉期、平衡期及相同层面腹主动脉CT值,计算fECV。以术后病理结果为金标准,利用受试者操作特征曲线分析fECV术前诊断胰腺导管腺癌淋巴结转移的效能。结果淋巴结转移阳性组33例,阴性组41例。淋巴结转移阳性组与阴性组的门脉期fECV比较,差异无统计学意义(=0.80,>0.05)。淋巴结转移阳性组与阴性组的平衡期fECV比较,差异有统计学意义(=2.84,<0.001)。门脉期及延迟期fECV对淋巴结转移的曲线下面积分别为0.517、0.870。结论 基于多层螺旋CT测量的平衡期fECV分数可评估胰腺导管腺癌淋巴结转移。
[关键词] 胰腺导管腺癌;CT值;细胞外容积分数;淋巴结转移
[中图分类号] R445.3[文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.26.009
Assessment of lymph node metastasis in pancreatic ductal adenocarcinoma using extracellular volume fraction
Department of Radiology, the First Hospital of Jiaxing, Jiaxing 314000, Zhejiang, China
[Abstract]ObjectiveTo assess the diagnostic efficacy of extracellular volume fraction(fECV) based on multi-slice spiral CT in evaluating lymph node metastasis of pancreatic ductal adenocarcinoma.MethodsA total of 74 patients diagnosed as pancreatic ductal adenocarcinoma from March 2018 to March 2023 in the First Hospitalof Jiaxing were retrospectively collected. All patients underwent enhanced multi-slice spiral CT examination.Hematocrit was collected before examination.CT values at the plain phase, portal phase, the equilibrium phase of the lesion and CT values of abdominal aorta at the same level were respectively measured after examination, and fECV was calculated.Using postoperative pathological results as the “gold standard”, the efficacy of fECV in diagnosing lymph node metastases of pancreatic ductal adenocarcinoma was evaluated by receiver operating characteristiccurve.Results There were 33 cases with lymph node metastasis in positive group and 41 cases in negative group. There was no statistically significant difference in fECV at the portal phase between lymph node metastasis positive group and negative group(=0.80, >0.05).There was statistically significant difference in fECV at the equilibrium phase between positive and negative lymph node metastasis group(=2.84, <0.001). The area under the curve of lymph node metastasis in portal phase and equilibrium phase were 0.517 and 0.870, respectively.Conclusion The fECV based on multi-slice spiral CT equilibrium phase can evaluate lymph node metastasis of pancreatic ductal adenocarcinoma.
[Key words]Pancreatic ductal adenocarcinoma; CT value; Extracellular volume fraction; Lymph node metastasis
胰腺导管腺癌发病率高,生存率低,80%的胰腺导管腺癌一经发现即为晚期,术后2年内复发率高,转移能力强,尤其淋巴结转移患者预后更差[1-3]。研究表明,细胞外容积分数(extracellular volume fraction,fECV)可预测胰腺导管腺癌的预后,胰腺导管腺癌内纤维组织增生,使细胞外容积扩大,造影剂缓慢进入并廓清延迟,在多期相增强CT检查中胰腺导管腺癌缓慢强化低于胰腺正常实质,但时间延迟后呈现逐渐比较增强的强化模式,fECV可直观显示肿瘤造影剂强化模式预测淋巴结转移,有助于临床进行准确的N分期,并指导后续辅助治疗,改善患者预后[4-7]。本研究旨在通过多层螺旋CT增强检查计算fECV评估胰腺导管腺癌淋巴结转移的价值。
1资料与方法
1.1 一般资料
回顾性分析2018年3月至2023年3月于嘉兴市第一医院被确诊为胰腺导管腺癌的74例患者的基本资料,患者一般资料见表1。纳入标准:①术后病理结果为胰腺导管腺癌者;②术前1个月行胰腺CT增强检查者;③患者影像资料及临床资料完整。排除标准:①术前有肿瘤相关放化疗病史;②有影响CT影像资料观察的运动或金属伪影。本研究经嘉兴市第一医院医学伦理委员会审核批准(伦理审批号:2024-KY-545)。
1.2 检查方法
使用320排螺旋CT扫描仪(日本Toshiba公司,Aquilion one)或64排螺旋CT扫描仪(德国Simens公司)。所纳入的74例患者术前均行CT平扫与CT增强扫描。CT扫描前患者禁食6~8h。扫描范围为肝脏上缘至双肾下缘水平。管电压120kV,自动管电流,层厚5mm,层间距5mm,螺距0.6,重建层厚1mm。CT增强扫描经肘前静脉用高压注射器团注非离子型比较剂碘海醇(300mgI/ml),流速3.5~4.0ml/s,剂量1.0ml/kg,比较剂注射后,动脉期30s,门脉期60s,延迟期180s。
1.3 图像分析及数据测量
所有病例影像资料传到PACS系统,测量胰腺导管腺癌平扫、门脉期及平衡期的CT值(CT、CT、CT)并计算胰腺导管腺癌ΔCT及ΔCT(ΔCT=CT-CT,ΔCT=CT-CT):感兴趣区选在肿瘤实性成分区,避开肿瘤囊变坏死区、非肿瘤区及血管伪影,同时测量同层面腹主动脉CT值(CT、CT、CT)并计算ΔCT(ΔCT=CT-CT):感兴趣区尽量位于血管中央,最大化测量,避开血管壁钙化斑块。计算fECV。fECV=(1-红细胞比容)×(ΔCT/ΔCT)×100%,其中红细胞比容于检查3d内采集。
由一名具有20年腹部影像诊断经验的影像科医生采用双盲法对所有病例影像资料进行淋巴结评估。淋巴结阳性评估标准:①短径≥9 mm;②9mm>短径≥5mm,且具有至少2个可疑形态学特征(边缘不规则或模糊、密度不均匀、圆形);③短径<5mm,且具有3个可疑形态学特征;计算影像科医师对胰腺导管腺癌淋巴结转移阳性诊断率,并与平衡期fECV比较,比较两者之间的诊断效果。
1.4 统计学方法
采用SPSS 25.0统计学软件对数据进行处理分析,计量资料以均数±标准差(x±s)表示,组间比较采用检验,计数资料用例数(百分率)[(%)]表示,以术后病理结果为金标准,应用受试者操作特征曲线下面积(area under the curve,AUC)分析fECV预测胰腺导管腺癌淋巴结转移的诊断效能。<0.05为差异有统计学意义。
2 结果
2.1 胰腺导管腺癌淋巴结转移阳性组与阴性组间fECV比较
胰腺导管腺癌淋巴结转移阴性组门脉期fECV为(0.12±0.06)Hu,阳性组为(0.14±0.08)Hu,两组比较差异有统计学意义(>0.05);胰腺导管腺癌淋巴结转移阳性组平衡期fECV为(0.31±0.09)Hu高于阴性组的(0.23±0.08)Hu,差异有统计学意义(<0.05)。
2.2 fECV对胰腺导管腺癌淋巴结转移的诊断效能
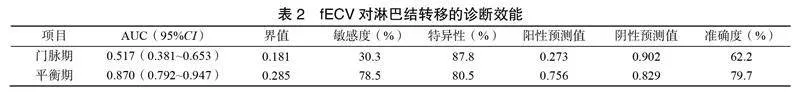
门脉期fECV对胰腺导管腺癌淋巴结转移的AUC值为0.517;平衡期fECV对淋巴结转移的AUC值为0.870,最大约登指数为0.563。当fECV≥0.285Hu,诊断为有淋巴结转移;fECV<0.285Hu,诊断为无淋巴结转移,见表2。
2.3 影像科医师及平衡期fECV对胰腺导管腺癌淋巴结转移的诊断效果
影像科医师对胰腺导管腺癌淋巴结转移阳性的诊断率为0.095,平衡期fECV对胰腺导管腺癌淋巴结转移阳性的诊断率为0.324,诊断效果明显高于影像科医师(<0.05)。
3 讨论
淋巴结转移影响胰腺导管腺癌预后非常重要的因素之一[8]。对于有淋巴结转移的患者,行淋巴结清扫是十分必要的,但清扫范围并不是越大越好,扩大淋巴结清扫并没有使患者从中受益。与淋巴结转移阳性比较,淋巴结转移阴性患者有显著的生存受益[9-10]。本研究中影像科医师诊断胰腺导管腺癌淋巴结转移阳性的诊断率较低,并不能满足临床需求。因此术前准确判定胰腺导管腺癌淋巴结有无转移对指导临床治疗及患者预后非常重要。fECV可无创预测术前结肠癌淋巴结转移情况[11]。本研究旨在评估fECV无创预测胰腺导管腺癌淋巴结转移,有助于临床治疗及改善患者预后。
胰腺组织由血管内空间、细胞内空间和细胞外血管外空间组成,胰腺导管腺癌乏血供,血管细少,故血管内空间可忽略,比较剂几乎不进入细胞内空间,因此增强CT胰腺导管腺癌的比较强化平衡期,通过定量测量fECV可直观显示肿瘤微环境和细胞外基质纤维化的相关信息[12]。胰腺炎症时通过胰腺星状细胞刺激α-平滑肌肌动蛋白表达使细胞外间隙基质蛋白过量生成引起胰腺纤维化,细胞外容积扩大,fECV值增大[13-14]。
肿瘤微环境和细胞外基质纤维化是肿瘤生物学侵袭性的关键因素,与胰腺导管腺癌预后相关[12]。胰腺导管腺癌细胞外基质大量纤维化导致缺血、缺氧及免疫抑制,增加肿瘤侵袭性及淋巴结转移[15]。此外,细胞外基质纤维化中癌症相关成纤维母细胞分泌细胞因子促进胰腺导管腺癌细胞增殖及淋巴结转移[16]。本研究平衡期fECV预测胰腺导管腺癌淋巴结转移的AUC为0.870,最大约登指数为0.563,当fECV≥0.285Hu,诊断为有淋巴结转移,fECV<0.285Hu,诊断为无淋巴结转移。fECV可预测淋巴结转移,fECV越大,淋巴结转移可能性越高,这与邵瑞丽[11]的研究结果一致。
肿瘤的强化程度和fECV不仅取决于肿瘤微环境如血流量、流速、渗透性及细胞外血管外组成成分,还取决于CT扫描方案,如延迟强化时间。本研究门脉期延迟60s,平衡期延迟180s,延迟时间越长使比较剂充分进入细胞外间隙,这也解释了平衡期fECV大于门脉期fECV,同时平衡期fECV预测胰腺导管腺癌淋巴结转移的AUC大于门脉期。研究表明延迟10min以上可使比较剂更加充分均匀分布于细胞外间隙[17]。然而延迟10min以上在临床常规工作中实现可能性较小,Yoon等[18]研究表明对于平衡临床常规工作和扫描方案,平衡期延迟180s所测fECV值是评估肝纤维化较好的扫描方案,与本研究平衡期延迟180s扫描方案一致。
本研究也有一些局限性:①样本量较小,在未来要扩大样本量使研究结果更有说服力;②10min延迟采集肿瘤强化可能会更均匀,虽然目前未有相关研究明确最佳延迟时间,但在临床检查中常规180s延迟强化可用于进行定量测量,因此本研究方法是有临床价值的;③本研究是一项单中心回顾性研究,需要多中心前瞻性研究验证fECV对胰腺导管腺癌淋巴结转移5f979ff351c65af3e29bac3b7565265188377506747c350bc0e741fb3b2e4b58的预测价值。经初步研究发现,多层螺旋CT测量fECV可评估胰腺导管腺癌淋巴结转移情况。fECV值越高,胰腺导管腺癌淋巴结转移可能性越大,有助于临床治疗方式选择和预测患者预后。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] SIEGEL R L, MILLER K D, WAGLE N S, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73(1): 17–48.
[2] RYAN D P, HONG T S, BARDEESY N. Pancreatic adenocarcinoma[J]. N Engl J Med, 2014, 371(22): 2140–2141.
[3] PAIELLA S, SANDINI M, GIANOTTI L, et al. The prognostic impact of para-aortic lymph node metastasis in pancreatic cancer: A systematic review and Meta-analysis[J]. Eur J Surg Oncol, 2016, 42(5): 616–624.
[4] FUJITA N, USHIJIMA Y, ITOYAMA M, et al. Extracellular volume fraction determined by dual-layer spectral detector CT: Possible role in predicting the efficacy of preoperative neoadjuvant chemotherapy in pancreatic ductal adenocarcinoma[J]. Eur J Radiol, 2023, 162: 110756.
[5] FUKUKURA Y, KUMAGAE Y, FUJISAKI Y, et al. Extracellular volume fraction with MRI: As an alternative predictive biomarker to dynamic contrast-enhanced MRI for chemotherapy response of pancreatic ductal adenocarcinoma[J]. Eur J Radiol, 2021, 145: 110036.
[6] OLIVE K P, JACOBETZ M A, DAVIDSON C J, et al. Inhibition of Hedgehog signaling enhances delivery of chemotherapy in a mouse model of pancreatic cancer[J]. Science, 2009, 324(5933): 1457–1461.
[7] HATA H, MORI H, MATSUMOTO S, et al. Fibrous stroma and vascularity of pancreatic carcinoma: Correlation with enhancement patterns on CT[J]. Abdom Imaging, 2010, 35(2): 172–180.
[8] TOL J A, BROSENS L A, VAN DIEREN S, et al. Impact of lymph node ratio on survival in patients with pancreatic and periampullary cancer[J]. Br J Surg, 2015, 102(3): 237–245.
[9] MICHALSKI C W, KLEEFF J, WENTE M N, et al. Systematic review and Meta-analysis of standard and extendedlymphadenectomy in pancreaticoduodenectomy for pancreatic cancer[J]. Br J Surg, 2007, 94(3): 265–273.
[10] SOHN T A, YEO C J, CAMERON J L, et al. Resected adenocarcinoma of the pancreas-616 patients: Results, outcomes, and prognostic indicators[J]. J Gastrointest Surg, 2000, 4(6): 567–579.
[11] 邵瑞丽. 基于CT的细胞外体积分数对结肠癌肝转移、淋巴结转移的预测研究[D]. 长春: 吉林大学, 2020.
[12] FUKUKURA Y, TAKUMI K, HIGASHI M, et al. Contrast-enhanced CT and diffusion-weighted MR imaging: Performance as a prognostic factor in patients with pancreatic ductal adenocarcinoma[J]. Eur J Radiol, 2014, 83(4): 612–619.
[13] LEE E, RYU G R, KO S H, et al. A role of pancreatic stellate cells in islet fibrosis and β-cell dysfunction in type 2 diabetes mellitus[J]. Biochem Biophys Res Commun, 2017, 485(2): 328–334.
[14] ZECHNER D, KNAPP N, BOBROWSKI A, et al. Diabetes increases pancreatic fibrosis during chronic inflammation[J]. Exp Biol Med:Maywood, 2014, 239(6): 670–676.
[15] APTE M V, XU Z, POTHULA S, et al. Pancreatic cancer: The microenvironment needs attention too![J]. Pancreatology, 2015, 15(Suppl4): 32–38.
[16] CHANG J H, JIANG Y, PILLARISETTY V G. Role of immune cells in pancreatic cancer from bench to clinical application: An updated review[J]. Medicine:Baltimore, 2016, 95(49): e5541.
[17] ZISSEN M H, WANG Z J, YEE J, et al. Contrast-enhanced CT quantification of the hepatic fractional extracellular space: Correlation with diffuse liver disease severity[J]. AJR Am J Roentgenol, 2013, 201(6): 1204–1210.
[18] YOON J H, LEE J M, KLOTZ E, et al. Estimation of hepatic extracellular volume fraction using multiphasic liver computed tomography for hepatic fibrosis grading[J]. Invest Radiol, 2015, 50(4): 290–296.
(收稿日期:2024–06–11)
(修回日期:2024–07–16)
