阿尔茨海默病和血管性痴呆关键致病基因的筛选与鉴定
2024-10-31苏曦阳尹安康韩璐王伟王娟



[摘要] 目的利用生物信息学方法分析阿尔茨海默病(Alzheimer’s disease,AD)和血管性痴呆(vascular dementia,VD)与正常对照组的差异表达基因(differentially expressed genes,DEGs),筛选关键基因并验证它们与这两种痴呆的关系。方法 从基因表达综合数据库(Gene Expression Omnibus,GEO)获取基因芯片数据集GSE122063,用GEO2R工具筛选AD、VD与正常对照组的DEGs,利用STRING数据库建立蛋白相互作用网络,使用Cytoscape筛选关键基因;利用DAVID数据库分析有网络连接的DEGs的基因本体(gene ontology,GO)富集和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路,预测DEGs的生物学功能;最后验证关键基因的表达,采用受试者操作特征曲线检测诊断效果。结果 AD和VD组分别筛选出1099个和505个DEGs,其中69个在蛋白相互作用网络中有关联。根据GO分析,DEGs主要存在于细胞的外侧质膜、表面和质膜,它们通过影响信号传导、炎症应答等生物过程和具有受体结合、信号受体活性等功能,共同导致痴呆的发生。根据KEGG分析,DEGs在微生物感染、类风湿关节炎、系统性红斑狼疮、炎症性肠病等免疫相关信号通路中有显著富集。鉴定4个关键基因:CCR5、CCL2、FCGR2A和ITGB2,它们在AD和VD组中均有高表达,这些基因的曲线下面积表明它们可能对痴呆的诊断有价值。结论通过生物信息学方法分析AD和VD,发现富集的信号通路和关键基因与免疫和炎症有关。
[关键词] 阿尔茨海默病;血管性痴呆;生物信息学分析;差异表达基因
[中图分类号] R741.02 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.26.003
Screening and identification of key pathogenic genes for Alzheimer’s disease and vascular dementia
1.Department of Laboratory Medicine, the Second Affiliated Hospital of Zhejiang Chinese Medical University, Hangzhou 310005, Zhejiang, China; 2.Department of Laboratory Medicine, Tongde Hospital of Zhejiang Province, Hangzhou 310012, Zhejiang, China
[Abstract]Objective This study utilizes bioinformatics methods to analyze differentially expressed genes (DEGs) between Alzheimer’s disease (AD) and vascular dementia (VD) compared to normal controls. The aim is to identify key genes and validate their relevance to both types of dementia. Methods Gene chip dataset GSE122063 were obtained from the Gene Expression Omnibus (GEO) database. Using the GEO2R tool, DEGs in AD, VD, and normal control group were screened. We constructed a protein-protein interaction network using the STRING database and identified key genes through Cytoscape. Subsequently, DAVID database were used to analyze gene ontology (GO) enrichment and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathways associated with interconnected DEGs, predicting their biological functions. Finally, diagnostic performance were validated and assessed by using receiver operating characteristic curves. Results In the AD and VD groups, we identified 1099 and 505 DEGs, respectively, with 69 genes showing associations in the protein-protein interaction network. GO analysis revealed that DEGs are primarily located in the extracellular matrix, cell surface, and plasma membrane. They influence biological processes such as signal transduction and inflammatory responses, with functions related to receptor binding and signal receptor activity, collectively contributing to dementia development. KEGG analysis indicated significant enrichment of DEGs in immune-related signaling pathways, including microbial infections, rheumatoid arthritis, systemic lupus erythematosus, and inflammatory bowel disease. Four key genes—CCR5, CCL2, FCGR2A, and ITGB2—with significantly elevated expression in both AD and VD groups were indentified. The area under the curve suggests their potential diagnostic value for dementia.ConclusionThrough bioinformatics analysis of AD and VD, the enriched signaling pathways and key genes associated with immunity and inflammation were discovered. These findings may play a crucial role in dementia progression and provide new insights for early diagnosis.
[Key words]Alzheimer’s disease; Vascular dementia; Bioinformatics analysis; Differentially expressed genes
痴呆是一种逐渐剥夺人类记忆力、思维能力和社会能力的神经系统疾病,随着中国及全球人口老龄化的加剧,其发病率不断攀升,成为公共卫生领域的一大挑战[1]。痴呆的发病机制尚未明确,这在某种程度上阻碍了疾病的早期识别和精准治疗。阿尔茨海默病(Alzheimer’s disease,AD)和血管性痴呆(vascular dementia,VD)是痴呆的两种主要类型,AD占所有类型痴呆的60%~80%,VD是最常见的非变性病痴呆[2-4]。AD的病理学研究主要集中在两种蛋白质的异常沉积:β-淀粉样蛋白(amyloid β-protein,Aβ)和tau蛋白[5]。Aβ在细胞外形成斑块,tau蛋白在细胞内形成纤维缠结。这些病理变化与神经炎症、突触损伤和神经元死亡相关,导致认知功能丧失。VD主要与小血管疾病、动脉粥样硬化、多发性梗死、血管性白质脑病和海马坏死等因素有关。尽管AD和VD在临床和病理上有所不同,但都会导致认知能力严重下降[6-8]。尽管现有研究已开始关注AD和VD的发病机制,但对其分子机制的理解仍不足。本研究利用在线数据库的组学数据,分析AD和VD患者与正常人间的差异表达基因(differentially expressed genes,DEGs),并进一步研究导致AD和VD发病的关键基因,为痴呆症的早期识别和干预提供理论支持。
1 资料与方法
1.1 获取基因数据
从基因表达综合数据库(Gene Expression Omnibus,GEO)下载GSE122063的基因微阵列数据集,该数据集基于GPL16699平台,包括56个AD样本、36个VD样本和44个非痴呆对照组样本。
1.2 筛选差异基因
GEO2R是一个在线工具,可比较GEO系列中的多个样品组并筛选出差异基因,将AD组和VD组与对照组比较。DEGs的甄选标准:调整后<0.05且|log FC|≥1.0。
1.3 构建蛋白网络
STRING数据库着力于构建与分析蛋白质间既有的及预测的交互网络,采用结合分值超过0.4的阈值表示中等及以上强度的蛋白-蛋白相互作用(protein-protein interaction,PPI)。利用Cytoscape软件3.10.0对获取的PPI网络进行可视化展示。
1.4 基因集富集分析
利用DAVID Version 6.8(https://david.ncifcrf. gov/)对筛选的DEGs进行基因本体(gene ontology,GO)功能富集和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析。设定值和FDR值均<0.05作为筛选阈值,<0.05为差异有统计学意义。
1.5 验证关键基因
GSE122063数据经log2处理,利用R(4.3.0)preprocessCore包进行数据标准化,对多个探针计算对应基因的平均值。使用ggpubr包和Wilcoxon test比较两组的表达差异。使用受试者操作特征曲线(receiver operating characteristic,ROC曲线)分析评估关键基因在痴呆症诊断中的有效性。
2 结果
2.1 筛选显著DEGs
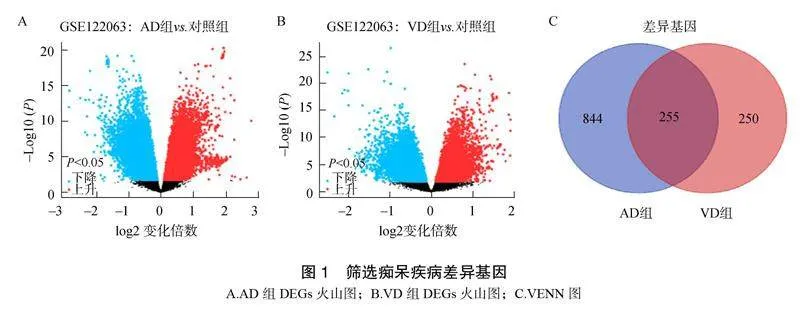
使用GEO2R工具绘制差异基因火山图,AD组筛选出1099个DEGs,包括402个上调和697个下调。VD组筛选出505个DEGs,包括165个上调和340个下调。通过VENN工具得到两组DEGs的255个重叠基因,见图1。
2.2 构建PPI网络并筛选关键基因
从255个DEGs中剔除非编码RNA(non-coding RNA,ncRNA),专注于编码蛋白的DEGs,利用STRING数据库和Cytoscape进行关联构建和可视化。网络中的139个节点代表剔除ncRNA后的139个DEGs,这些被STRING数据库识别并用于构建PPI网络,网络中的69个DEGs通过209条边形成紧密的蛋白网络关系,见图2。使用Cytoscape的cytoHubba插件对网络进行基于4种拓扑分析算法的分析:最大团中心性(maximal clique centrality, MCC)、最大邻域组件密度(density of maximum neighborhood component,DMNC)、最大邻域组件(maximum neighborhood component,MNC)、度中心性,分别可视化4种算法下位居前10的关键基因,并用韦恩图取交集筛选得到4个重叠的关键基因:CCR5、CCL2、FCGR2A、ITGB2。
2.3 DEGs功能及通路分析
利用DAVID在线数据库对上述69个具有蛋白交互关系的DEGs进行GO和KEGG分析。GO分析表明,DEGs 在生物过程(biology process,BP)方面主要涉及细胞间信号传导、炎症应答等;在细胞组分(cellular component,CC)方面主要分布于外侧质膜、血小板微粒等部位;在分子功能(moleclar function,MF)层面主要集中在受体结合、跨膜信号受体活性、信号受体活性等功能上。KEGG通路分析显示,DEGs涉及多种与微生物感染相关的通路(如冠状病毒和弓形虫感染)及其他通路(如类风湿关节炎和炎症性肠病等),见图3。
2.4 验证关键基因的表达和诊断效果
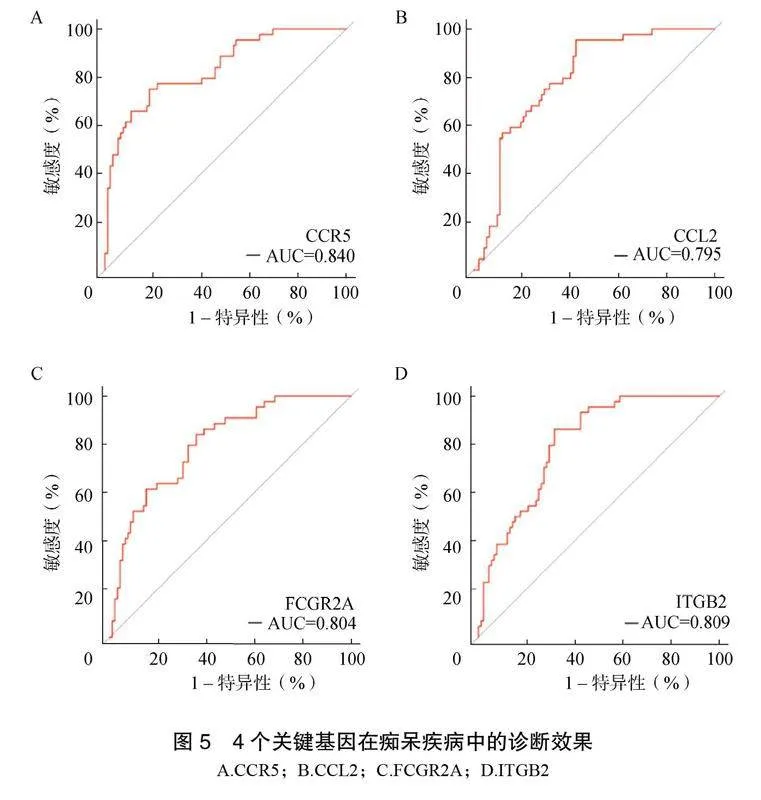
分析CCR5、CCL2、FCGR2A、ITGB2在痴呆疾病中的表达差异,发现AD和VD患者组织中的这些基因的mRNA表达上调,见图4。采用ROC曲线对CCR5、CCL2、FCGR2A、ITGB2的诊断效率进行评价,结果显示CCR5、CCL2、FCGR2A、ITGB2的曲线下面积(area under the curve,AUC)分别为0.840、0.795、0.804、0.809,均>0.75,见图5。
3 讨论
随着全球人口老龄化的加速,痴呆(特别是AD和VD)已成为全球健康的主要挑战之一[9]。尽管痴呆症的病理机制已有一定的研究,但其分子层面的复杂性仍是一个未解之谜,迫切需要更多的生物标志物来辅助诊断和治疗策略的发展。
本研究选取GSE122063数据集,分析其基因表达数据,寻找痴呆症相关基因。首先分析AD、VD和对照组的差异基因,AD组1099个DEGs,VD组505个DEGs。其次,鉴定并验证关键基因CCR5、CCL2、FCGR2A、ITGB2在AD和VD中的高表达, AUC值均>0.75,具有良好诊断价值。这些基因与免疫和炎症反应有关,与痴呆的炎性发病机制是一致的[10]。CCR5是一种趋化因子受体,可调节免疫细胞的迁移和活化。研究表明CCR5与AD的发展有着紧密的联系,是一种关键的炎症受体家族成员,且在AD的发展中起加速作用[11-12]。CCL2是一种趋化因子,可招募免疫细胞到炎症部位。一项系统性回顾分析发现,CCL2在AD患者的血液和脑脊液中的浓度显著增加[13-14];也有研究报道CCL2在大脑中的过表达可加速Tau蛋白病理学的发展[15]。FCGR2A是一种免疫球蛋白受体,可介导免疫细胞的吞噬和活化,这暗示FCGR2A在免疫反应中的作用可能与痴呆症的发病机制有关。ITGB2是一种整合素,可调节细胞的黏附和迁移,其表达增加与微胶质细胞的激活有关。微胶质细胞作为大脑内主导的免疫细胞,在AD的神经炎症及神经退行性进程中扮演核心角色,ITGB2的微胶质细胞亚群在能量代谢、细胞周期、血管生成、神经髓磷脂形成和修复等方面具有特定功能,在AD患者的血液和脑脊液中的浓度显著增加,这或可揭示ITGB2在痴呆症病理生理过程中的潜在影响,表明其在疾病机制中扮演重要角色[16-20]。这些基因的高表达可导致痴呆患者的神经系统出现过度的免疫反应和炎症反应,从而导致神经细胞的损伤和死亡。在未来的研究中,需要进一步探索这些基因在不同类型痴呆症中的具体作用及其如何与其他已知的病理过程发生关系。
最后,KEGG通路富集分析揭示与微生物感染的关联,这与广泛讨论的AD病理机制的微生物假说一致,微生物参与维持中枢神经系统的稳态,可能是中枢神经系统功能障碍的潜在原因。这些DEGs显著富集于冠状病毒、弓形虫感染、类风湿关节炎、系统性红斑狼疮、炎症性肠病等信号通路上。研究发现新冠病毒可导致类似AD的痴呆,这种关联可能通过神经炎症和脑微血管损伤机制[21]。弓形虫感染可导致宿主行为的改变,这种行为改变被认为是弓形虫在大脑中引起的免疫反应,潜在影响人类的行为,导致认知功能下降[22]。同时有相关文献报道类风湿关节炎、系统性红斑狼疮、炎症性肠病可能与认知障碍和痴呆有关[23]。这些通路都与免疫反应和炎症反应有关,这进一步支持本研究的假设,即免疫系统与神经系统的交互作用可能构成痴呆症进展中的一个关键驱动因素,这种神经炎症可归因于微生物感染,如新冠病毒和弓形虫感染,这些感染可加剧或触发痴呆症状。此外,这些通路也可能是痴呆的潜在治疗靶点,通过调控这些通路,可减轻痴呆患者的症状,甚至阻止痴呆的发展。
总之,本研究可为进一步阐明痴呆的发病机制提供新的线索。但本研究仍存在一定的局限性,如样本集的规模较为有限,故亟需在更大规模的样本集中复现研究,以确保研究成果的可靠性。此外,鉴于当前研究主要依赖生物信息学的理论分析,未来有必要开展体内外实验,对研究结论进行实证性的补充与确认。本研究采用计算生物信息学方法分析痴呆患者中的DEGs,表明CCR5、CCL2、FCGR2A、ITGB2是上调基因,同时具有较高的诊断价值,可能在痴呆症中发挥重要作用,为痴呆症的早期诊断和治疗提供新的可能性。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] RAZ L, KNOEFEL J, BHASKAR K. The neuro- pathology and cerebrovascular mechanisms of dementia[J]. J Cereb Blood Flow Metab, 2016, 36(1): 172–186.
[2] WILBUR J. Dementia: Dementia types[J]. FP Essent, 2023, 534: 7–11.
[3] ROSTAGNO A A. Pathogenesis of Alzheimer’s disease[J]. Int J Mol Sci, 2022, 24(1): 107.
[4] O’BRIEN J T, THOMAS A. Vascular dementia[J]. Lancet, 2015, 386(10004): 1698–1706.
[5] SCHELTENS P, DE STROOPER B, KIVIPELTO M, et al. Alzheimer’s disease[J]. Lancet, 2021, 397(10284): 1577–1590.
[6] SPIRES-JONES T L, HYMAN B T. The intersection of amyloid beta and tau at synapses in Alzheimer’s disease[J]. Neuron, 2014, 82(4): 756–771.
[7] AMAR K, WILCOCK G. Vascular dementia[J]. BMJ, 1996, 312(7025): 227–231.
[8] CAVALIERI M, ENZINGER C, PETROVIC K, et al. Vascular dementia and Alzheimer’s disease-Are we in a dead-end road?[J]. Neurodegener Dis, 2010, 7(1-3): 122–126.
[9] PRINCE M, ALI G C, GUERCHET M, et al. Recent global trends in the prevalence and incidence of dementia, and survival with dementia[J]. Alzheimers Res Ther, 2016, 8(1): 23.
[10] KINNEY J W, BEMILLER S M, MURTISHAW A S, et al. Inflammation as a central mechanism in Alzheimer’s disease[J]. Alzheimers Dement (N Y), 2018, 4: 575–590.
[11] POWER C A, MEYER A, NEMETH K, et al. Molecular cloning and functional expression of a novel CC chemokine receptor cDNA from a human basophilic cell line[J]. J Biol Chem, 1995, 270(33): 19495–19500.
[12] LI T, ZHU J. Entanglement of CCR5 and Alzheimer’s disease[J]. Front Aging Neurosci, 2019, 11: 209.
[13] LIN Z, SHI J L, CHEN M, et al. CCL2: An important cytokine in normal and pathological pregnancies[J]. Front Immunol, 2022, 13: 1053457.
[14] ZHOU F, SUN Y, XIE X, et al. Blood and CSF chemokines in Alzheimer’s disease and mild cognitive impairment: A systematic review and Meta-analysis[J]. Alzheimers Res Ther, 2023, 15(1): 107.
[15] JOLY-AMADO A, HUNTER J, QUADRI Z, et al. CCL2 overexpression in the brain promotes glial activation and accelerates tau pathology in a mouse model of tauopathy[J]. Front Immunol, 2020, 11: 997.
[16] ALBERICI F, BONATTI F, MARITATI F, et al. Association of a polymorphism of the Fcγ-receptor 2A (FCGR2A) gene with chronic periaortitis[J]. Clin Exp Rheumatol, 2018, 37(2): 222–226.
[17] DAI Y, CHEN W, HUANG J, et al. FCGR2A could function as a prognostic marker and correlate with immune infiltration in head and neck squamous cell carcinoma[J]. Biomed Res Int, 2021, 2021: 8874578.
[18] SEGUIN L, DESGROSELLIER J S, WEIS S M, et al. Integrins and cancer: Regulators of cancer stemness, metastasis, and drug resistance[J]. Trends Cell Biol, 2015, 25(4): 234–240.
[19] ZENG F, CAO J, HONG Z, et al. Single-cell analyses reveal the dynamic functions of Itgb2+ microglia subclusters at different stages of cerebral ischemia-reperfusion injury in transient middle cerebral occlusion mice model[J]. Front Immunol, 2023, 14: 1114663.
[20] KAMALIAN A, HO S G, PATEL M, et al. Exploratory assessment of proteomic network changes in cerebrospinal fluid of mild cognitive impairment patients: A pilot study[J]. Biomolecules, 2023, 13(7): 1094.
[21] PEÑA-BAUTISTA C, ÁLVAREZ-SÁNCHEZ L, FERRER-CAIROLS I, et al. Assessment of COVID-19 lockdown effect on early Alzheimer’sdisease progression[J]. J Neurol, 2023, 270(10): 4585–4592.
[22] FABIANI S, PINTO B, BONUCCELLI U, et al. Neurobiological studies on the relationship between toxoplasmosis and neuropsychiatric diseases[J]. J Neurol Sci, 2015, 351(1-2): 3–8.
[23] SHARMA S R, CHEN Y. Rheumatoid arthritis and cognitive impairment or dementia: An updated review of epidemiological data[J]. J Alzheimers Dis, 2023, 95(3): 769–783.
(收稿日期:2024–06–12)
(修回日期:2024–07–16)
