2型糖尿病患者血糖控制与MRI脑白质高信号体积的相关性
2024-10-30夏娅园刘培培李林慧洪霞师毅冰
摘要:目的 研究2型糖尿病(T2DM)患者血糖相关指标及血糖控制情况对MRI脑白质高信号(WMH)体积的影响。方法" 本研究为回顾性病例对照研究,以2022年7月~2023年12月就诊于徐州市中心医院的149例T2DM患者为研究对象,按糖化血红蛋白(HbA1c)水平将其分为血糖控制达标组(HbA1clt;7%,n=66)和未达标组(HbA1c≥7%,n=83),收集所有患者住院期间完成的颅脑MRI检查图像及相关血液学检查结果。采用ITK-SNAP软件对患者的WMH进行勾画并得出体积。采用多重线性回归分析法,分析T2DM患者血糖控制情况与WMH体积之间的相关性。结果" T2DM患者的HbA1c水平与WMH体积有关;血糖控制不达标组的WMH体积、T2DM病程、高血压、空腹血糖、餐后2 h血糖、空腹胰岛素水平、甘油三酯均高于血糖控制达标组(Plt;0.05)。校正年龄、性别及其他危险因素之后的多重线性回归分析结果表明,在T2DM患者中,WMH体积与血糖控制情况之间存在线性关系。结论" T2DM患者血糖控制情况是WMH体积的重要影响因素,血糖控制较差者易获得更高的WMH体积,这为有WMH相关发病风险的个体提供了强化预防策略和监测早期治疗的依据。
关键词:2型糖尿病;血糖控制;磁共振成像;脑白质高信号;相关性
Correlation between glycemic control and MRI white matter hyperintensity volume in patients with type 2 diabetes mellitus
XIA Yayuan1, LIU Peipei2, LI Linhui3, HONG Xia1, SHI Yibing1,2
1Affiliated Xuzhou Clinical College of Xuzhou Medical University, Xuzhou 221009, China; 2Department of Photography, Xuzhou Central Hospital, Xuzhou 221009, China;3Department of Imaging, Affiliated Hospital of Nantong University, Nantong 226001, China
Abstract: Objective To study the effects of glycemic-related indexes and glycemic control on MRI white matter hyperintensity (WMH) volume in patients with type 2 diabetes mellitus (T2DM). Methods A retrospective case-control study was used. A total of 149 T2DM patients admitted to Xuzhou Central Hospital from July 2022 to December 2023 were enrolled in this study, and they were divided into the glycemic control attainment group (HbA1clt;7%, n=66) and the non-attainment group (HbA1c≥7%, n=83) according to the level of glycosylated hemoglobin (HbA1c), and the craniocerebral MRI and related hematological examination results completed during hospitalization were collected from all patients. ITK-SNAP software was used to outline the patients' WMH and derive the volume. Multiple linear regression analysis was used to analyze the correlation between glycemic control and WMH volume in T2DM patients. Results The HbA1c level of T2DM patients was correlated with WMH volume. WMH volume, duration of T2DM, hypertension, fasting blood glucose, 2 h postprandial blood glucose, fasting insulin, and triglyceride in the glycemic control non-attainment group were all higher than those in the attainment group (Plt;0.05). The multiple linear regression analysis after correcting for age, gender and other risk factors suggested that there was a linear relationship between WMH volume and glycemic control in T2DM patients. Conclusion Glycemic control in T2DM patients is an important influence on WMH volume, and those with poorer glycemic control are susceptible to higher WMH volumes, which provides a basis for intensifying preventive strategies and monitoring of early treatment in individuals at risk for WMH-related morbidity.
Keywords: type 2 diabetes mellitus; glycemic control; magnetic resonance imaging; white matter hyperintensity; correlation
脑白质高信号(WMH)是脑小血管病最常见的影像学特征之一[1]" ,在颅脑MRI平扫图像中表现为脑白质区域斑点状、斑片状异常信号,在T2WI和T2WI FLAIR序列上呈现为高信号,而在T1WI序列上呈现为低信号[2]" 。脑白质高信号的病理表现主要包括该区域髓鞘苍白肿胀、血管周围间隙扩大、神经纤维密度减低等[3, 4]" ,但有关于WMH的具体发生机制尚不明确,可能包括以下几点原因:既往研究表明WMH患者血脑屏障通透性增高,使液体、蛋白等成分进入血管周围组织引起间质液体增加,破坏神经纤维,继而表现为WMH[5, 6];脑白质区域由终末动脉供血,是脑组织中最薄弱的灌注区域,长期慢性缺血引发缺血缺氧性脑损伤[7] ;炎症反应[8] 、脑铁稳态失衡[9] 、遗传[8] 等原因也可能会导致WMH的发生。WMH与多种疾病的发生有关,如认知能力下降[10-12] 、卒中风险增加[13]" 、卒中后预后恶化[14]以及抑郁症风险增加[15, 16]等。导致脑小血管病的可能危险因素多种多样,现阶段的研究结果表明主要涵盖以下两种因素,即年龄和遗传等不可干预因素,以及高血压、糖尿病、高脂血症、吸烟等可干预因素[17, 18]。
糖尿病已经成为继癌症、心脑血管疾病的第3大慢性疾病[19]。数据显示,我国糖尿病患病率为10.9%[20],2020年糖尿病患者总人数达到1.298亿[21]。2型糖尿病(T2DM)的发病机制主要为高血糖、胰岛素抵抗,致使机体产生代谢紊乱、出现慢性炎症状态,高血糖状态引起氧化应激,通过引起内皮功能障碍影响神经元活性。既往研究表明,携带APOE等位基因的糖尿病患者糖化血红蛋白(HbA1c)水平与WMH负荷有关[22],可见T2DM与WMH发病机制密切相关。但既往研究多集中于研究是否患有糖尿病与WMH之间的相关性,即探讨糖尿病是否是WMH发生的危险因素,糖尿病血糖控制情况在WMH体积方面的影响尚不清楚。《中国2型糖尿病防治指南》(2020版)将HbA1clt;7%作为大部分非妊娠成年T2DM患者的理想血糖控制指标[23] 。因此,本研究将T2DM患者分为血糖控制达标组和不达标组,拟探讨血糖控制是否达标与WMH体积之间的关系,以期为减少或延缓T2DM患者脑小血管病的发生和发展提供依据。
1" 资料与方法
1.1" 一般资料
本研究回顾性收集2022年7月~2023年12月于徐州市中心医院内分泌科接受常规治疗并完成颅脑MRI检查的149例T2DM患者为研究对象,其中血糖控制达标组66例(44.3%),控制不达标组83例(55.7%)。本研究获得徐州市中心医院医学伦理委员会审核批准(审批号:XZXY-LK-20240709-0106)。
纳入标准:符合糖尿病的诊断标准[23] (典型临床表现加上以下4项中的1项):随机血糖≥11.1 mmol/L、空腹血糖≥7.0 mmol/L、口服葡萄糖耐量试验2 h血糖≥11.1 mmol/L、HbA1c≥6.5%;颅脑MR平扫检查影像学图像、实验室检查结果等临床资料完整;影像学检查及实验室检查间隔时间不超过1周。排除标准:脑外伤、脑出血、大面积脑梗死、脑肿瘤、动静脉畸形及颅脑手术等可能影响WMH勾画的病例;非血管源性白质病变(免疫脱髓鞘、代谢、毒性、感染及其他原因);帕金森病、多发性硬化症、阿尔茨海默病;MRI扫描时头部剧烈移动,成像质量欠佳。
血糖控制情况评估:根据血糖控制目标HbA1c=7%为界限,将研究对象分为血糖控制达标(有T2DM病史,坚持非药物治疗、药物治疗或胰岛素治疗后,HbA1clt;7%)和血糖控制不达标(有T2DM病史,未治疗或规律药物或胰岛素治疗后,HbA1c≥7%)。
通过医院电子信息系统收集并总结符合条件的患者的一般资料,包括年龄、性别、基础疾病史(高血压、心脏病)、入院血压(收缩压、舒张压)、T2DM病程,血糖相关指标[HbA1c、空腹血糖(FPG)、餐后2 h血糖(2hPG)、空腹胰岛素水平(FINS)、空腹C肽水平(FCP)],血脂相关指标[总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)]。
1.2" 图像数据采集
所有T2DM患者均在本次住院期间完成了颅脑MRI平扫检查。采用Philips Ingenia 3.0 T磁共振扫描仪,包括T1WI序列、T2WI序列、DWI序列、ADC序列、T2 FLAIR序列。通过医院的影像归档和通信系统即PACS系统收集并总结符合条件的T2DM患者的影像学资料,排除质量欠佳的图像。
1.3" WMH体积测量
对于成功纳入的T2DM患者的MRI图像,由2位具有5年以上神经影像学诊断经验的影像科医师对WMH区域进行勾画,勾画软件采用ITK-SNAP 4.0.2,勾画时医师知道患者患有T2DM,但不知道其具体的临床血液学检查资料。2位医师在T2 FLAIR序列上沿着WMH边缘手动逐层勾画,最终由软件自动得出WMH的体积。为了获得相似的图像,使用ITK-SNAP工具“自动调整对比度”。若2位医师勾画WMH时出现争议,则通过商讨得出一致意见。
1.4" 统计学分析
采用SPSS25.0软件进行统计学分析,首先采用Shapiro-Wilk对计量资料进行正态性检验,当符合正态分布的时以均数±标准差表示,组间比较采用独立样本t检验;不符合正态分布的以中位数(四分位数间距)表示,组间比较采用Mann-Whitney U检验。计数资料以n(%)表示,组间比较采用χ2检验。采用多重线性回归方法分析因变量与自变量之间的线性依存关系,得出导致T2DM患者WMH体积增加的相关危险因素。此外,控制年龄、性别及其他危险因素(高血压和心脏病史、血糖及血脂相关指标),评估血糖控制情况与T2DM患者WMH体积之间的关系。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 两组临床资料比较
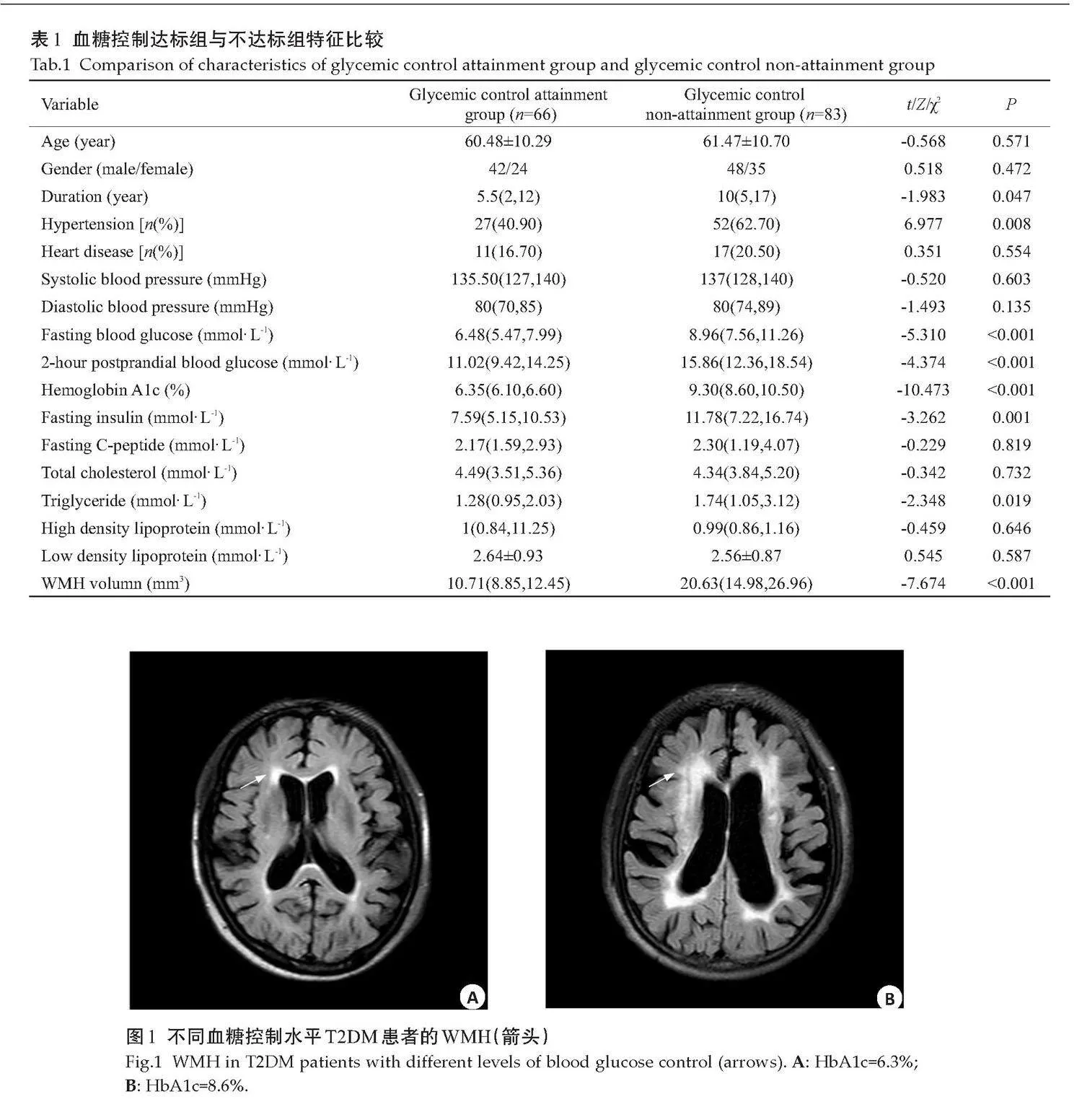
两组年龄、性别、心脏病、收缩压、舒张压、TC、HDL、LDL、FCP的差异无统计学意义(Pgt;0.05)。血糖控制不达标组的WMH体积、T2DM病程、高血压比例、FPG、2hPG、FINS、TG均高于血糖控制达标组,差异有统计学意义(Plt;0.05,表1)。典型病例(图1)。
2.2" 血糖相关指标及其他因素与T2DM患者WMH体积之间的相关性
以WMH体积为因变量,以患者的年龄、性别及其他危险因素(高血压和心脏病史、血糖及血脂相关指标)作为自变量,首先对各自变量进行共线性分析,得出方差膨胀因子lt;10,各自变量之间均不存在共线性关系。得出的多重线性回归模型具有统计学意义(Plt;0.05),结果显示,年龄、高血压、HbA1c可以有效地被纳入影响WMH体积的回归方程中,表明T2DM患者的WMH体积与年龄、HbA1c、高血压存在相关性(调整后R2=0.340),且HbA1c在纳入分析的因素中影响较大,HbA1c每增加1%,患者WMH体积就增加2.644 cm3(表2)。
2.3" 血糖控制情况与WMH体积之间的相关性
将血糖控制情况加入校正年龄、性别及其他危险因素的多重线性回归分析之中,结果表明T2DM患者血糖控制情况是WMH体积的影响因素(t=4.455,Plt;0.001),血糖控制不达标群体的WMH体积平均比控制达标群体高9.782 cm3。
2.4" 典型病例影像分析
2例80岁男性T2DM再治疗入院的颅脑MRI平扫检查图像显示,其中1例患者血糖控制达标(HbA1c 6.3%,图1A),另1例患者血糖控制不达标(HbA1c 8.6%,图1B),显示血糖控制不达标者WMH体积大于血糖控制达标者。
3" 讨论
随着人类寿命的延长,老年糖尿病患者人数迅速增长[23]。国际糖尿病联盟预测,到2045年全世界将有约7亿人患有糖尿病[24]。而中国的糖尿病发病率高居全世界首位[25],其中90%以上是T2DM,其病因是胰岛素抵抗或者胰岛素分泌不足[26-27]。脑组织作为人体中枢神经系统的核心组成部分,其结构错综复杂,血管网紧密交织,在糖尿病的影响下,这一复杂的血管网络便成为了微血管病变的主要攻击目标之一。糖尿病损伤脑组织的可能机制多种多样,包括但不限于:血糖升高导致组织高耗氧、高氧化,以及线粒体分裂状态,引起组织活性氧过度生成,致使氧化应激的发生,通过激活多元醇代谢途径,促进血管内皮功能障碍和炎症因子的表达[21];另外,氧化应激会导致机体异常代谢物的积聚、重要代谢辅助因子的丧失,进而造成大脑神经元凋亡、神经退行性变等[28]。糖尿病可以使血脑屏障结构完整性遭到破坏,使其通透性增加,液体、蛋白等成分渗漏到血管周间隙引起间质液体增加,继而损害脑血流动力学[29]。而WMH作为脑小血管病的重要体现,既往研究结果表明WMH病灶内的含水量显著升高,证实了WMH的发生可能与血脑屏障通透性增加、间质液体增加有关[30]。因此推测血糖控制情况可能与WMH相关。
HbA1c可以反映T2DM患者近6~8周的血糖控制情况[31],也是糖尿病患者血糖控制情况的最重要指标[23]。本研究采用国内最新糖尿病血糖控制标准将研究对象分为血糖控制达标组和不达标组,结果发现:T2DM患者的HbA1c水平与WMH体积有关,但与空腹血糖或者餐后2 h血糖无关;血糖控制不达标组WMH体积、T2DM病程、高血压比例、FPG、2hPG、HbA1c、FINS、TG均高于血压控制达标组。在调整了年龄、性别及其他危险因素后,血糖控制情况与WMH体积相关。HbA1c水平与WMH负荷相关,而不是FPG,这与既往研究一致[32],但部分研究[13]表示FPG与WMH量显著相关。这一差异可能说明HbA1c和FPG对WMH发生具有不同的作用。此外,也有研究提出血糖波动指标与相关血管并发症之间存在相关性[33],后续将在本文研究基础上,进一步探讨血糖波动指标与WMH之间的关系。
T2DM患者血糖控制情况与WMH负荷存在相关性,血糖控制不达标的T2DM患者WMH体积更大。这与既往研究结果[13, 34]不一致,既往研究报道血糖控制情况与WMH之间并无关联,这可能是由于人种差异、入排标准不同以及病灶勾画方法之间的差异等引起的。
血糖控制不达标的T2DM患者WMH负荷更大,这可能是因为血糖控制不达标会诱发炎症反应和氧化应激,引起多元醇代谢途径中的异常代谢物积聚,导致血管内皮功能障碍,从而造成大脑神经元凋亡、神经炎症;同时炎症介质释放的炎症因子破坏血脑屏障,使间质液体增加,破坏神经纤维,导致WMH的发生。而更大的WMH体积更能代表脑小血管病的严重程度,因此,这种相关性突显了糖尿病血糖控制不良可能恶化脑血管健康状况,强调了T2DM患者积极控糖治疗对预防脑微血管并发症的重要性,为临床诊疗中维持大脑健康状态提供了强有力的理论依据。虽然强化糖尿病血糖控制能够降低发生脑小血管病发生或进展的可能性,但是仍然有很多患者不重视或者不积极治疗。患者应该在医生的指导下控制该疾病的发展及并发症的出现。本研究发现血糖控制是T2DM患者WMH非常重要且可被干预的危险因素,因此应积极科普糖尿病血糖控制的重要性,积极治疗使血糖控制在达标的范围内,延缓病情发展,预防脑小血管病的发生与发展。
本研究的局限性:本研究是一项单中心研究,部分患者由于临床资料不完整而被排除,可能存在选择偏倚;本研究患者的血糖数据是在得到饮食控制的情况下收集的,这不能完全代表患者日常生活中的血糖水平。后续研究应进一步向多中心、前瞻性、大样本方向发展,结合其他磁共振技术如扩散张量成像、T1 mapping及动态增强MRI进一步了解WMH及其周围异常组织的微结构损伤,同时进一步探索糖尿病与脑小血管病其他生物标志物之间的相关性。
综上所述,本研究发现T2DM患者的HbA1c水平与WMH体积存在相关性,在调整了年龄、性别及其他危险因素后,血糖控制水平是影响WMH负荷的重要危险因素,即血糖控制水平较差会导致更高的WMH。这种相关性表明了糖尿病可能影响脑小血管健康,强调了管理糖尿病健康对改善大脑健康状态的重要性,在一定程度上指导了内分泌科医师需要在临床治疗中加强对血糖控制的严格把控,进而预防糖尿病脑微血管并发症的发生。未来的研究可进一步探讨血糖波动指标与WMH之间的关系,糖尿病高血糖状态与脑小血管病其他生物标志物之间的相关性,以及结合其他新技术进一步了解WMH及其周围异常组织的微结构损伤。
参考文献:
[1]" "Jiang JY, Gao YY, Zhang R, et al. Differential effects of serum lipoprotein-associated phospholipase A2 on periventricular and deep subcortical white matter hyperintensity in brain[J]. Front Neurol, 2021, 12: 605372.
[2]" " 中国研究型医院学会脑小血管病专业委员会《中国脑小血管病诊治专家共识》编写组, 胡文立, 黄勇华, 等. 中国脑小血管病诊治专家共识2021[J]. 中国卒中杂志, 2021, 7(7): 716-26.
[3]" " 周心连, 雷春艳, 杨云凤, 等. 脑白质高信号对急性缺血性脑卒中取栓预后影响的研究进展[J]. 中国医学创新, 2022, 8(20): 163-9.
[4]" "Lin J, Wang DL, Lan LF, et al. Multiple factors involved in the pathogenesis of white matter lesions[J]. Biomed Res Int, 2017, 2017: 9372050.
[5]" "Wong SM, Jansen JFA, Zhang CE, et al. Blood-brain barrier impairment and hypoperfusion are linked in cerebral small vessel disease[J]. Neurology, 2019, 92(15): e1669-e1677.
[6]" Huang YH, Zhou L, ZhangBao JZ, et al. Peripapillary and parafoveal vascular network assessment by optical coherence tomography angiography in aquaporin‑4 antibody‑positive neuromyelitis optica spectrum disorders[J]. Br J Ophthalmol, 2019, 103(6): 789-96.
[7]" "Dolui S, Tisdall D, Vidorreta M, et al. Characterizing a perfusion-based periventricular small vessel region of interest[J]. Neuroimage Clin, 2019, 23: 101897.
[8]" "刘思妤, 李凤莲, 贾文辉. 脑白质高信号不同亚型的病理生理机制及危险因素研究进展[J]. 中西医结合心脑血管病杂志, 2023, 21(3): 470-3.
[9]" "Bauer CE, Zachariou V, Seago E, et al. White matter hyperintensity volume and location: associations with WM microstructure, brain iron, and cerebral perfusion[J]. Front Aging Neurosci, 2021, 13: 617947.
[10] Habes M, Erus G, Toledo JB, et al. White matter hyperintensities and imaging patterns of brain ageing in the general population[J]. Brain, 2016, 139(Pt 4): 1164-79.
[11] van Gennip ACE, Stehouwer CDA, van Boxtel MPJ, et al. Association of type 2 diabetes, according to the number of risk factors within target range, with structural brain abnormalities, cognitive performance, and risk of dementia[J]. Diabetes Care, 2021, 44(11): 2493-502.
[12] Teng ZJ, Feng J, Liu RH, et al. Cerebral small vessel disease is associated with mild cognitive impairment in type 2 diabetes mellitus[J]. Diabetes Metab Syndr Obes, 2022, 15: 1985-94.
[13]" Grosu S, Lorbeer R, Hartmann F, et al. White matter hyperintensity volume in pre‑diabetes, diabetes and normoglycemia[J]. BMJ Open Diabetes Res Care, 2021, 9(1): e002050.
[14] Curtze S, Melkas S, Sibolt G, et al. Cerebral computed tomography-graded white matter lesions are associated with worse outcome after thrombolysis in patients with stroke[J]. Stroke, 2015, 46(6): 1554-60.
[15]" Zhou RX, Cai QQ, Liu C, et al. Association between white matter hyperintensity and anxiety/depression[J]. Cereb Cortex, 2024, 34(4): bhae149.
[16]" Xu JX, Chen HF, Hu ZQ, et al. Characteristic patterns of functional connectivity‑mediated cerebral small vessel disease‑related cognitive impairment and depression[J]. Cereb Cortex, 2024, 34(1): bhad468.
[17]" 冯" 明, 李海亮. 脑小血管病相关危险因素的研究进展[J]. 继续医学教育, 2023, 37(5): 165-8.
[18]" 周西瑞, 喻志源, 骆" 翔. 脑白质高信号的研究进展[J]. 神经损伤与功能重建, 2020, 15(8): 464-5, 468.
[19]" 杨晓赞, 王丽辉, 彭丽萍, 等. 老年2型糖尿病合并侵袭性肺真菌病的研究进展[J]. 中国老年学杂志, 2023, 43(16): 4087-92.
[20]" 刘煜东, 段瑞生. 重症肌无力与2型糖尿病关系的研究进展[J]. 实用医院临床杂志, 2023, 20(6): 14-7.
[21]" 赵蕙琛, 扈艳雯, 刘元涛, 等. 糖尿病血管并发症病理机制研究进展[J]. 青岛医药卫生, 2023, 55(6): 432-5.
[22]" Shinohara M, Tashiro Y, Suzuki K, et al. Interaction between APOE genotype and diabetes in cognitive decline[J]. Alzheimers Dement, 2020, 12(1): e12006.
[23] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 国际内分泌代谢杂志, 2021, 41(5): 482-548.
[24]" Armstrong DG, Boulton AJM, Bus SA. Diabetic foot ulcers and their recurrence[J]. N Engl J Med, 2017, 376(24): 2367-75.
[25]" 靳云姗, 王晓丽, 崔永健, 等. 2型糖尿病患者脑白质疏松的影响因素分析[J]. 中国实用神经疾病杂志, 2016, 19(17): 43-6.
[26]" Du YQ, Wang J, Fan WJ, et al. Preclinical study of diabetic foot ulcers: from pathogenesis to vivo/vitro models and clinical therapeutic transformation[J]. Int Wound J, 2023, 20(10): 4394-409.
[27]Tamura Y, Araki A. Diabetes mellitus and white matter hyperintensity[J]. Geriatr Gerontol Int, 2015, 15(Suppl 1): 34-42.
[28] Shen DF, Tian XY, Sang WX, et al. Effect of melatonin and resveratrol against memory impairment and hippocampal damage in a rat model of vascular dementia[J]. Neuroimmunomodulation, 2016, 23(5/6): 318-31.
[29]" 张丹平, 徐玲妙. 糖尿病与血管性痴呆发病的关联、病理机制及防治策略研究[J]. 预防医学, 2023, 35(7): 582-6.
[30] Iordanishvili E, Schall M, Loução R, et al. Quantitative MRI of cerebral white matter hyperintensities: a new approach towards understanding the underlying pathology[J]. Neuroimage, 2019, 202: 116077.
[31]" 赵" 花, 张丽侠, 郑丽丽. 2型糖尿病患者血糖控制水平对骨密度的影响[J]. 郑州大学学报: 医学版, 2015, 50(1): 124-7.
[32]" 王" 伟, 王绍才, 张" 超, 等. 老年2型糖尿病患者血糖控制与脑白质高信号进展的相关性[J]. 中国医学计算机成像杂志, 2023, 29(6): 603-7.
[33]" 左怡静, 李全忠. 2型糖尿病患者葡萄糖在目标范围内时间与血浆致动脉硬化指数的相关性分析[J]. 医药论坛杂志, 2022, 43(10): 1-5.
[34]" de Havenon A, Majersik JJ, Tirschwell DL, et al. Blood pressure, glycemic control, and white matter hyperintensity progression in type 2 diabetics[J]. Neurology, 2019, 92(11): e1168-e1175.
(编辑:林" 萍)
收稿日期:2024-06-12
基金项目:吴阶平医学基金会临床科研专项基金项目(320.6750.2023-11-24)
作者简介:夏娅园,在读硕士研究生,E-mail: xhccxyy0101@163.com
通信作者:师毅冰,硕士,主任医师,E-mail: xzctsyb@126.com
