基于磁共振成像的影像组学特征在脑胶质瘤分级中的应用
2024-10-30樊丽华韩冬贾永军段海峰于楠于勇郑运松魏伟
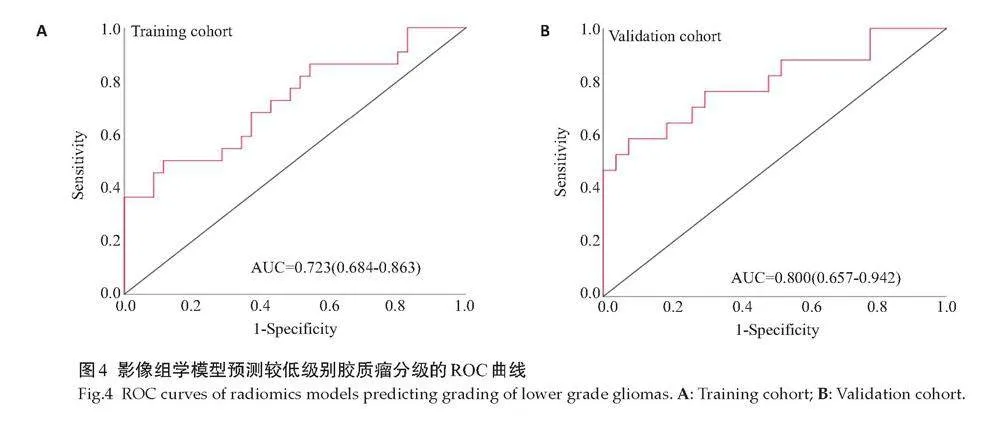
摘要:目的" 基于MRI T2WI序列构建的影像组学模型区分脑胶质瘤Ⅱ级和Ⅲ级的诊断效能。方法" 本研究影像学数据均来自于癌症基因组数据集,收集了梅奥诊所于2002年10月~2011年8月进行MRI平扫及肿瘤分级的159例大脑胶质瘤数据,包括胶质Ⅱ级(n=104)和Ⅲ级(n=55),按7:3的比例将患者分为训练组(n=111)和验证组(n=48)。将T2WI图像导入ITK-SNAP v.3.4.0软件,手动勾画大脑全肿瘤感兴趣区(VOI),然后将勾画过的数据导入A.K软件用于提取肿瘤的影像组学特征,共396个特征被提取,主要特征包括6类,分别为直方图、灰度共生矩阵、灰度大小区域矩阵、灰度行程矩阵、形状及Haralick。采用LASSO回归模型进行进一步的特征筛选。根据筛选得到的特征与其相应回归系数的加权线性组合构建影像组学模型,并据此计算每位患者的影像组学评分。在训练组和验证组中采用ROC曲线下面积(AUC)评估影像组学模型的预测性能。影像组学的校准度采用Hosmer-Lemeshow检验进行评价。通过采用决策曲线分析进行评估影像组学模型的临床价值。结果" 筛选出4个影像组学特征,建立与胶质瘤分级显著相关的影像组学模型。该模型在训练组中AUC为0.723(95% CI: 0.684~0.863),敏感度为75%,特异度为89%,校准度为0.120。在验证组中,AUC为0.800(95% CI:0.657~0.942),敏感度为73%,特异度为82%,校准度为0.561。决策曲线分析显示阈值概率在0.17%~0.99% 时,影像组学模型对较低级别胶质瘤的分级能力优于将所有患者认为Ⅱ级及Ⅲ级。结论" 基于MRI T2WI序列图像建立的影像组学模型有助于区分较低级别胶质瘤的Ⅱ级及Ⅲ级,为患者制定手术方案和预后情况提供一种无创性技术手段。
关键词:胶质瘤;影像组学;MRI
Application value of radiomics features based on magnetic resonance imaging" in grading of cerebral of gliomas
FAN Lihua1, HAN Dong1, JIA Yongjun1, DUAN Haifeng1, YU Nan1, 2, YU Yong1, 2, ZHENG Yunsong1, 2, WEI Wei1
1Department of Medical Imaging, Affiliated Hospital of Shaanxi University of Traditional Chinese Medicine, Xianyang 712000, China; 2School of Medical Technology, Shaanxi University of Traditional Chinese Medicine, Xianyang 712046, China
Abstract: Objective To evaluate the value of radiomics model in distinguishing grade II and III of gliomas from T2-weighted MRI images. Methods 159 gliomas patients (Mayo Clinic, October 2002- August 2011), who underwent non-enhanced MRI and tumor grades confirmation from the Cancer Genome Atla (TCIA) data portal, including grade II (n=104) and III (n=55) of gliomas. Patients were divided into training cohorts (n=111) and validation cohorts (n=48) in a ratio of 7:3. Gliomas were imported into the ITK-SNAP to manually delineate volume of interest (VOI) on T2-weighted images. The delineated data was imported into A.K software (Artificial Intelligence Kit v.3.1.0.R, GE Company) to extract tumor radiomics features. A total of 396 features were extracted, and the main features included 6 categories including Histogram, GLCM, GLSZM, RLM, Form Factor, Haralick. LASSO regression was used for feature screening. A formula was generated using a linear combination of selected features that were weighted by their respective LASSO coefficient. A radiomics score was calculated for each patient by the formula. The predictive accuracy of radiomics model was quantified by AUC in both cohorts. The calibration degree of the radiomics was evaluated by Hosmer‑Lemeshow test. The clinical usefulness of the radiomics model was assessed by decision curve analysis. Results Four radiomics features were chosen to build a radiomics model that distinguished grade II and III of gliomas with an AUC, sensitivity, specificity and CD of 0.723, 75%, 89%, 0.120 in training cohort; and 0.800, 73%, 82%, 0.561 in the validation cohort, respectively. When the threshold probability of DCA is 0.17%-0.99%, the classification of lower grade glioma by radiomics model is better than that of all patients as grade II and III. Conclusion" The radiomics model based on T2-weighted MRI images can distinguish grade II and III of lower grade gliomas, providing a non-invasive technique for developing a surgical plan and prognosis for gliomas patients.
Keywords: gliomas; radiomics; MRI
脑胶质瘤是常见的恶性中枢神经系统肿瘤[1] ,WHO将其分为Ⅰ~Ⅳ级,Ⅰ、Ⅱ级为低级别,Ⅲ、Ⅳ级为高级别[2] ,Ⅱ、Ⅲ级为较低级别胶质瘤[] 。胶质瘤的精确组织学分级对患者的治疗方案及预后非常重要。在临床上区分Ⅱ级和Ⅲ级胶质瘤的金标准是病理活检,但其为有创性检查,不仅增加了并发症发生率,还增加患者的死亡率,不适合进行术前分级[4] 。在术前寻找一种无创性方法对胶质瘤进行准确术前分级至关重要。磁共振成像是一种无创性检查,可提供肿瘤的位置、大小及形态[5] ,但是对于胶质瘤的精确分级有一定的局限性。影像组学是一种图像分析方法,其主要基于CT、MRI图像提取大量的数据特征[6] ,进一步处理分析,最终挖掘出预测肿瘤组织学分级的影像学特征。近年来影像组学对很多种疾病的研究较多,目前有研究提取了影像组学特征在预测较低级别脑胶质瘤分级中的应用,但是预测效能不理想。故本研究基于MRI技术与影像组学,评估T2WI序列建立的影像组学标签鉴别脑胶质瘤Ⅱ级和Ⅲ级的能力,旨在为胶质瘤患者制定手术方案和预后情况提供更多影像学依据。
1" 资料与方法
1.1" 一般资料
本研究所有影像学数据均来自于癌症基因组数据库[7, 8] ,并且通过了癌症研究所伦理委员会的审批,收集了梅奥诊所于2002年10月~2011年8月共159例大脑胶质瘤数据,均进行了MRI平扫及手术病理活检,包括胶质瘤Ⅱ级(n=104)和Ⅲ级(n=55)。应用分层抽样方法按7:3的比例将患者分为训练组(n=111)和验证组(n=48)。
1.2" 感兴趣区勾画及影像组学特征计算
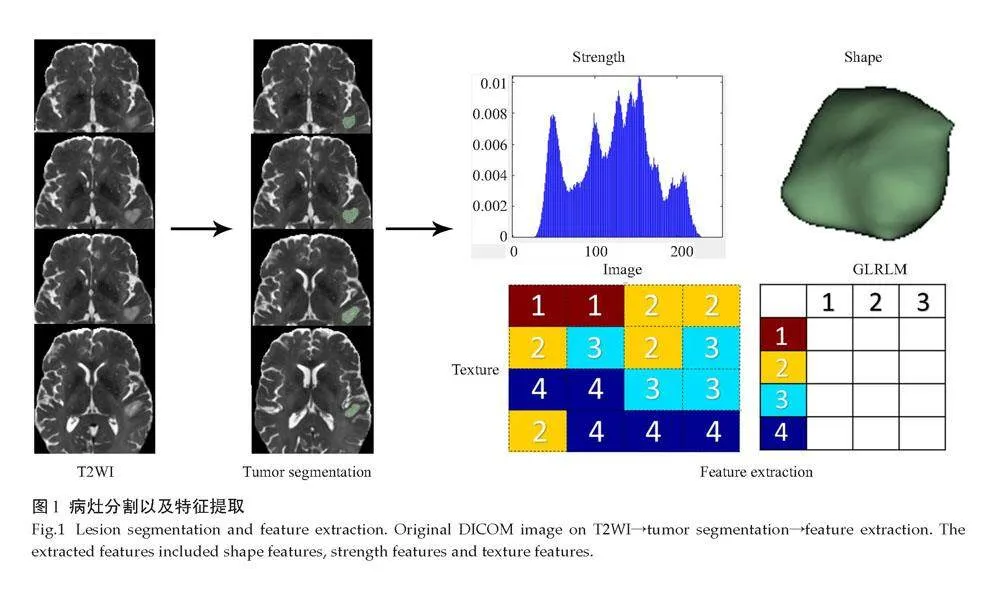
本研究将T2WI横断位图像导入ITK-Snap v.3.4.0软件,然后由1位具有高级资历的影像科诊断医师勾画病灶的全肿瘤区域容积兴趣区(VOI),包含出血、坏死囊变区以及瘤周水肿。将肿瘤的VOI保存为边界文件(.nii格式),2月后再经一位影像医师手动修正,1.nii文件以保证边界文件的准确性。将此边界文件及Dicom数据导入A.K软件(Artificial Intelligence Kit v.3.1.0.R,GE)共提取396个影像组学特征,特征包含直方图、灰度共生矩阵、灰度大小区域矩阵、灰度行程矩阵、形状及Haralick 6类,其中灰度共生矩阵及灰度行程矩阵步长设置为1、4及7(图1)。
1.3" 影像组学特征筛选及模型的建立
采用LASSO回归模型对训练组进一步筛选胶质瘤的影像组学特征。将筛选得到的特征及其系数的积和构建影像组学模型,并计算每位患者的影像组学评分。用验证组的数据对建立的影像组学模型进行验证。
1.4" 影像组学标签效能评估
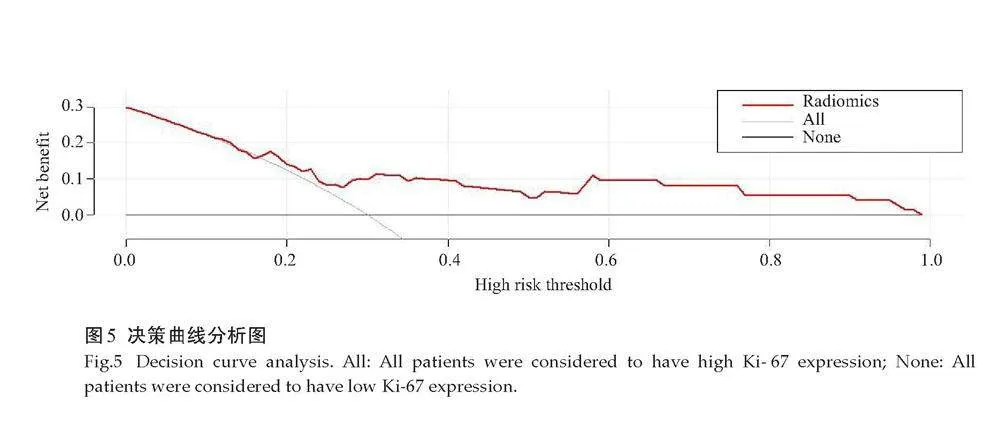
对训练组和验证组绘制ROC曲线,计算敏感度及特异度,应用ROC曲线下面积(AUC)评估影像组学模型的鉴别效能。采用Hosmer-Lemeshow检验分析影像组学模型在训练组和验证组的校准度。影像组学预测模型采用决策曲线分析(DCA)[9] ,分析不同概率阈值下的患者净受益情况,评估影像组学模型的临床价值。
1.5" 统计学分析
采用SPSS25.0软件及R语言对数据进行统计分析,以Plt;0.05为差异有统计学意义。服从正态分布且方差齐的计量资料以均数±标准差表示,组间比较采用独立样本t检验。计数资料以n(%)表示,组间比较采用卡方检验。一致性检验时二分类参数采用Kappa检验,有序多分类参数采用Weighted-Kappa检验。
2" 结果
2.1" 影像组学评分
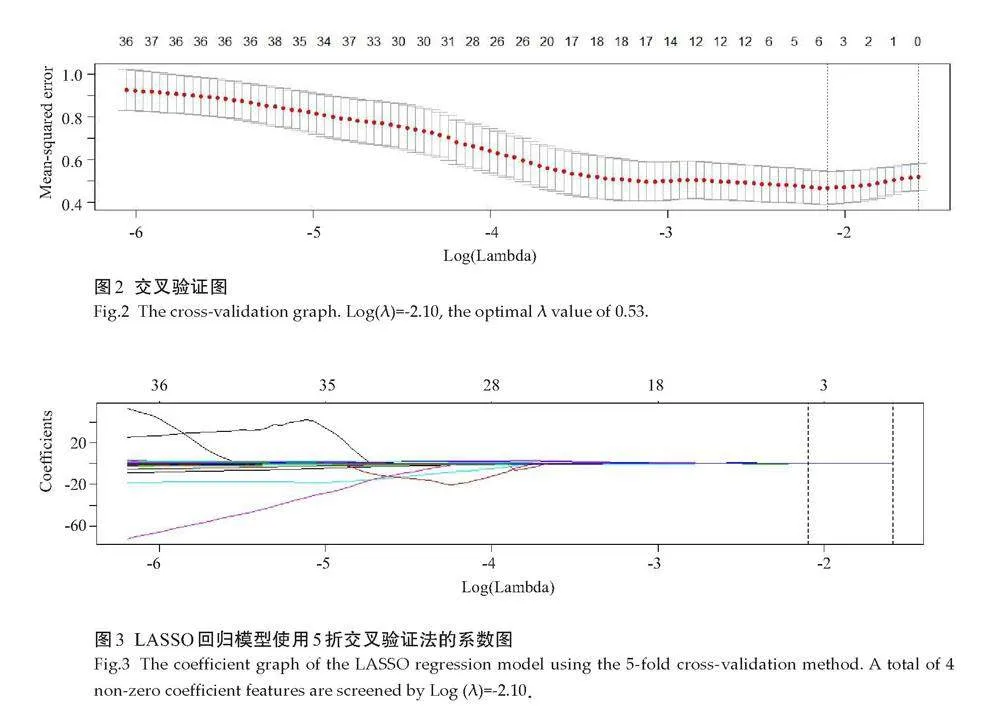
经交叉验证确定最优λ值为0.53[log(λ)=-2.10](图2)。4个非零系数的影像组学特征被筛选(图3)。将这4个特征及其系数的积和建立影像组学风险评分。在训练组,胶质瘤Ⅱ级和Ⅲ级的影像组学评分分别为-1.87±1.11及0.48±1.14,差异有统计学意义(t=-7.53,Plt;0.01),在验证组分别为-1.16±1.27及0.64±0.92,差异有统计学意义(t=-3.56,Plt;0.01)。
2.2" 影像组学模型诊断效能
训练组的AUC为0.723(95% CI: 0.684~0.863),敏感度为75%,特异度为89%,Hosmer-Lemeshow检验结果显示校准度为0.709(图4A)。验证组的AUC为0.800(95% CI: 0.657~0.942),敏感度为73%,特异度为82%,校准度为0.561(图4B)。
2.3" DCA
DCA显示,当概率阈值在0.17%~0.99%时,影像组学模型对较低级别胶质瘤的分级能力优于将所有患者认为Ⅱ级和Ⅲ级(图5)。
3" 讨论
脑胶质瘤是最常见的原发性恶性脑肿瘤,占颅内原发性肿瘤的40%~50%[10] ,其分级程度与治疗手段及预后紧密相关[11] ,术前的诊断及分级至关重要。组织病理学检查在胶质瘤术前分级中应用受到了限制[12] 。MRI是诊断胶质瘤和术前分级最常用的影像学检查[13] ,但是其不能精确评估胶质瘤的术前分级[14-18] 。而影像组学基于CT、MRI、PET-CT图像提取大量影像学特征[19] ,具有无创性、易操作及可定量的优点[20] ,在胶质瘤分级方面应用较多[21] 。本研究结果显示,基于MRI常规T2WI序列的影像组学模型可以较好的区分较低级别胶质瘤的Ⅱ级和Ⅲ级,在训练组和验证组中的AUC均较高,敏感度和特异度也较高。DCA显示阈值概率在0.17%~0.99%时,使用影像组学标签鉴别胶质瘤分级优于将所有患者认为Ⅱ级和Ⅲ级。
本研究选用T2WI序列来建立影像组学标签。由于T2WI序列对肿瘤内部的坏死囊变成分更敏感,有文献表明T2WI可以间接地反映肿瘤的恶性程度。有研究发现 T2WI图像高信号提示前列腺癌分级较高[22] ;有学者发现T2WI高信号与肝细胞癌生长速度有关,提示肿瘤更具侵袭性[23] 。还有研究发现T2WI序列上可以显示颅内孤立性纤维瘤内部的具体信号,对其诊断提供了较好的帮助[24] ,这与本研究应用的序列一致。
本研究发现基于T2WI序列的影像组学方法可以较好的区分较低级别胶质瘤的Ⅱ级和Ⅲ级。有研究基于MRI序列构建的影像组学对胶质瘤进行术前分级,从66例胶质瘤患者术前的FLAIR、ADC和T1WI增强图像中共提取了114个影像组学特征,并对这些特征进行进一步筛选,筛选出8个具有显著相关的特征[25] 。该方法能够说明基于多种 MRI 序列的影像组学模型对胶质瘤分级具有良好的价值,但是没有对胶质瘤的Ⅲ、Ⅲ级进行分级;而本研究从T2WI序列构建的影像组学中提取了396个影像组学特征,筛选出8个非零系数特征,对较低级别胶质瘤的Ⅱ、Ⅲ级具有较好的鉴别能力,与既往研究结果一致。有学者对GBM肿瘤的分子亚型进行了分类,AUC值达到0.82[26] ;有学者对LGG的EGFR分子表达情况进行预测,验证组中的AUC值达到0.95[27] 。本研究在训练组和验证组中影像组学对较低级别胶质瘤分级诊断的AUC均大于0.7,这与既往研究[28] 结果一致。基于既往研究[29] 采用影像组学分析脑胶质瘤分级,通过多类算法结果显示:对低级别胶质瘤识别率达90.9%,但是对高级别胶质瘤识别率较低。有研究通过影像组学中直方图、模型建立和灰度共生矩阵的方法从MRI的FLAIR、T1、T1增强和T2序列中提取出45个可量化胶质瘤性质的影像组学特征,其中13个特征可有效对脑胶质瘤进行分级[30] 。也有研究发现基于多模态MRI影像组学特征在精准预测胶质瘤组织学亚型方面有很大的优势,影像组学鉴别Ⅱ级和Ⅲ级胶质瘤的AUC值为0.896,显示有很高的鉴别能力[31] 。本研究结果与以上文献结果一致,运用影像组学模型可以对较低级别胶质瘤的Ⅱ级和Ⅲ级进行精确鉴别。
本研究的局限性:本研究仅从T2WI序列提取影像组学特征,并没有将DWI、T1WI、FLAIR及增强扫描等序列进行研究,未来可将多种序列建立影像组学模型;通过影像组学模型仅对内部数据进行了验证,后续将收集大量数据进行模型验证;影像组学模型只预测了较低级别胶质瘤的分级,后续应将高低级别胶质瘤均纳入研究。
综上,本研究运用影像组学模型对有病理结果的较低级别胶质瘤分级进行了分析,根据筛选的影像学特征建立的影像组学模型,可以准确地对较低级别胶质瘤的组织学亚型进行分级,为患者制定治疗手段及评估预后情况提供一种无创性检查手段。
参考文献:
[1]" " 于子页, 徐" 铭, 徐宏治. 中枢神经系统胆固醇代谢及其对脑胶质瘤免疫治疗的作用[J]. 中国临床神经科学, 2021, 29(1): 88-95.
[2]" "Dequidt P, Bourdon P, Tremblais B, et al. Exploring radiologic criteria for glioma grade classification on the BraTS dataset[J]. IRBM, 2021, 42(6): 407-14.
[3]" " 王天达, 席海蛟, 袁" 涛, 等. 较低级别胶质瘤相关基因表型的形态与功能MR研究进展[J]. 临床放射学杂志, 2021, 40(10): 2037-41.
[4]" "张昌飞, 杜福川, 张昌凯. MRI影像组学在胶质瘤术前分级评估中的应用[J]. 中国CT和MRI杂志, 2022, 20(5): 16-9.
[5]" " 孙树珂. 瘤内磁敏感信号对脑星形细胞瘤术前分级诊断的价值[J]. 世界最新医学信息文摘: 连续型电子期刊, 2019, 19(39): 175.
[6]" "Sun H, Li H, Zhang T, et al. Progress in research and application of Radiomics[J]. Tumor, 2017, 37(10): 1092-9.
[7]" "Erickson, B, Akkus, Z, Sedlar, J, et al. (2017) Data from LGG-1p19qDeletion (Version 2)[EB/OL]. The Cancer Imaging Archive. https://doi.org/10.7937/K9/TCIA.2017.DWEHTZ9V
[8]" "Clark K, Vendt B, Smith K, et al. The cancer imaging archive (TCIA): maintaining and operating a public information repository[J]. J Digit Imag, 2013, 26(6): 1045-57.
[9]" "Lane BR, Samplaski MK, Herts BR, et al. Renal mass biopsy: a renaissance?[J]. J Urol, 2008, 179(1): 20-7.
[10]" 王" 钥, 王" 爽, 安宇铮, 等. 脑胶质瘤相关miRNA的研究进展[J]. 齐齐哈尔医学院学报, 2020, 41(22): 2852-5.
[11]" 尹" 娣, 陈国丹, 盛玉瑞, 等. 常规MRI联合扩散峰度成像的影像组学模型对脑胶质瘤分级的预测[J]. 中国中西医结合影像学杂志, 2022, 20(2): 117-21, 136.
[12]" Wang TJC, Mehta MP. Low-grade glioma radiotherapy treatment and trials[J]. Neurosurg Clin N Am, 2019, 30(1): 111-8.
[13]" 王 伟, 沈龙山, 程 雯, 等. 基于常规MRI的影像学特征联合MRS在脑胶质瘤术前分级评估及预测术后复发的应用研究[J]. 中国CT和MRI杂志, 2023, 9(7): 15-8.
[14]" 齐" 雪. 基于常规MRI图像的不同影像组学模型在脑胶质瘤术前分级中的应用[D]. 沈阳: 中国医科大学, 2019.
[15]" Han YQ, Xie Z, Zang YL, et al. Non-invasive genotype prediction of chromosome 1p/19q co-deletion by development and validation of an MRI-based radiomics signature in lower-grade gliomas[J]. J Neurooncol, 2018, 140(2): 297-306.
[16] Bai Y, Lin YS, Tian J, et al. Grading of gliomas by using monoexponential, biexponential, and stretched exponential diffusion-weighted MR imaging and diffusion kurtosis MR imaging[J]. Radiology, 2016, 278(2): 496-504.
[17] Fudaba H, Shimomura T, Abe T, et al. Comparison of multiple parameters obtained on 3T pulsed arterial spin-labeling, diffusion tensor imaging, and MRS and the Ki-67 labeling index in evaluating glioma grading[J]. AJNR Am J Neuroradiol, 2014, 35(11): 2091-8.
[18] Hsieh KL, Tsai RJ, Teng YC, et al. Effect of a computer-aided diagnosis system on radiologists' performance in grading gliomas with MRI[J]. PLoS One, 2017, 12(2): e0171342.
[19]" 谢" 凯, 孙鸿飞, 林" 涛, 等. 影像组学中特征提取研究进展[J]. 中国医学影像技术, 2017, 33(12): 1792-6.
[20]" 林" 泽, 左敏静. 影像组学在肺癌脑转移诊断中的研究进展[J]. 现代肿瘤医学, 2024, 32(2): 383-6.
[21]" 曹勇勇, 付" 饶, 吕宏尧, 等. 基于人工智能的影像组学与数字病理学研究在脑胶质瘤诊断中的应用进展[J]. 中华脑科疾病与康复杂志: 电子版, 2020, 10(4): 230-3.
[22]Schieda N, Coffey N, Gulavita P, et al. Prostatic ductal adenocarcinoma: an aggressive tumour variant unrecognized on T2 weighted magnetic resonance imaging (MRI)[J]. Eur Radiol, 2014, 24(6): 1349-56.
[23] Jha RC, Zanello PA, Nguyen XM, et al. Small hepatocellular carcinoma[J]. Acad Radiol, 2014, 21(11): 1455-64.
[24]" 王" 璐, 徐万里, 郑屹峰. 颅内孤立性纤维瘤的MRI表现及误诊分析8例[J]. 浙江医学, 2021, 43(10): 1123-6.
[25] Qin JB, Liu ZY, Zhang H, et al. Grading of gliomas by using radiomic features on multiple magnetic resonance imaging (MRI) sequences[J]. Med Sci Monit, 2017, 23: 2168-78.
[26]" Yang D, Rao G, Martinez J, et al. Evaluation of tumor‑derived MRI‑textures for discriminating GBM subtype and survival[J]. Med Phys, 2015, 42(11): 6725-35.
[27] Li YM, Liu X, Xu KB, et al. MRI features can predict EGFR expression in lower grade gliomas: a voxel-based radiomic analysis[J]. Eur Radiol, 2018, 28(1): 356-62.
[28] Tian Q, Yan LF, Zhang X, et al. Radiomics strategy for glioma grading using texture features from multiparametric MRI[J]. J Magn Reson Imaging, 2018, 48(6): 1518-28.
[29] Zacharaki EI, Wang SM, Chawla S, et al. Classification of brain tumor type and grade using MRI texture and shape in a machine learning scheme[J]. Magn Reson Med, 2009, 62(6): 1609-18.
[30]" Zhang X, Xu XP, Tian Q, et al. Radiomics assessment of bladder cancer grade using texture features from diffusion-weighted imaging[J]. J Magn Reson Imaging, 2017, 46(5): 1281-8.
[31] Su CL, Jiang JJ, Zhang S, et al. Radiomics based on multicontrast MRI can precisely differentiate among glioma subtypes and predict tumour-proliferative behaviour[J]. Eur Radiol, 2019, 29(4): 1986-96.
(编辑:熊一凡)
收稿日期:2024-05-23
基金项目:咸阳市科技局重点研发计划项目(S2023-ZDYF-SF-1756)
作者简介:樊丽华,在读硕士研究生,主治医师,E-mail: 1416281918@qq.com
通信作者:魏" 伟,硕士,主治医师,E-mail: 421064549@qq.com
