协调多CT设备间肝脏影像组学特征的一致性
2024-10-30周创辉周建伟麦迪娜·巴吐尔黄靖涵秦耿耿钟海舰


摘要:目的" 评估健康肝脏影像组学特征在多种CT扫描仪中的一致性,并探究基于图像和基于特征的协调方法对结果的影响。方法" 回顾性收集2015年1月1日~2023年1月1日赣州市人民医院4台CT设备的243例健康成年人的腹部CT检查结果(Optima CT660:n=83,Revolution 512 CT:n=56,Emotion 16:n=69,Definition AS+CT:n=35)。对每位患者在肝门层面选择肝实质勾画直径为30 mm的三维感兴趣区域,使用Pyradiomics提取93个影像组学特征。采用均值中心化、Z-Score、重采样、直方图匹配和ComBat方法协调设备间的差异。使用Mann-Whitney U检验比较两台扫描仪之间以及应用协调方法前后特征的一致性,并计算Cohen's d值,以评估不同方法的影响大小。结果" 肝脏影像组学特征总体一致性为55.38%,其中在相同制造商设备中为87.10%,在不同制造商设备为39.52%;经均值中心化、 Z-Score 、重采样、直方图匹配和ComBat方法协调后,总体保持一致的特征比例分别为:44.82%、68.82%、66.49%、76.52%和100%;d值分别为-0.57、0.62、0.57、0.78、1.59。结论" 肝脏CT影像组学特征在不同设备之间的一致性较差,仅在同一制造商的扫描仪中保持良好。基于图像和特征的协调方法能有效减少由不同CT制造商和设备型号引起的特征变异;其中,重采样和直方图匹配依赖于具体的参数设置和参考图像的选取;基于特征的ComBat协调表现最佳,使得所有特征在不同设备之间均能保持一致,对未来跨设备或跨中心的研究具有积极影响。
关键词:CT;批次效应;影像组学;特征一致性;图像协调;特征协调
Harmonizing the consistency of liver radiomic features across multiple CT devices
ZHOU Chuanghui1, ZHOU Jianwei2, MAIDINA Batuer3, HUANG Jinghan3, QIN Genggeng1, 2, ZHONG Haijian1
1School of Medical and Information Engineering, Gannan Medical University, Ganzhou 341000, China; 2Department of Medical Imaging Diagnosis, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China; 3School of Biomedical Engineering, Southern Medical University, Guangzhou 510515, China
Abstract: Objective To evaluate the consistency of radiomic features of the healthy liver across multiple CT scanners and to investigate the impact of image-based and feature-based harmonization methods on the results. Methods Abdominal CT examinations of 243 healthy adults (Optima CT660: n=83, Revolution 512 CT: n=56, Emotion 16: n=69, Definition AS+CT: n=35) were retrospectively collected from January 1, 2015 to January 1, 2023 at four CT scanners of Ganzhou People's Hospital. For each patient, a 30 mm diameter three-dimensional region of interest was delineated in the liver parenchyma at the portal vein level, and 93 radiomic features were extracted using Pyradiomics. Mean centering, Z-Score, resampling, histogram matching, and ComBat methods were used to harmonize inter-device differences. The Mann-Whitney U test was used to compare the consistency of features between two different scanners before and after applying harmonization methods, and Cohen's d value was calculated to assess the effect size of different methods. Results The overall consistency of liver radiomic features was 55.38%, with 87.10% consistency among devices from the same manufacturer and 39.52% among devices from different manufacturers. After harmonization with mean centering, Z-Score, resampling, histogram matching, and ComBat methods, the proportions of consistent features were 44.82%, 68.82%, 66.49%, 76.52%, 100%, respectively; the d values were -0.57, 0.62, 0.57, 0.78, 1.59, respectively. Conclusion The consistency of liver CT radiomic features is poor between different devices, maintaining good consistency only among scanners from the same manufacturer. Image-based and feature-based harmonization methods can effectively reduce feature variation caused by different CT manufacturers and device models. Among these methods, resampling and histogram matching depend on specific parameter settings and the selection of reference images. The feature-based ComBat harmonization performs best, ensuring that all features remain consistent across different devices, which positively impacts future cross-device or cross-center studies.
Keywords: CT; batch effects; radiomics; feature consistency; image harmonization; feature harmonization
影像组学是一种通过提取和分析医学影像中的大量定量特征来揭示疾病信息的方法,旨在提高疾病诊断、治疗评估和预后预测的准确性[1-3]。然而,在多中心研究中,不同CT扫描设备和制造商之间的差异会产生批次效应[4-5],显著影响了特征的一致性和稳定性,从而限制其在跨设备和跨中心的应用,这已成为当前研究的主要挑战之一[6]。已有研究指出,基于图像或特征的协调方法能有效提升影像组学特征的一致性[7],但这些研究的评估方法较为单一,并且多以病变组织和体模为评估对象[8-9]。基于病变组织的研究可能会受到个体病变异质性的影响,而体模也难以完全模拟真实生物组织的复杂性和变异性。因此,本研究以健康肝脏组织为对象,分析其影像组学特征在多种CT扫描仪中的一致性,并系统评估基于图像(均值中心化、Z-Score、重采样和直方图匹配)和基于特征(ComBat)的协调方法对特征一致性的影响。
1" 资料与方法
1.1" 一般资料
检索2015年1月1日~2023年1月1日在赣州市人民医院(南方医院赣州医院)4台CT设备上进行的腹部CT检查资料,共纳入243例患者的CT扫描数据。纳入标准:接受腹部CT检查,图像质量良好,无伪影;患者有详细完整的临床信息记录;无任何肝脏相关疾病,包括良性病变(如囊肿)和既往史。排除标准:图像质量差,无法满足感兴趣区域的分割;肝脏实质或结构存在异常。对来自4台CT扫描仪的患者组进行了显著性差异测试,以评估可能影响结果的因素。患者在年龄和性别上的差异无统计学意义(Pgt;0.05,表1)。
1.2" 图像采集
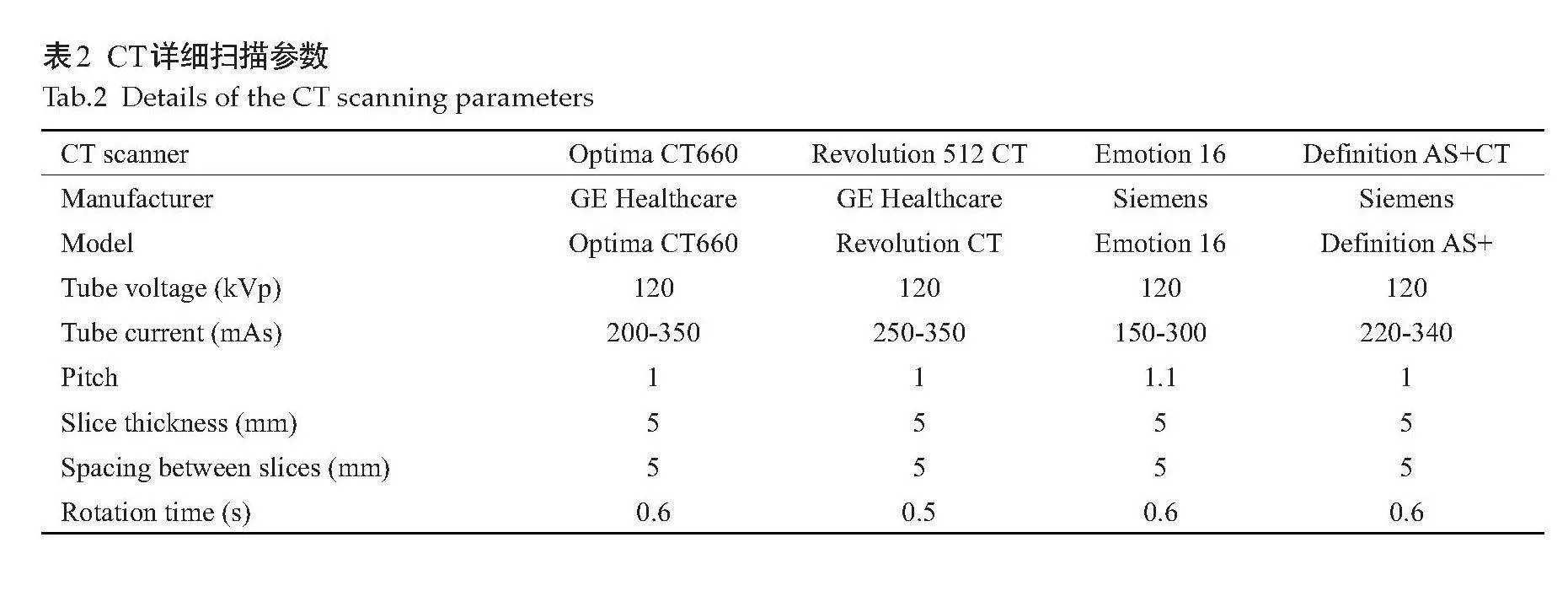
CT检查采用Optima CT660(GE Healthcare)、Revolution 512 CT(GE Healthcare)、Emotion 16(Siemens Healthcare)、Definition AS+(Siemens Healthcare)多排螺旋CT系统。以上各设备分别简称为A、B、C、D。患者在检查前需禁食8~12 h,检查前5~10 min饮用800~1000 mL温水,并接受呼吸训练。患者仰卧,双脚先进入扫描仪,双手上举至头顶,进行上腹部CT平扫。扫描范围为膈顶至肝脏下缘。各CT设备的详细扫描参数(表2)。
1.3" 基于图像的协调
1.3.1" 图像重采样" "通过改变图像的空间分辨率或体素大小,对不同设备的图像进行标准化。采用SimpleITK 2.3.0库中的sitkLinear插值方法,将图像重采样到目标分辨率1 mm×1mm×1 mm、2 mm×2 mm×2 mm或3 mm×3 mm×3 mm,详见公式(1):
[I´(x´,y´,z´) = InterpolateI(x,y,z)" " " " " " " " " nbsp; " " (1)]
其中,[I´(x´,y´,z´) ]是重采样后的图像,[ Interpolate]是插值函数,[(x,y,z)]和 [(x´,y´,z´) ]分别是原始和目标图像的体素坐标。
1.3.2" 均值中心化" "通过减去体积强度的均值来标准化图像强度值,见公式(2):
[Zi = Xi - X" " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " (2)]
其中[Zi ]是第[i]个体素的归一化强度,[Xi ]是第[i]个体素的原始强度,[X" ]是整个体积强度分布的均值。
1.3.3" Z-Score归一化" " 将图像强度分布标准化为均值为零方差为1,见公式(3):
[Zi = Xi - Xσ" " " " " " " " " " " " " " " " " " " " " " " " " " " " " " (3)]
其中,[Zi ]是第[i]个体素的归一化强度,[Xi ]是第[i]个体素的原始强度,[X]和[σ]分别是整个图像体积强度分布的均值和标准差。
1.3.4" 直方图匹配" "通过使用特定体积的直方图作为参考来重塑体积直方图。包括以下3个步骤:计算图像的直方图[Himg]和参考图像的直方图[HRef];计算2个图像直方图的离散累积分布函数CDFs,即[CDFimg]和[CDFRef];计算一个映射,将图像的体积强度分布转换为参考图像的像度分布,见公式(4):
[M(Ximg) = argminx| CDFimg(Ximg) - CDFRef(Xref) |" "(4)]
其中[M(Ximg) ]表示映射函数,它将体积图像中的像素强度[Ximg]映射到一个新的强度值。 [CDFimg(Ximg) ]是体积图像的累积分布函数,[CDFRef(Xref)]是参考图像的累积分布函数。[ argminx]表示对x进行最小化操作,即找到使得 [CDFimg(Ximg) - CDFRef(Xref)]最小的x值。本研究从每个扫描仪中随机选取参考序列,重复分析4次。
1.4" 图像分割及影像组学特征提取
由1位具有5年腹部诊断经验的影像科医师使用开源软件3D Slicer(Version 5.4.0 http://www.slicer.org)对感兴趣区域(ROI)提取93个影像组学特征。包括18个一阶特征,24个灰度共生矩阵(GLCM)、16个灰度游程矩阵(GLRLM)、16个灰度大小区域矩阵(GLSZM)、5个邻域灰度差矩阵(NGTDM)、14个灰度依赖矩阵(GLDM)。由于人为设置ROI大小,形状特征被排除在外。所有特征的数学定义符合影像生物标志物标准化倡议[10]所描述的定义。
1.5" 基于特征的ComBat协调
ComBat是一种数据驱动的标准化技术,最初为基因组学开发的,现已被成功应用于医学影像数据的校正。该方法通过贝叶斯框架估计和调整批次效应[11],从而校正由设备和扫描协议差异引起的影像组学特征变化,使不同批次的影像数据在特征层面上具有更高的一致性[12]。ComBat协调模型如公式(5)所示:
[YCombatij =Yij-α-γiδi+α" " " " " " " " " " " " " " " " " " " " "(5) ]
其中,[α],[γi]和[δi]分别是特征平均值、加性批次效应和乘性批次效应的估计值,而 [YCombatij]是去除第[i]个扫描仪效应后的第[j]个特征的转换值。对于ComBat的应用,采用neuroComBat(Version 0.2.12)软件包[13]。
1.6" 统计学分析
采用Python3.11.0中的Scipy软件包进行统计分析。对性别采用卡方检验,对年龄采用Kruskal-Wallis H检验,分析各组患者的性别和年龄差异是否有统计学意义。使用Mann-Whitney U检验比较两种扫描仪之间以及应用协调方法前后影像组学特征的分布。由于考虑了4种不同的扫描仪,共进行了6次成对比较(A vs B、A vs C、A vs D、B vs C、B vs D、C vs D)。所有检验均采用Bonferroni法校正显著性水平。还使用上述检验对协调前后保持一致的特征数目进行差异分析,并计算Cohen's d值,以评估不同方法的影响大小。其中,dgt;0表示正向效应,dlt;0表示负向效应,且绝对值越大,两组数据差异越明显。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 原始特征
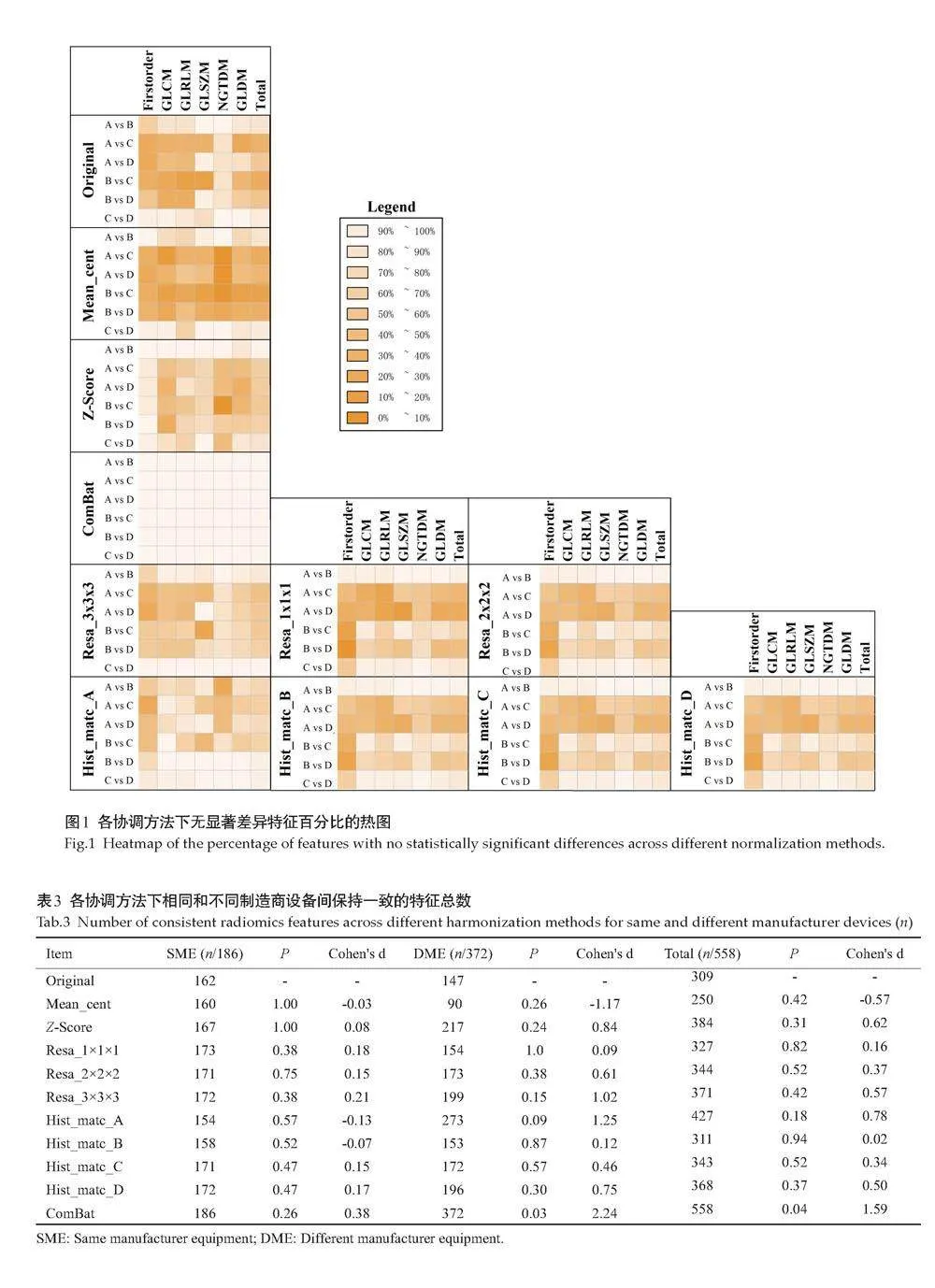
在未应用任何协调方法前,一阶特征、GLCM和GLRLM特征稳定性较差,超过一半的特征在设备间未能保持稳定,仅NGTDM在各设备间保持良好的一致性。四台设备之间特征总体一致性为55.38%(309/558)。使用同一制造商的不同扫描仪(A vs B、C vs D)时,所有特征类别均保持较高的一致性,达87.10%(162/186);但使用不同制造商的扫描仪(A vs C、A vs D、B vs C、B vs D)时,特征的一致性较差,仅为39.52%(147/372)(图1)。
2.2" 基于图像的协调
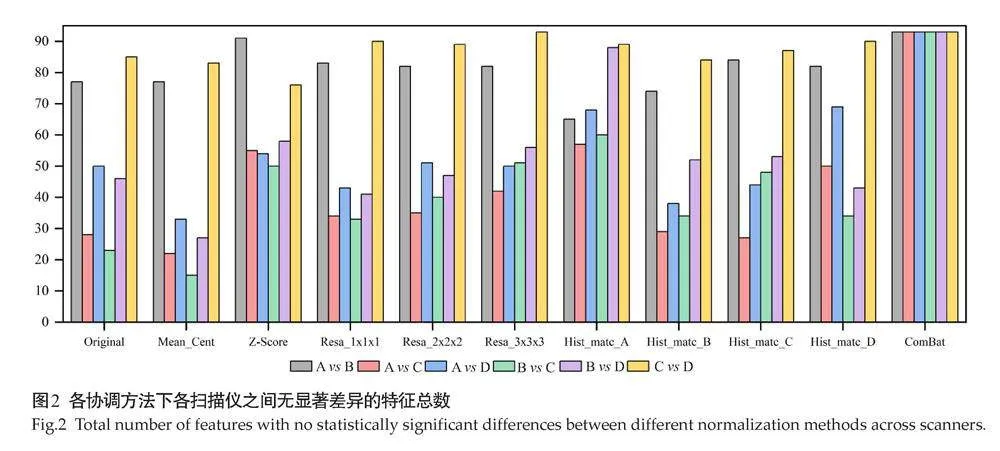
在应用基于图像的协调方法后,总体上仅Z-Score、Resa_3×3×3、Hist_matc_A显著提升了特征在设备间的一致性(Plt;0.05),保持一致的特征数目比例分别为68.82%、66.49%、76.52%。其余方法特征在协调前后均未能表现出显著差异,其中均值中心化方法反而显著降低了设备间特征的一致性,比例为44.82%(P=0.42,d=-0.57)。
Z-Score协调方法使保持一致的特征数量达到384个(d=0.62),其对一阶特征、GLRLM和GLSZM特征的协调效果最好。尤其是一阶特征,Z-Score几乎消除了特征在两两设备之间的差异(图1)。
在3种重采样方案中,Resa_3×3×3的效果最好(d=0.57),设备间保持一致的特征数目提升至371个。当目标体素为1×1×1和2×2×2时,虽总体上提升了保持一致的特征数目:Resa_1×1×1为327个(P=0.82),Resa_2×2×2为344个(P=0.52),差异均无统计学意义。此外,Resa_3×3×3在所有设备间(6次设备间两两比较中)均能有效的提升保持一致的特征数目(图1~2,表3)。
在4次直方图匹配中,Hist_matc_A和Hist_matc_D取得显著效果(d=0.78、0.50)。设备间保持一致的特征数目分别提升至427个和368个,其中Hist_matc_A位列第1。通过对各设备的成对比较(图2),发现Hist_matc_A获得相似的特征增加主要是A vs C 、B vs C和B vs D之间的显著增加,A vs B间的差异无统计学意义(P=0.57,d=-0.13)。相反,以B和C设备图像为参考时,能增加一致的特征数目:以B设备为参考时 311个(P=0.94),以C设备为参考时343个(P=0.52),差异无统计学意义。
2.3" 基于特征的协调
基于特征的ComBat协调方法在相同和不同制造商的设备中均表现出卓越的性能,能够有效协调六大类特征,使设备间总体保持一致的特征数目提升至558个(d=1.59)。
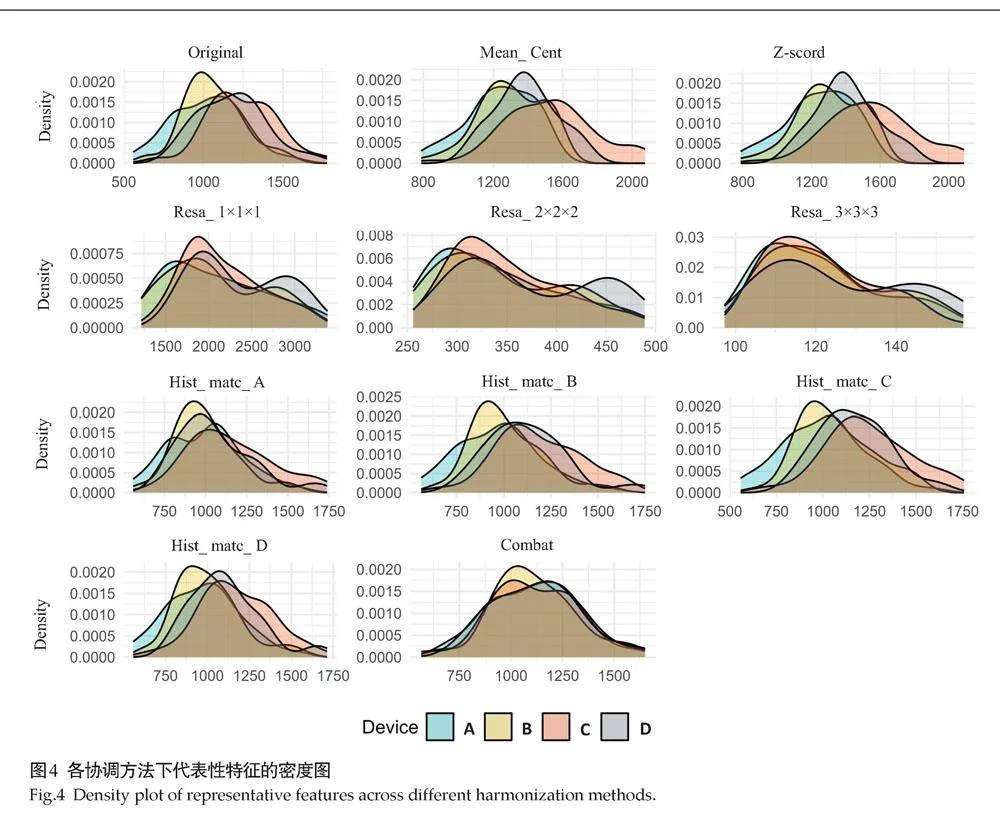
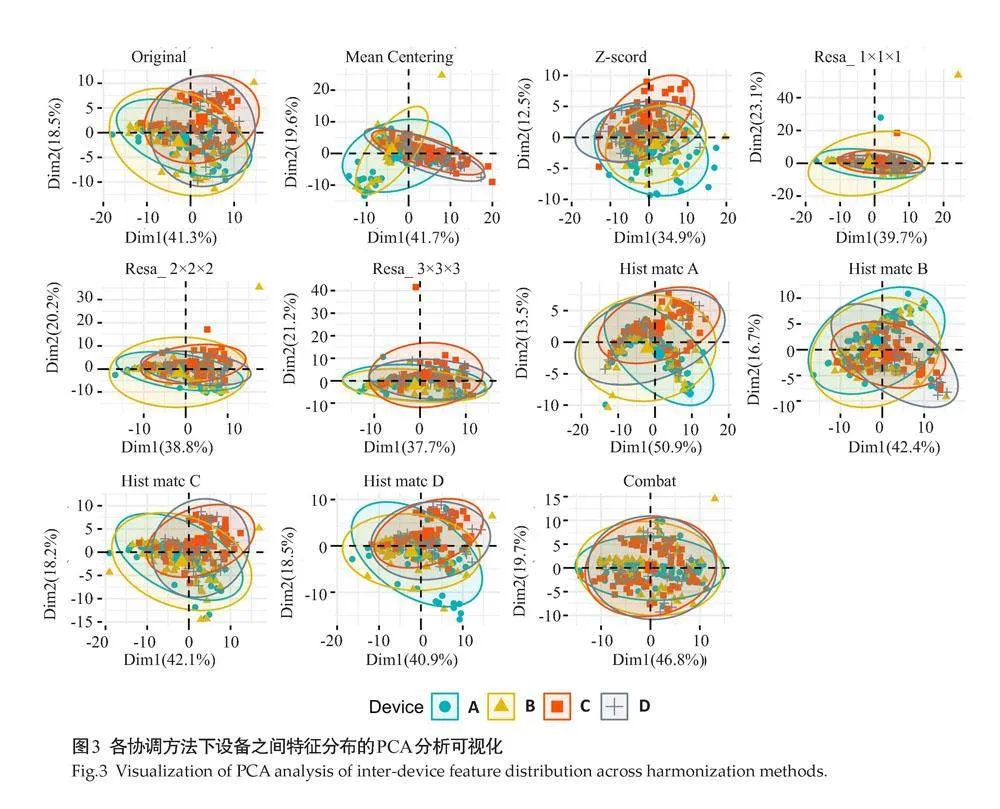
对不同协调方法结果进行PCA分析后的可视化结果显示,各点根据前两个主成分定位,每个椭圆适当地包含了某一领域的点(图3)。在原始图中,设备A和B以及C和D之间存在较高的重叠,这与表3中相同制造商设备具有较高的一致性相符。在应用协调方法后,Z-Score、Resa_3×3×3、Hist_matc_A和ComBat协调方法使得4台扫描仪的特征分布更为聚集。代表性特征(GLRLM_GrayLevelNonUniformity)的密度图显示了各协调方法后特征数值的具体分布(图4)。
3" 讨论
本研究分析了不同CT设备中健康肝脏组织影像组学特征的一致性,并系统评估了基于图像(均值中心化、Z-Score、重采样和直方图匹配)和基于特征的ComBat协调对特征的影响,为今后影像组学在肝脏疾病研究中的应用提供了重要参考。
本研究发现,在未应用任何协调方法前,六大类影像组学特征中,仅NGTDM特征在不同设备间表现出较好的一致性,而其余特征的一致性均较差,这与先前的研究结果一致[14-15]。根据PyRadiomics软件包[16]中对NGTDM特征的定义,即像素与其邻近像素之间的变化程度、空间强度变化以及变化的显著性,表明这些特征主要用于检测局部纹理变化。这表明在不同扫描设备上采集的图像中,局部纹理特征可能保持了较好的稳定性[17]。此外,特征在相同制造商设备间的一致性明显高于不同制造商设备间,这可能是因为同一制造商的设备在图像采集[18]、数据处理和图像重建设置方面具有更高的相似性[19-20]。有研究评估了3台双能CT设备间的特征稳定性,在患者组中发现,不同扫描设备之间特征的一致性比例介于51.4%~71.1%[21],与本研究的结果一致。此外,有研究在一项关于肺结节的多中心体模研究中也指出,CT制造商、设备型号以及采集参数均会导致特征出现不同程度的变异[22]。本研究结果进一步验证了这一点,并突出了同一制造商设备间的一致性明显高于不同制造商设备间的现象,这提示在今后的影像组学研究中需要谨慎考虑由不同制造商带来的显著差异。
在应用基于图像的协调方法后,本研究发现各个方法对结果的影响方向和幅度有所不同。其中,均值中心化方法不仅未能增加统计上保持一致的特征数目,反而使保持一致的特征数目减少至250个,而Z-Score方法则显著增加了统计上保持一致的特征数目。这可能是因为均值中心化仅调整图像的均值,而忽略了设备间图像特征方差的差异。Z-Score方法通过同时调整均值和标准差,使得数据在均值和方差上都得到了统一,从而更有效地校正了设备间的差异。此前,有学者利用单一T2WI-MRI序列发现,指出Z-Score方法相比均值中心化能更显著地协调特征,但这一发现未在多平台数据集中验证[23] 。为克服这一局限,本研究采用了多制造商、多设备数据集,进一步验证了其在多样化数据环境中的鲁棒性和可靠性,突显了Z-Score方法在实际应用中的可行性。本研究意外地发现,在3种常用的重采样方案中,目标体素为3×3×3时表现最佳,能够有效提升在各设备两两比较中一致的特征数目。既往一项基于大脑MRI的研究指出,重采样为1×1×1时能够最好地去除批次效应[24] ,这可能是因为CT图像相较于MRI具有更高的空间分辨率和较低的噪声水平,使得3×3×3的体素能够平滑不同设备的分辨率差异,同时保持足够的细节信息,有助于减少设备间的批次效应[25] 。此外,插值算法的选择也会影响结果。基于直方图匹配的协调方法,在参考设备的选择方面表现出较大的差异(以A、B、C、D设备为参考时保持一致的特征数目分别为427、311、343、369),这表明参考设备的选取对结果具有显著影响。尽管以A设备为参考时取得了最佳结果,但在A vs B中稍有恶化,产生这一现象的原因尚无法完全解释,可能取决于原始序列的直方图与参考图像的直方图之间的初始差异。与基于MRI数据的既往研究[26-27] 相比,本研究取得了更为显著的结果,可能是因为本研究以健康肝脏组织为对象,相较于异常组织,其密度和灰度分布更均匀,且本研究所使用的CT扫描设备具有更一致的扫描参数。
本研究中,ComBat方法相较于其他协调方法取得了最佳结果,完全消除了设备间的批次效应,使特征在各设备间保持一致。这表明ComBat方法可以有效消除由不同CT制造商和设备型号引起的批次效应,在多中心多设备数据协调中展现出巨大的潜力[28] 。一项基于颌下腺超声设备的研究也观察到了类似现象,使用ComBat方法后,94.12%(16/17)的特征在设备间保持一致[29] 。此外,基于体模的研究也指出ComBat方法能有效降低不同扫描仪间影像组学特征的差异[30] 。
本研究与既往研究有所不同:本研究以健康肝脏组织为对象,能够有效消除基于病变和体模研究的固有缺陷;此外,为了消除不同个体感兴趣区域分割带来的差异,本研究选择标准影像解剖层面并固定ROI大小进行分割;另一方面,本研究纳入了多种协调方法,并探讨了不同参数设置对特征一致性的影响。
本研究尚存在以下不足:本研究使用了来自单一中心的数据,且纳入的设备数量和患者人数有限,结果有待在未来的研究中进一步验证;本研究没有考虑各种协调方法的组合对结果的影响,而是单独评估了每种方法;尽管本研究患者没有已知疾病,且肝脏功能和形态结构均无异常,但仍不能完全排除患者肝脏微观结构变化对结果的潜在影响。后续研究将扩大研究范围,纳入多中心数据以验证结果的普遍性并探索不同协调方法组合对结果的影响;此外,将进一步研究肝脏微观结构变化对特征的潜在影响,以提高结果的准确性和可靠性。
综上所述,肝脏CT影像组学特征在同一制造商的扫描仪中表现出良好的一致性,显著优于不同制造商的扫描仪。基于图像和特征的协调方法能够有效减少由CT制造商和设备型号引起的影像组学特征的变异,从而确保在多设备多制造商研究中影像组学特征的可重复性和再现性。特别是基于特征的ComBat方法表现最佳,使得特征在各设备间保持一致,有助于未来跨设备或跨中心成像数据的研究,从而提高模型的普适性。
参考文献:
[1]" Mayerhoefer ME, Materka A, Langs G, et al. Introduction to radiomics[J]. J Nucl Med, 2020, 61(4): 488-95.
[2]" "McCague C, Ramlee S, Reinius M, et al. Introduction to radiomics for a clinical audience[J]. Clin Radiol, 2023, 78(2): 83-98.
[3]" "Abbasian Ardakani A, Bureau NJ, Ciaccio EJ, et al. Interpretation of radiomics features‑a pictorial review[J]. Comput Methods Programs Biomed, 2022, 215: 106609.
[4]" "Zhao BS. Understanding sources of variation to improve the reproducibility of radiomics[J]. Front Oncol, 2021, 11: 633176.
[5]" "石镇维, 刘再毅. 影像组学研究的困境和出路[J]. 中华放射学杂志, 2022, 56(1): 9-11.
[6]" "Fusco R, Granata V, Grazzini G, et al. Radiomics in medical imaging: pitfalls and challenges in clinical management[J]. Jpn J Radiol, 2022, 40(9): 919-29.
[7]" "Mali SA, Ibrahim A, Woodruff HC, et al. Making radiomics more reproducible across scanner and imaging protocol variations: a review of harmonization methods[J]. J Pers Med, 2021, 11(9): 842.
[8]" "Stamoulou E, Spanakis C, Manikis GC, et al. Harmonization strategies in multicenter MRI-based radiomics[J]. J Imaging, 2022, 8(11): 303.
[9]" "Dewi DEO, Sunoqrot MRS, Nketiah GA, et al. The impact of pre-processing and disease characteristics on reproducibility of T2-weighted MRI radiomics features[J]. MAGMA, 2023, 36(6): 945-56.
[10] Zwanenburg A, Vallières M, Abdalah MA, et al. The image biomarker standardization initiative: standardized quantitative radiomics for high‑throughput image‑based phenotyping[J]. Radiology, 2020, 295(2): 328-38.
[11] Johnson WE, Li C, Rabinovic A. Adjusting batch effects in microarray expression data using empirical Bayes methods[[J]. Biostatistics, 2007, 8(1): 118-27.
[12]Horng H, Singh A, Yousefi B, et al. Generalized ComBat harmonization methods for radiomic features with multi‑modal distributions and multiple batch effects[J]. Sci Rep, 2022, 12(1): 4493.
[13] Fortin JP, Cullen N, Sheline YI, et al. Harmonization of cortical thickness measurements across scanners and sites[J]. Neuroimage, 2018, 167: 104-20.
[14] Jensen LJ, Kim D, Elgeti T, et al. Stability of liver radiomics across different 3D ROI sizes‑an MRI in vivo study[J]. Tomography, 2021, 7(4): 866-76.
[15]" Zhong JY, Pan ZL, Chen Y, et al. Robustness of radiomics features of virtual unenhanced and virtual monoenergetic images in dual-energy CT among different imaging platforms and potential role of CT number variability[J]. Insights Imaging, 2023, 14(1): 79.
[16] van Griethuysen JJM, Fedorov A, Parmar C, et al. Computational radiomics system to decode the radiographic phenotype[J]. Cancer Res, 2017, 77(21): e104-e107.
[17] Wang H, Zhou YK, Wang X, et al. Reproducibility and repeatability of CBCT‑derived radiomics features[J]. Front Oncol, 2021, 11: 773512.
[18] Meyer M, Ronald J, Vernuccio F, et al. Reproducibility of CT radiomic features within the same patient: influence of radiation dose and CT reconstruction settings[J]. Radiology, 2019, 293(3): 583-91.
[19]Berenguer R, Pastor‑Juan MDR, Canales‑Vázquez J, et al. Radiomics of CT features may be nonreproducible and redundant: influence of CT acquisition parameters[J]. Radiology, 2018, 288(2): 407-15.
[20] Chen Y, Zhong JY, Wang L, et al. Robustness of CT radiomics features: consistency within and between single‑energy CT and dual-energy CT[J]. Eur Radiol, 2022, 32(8): 5480-90.
[21]" Lennartz S, O'Shea A, Parakh A, et al. Robustness of dual-energy CT‑derived radiomic features across three different scanner types[J]. Eur Radiol, 2022, 32(3): 1959-70.
[22]Peng XQ, Yang SY, Zhou LX, et al. Repeatability and reproducibility of computed tomography radiomics for pulmonary nodules: a multicenter phantom study[J]. Invest Radiol, 2022, 57(4): 242-53.
[23]Scalco E, Belfatto A, Mastropietro A, et al. T2w‑MRI signal normalization affects radiomics features reproducibility[J]. Med Phys, 2020, 47(4): 1680-91.
[24]" Li YP, Ammari S, Balleyguier C, et al. Impact of preprocessing and harmonization methods on the removal of scanner effects in brain MRI radiomic features[J]. Cancers, 2021, 13(12): 3000.
[25]Bologna M, Tenconi C, Corino VDA, et al. Repeatability and reproducibility of MRI‑radiomic features: a phantom experiment on a 1.5 T scanner[J]. Med Phys, 2023, 50(2): 750-62.
[26] Giannini V, Panic J, Regge D, et al. Could normalization improve robustness of abdominal MRI radiomic features?[J]. Biomed Phys Eng Express, 2023, 9(5): doi: 10.1088/2057-1976/ace4ce.
[27]Salome P, Sforazzini F, Grugnara G, et al. MR intensity normalization methods impact sequence specific radiomics prognostic model performance in primary and recurrent high-grade glioma[J]. Cancers, 2023, 15(3): 965.
[28]Ligero M, Jordi‑Ollero O, Bernatowicz K, et al. Minimizing acquisition‑related radiomics variability by image resampling and batch effect correction to allow for large-scale data analysis[J]. Eur Radiol, 2021, 31(3): 1460-70.
[29]" Choi YJ, Jeon KJ, Lee AR, et al. Harmonization of robust radiomic features in the submandibular gland using multi‑ultrasound systems: a preliminary study[J]. Dentomaxillofac Radiol, 2023, 52(2): 20220284.
[30] Zhang XL, Iqbal Bin Saripan M, Wu YJ, et al. The impact of the combat method on radiomics feature compensation and analysis of scanners from different manufacturers[J]. BMC Med Imaging, 2024, 24(1): 137.
(编辑:熊一凡)
收稿日期:2024-06-06
基金项目:广东省自然科学基金(2414050003969);赣州市科技计划项目(2022-RC1349)
作者简介:周创辉,在读硕士研究生,E-mail: 1549935583@qq.com
通信作者:钟海舰,博士,教授,E-mail: hjzhong2007@gmu.edu.cn;秦耿耿,博士,主任医师,E-mail: zealotq@smu.edu.cn
