小儿垂体朗格汉斯细胞组织细胞增生症临床特征和MRI表现
2024-10-30杨春兰徐守军刘龙平谢丽春
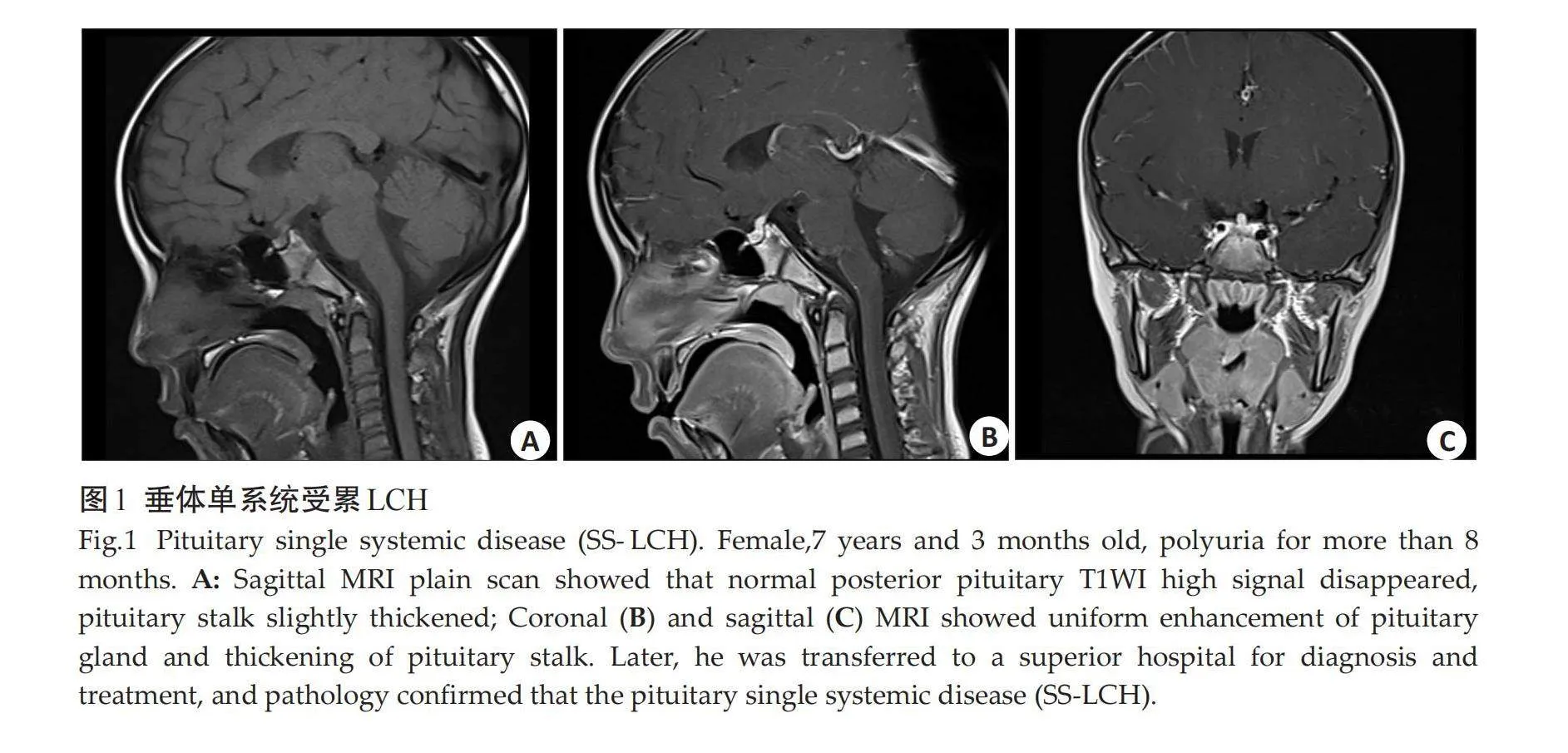
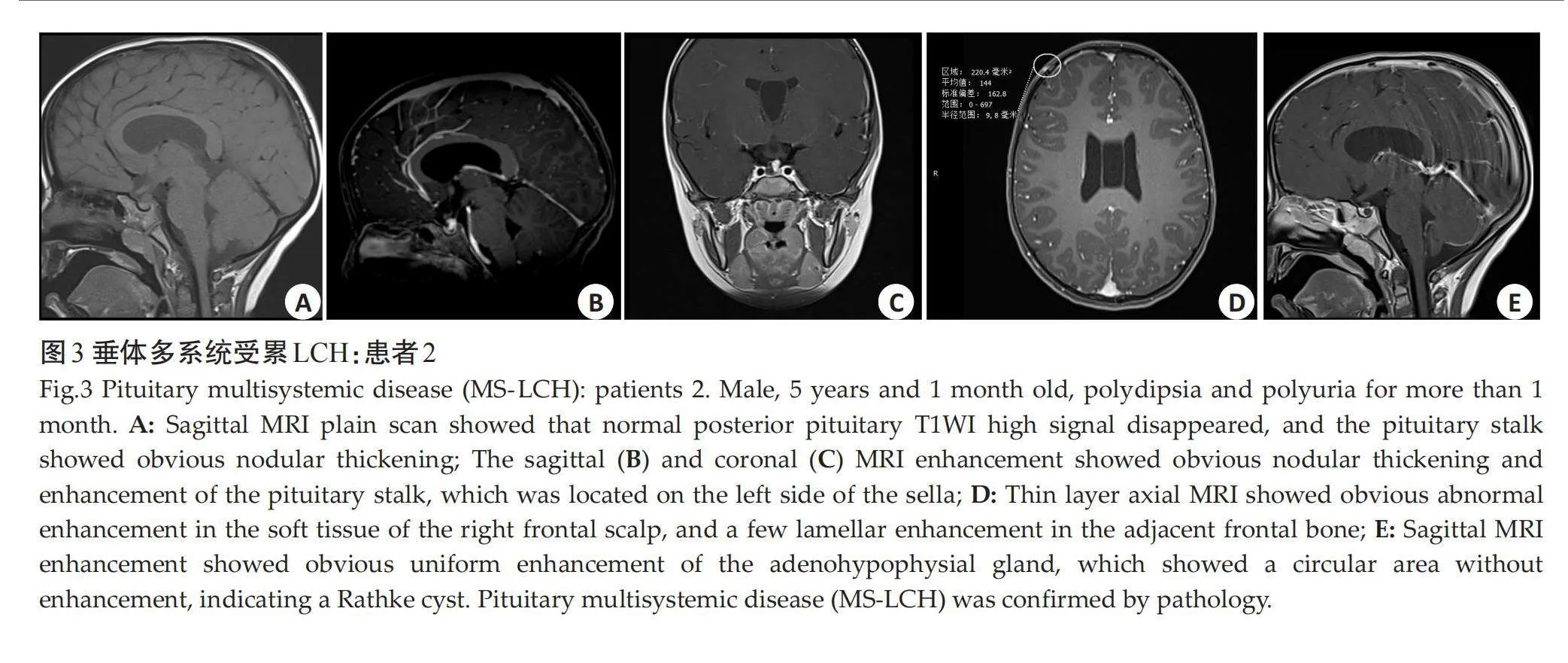
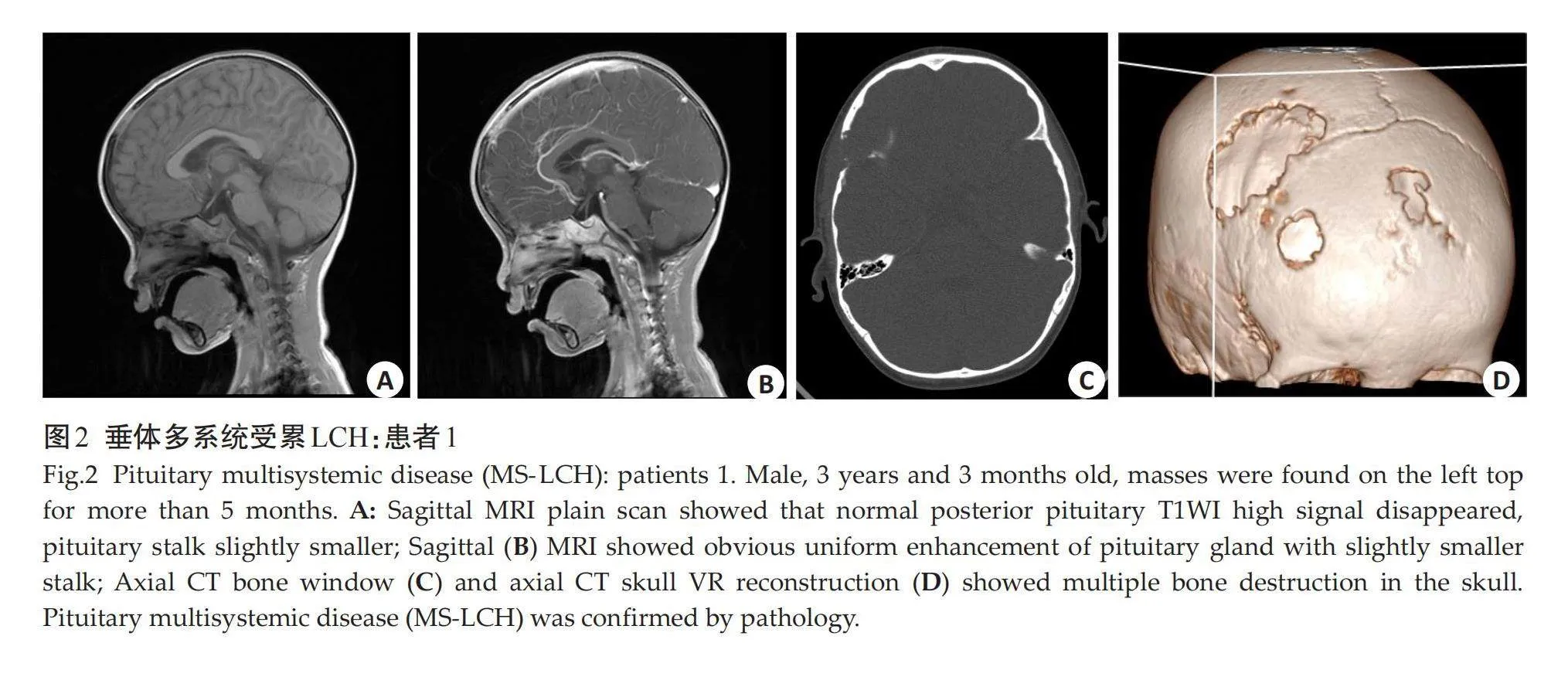
摘要:目的" 探讨小儿垂体朗格汉斯细胞组织细胞增生症(LCH)的临床特征和MRI表现。方法" 回顾性分析2014年11月~2023年8月经病理证实的23例垂体LCH患儿MRI资料,其中男12例,女11例,年龄1岁~12岁6月(6.72±3.33岁)。观察病变部位、垂体高度、神经垂体是否存在、垂体柄形态、大小、垂体强化方式、垂体/松果伴随病变等,并总结、归纳垂体LCH的MRI表现。结果" 首次就诊原因主要为尿崩症,其它就诊症状为顶部包块2例,顶部压痛1例,颈部包块1例。垂体单系统受累16例,其余均为多系统受累,垂体外常累及颅面骨,少见受累部位为肺部、肋骨等。腺垂体明显凹陷、变薄1例,饱满/隆起4例;神经垂体高信号均未见;垂体柄增粗13例,细小2例,另有1例漏斗部线样狭窄、上段结节状增粗,无明显增粗/细小7例;增强后垂体均明显均匀强化;伴随Rathke囊肿/残腔3例,松果体囊肿2例。结论" 小儿垂体LCH磁共振表现具有一定特征性,有助于诊断。
关键词:垂体;朗格汉斯细胞组织细胞增生症;磁共振成像
Clinical characteristics and" MRI manifestations of Langerhans cell histiocytosis in children
YANG Chunlan1, XU Shoujun2, LIU Longping2, XIE Lichun3
1Department of Hematology and Oncology, 2Department of Radiology, Shenzhen Children's Hospital, Shenzhen 518026, China; 3Department of Pediatrics, The Third Affiliated Hospital of Guangzhou Medical University (The Women and Children's Medical Center of Guangzhou Medical University), Guangzhou 510530, China
Abstract: Objective To investigate the MRI and clinical characteristics of Langerhans cell histiocytosis (LCH) of pituitary gland in children. Methods We conducted a retrospective analysis the MRI data of the 23 children with pituitary LCH confirmed by pathological from November 2014 to August 2023, including 12 males and 11 females with an average age of 1 year to 12 years 6 months (6.72±3.33 years old). The lesion location, pituitary height, presence of neurohypophysis, pituitary stalk shape, size, pituitary reinforcement, and pituitary/pineal concomitant lesions were observed. The MRI findings of pituitary LCH were summarized. Results The main reason for the first visit was diabetes insipidus, and other symptoms were head mass in 2 cases, head tenderness in 1 case and neck mass in 1 case. Only pituitary was involved in 16 cases, and the rest were multisystem involved. Craniofacial bones were often involved outside the pituitary, and lungs and ribs were rarely involved. The adenohypophyseal was significantly depressed and thin in 1 case and full/bulging in 4 cases. No neurohypophysial hypersignal was found in all cases. The adenohypophyseal was significantly depressed and thin in 1 case and full/bulging in 4 cases. No neurohypophysial hypersignal was found in all cases. There were 13 cases of pituitary stalk thickening, 2 cases of fine, 1 case of funnel line stenosis, the upper segment nodular thickening, 7 cases without obvious thickening/fine. The pituitary was enhanced uniformly after enhancement. There were 3 cases with rathke cyst/remnant cavity and 2 cases with pineal cyst. Conclusion The MRI manifestations of pituitary LCH in children have certain characteristics, which is helpful for diagnosis.
Keywords: pituitary; Langerhans cell histiocytosis; magnetic resonance imaging
收稿日期:2023-11-02
基金项目:广东省高水平临床重点专科(SZGSP012);广东省基础与应用基础研究基金项目(2022A1515111121);深圳市医学重点学科建设经费(SZXK034);深圳市医疗卫生三名工程项目资助(SZSM202011005);深圳市基础研究专项(自然科学基金)基础研究面上项目(JCYJ20220530155616038)
作者简介:杨春兰,硕士,主治医师,E-mail: 498853012@qq.com
通信作者:徐守军,博士,主治医师,E-mail: 287928145@qq.com
朗格汉斯细胞组织细胞增生症(LCH)是一组以未成熟树突状细胞克隆增殖为特征的疾病,可发生于人体任何器官或系统,但其表现因发病部位和程度不同而异[1-4]。垂体LCH发病率较低,目前对其认识仍不足,常被误诊和漏诊,易延误患儿治疗,长期预后较差,容易造成不可逆的伤害,并发后遗症,进一步加大治疗难度[5]。既往针对垂体LCH的临床特征和MRI表现研究较少,且样本量相对较小[2, 6-9]。本研究回顾性分析经病理证实的23例垂体LCH患儿病例资料,总结垂体LCH的临床特征和MRI表现,旨在提高对该病的认识和诊断的正确率,为患儿早期诊断及临床科学治疗提供客观依据。
1" 资料与方法
1.1" 一般资料
回顾性分析2014年11月~2023年8月经病理证实的23例LCH患儿MRI资料,其中男12例、女11例,年龄1岁~12岁6个月(6.72±3.33岁)。23例均行MRI平扫及增强检查。纳入标准:经病理学证实的初诊LCH患儿;于本院治疗期间患儿本人和(或)其监护人签署过后期可能会被纳入病例回顾性研究告知书者。排除标准:无初次MRI检查资料者;临床资料不完整者;于本院治疗期间患儿本人和(或)其监护人未签署过后期可能会被纳入病例回顾性研究告知书者。检查前患者本人和(或)其监护人均签署过知情同意书。本研究为回顾性病例研究,无伦理委员会审批。
1.2" 影像学检查方法
使用Siemens Skyra 3.0 T MR/GE OptimaMR360
1.5 T MR扫描仪。采用头颈联合相控阵线圈。患儿仰卧,定位扫描完成后进行常规平扫及增强扫描。分别采集垂体矢状位和冠状位T1WI、T2WI图像。增强扫描:经肘静脉以0.1 mmol/kg体质量注射钆布醇,流率2 mL/s,分别进行冠状位T1WI动态增强扫描及矢状位T1WI增强扫描。部分病例同时进行了颅脑MRI/CT扫描。
对于不能配合的患儿在行MRI扫描前给予稀释水合氯醛镇静(浓度稀释至0.5%后按0.5 mL/kg用药,最大用药剂量不超过10 mL)。
1.3" 图像分析
由2位工作10年以上经验丰富的儿科影像诊断医生进行独立阅片,观察发病部位、垂体高度、神经垂体是否存在、垂体柄形态、大小、垂体强化方式、垂体/松果伴随病变等。如意见不一致,经讨论后达成一致意见。
2" 结果
2.1" MRI表现
垂体单系统受累16例,其余均为多系统受累,垂体外常累及颅面骨,少见受累部位为肺部、肋骨等。腺垂体明显凹陷、变薄1例(1 mm),饱满/隆起4例(1例12 mm、3例8 mm);神经垂体高信号均未见;垂体柄增粗13例(中度增粗9例,轻、重度增粗各2例),细小2例,另有1例漏斗部线样狭窄、上段结节状增粗,无明显增粗/细小7例;增强后垂体均明显均匀强化;伴随Rathke囊肿/残腔3例,松果体囊肿2例(图1~3)。
2.2" 就诊原因
首次因尿崩症(DI)就诊19例,其它就诊原因为顶部包块2例,顶部压痛1例,颈部包块1例。
3" 讨论
LCH是一种罕见的单核-巨噬细胞系统疾病,以表皮树突状细胞的克隆增殖为特征[2]。可能的发病机制是BRAFV600E突变、MAP2K1突变或MAPK/ ERK活化引起的克隆增生性疾病[1,10-12]。LCH发病率为3~5例/百万,男性多于女性,且多见于15岁以下小儿,成人罕见[1, 8, 11, 13]。本组患儿年龄1岁~12岁6个月(6.72±3.33岁)。LCH可生长在任何器官或系统,表现为单系统疾病(SS-LCH)或多系统疾病(MS-LCH),前3受累器官分别是骨骼(80%)、皮肤(33%)和垂体(25%),少见受累器官有肝脏(15%)、肺(15%)、淋巴结(5%~20%)、中枢神经系统[CNS(2%~4%),除垂体外][1, 2, 14-15]。本组中垂体SS-LCH 16例,其余均为MS-LCH,垂体外常累及颅面骨,少见受累部位为肋骨、肺部等。LCH最终诊断基于活检,免疫组织化学染色特征性表现为电子显微镜下Birbeck颗粒的存在和S100和CD1和/或CD 207蛋白标记的阳性[1, 11, 15-17]。垂体SS-LCH十分罕见,既往多为个案报道[7-8]。且临床缺乏特异性表现,颅内组织活检难度大,风险较高,故而诊断较为困难,多数患者仅能通过定期随访,直至病变不断进展[7]。
根据既往文献报道,同时结合本组病例,垂体LCH有如下MRI特点:(1)约50%以上累及垂体柄,受累垂体柄最常见征象为增粗[2, 17-19]。这一方面是由于未成熟树突状细胞克隆增殖,另一方面由于朗格汉斯细胞可通过募集协同炎症细胞触发强烈免疫反应[18]。有学者提出按垂体柄增粗程度分为轻、中、重度3类:轻度(3~3.9 mm)、中度(4~6.5 mm)或重度(gt;6.5 mm)[11, 17]。本组病例中垂体柄增粗13例(其中中度增粗9例,轻、重度增粗各2例)、细小2例,另有1例漏斗部线样狭窄,上部结节状增粗,无明显增粗/细小7例。但垂体柄增粗并非垂体LCH特异性表现[20-21];(2)腺垂体T1WI及T2WI均为等信号;(3)垂体后叶高信号缺失[7, 9, 17, 22]。神经垂体高信号是否存在被认为是神经垂体功能状态的一种标志[6]。因正常垂体后叶内贮存有含抗利尿激素的神经分泌颗粒,可使T1值下降,呈T1WI高信号[6]。当LCH侵犯垂体后叶,其内抗利尿激素分泌颗粒耗竭时T1WI高信号消失,但并非垂体 LCH 的特异性表现[9]。本组病例神经垂体高信号均未见。(4)多均匀强化[2, 17, 22]。本组病例增强后垂体均明显均匀强化。(5)边界多较清晰[2]。(6)腺垂体扁小或隆起。本组病例中腺垂体明显凹陷、变薄1例(1 mm),饱满/隆起4例(1例12 mm、3例8 mm)。(7)垂体及松果体伴随征象。本组病例伴随Rathke囊肿/残腔3例,松果体囊肿2例。
此外,当垂体LCH作为CNS-LCH一部分存在时,MRI可见神经节变性和轴外累及脑膜、松果体和脉络丛[23];其中神经节变性是一种不可逆的并发症,通常表现为小脑和基底神经节的双侧对称病变;CNS-LCH多为MS-LCH,男性多见[15, 17, 22]。
LCH临床表现多种多样,且与特定器官受累有关,诸如骨痛、皮肤溃疡、多尿等[1]。垂体LCH最常见的临床表现是DI(15%~30%)[1, 4, 16, 19]。DI是一种肾脏水平衡障碍,其特征是无法浓缩尿液,导致多尿和随后的多饮[11]。DI分为中枢性和肾源性,其中中枢性DI是由于抗利尿激素减少所致[11, 24]。抗利尿激素是由下丘脑视上核和室旁核中的大细胞神经元产生,经垂体柄内下丘脑神经垂体束向下运输[11, 21, 24]。下丘脑神经垂体束由起自下丘脑视上核及室旁核的大细胞神经元至垂体后叶的轴突组成,主要负责运输抗利尿激素和催产素[21]。垂体LCH所致中枢性DI主要有两个原因,一是由于下丘脑视上核和室旁核中的大细胞神经元破坏或变性引起,如超过80%大细胞神经元受损,就会因为抗利尿激素缺乏而出现中枢性DI[11, 24]。二是因为垂体发生LCH时,增殖的病理性树突状细胞向下丘脑-垂体轴浸润性生长,导致运输抗利尿激素通路中断,最终导致不可逆性中枢性DI[8, 21]。有全身性病变和颅面受累(特别是耳朵、眼睛和口腔受累)时发生DI的风险更高[1, 4]。本组病例中首次因DI就诊19例(82.6%)。再者,垂体LCH也会影响垂体前叶其他激素释放[21]。有文献报道在诊断DI中位时间4.5年后,67%的患者出现一种或多种垂体前叶激素分泌不足,其次是生长激素缺乏症(66.7%)、促卵泡激素-黄体生成素缺乏症(58.3%)、促甲状腺激素促肾上腺皮质激素缺乏症(41.6%)和全垂体功能低下症(41.6%)[4]。从而导致患者出现食欲减退、乏力、生长发育迟缓、遗精减少、月经紊乱、闭经、性欲减退等各种腺垂体功能减退症状[7]。此外,神经节变性可导致认知异常、执行功能障碍和记忆时间缩短[25]。患有CNS风险病变或共存DI时出现神经节变性的风险更高[25]。当出现嗜食、嗜睡、体温调节紊乱和短期记忆障碍等下丘脑相关症状时,提示病变累及了下丘脑,出现神经节变性[7]。
垂体LCH需要同淋巴细胞性垂体炎、生殖细胞瘤和其他CNS疾病鉴别。淋巴细胞性垂体炎是一种罕见但也是最常见的慢性垂体炎症,小儿淋巴细胞性垂体炎最重要的临床表现是中枢性DI、垂体前叶缺乏症和生长迟缓,与垂体LCH相似[2]。鞍上区生殖细胞肿瘤可引起内分泌紊乱,如多饮/多尿、身材矮小、性早熟/青春期延迟、中枢性甲状腺功能减退或中枢性肾上腺功能不全等,但特异性肿瘤标志物可能升高[2, 16-17, 22]。此外,它们MRI表现相似,均可出现垂体柄增粗、垂体弥漫性增大和神经垂体T1WI高信号减弱或消失,相互鉴别困难,最终主要依赖于免疫组织化学[2]。
垂体LCH治疗原则主要为手术和化疗[1, 4, 26]。完全手术切除仅对孤立性DI患儿有较好的疗效,但术后可复发[1-2]。如有垂体柄增厚、强化,则应进行全身化疗,以防止浸润引起的组织损伤,防止激素不足,并可能保留神经—肾上腺功能[4]。放疗对少数有颅外病变的患者效果良好[15]。此外,手术结合放疗可能是另一种有效方法[2]。单纯的手术、放疗或化疗无法恢复垂体激素缺乏症,应长期给予适当的内分泌激素替代治疗[4]。LCH预后分3个阶段:SS-LCH常预后良好,MS-LCH预后较差,器官功能障碍MS-LCH预后最差[2, 19]。目前LCH患者的总生存率超过90%,无事件生存率约为55%[25],如果涉及“高风险”器官,如骨髓、肝脏和脾脏,预后较差[15, 18]。
本研究存在一定的局限性:本研究是回顾病例资料,且未对病灶治疗后转归及临床激素水平进行归纳总结,在今后的研究中有待完善。
综上所述,垂体LCH主要表现为受累垂体柄增粗,增强后多均匀强化,垂体后叶高信号缺失。当垂体LCH作为CNS-LCH一部分存在时,MRI可见神经节变性和轴外累及脑膜、松果体和脉络丛。LCH表现多种多样,且与特定器官受累有关。垂体LCH最常见的表现是DI,有全身性病变和颅面受累时发生DI的风险更高。诊断DI后,可出现一种或多种垂体前叶激素分泌不足、生长激素缺乏症、促卵泡激素-黄体生成素缺乏症、促甲状腺激素促肾上腺皮质激素缺乏症和全垂体功能低下症,从而导致多种激素相关临床表现。神经节变性可导致认知异常、执行功能障碍和记忆时间缩短。患有CNS风险病变或共存DI时出现神经变性的风险更高。垂体LCH治疗原则主要为手术和化疗。放疗对少数有颅外病变的患者效果良好。当病变向上累及下丘脑时,可出现多种下丘脑相关症状。单纯的手术、放疗或化疗无法恢复垂体激素缺乏症,应长期给予适当的内分泌激素替代治疗。小儿垂体LCH临床及MRI表现具有一定特征性,全面了解有助于准确诊断。
参考文献:
[1]" "Tan HW, Yu K, Yu YR, et al. Isolated hypothalamic‑pituitary Langerhans'cell Histiocytosis in female adult: a case report[J]. Medicine, 2019, 98(2): e13853.
[2]" "Zhou W, Rao J, Li C. Isolated Langerhans cell histiocytosis in the hypothalamic‑pituitary region: a case report[J]. BMC Endocr Disord, 2019, 19(1): 143.
[3]" "王志成, 邓" 侃, 张" 毅, 等. 内镜下扩大经鼻蝶入路鞍上垂体柄占位性病变活检术临床价值初探[J]. 中国现代神经疾病杂志, 2019, 19(3): 177-83.
[4]" "Yang IC, Lee GJ, Han MS, et al. Langerhans cell Histiocytosis involving second cervical vertebra and the hypothalamus and pituitary in an adult[J]. World Neurosurg, 2020, 142: 142-6.
[5]" "龙庆玲, 李长钢. 儿童朗格汉斯细胞组织细胞增生症的诊治新进展[J]. 安徽医药, 2019, 23(6): 1065-9.
[6]" " 黄文献, 曾洪武, 张龚巍, 等. 儿童孤立性垂体柄朗格汉斯细胞组织细胞增生症的MRI表现[J]. 中国医学影像学杂志, 2016, 24(4): 245-7, 252.
[7]" " 王志成, 朱建宇, 张" 毅, 等. 鞍区朗格汉斯细胞组织细胞增生症临床特点分析[J]. 中国现代神经疾病杂志, 2020, 20(7): 625-31.
[8]" " 雷" 霆, 刘 锐, 吴陈兴, 等. 鞍区朗格汉斯细胞组织细胞增生症疾病特征的初步观察[J]. 中华神经外科杂志, 2021, 37(12): 1246-50.
[9]" " 黄" 娟, 付雨菲. 朗格汉斯细胞组织细胞增生症的分型及影像学表现[J]." 临床放射学杂志, 2022, 41(10): 1977-81.
[10]" 廖雪莲, 蒋" 慧, 陆正华, 等. 儿童朗格罕细胞组织细胞增生症45例临床分析[J]. 中华实用儿科临床杂志, 2017, 32(15): 1145-8.
[11]" Brys ADH, Vermeersch S, Forsyth R, et al. Central diabetes insipidus: beware of Langerhans cell Histiocytosis![J]. Neth J Med, 2018, 76(10): 445-9.
[12]" 崔" 蕾, 张" 莉, 廉红云, 等. 儿童朗格罕细胞组织细胞增生症BRAFV600E突变对预后的影响[J]. 中国循证儿科杂志, 2020, 15(2): 102-7.
[13]" 邢" 菲, 孙娜娜, 刘希胜. 朗格汉斯细胞组织细胞增生症的影像学诊断及病理学特征[J]. 实用放射学杂志, 2019, 35(8): 1294-8.
[14]" 张" 莉, 廉红云, 马宏浩, 等. 单器官受累朗格罕细胞组织细胞增生症112例[J]. 中华实用儿科临床杂志, 2016, 31(15): 1172-4.
[15]" Bärtschi P, Luna E, González-López P, et al. A very rare case of right insular lobe Langerhans cell Histiocytosis (CD1+) mimicking glioblastoma multiforme in a young adult[J]." World Neurosurg, 2019, 121: 4-11.
[16]" 王" 斐, 全会标, 陈道雄, 等. 朗格汉斯组织细胞增生症合并高血糖高渗状态一例[J]. 中华内科杂志, 2020, 59(3): 232-4.
[17]" Moszczyńska E, Baszyńska-Wilk M, Zasada K, et al. Pituitary stalk thickening in patients under 18 years of age the most common causes and diagnostic procedures[J]. Pedm, 2022, 28(3): 213-27.
[18]" 张水花, 张" 景, 韩" 佩, 等. PET/MRI观察朗格汉斯细胞组织细胞增生症[J]. 中国医学影像技术, 2021, 37(11): 1604-8.
[19]" 乐" 颖, 王元阳, 彭全洲, 等. 累及垂体和甲状腺的成人朗格汉斯细胞组织细胞增生症1例[J]. 中华内科杂志, 2022, 61(3): 327-30.
[20]" 徐加利, 冯" 逢, 有" 慧, 等. 48例垂体柄增粗MRI表现[J]. 中国医学影像学杂志, 2017, 25(2): 98-100.
[21]" 史红媛, 建方方, 卞留贯, 等. 垂体柄病变的MRI影像与临床特征分析[J]. 医学影像学杂志, 2023, 33(2): 181-5.
[22] Elżbieta M, Karolina K, Marta BW, et al. Pituitary stalk thickening: causes and consequences. the children’s memorial health institute experience and literature review[J]. Front Endocrinol, 2022, 13: :868558.
[23]" 邹" 珍, 赵康艳. 朗格汉斯细胞组织细胞增生症累及中枢神经系统1例[J]. 中国临床医学影像杂志, 2021, 32(4): 291-3.
[24]" Bianco D, Napoli F, Morana G, et al. Endocrine outcomes in central diabetes insipidus: the predictive value of neuroimaging \"mismatch pattern\"[J]. J Clin Endocrinol Metab, 2020, 105(11): 540.
[25]" Li N, Cui L, Ma HH, et al. Osteopontin is highly secreted in the cerebrospinal fluid of patient with posterior pituitary involvement in Langerhans cell Histiocytosis[J]. Int J Lab Hematol, 2020, 42(6): 788-95.
[26]" 方凯弘, 徐倩玥, 余" 红. 儿童朗格汉斯细胞组织细胞增生症病因和治疗进展[J]. 临床儿科杂志, 2019, 37(3): 228-32.
(编辑:林" 萍)
