立枯丝核菌Rhi-milR9829-5p与水稻和大豆互作的分子机理
2024-10-29赵宏伟薛敏武家斌李晓明



关键词:立枯丝核菌;Rhi-milR9829-5p;水稻;大豆
立枯丝核菌(RhizoctoniasolaniKühn)可侵染水稻、大豆、玉米等260多种植物,引起水稻纹枯病、玉米纹枯病和大豆纹枯、根腐等病害,特别是在高温、高湿或氮肥过量条件下发病尤为严重,给农业生产造成巨大损失[1-4]。根据菌丝的融合特征,立枯丝核菌可划分为14个融合群(AG-1~AG-13和AG-BI),其中AG-1又划分为AG1ⅠA、AG1ⅠB、AG1ⅠC、AG1ⅠD四个亚群。不同融合群的致病力因寄主植物、地理位置等的不同而呈现一定的差异,AG1ⅠA是水稻纹枯病的主要致病菌,也是玉米纹枯病、大豆纹枯病、大豆根腐病的优势致病融合群[5]。通常,立枯丝核菌的主要致病因子为毒素和细胞壁降解酶,通过影响酶活性和膜通透性等导致细胞死亡,但其具体作用机制尚不清楚[6,7]。目前,对纹枯病的防治主要是化学药剂防治,但该防治方法存在严重的环境污染和病原菌抗药性问题。因此,优化植物自身防御机制,提高其抗病能力,不仅可降低对化学药剂的依赖,也有助于减少环境风险和保护生态平衡,是一种经济、环保的解决方案。
microRNA(miRNA)是一类短小的非编码RNA分子,通常由约20~25个核苷酸组成[8],通过转录或翻译水平的抑制从而负调控靶基因的表达水平,在各种生物过程中发挥重要作用[9]。近年来,随着分子生物学技术的发展,miRNA在植物抗病过程中的功能及其分子机制,特别是miRNA在病原菌和植物间的相互跨界调控功能作用备受关注。已有报道表明,在病原菌侵染植物的过程中,真菌miRNA可以转移到植物中,通过调控植物靶基因的表达来增强自身致病力[10];同时,植物miRNA也可以转移到真菌中,通过对病原菌相关基因的调控增强自身抗病性[11]。虽然目前已经报道了多个miRNA能够参与植物抗病性调控的过程[12,13],但是miRNA参与调控水稻、大豆与立枯丝核菌相互作用的分子机制仍不清楚。另外,miRNA能够同时调控多个靶基因的表达,能够在一定程度上避免免疫逃避现象,因此,揭示miRNA对水稻、大豆抗病性的调控功能及分子机制,能够为培育持久抗病性的水稻和大豆品种提供理论基础。
在前期研究中,我们通过对立枯丝核菌进行全基因组小RNA测序,鉴定了171个micro-likeRNAs(milRNAs),其中18个milRNAs可能参与立枯丝核菌和玉米的互作。在立枯丝核菌侵染玉米的过程中,Rhi-milR9829-5p的表达量呈现先升高后下降的趋势,在侵染3d时达到最高值,约为正常培养的病原菌中的16倍,推测RhimilR9829-5p极有可能参与了立枯丝核菌与玉米互作的过程。通过功能注释、表达量分析、突变体接种等,验证了Rhi-milR9829-5p通过调控玉米Kelch样家族基因GRMZM2G412674的表达参与了玉米纹枯病的调控过程[14]。由于miRNA在进化过程中具有高度的保守性,因此,本研究试图进一步探究Rhi-milR9829-5p对水稻纹枯病抗性的调控作用。我们构建了Rhi-milR9829-5p成熟体的超量表达载体并在水稻中进行稳定遗传转化,获得了过表达Rhi-milR9829-5p的水稻转基因植株,发现其对纹枯病的抗性明显变弱。此外,我们利用生物信息学方法分别预测了RhimilR9829-5p在水稻和大豆中的靶基因,发现Rhi-milR9829-5p可通过多种途径调节作物对纹枯病的抗性,且在水稻和大豆中具有显著区别,推测立枯丝核菌对单、双子叶植物的致病机理存在差异。
1 材料与方法
1.1 真菌菌株和植物材料
接种用立枯丝核菌YWK196为纹枯病菌AG1-IA融合群菌株,培养于马铃薯葡萄糖琼脂培养基(PDA;20%马铃薯,2%葡萄糖和2%琼脂,w/v)上,28℃黑暗培养。
水稻品种为中花11(ZH11),种植于山东农业大学岱宗校区温室中,温度28℃,相对湿度70%,光暗循环为16h/8h。
1.2 Rhi-milR9829-5p超量表达载体的构建
参考前人研究[15],以pNW55载体为模板,利用PCR引物OE9829F/primerⅡ、PrimerⅠ/primerⅣ、PrimerⅢ/OE9829R(见表1)分别扩增三段PCR产物,再用引物OE9829F/OE9829R通过融合PCR扩增得到555bp片段,用限制性内切酶KpnI和BamHI进行双酶切,酶切好的片段连接到pNW55载体上,获得过表达载体pNW55::Rhi-milR9829-5p。
1.3 立枯丝核菌接种及病斑统计
活化的立枯丝核菌置于马铃薯培养基(200g马铃薯,20g蔗糖,20g琼脂粉,加水至1L)平板上,于28℃培养3d后用打孔器在平板上打出直径为4mm的菌饼。取水稻孕穗期叶片,将叶片平铺在接种盘内,将菌饼有菌丝的一面接触水稻叶片,平铺在水稻叶片上,在接种部位喷水保湿,以利于纹枯病菌的侵染。接种3d后调查病斑长度,依据病斑长度衡量病情,调查数据进行t检验分析其显著性(Plt;0.05)。
1.4 实时荧光定量PCR检测Rhi-milR9829-5p的表达量
取Rhi-milR9829-5p成熟体过量表达的水稻转基因植株叶片,TRIzol法提取总RNA后利用试剂盒合成cDNA(康为世纪,CW2141S)。合成Rhi-milR9829-5p成熟体特异性引物并利用miRNA定量PCR试剂盒进行实时荧光定量PCR分析(康为世纪,CW2141S),。以立枯丝核菌的18SrRNA基因为内参基因,每个实验重复3次,利用ΔΔCt方法计算相对表达量。所用定量PCR仪为德国AnalytikJenaAG公司的qTOWER3。引物序列见表2。
1.5 实时荧光定量PCR检测真菌生物量
取接种纹枯病菌3天后的Rhi-milR9829-5p过量表达水稻叶片的发病部位,以接种后的中花11叶片病斑为对照,分别提取总RNA并利用逆转录酶合成cDNA,利用Rhi-18SrRNA特异性引物和基因定量PCR试剂盒进行扩增(康为世纪,CW0718M)。每个实验重复3次,利用ΔΔCt方法计算相对表达量。所用定量PCR仪为德国AnalytikJenaAG公司的qTOWER3。引物序列见表2。
1.6 Rhi-milR9829-5p靶基因预测
利用psRNA-Target网站(https://www.zhaolab.org/psRNATarget/)预测Rhi-milR9829-5p在水稻和大豆中的靶基因[16],参数设置为:目标基因数量为30个,目标片段长度为10~15NT,其余参数为psRNA-Target网站默认参数。
2 结果与分析
2.1 Rhi-milR9829-5p负调控水稻对纹枯病的抗性
为了分析Rhi-milR9829-5p在水稻与立枯丝核菌互作中的功能,我们获得了Rhi-milR9829-5p成熟体过量表达的水稻转基因植株,实时荧光定量PCR分析表明,在过量表达植株中RhimilR9829-5p的表达量显著升高(图1A)。在孕穗期对T1代转基因植株接种YWK196,接种3d后观察过量表达植株和野生型ZH11的病斑面积,发现过量表达植株发病面积更大(图1B);进一步进行病斑长度的测量和统计分析,发现与野生型相比,超量表达株系病斑长度增加了4~7cm(图1C),显著降低了水稻对纹枯病菌的抗性(Plt;0.05)。此外,在接种3天后取病斑部位检测真菌生物量,结果显示Rhi-milR9829-5p过量表达的水稻植株真菌生物量显著高于对照,推测过量表达水稻的叶片细胞坏死程度会更加严重。以上结果表明立枯丝核菌Rhi-milR9829-5p负调控水稻对纹枯病的抗性。
2.2 Rhi-milR9829-5p在水稻中的靶基因预测
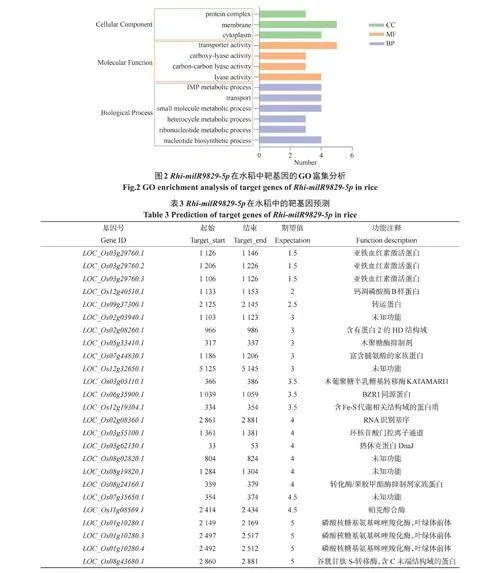
为了深入研究Rhi-milR9829-5p参与水稻—立枯丝核菌互作的分子机制,我们利用生物信息学方法对Rhi-milR9829-5p在水稻中的靶基因进行了预测。通过分析,在水稻中共预测到了25个具有Rhi-milR9829-5p结合位点的靶基因,均为100%匹配(表2)。
2.3 Rhi-milR9829-5p在水稻中靶基因的功能注释
为了明确Rhi-milR9829-5p负调控水稻纹枯病抗性的分子机制,对预测的靶基因进行了功能注释。GO富集分析显示,水稻中的25个靶基因被富集在不同的生物学过程、分子功能和细胞组分中。生物学过程主要被划分为核苷酸生物合成过程(GO:0009165)、核糖核苷酸代谢过程(GO:0009259)、杂环代谢过程(GO:0046483)、小分子代谢过程(GO:0044281)、运输过程(GO:0006810)、嘌呤核苷酸代谢过程(GO:0046040)六个过程。分子功能主要包括:酶活性(GO:0016829)、碳-碳裂解酶活性(GO:0016830)、羧基裂解酶活性(GO:0016831)和转运活性(GO:0005215)四个功能。细胞组分富集在细胞质(GO:0005737)、薄膜(GO:0016020)和蛋白质复合物(GO:0043234)三个部分(图2)。其中,靶基因LOC_Os08g43680编码一个谷胱甘肽S-转移酶,已有研究表明,谷胱甘肽S-转移酶可以增强小麦对白粉病的抗性[17],并且谷胱甘肽S-转移酶能够介导纹枯病对新型农药双苯菌胺的代谢抗性和多重抗药性[18]。此外,另一个靶基因LOC_Os12g40510编码的钙调磷酸酶亚基B蛋白(OsCBL2)是能够感知细胞内Ca2+浓度变化,参与植物对外界逆境的应答、生长发育调节和信号传导等重要过程。并且前人研究发现CBL与CBL互作激酶(CIPK)形成CBL-CIPK复合体,从而影响白粉菌对小麦的侵染作用[19]。这些结果表明,立枯丝核菌Rhi-milR9829-5p可能通过靶向调控水稻的靶基因进而调控自身致病力。
2.4 Rhi-milR9829-5p在大豆中的靶基因预测
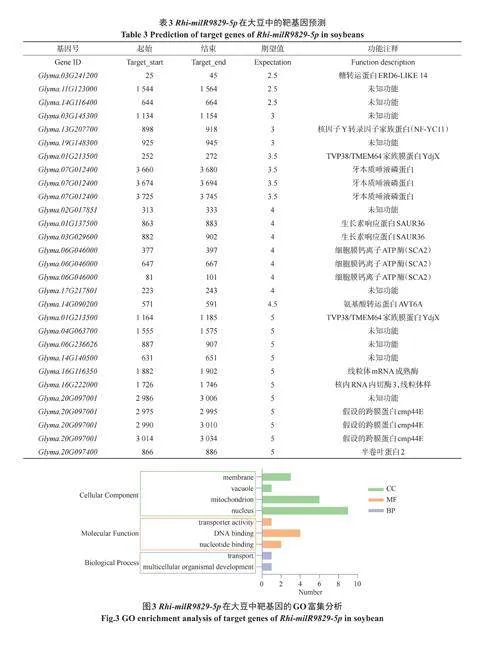
立枯丝核菌能够侵染大豆引起大豆立枯病、根腐病等。由于真菌miRNA对作物抗病性的调控具有高度保守性,因此,为了了解RhimilR9829-5p在立枯丝核菌—大豆互作过程中的调控作用,我们对Rhi-milR9829-5p在双子叶植物大豆中的靶基因进行了生物信息学预测并鉴定到29个潜在的靶基因,均为100%匹配(表3)。
2.5 Rhi-milR9829-5p在大豆中靶基因的功能注释
为了进一步确定Rhi-milR9829-5p参与立枯丝核菌—大豆的互作过程,我们对Rhi-milR9829-5p在大豆中预测得到的靶基因进行了GO富集分析,发现只有Glyma.01g137500和Glyma.03g241200两个基因可被富集到GO的生物学过程,分别为运输过程和细胞器发育。靶基因的分子功能被富集在转运活性(GO:0005215)、核苷酸结合(GO:0000166)和DNA结合(GO:0003677)三个部分。根据GO富集分析的结果发现,富集到的靶基因在细胞核(GO:0005634)、线粒体(GO:0005739)、薄膜(GO:0016020)和液泡(GO:0005773)中发挥功能(图3)。
在已有研究表明,Rhi-milR9829-5p在大豆中的靶基因Glyma.06G046000编码一个质膜Ca2+-ATP酶(SCA2),有研究表明钙信号可以协调植物-微生物相互作用,钙(Ca2+)作为重要的第二信使,将微生物信号的感知与植物中建立免疫和共生反应之间的联系,植物通过质膜定位的模式识别受体来区分不同的微生物,被不同的细胞内结合蛋白感知,促进下游防御相关基因的表达,参与调控植物免疫[20]。靶基因Glyma.13G207700编码一个核因子Y转录因子家族蛋白(NF-YC)。在水稻中,NF-YC转录因子家族成员OsHAP2E能够提高水稻对稻瘟病的抗性[21],推测NF-YC转录因子能够在单、双子叶植物的抗病过程中均发挥作用。
3 讨论
miRNA是一段短小的非编码RNA,对生物体内各个生物学过程的调控发挥着至关重要的作用。近年来,miRNA的跨物种调控功能已被广泛研究和认可。在病原菌与植物互作过程中,miRNA可通过多种方式实现跨物种调控[22]。一方面,丛枝菌根真菌可释放miRNA或其他RNA到寄主植物细胞中,干扰植物基因表达,促进病原菌对植物的侵染[23]。另一方面,植物也可产生miRNA来调节其对病原真菌的响应[24]。这种miRNA介导的跨物种调控可通过靶向病原菌基因表达进而抑制其生长,或通过调控植物靶基因来影响植物的抗病反应以增强免疫能力。本研究通过将立枯丝核菌Rhi-milR9829-5p成熟体在水稻中进行过量表达,发现Rhi-milR9829-5p能够负调控水稻的抗病性,并且Rhi-milR9829-5p能够跨界调控水稻和大豆的靶基因,进一步证实了miRNA在病原菌—植物互作中的跨界调控功能,为理解病原菌侵染机制和植物抗病机制提供了新的视角和研究方向。
miRNA在不同层次的免疫中起作用,包括病原体相关的模式触发的效应器触发的免疫[25]。课题组在之前的研究中,鉴定到一个参与植物-微生物互作的立枯丝核菌milRNA,命名为RhimilR9829-5p。本研究的结果表明,在水稻品种ZH11中过量表达Rhi-milR9829-5p时,水稻对纹枯病的抗性显著减弱。已有研究表明,抑制水稻Osa-miR444.2的表达可通过植物激素途径提高水稻对纹枯病的抗性[8],这与我们的结论相似,说明多数miRNA参与植物-微生物互作的途径,并且负调控水稻对纹枯病的抗性。
立枯丝核菌对单、双子叶植物的致病机理存在显著差异。在单子叶植物水稻中,RhimilR9829-5p被预测能够靶向LOC_Os08g43680基因,该基因编码谷胱甘肽S-转移酶。而在双子叶植物大豆中,Rhi-milR9829-5p的靶基因包括Glyma.06G046000,该基因编码质膜Ca2+-ATP酶(SCA2)。这些靶点的差异可能反映了立枯丝核菌在不同植物类型中的致病机理是不同的。在水稻中,由于靶向的部分基因编码谷胱甘肽S-转移酶,可能会影响水稻细胞内的氧化还原平衡或细胞信号传导途径,从而增加植物对立枯丝核菌侵染的敏感性[26]。而在大豆中,靶向的基因编码质膜Ca2+-ATP酶,可能与钙离子信号传导有关,进一步调节了植物对立枯丝核菌的抗性或感受性[24]。这种差异性的靶向机制揭示了立枯丝核菌在不同植物宿主中致病的复杂性,为理解其病原性与宿主互作提供了重要线索。
miRNA是与靶向mRNA结合并影响结合mRNA的稳定性或翻译效率的调节性RNA分子[27]。因此,我们通过生物信息学分析预测RhimilR9829-5p在水稻和大豆中的靶基因,值得注意的是,对这些靶基因进行GO富集分析发现其中多个基因被注释为与植物免疫密切相关,并且通过核苷酸生物合成过程、小分子代谢过程、运输和多细胞生物发育等多个途径参与调节植物免疫,说明Rhi-milR9829-5p在生物胁迫中起着至关重要的作用,Rhi-milR9829-5p是一个广谱抗性的调节因子。然而,Rhi-milR9829-5p如何调节靶基因来激活植物免疫应答的机理需要进一步的研究。
4 结论
针对课题组前期鉴定到的参与调控纹枯病抗性的立枯丝核菌Rhi-milR9829-5p,构建了RhimilR9829-5p成熟体的过量表达载体并在水稻ZH11中进行遗传转化,获得了Rhi-milR9829-5p过量表达的转基因水稻植株,接种纹枯病菌后发现过表达植株对纹枯病菌的抗性显著降低。通过生物信息学方法预测了Rhi-milR9829-5p在水稻和大豆中的靶基因,其中水稻中共有25个靶基因,大豆中共得到29个靶基因,通过基因功能注释和GO富集分析将这些靶基因富集在核苷酸生物合成过程、小分子代谢过程、运输和多细胞生物发育等多个途径中,说明Rhi-milR9829-5p在立枯丝核菌侵染水稻和大豆时可以通过调控多种生物学过程参与激活植物免疫反应。同时,RhimilR9829-5p在水稻和大豆中的靶基因也参与了不同的生物学过程,推测其在水稻中可能通过细胞内的氧化还原反应而影响抗病性,而在大豆中更可能通过钙离子信号转导来影响抗病性。总之,本研究为揭示miRNA了在立枯丝核菌与水稻、大豆互作过程中的调控作用,为解析纹枯病的致病机制、提高植物抗病性提供了新的见解。
