利用双重实时荧光重组酶辅助扩增技术快速检测肉制品中鼠源性成分
2024-10-09刘明明周朝旭颜海燕田碧英李根容



摘 要:为实现肉制品中大鼠和小鼠源性成分的同步检测,基于实时荧光重组酶辅助扩增(real-time recombinase-aided amplification,Rt-RAA)技术,以大鼠COX3基因和小鼠16S rRNA基因序列保守区域为靶标,分别设计相应的Rt-RAA引物和探针,通过反应参数的优化确定最佳双重Rt-RAA检测反应条件。进一步对建立的双重Rt-RAA检测方法进行特异性、灵敏度及稳定性评估,并应用该方法对模拟市售肉制品进行检测。结果表明,所建立的双重Rt-RAA检测方法特异性强、稳定性好,大鼠和小鼠源性成分的检出限分别为0.5%和0.2%,同步检测2 种源性成分检出限为0.5%,同步检测混合模拟市售样品检出限仍低至0.5%,双重Rt-RAA与实时荧光定量聚合酶链式反应对市售样品和模拟样品检测结果高度一致。因此,本研究建立的双重Rt-RAA检测方法适用于大鼠和小鼠源性成分的检测,为肉制品掺假检测提供了一种快捷、高效及准确的新方法。
关键词:大鼠;小鼠;肉制品;实时荧光重组酶辅助扩增技术;肉制品掺假
Rapid Detection of Mouse-Derived Components in Meat Products by Duplex Real-Time Recombinase-Aided Amplification
LIU Mingming, ZHOU Zhaoxu, YAN Haiyan, TIAN Biying, LI Genrong*
(National Center of Quality Supervision & Inspection Agricultural Processed Products and Condiments,
Chongqing Academy of Metrology and Quality Inspection, Chongqing 400020, China)
Abstract: In this study, real-time recombinase-aided amplification (Rt-RAA) was used for the synchronous detection of rats- and mice-derived components in meat products. Primers and probes targeting the conserved sequences of the COX3 gene in rats and those of the 16S rRNA gene in mice were designed. The reaction parameters were optimized to establish the optimal reaction conditions for duplex Rt-RAA detection. Furthermore, the specificity, sensitivity and stability of the established duplex Rt-RAA method were evaluated, and it was applied to simulated commercial meat products. The results showed that this method had strong specificity and stability. The detection limits for rats- and mice-derived components were 0.5% and 0.2%, respectively. The detection limits for their synchronous detection were both 0.5%, and the detection limits for synchronous detection of rats- and mice-derived components mixed in simulated commercial meat samples were still as low as 0.5%. Using duplex Rt-RAA and real-time fluorescence quantitative polymerase chain reaction (real-time PCR), highly consistent results were obtained for commercially available samples and simulated samples. Therefore, the duplex Rt-RAA method is suitable for the detection of rats- and mice- derived components in meat products, providing a fast, efficient, and accurate new method for the detection of meat product adulteration.
Keywords: rats; mice; meat products; real-time recombinase-aided amplification; meat product adulteration
DOI:10.7506/rlyj1001-8123-20240522-122
中图分类号:TS251.7 文献标志码:A 文章编号:1001-8123(2024)09-0015-06
引文格式:
刘明明, 周朝旭, 颜海燕, 等. 利用双重实时荧光重组酶辅助扩增技术快速检测肉制品中鼠源性成分[J]. 肉类研究, 2024, 38(9): 15-20. DOI:10.7506/rlyj1001-8123-20240522-122. http://www.rlyj.net.cn
LIU Mingming, ZHOU Zhaoxu, YAN Haiyan, et al. Rapid detection of mouse-derived components in meat products by duplex real-time recombinase-aided amplification[J]. Meat Research, 2024, 38(9): 15-20. DOI:10.7506/rlyj1001-8123-20240522-122. http://www.rlyj.net.cn食品掺假是指在未注明标签的情况下,添加或减少某些改变食品成分、影响营养价值甚至不被社会接受的物质[1]。目前,肉制品是提供人体氨基酸和蛋白质等必需营养物质的重要来源之一,随着国内外生活水平的不断提升,其消耗量逐年递增,一些制造商为追逐更高利润,用廉价肉代替或掺入优质肉类但并未注明标签进行销售,如在牛肉产品中掺加马肉和猪肉[2]、羊肉产品中掺加鼠肉[3]等。故肉类掺假不仅使消费者利益受损,且威胁健康,特别是鼠肉,因鼠类对生存环境要求较低,常携带大量病毒,且可能食用毒鼠药物中毒[4]。因此,不真实的肉制品标签可能避开检验检疫,使人畜共患的病毒传入人体,造成严重的公共卫生风险[5]。虽然我国的食品安全监管部门对于肉类掺假方面严格筛查,但相应的检测标准仍有待完善[6],尤其是鼠肉这种特殊成分的鉴定。此外,现有的检测方法难以满足肉类快速消费下大批量产品的检测需求。因此,亟需建立快速、有效、准确和高通量的检测技术,以防止掺假肉制品的非法销售。
脱氧核糖核酸(deoxyribonucleic acid,DNA)是大多数生物体的遗传物质,相比于蛋白质具有更高的稳定性和特异性,因此基于DNA的聚合酶链式反应(polymerase chain reaction,PCR)技术在现有的肉类掺假检测方法中应用最为广泛[7],如传统PCR、实时荧光定量PCR(real-time fluorescence quantitative PCR,real-time PCR)和数字PCR(digital PCR,dPCR)等[8-9]。传统PCR技术具有操作简单、成本低廉的优点,但其检测时间长且不能定量分析。虽然real-time PCR和dPCR实现了实时定量或定性检测,但其设备昂贵,对人员专业程度要求较高[10-11]。近年来,随着等温扩增技术的发展,如环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术已被应用于加工肉制品中肉的种类鉴定[12],该技术在恒温条件下可扩增目标DNA,但需4~6 条扩增引物,易出现假阳性,且扩增时间长(1 h以上)[13]。
实时荧光重组酶辅助扩增(real-time recombinase- aided amplification,Rt-RAA)作为近年来新兴的扩增技术,克服了传统PCR等PCR技术检测时间长且需依赖变温仪器的缺点,在恒温条件下即可实时快速扩增目的DNA[14]。此外,相比于LAMP,Rt-RAA仅需1 对引物和1 条中间修饰的探针,避免了因引物二聚体导致的假阳性。因其具有恒温、快速、准确及操作简便的优点,在本研究中基于Rt-RAA检测技术建立同步鉴定大鼠、小鼠源性成分的检测方法,并评估其特异性、灵敏度和稳定性,实现这2 种成分在肉制品中的快速检测,旨在为肉类掺假提供更有效的检测方法。
1 材料与方法
1.1 材料与试剂
大鼠、小鼠活体购自广东省医学实验动物中心。鸭肉、牛肉、马肉、羊肉、猪肉、鸡肉、鹅肉购自当地(重庆)超市,除马肉外其他通过外观确认。马肉与购自京东和淘宝的骆驼肉、马鹿肉、梅花鹿肉、驴肉的真实性通过相关检测标准进行鉴定。
RAA荧光核酸扩增试剂盒 杭州众测生物科技有限公司;通用型核酸提取试剂盒 成都TaKaRa公司。
1.2 仪器与设备
JXFSTPRP-32组织研磨仪 上海净信实业发展有限公司;CFX96 Touch荧光定量PCR仪 美国Bio-Rad公司;Nanodrop ONEc超微量分光光度计 美国Thermo Scientific公司;ME403千分之一电子天平 瑞士Mettler Toledo公司;GR85DA高压灭菌锅 致微(厦门)仪器有限公司。
1.3 方法
1.3.1 样品处理
羊肉、猪肉、牛肉作为日常食用的肉类,并且为红肉,与鼠肉相似,故本研究将此3 种鲜肉充分粉碎混合作为后续实验样本基底肉(以下称基底肉)。将基底肉与大鼠和小鼠肉按照不同的质量比进行混合,以确定混合肉制品中大鼠和小鼠源性成分检出限。
实际的深加工或熟肉制品(如肉串、火腿肠等)中,通常存在多种肉混合的情况。为了模拟检测市售深加工或熟肉制品,将新鲜的羊肉、猪肉、牛肉与大鼠和小鼠肉按照不同的质量比进行混合,并通过高压灭菌锅121 ℃、20 min进行高压蒸熟处理。
1.3.2 样本DNA提取
参考试剂盒使用说明书进行提取,取25~100 mg组织样本置于含钢珠的离心管中,将裂解液加入其中进行充分研磨,随后加入相应的蛋白酶和RNA酶于56 ℃水浴锅中至样品组织完全溶解,后续通过吸附、离心、洗涤和洗脱得到总基因组DNA。采用超微量分光光度计在260 nm和280 nm波长处测定DNA浓度和纯度,将纯度(A260 nm/A280 nm)为1.7~1.9的样本基因组DNA稀释至约150 ng/mL,并于-20 ℃保存,备用。
1.3.3 双重Rt-RAA引物、探针设计与合成
基于小鼠16S rRNA基因序列(序列号:GU332589.2)和大鼠细胞色素c氧化酶亚基III(cytochrome c coxidase subunit III,COX3)基因(基因ID:26204),根据Rt-RAA引物和探针设计原则,使用Snap Gene软件设计大鼠、小鼠特异性引物各1 对,从引物区间扩增子序列区域设计RAA探针各1 条(表1)。引物和探针均由北京擎科生物科技有限公司合成。
1.3.4 大鼠和小鼠双重Rt-RAA检测条件
首先对双重Rt-RAA方法的引物和探针浓度、反应温度等检测条件进行测试与优化。通过Rt-RAA核酸扩增试剂(荧光型)说明书运行程序,测试双重Rt-RAA反应体系中不同的引物和探针浓度,最终优化得到最佳反应体系包括400 nmol/L COX3-F、-R引物,200 nmol/L COX3-P探针,200 nmol/L 16S rRNA-F、-R引物,60 nmol/L
16S rRNA-P探针,25 μL水化缓冲液,2.5 mL MgAc缓冲溶液(280 mmol/L),DNA模板各1 μL,用双蒸水补齐至50 μL。在此体系下,设置31~41 ℃的温度梯度进行反应,最终确立39 ℃为最佳反应温度。每组实验设置3 个平行。
双重Rt-RAA检测条件反应程序为:30 s/循环,40 个循环。
1.3.5 双重Rt-RAA特异性实验
按照1.3.4节确立的最终双重Rt-RAA检测条件,对建立的方法进行特异性验证实验,以提取的鸭肉、牛肉、马肉、羊肉、猪肉、鸡肉、鹅肉、骆驼肉、马鹿肉、梅花鹿肉及驴肉DNA为特异性实验验证的非目标扩增序列,以大鼠肉和小鼠肉的DNA为阳性对照,并用双蒸水作为空白对照,以确定所建立方法的特异性。
1.3.6 双重Rt-RAA灵敏度实验
将大鼠肉和小鼠肉分别与基底肉混合,制成大鼠肉和小鼠肉质量分数均分别为20%、10%、5%、2%、1%、0.5%、0.2%、0%的2 组混合模拟样品,按照1.3.2节提取DNA,按照1.3.4节最佳反应条件及反应程序进行恒温扩增,以确定所建立的方法分别对大鼠肉、小鼠肉的检测灵敏度和同步检测大鼠肉、小鼠肉的灵敏度,并与BJS 201904《食品中多种动物源性成分检测实时荧光PCR法》中real-time PCR方法检测灵敏度进行对比。
1.3.7 双重Rt-RAA稳定性实验
以1.3.6节确定的大鼠肉、小鼠肉的检出限进行6 次平行实验,按照1.3.4节最佳反应条件及反应程序进行双重Rt-RAA扩增,以确定该检测方法的稳定性。
1.3.8 模拟市售样品实验
按照1.3.1节方法制备1.3.6节质量比模拟样品,制得同时含有大鼠肉和小鼠肉且各自所占质量分数分别为10%、5%、2%、1%、0.5%、0.2%、0%的7 种混合模拟市售熟肉制品,按照1.3.2节提取DNA,按照1.3.4节最佳反应条件及反应程序进行扩增,以确定该方法对实际样品中大鼠肉、小鼠肉同步检检测的可靠性。
1.3.9 市售样品和模拟样品实验
在烧烤店和烧烤摆位购买25 份样品,按照1.3.1节方法制作模拟样品,大鼠、小鼠肉质量分数均为0.5%。按照1.3.2节提取DNA,利用本研究建立的双重Rt-RAA方法和real-time PCR方法进行鼠源性成分检测,对比分析并评价实验结果。
1.4 数据处理
采用PowerPoint软件作图。采用Excel软件进行数据处理,实验结果以±s表示。
2 结果与分析
2.1 双重Rt-RAA检测条件的建立与优化
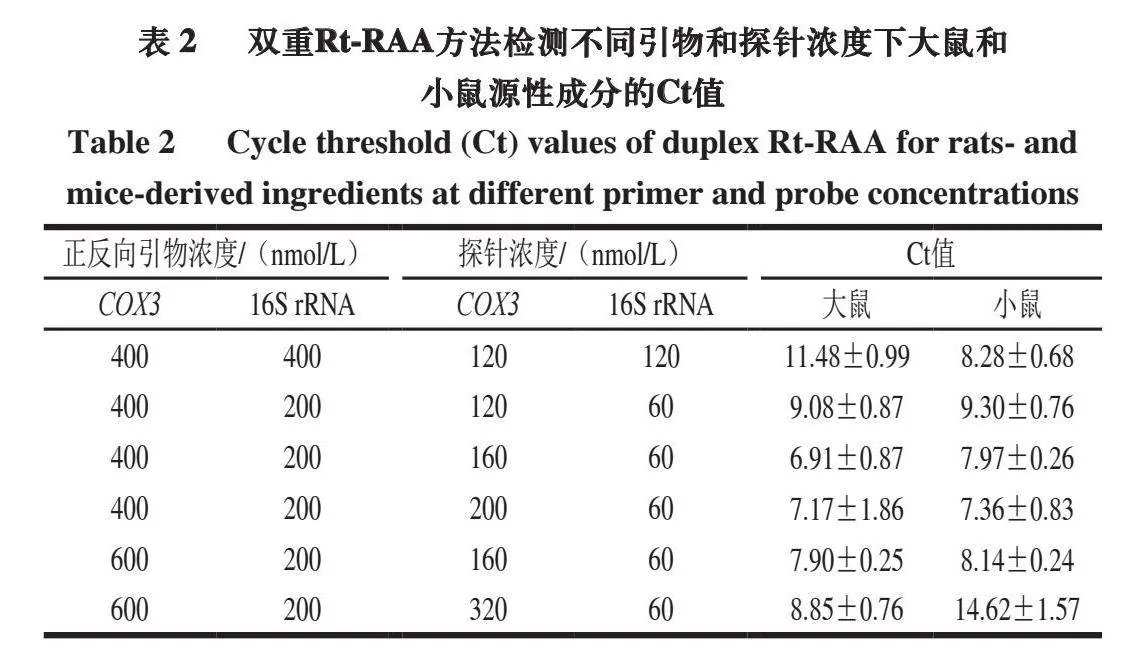
本研究主要对引物和探针浓度进行优化,最大限度地提高双重Rt-RAA检测方法扩增效率。如表2所示,在双重反应体系中大鼠和小鼠的引物(400 nnmol/L)和探针(120 nmol/L)浓度相同的条件下,小鼠的荧光扩增曲线对大鼠的荧光扩增曲线表现出一定的抑制。因此,通过降低小鼠的引物和探针浓度,并增加大鼠的引物和探针浓度,对双重扩增体系进行优化。最终确定小鼠的引物和探针浓度分别为200 nmol/L和60 nmol/L,大鼠的引物和探针浓度分别为400 nmol/L和200 nmol/L,并得到双重Rt-RAA最佳检测循环阈(cycle threshold,Ct)值。
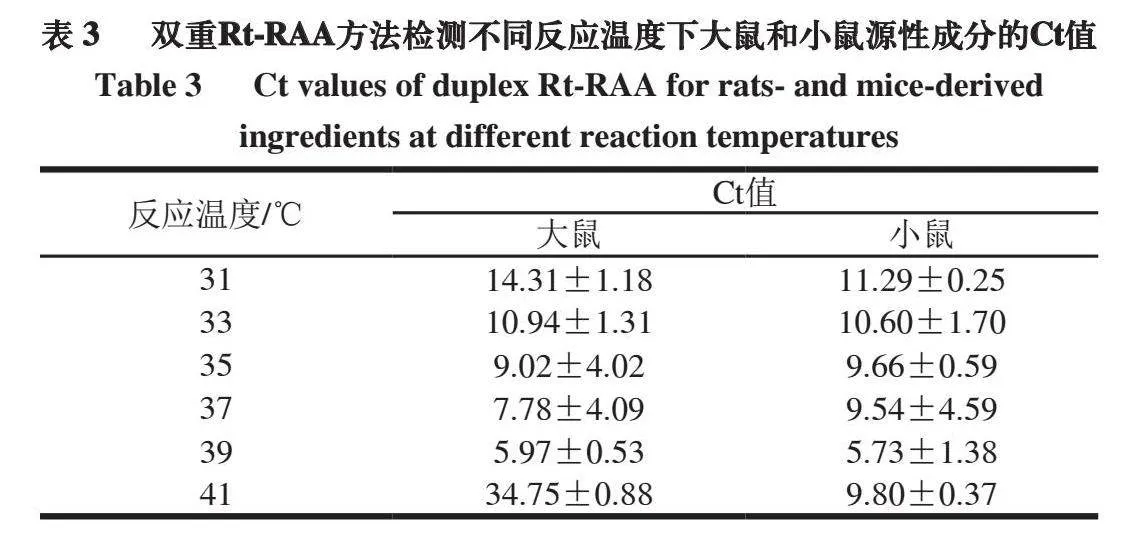
为了优化双重Rt-RAA检测方法反应温度,在31~41 ℃进行温度梯度实验。如表3所示,在31~39 ℃,随着温度的升高,检测大鼠和小鼠的Ct值逐渐降低。在41 ℃时,荧光扩增曲线则呈现出延迟,其中大鼠延迟幅度最大。因此,为了使双重Rt-RAA方法实现快速检测,将39 ℃作为最佳反应温度。
2.2 双重Rt-RAA的检测特异性
按照优化的检测条件对双重Rt-RAA方法进行特异性验证。如图1所示,提取的鸭肉、牛肉、马肉、羊肉、猪肉、鸡肉、鹅肉、骆驼肉、马鹿肉、梅花鹿肉及驴肉等非目标DNA和空白对照均未出现扩增,只有大鼠和小鼠样品DNA出现了扩增曲线,表明双重Rt-RAA检测方法具有良好的特异性。
2.3 双重Rt-RAA的检测灵敏度
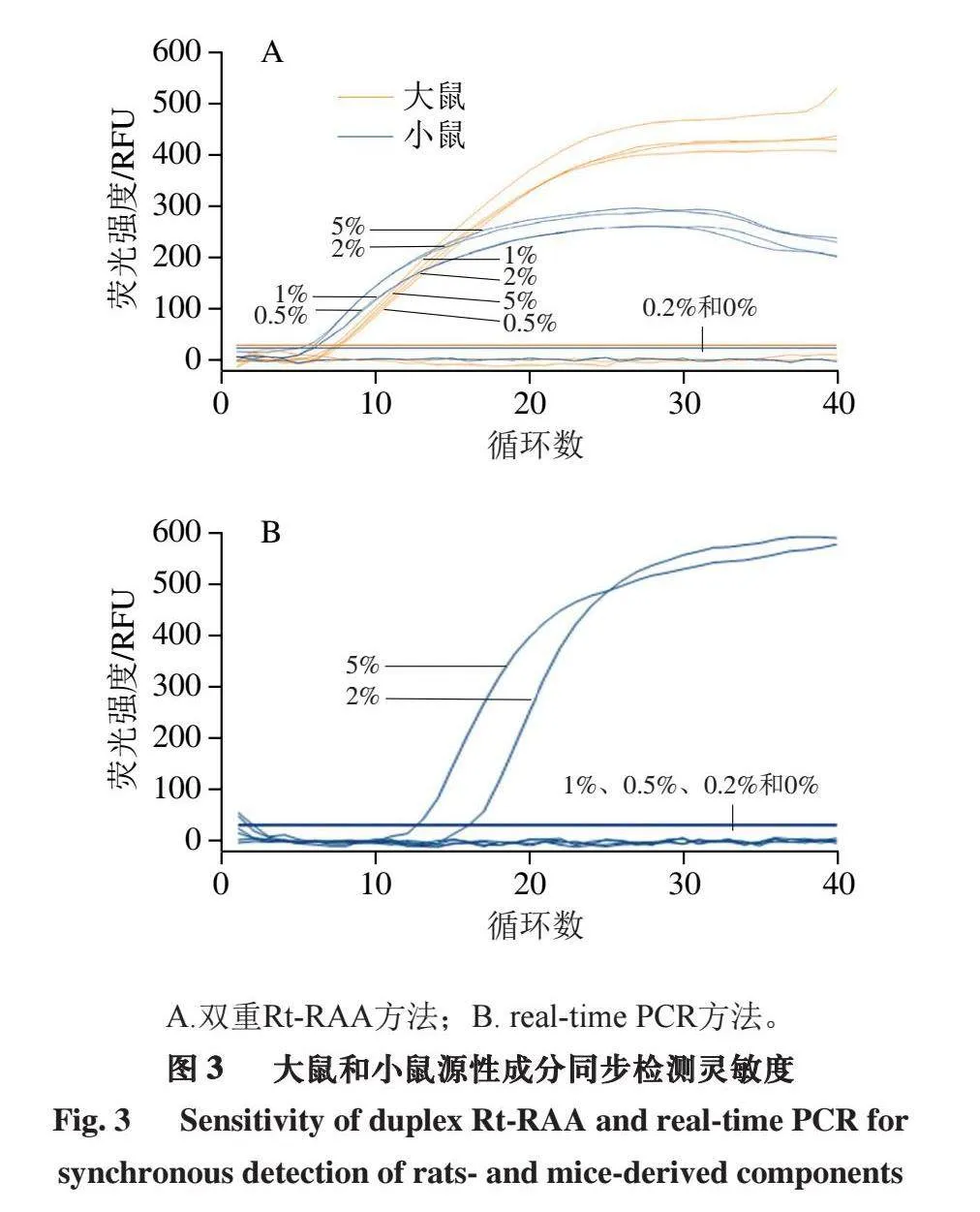
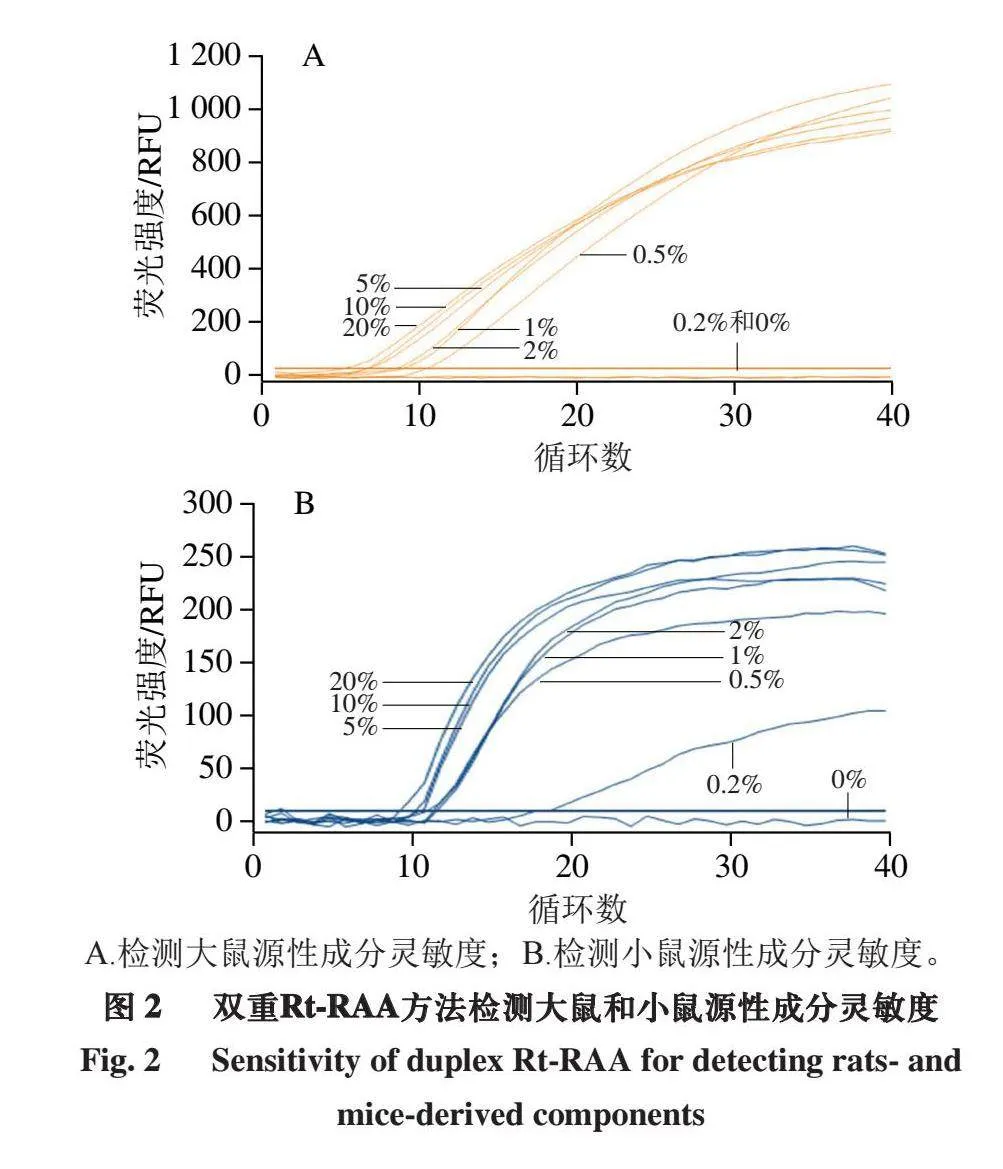
如图2所示,大鼠和小鼠源性成分的检测灵敏度分别为0.5%和0.2%。
A.检测大鼠源性成分灵敏度;B.检测小鼠源性成分灵敏度。
根据其检测灵敏度,仍以羊肉、猪肉、牛肉粉碎混合作为基底肉,制备同时含有大鼠肉和小鼠肉,其质量分数均分别为5%、2%、1%、0.5%、0.2%、0%的6 种混合样品,结果表明,利用双重Rt-RAA方法同步检测大鼠和小鼠源性成分的灵敏度仍低至0.5%(图3A),real-time PCR方法检测灵敏度则为2%(图3B)。表明本研究建立的鼠源性双重Rt-RAA检测方法灵敏度较传统的real-time PCR检测方法得到进一步的提升,为检测更低质量比鼠源性成分提供了新的方法。
A.双重Rt-RAA方法;B. real-time PCR方法。
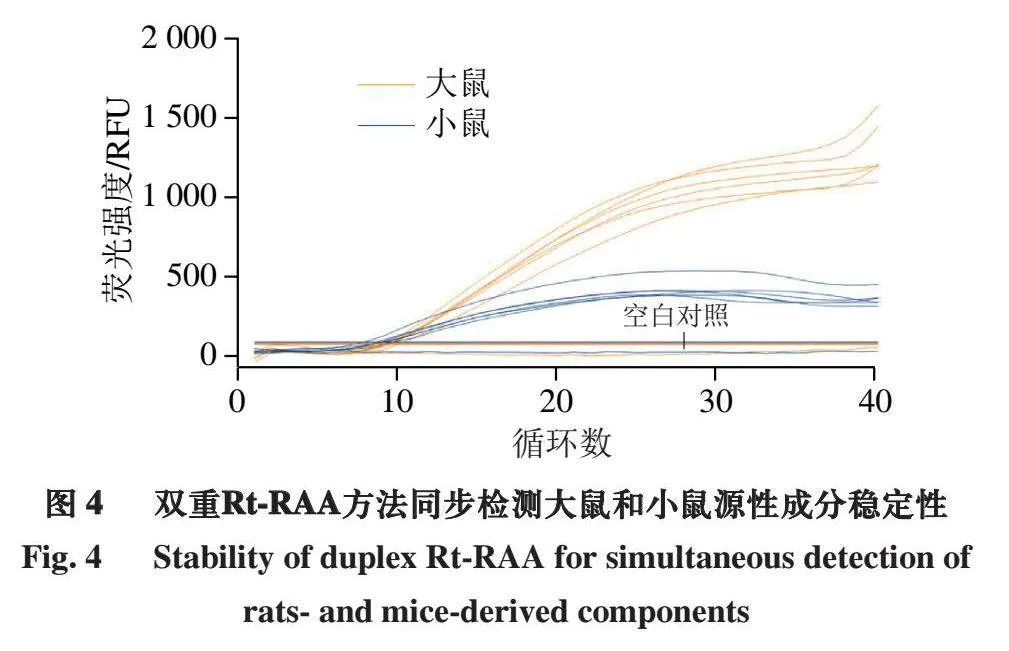
2.4 双重Rt-RAA的检测稳定性
为了确定双重Rt-RAA方法同步检测大鼠和小鼠源性成分的稳定性,本研究对同时含有大鼠肉与小鼠肉且各自所占质量分数均为0.5%的模拟样品进行同步检测。如图4
所示,对设置的6 个平行,均能同步扩增出大鼠和小鼠DNA,表明所建立的双重Rt-RAA方法具有良好的稳定性。
2.5 模拟市售样品测定结果
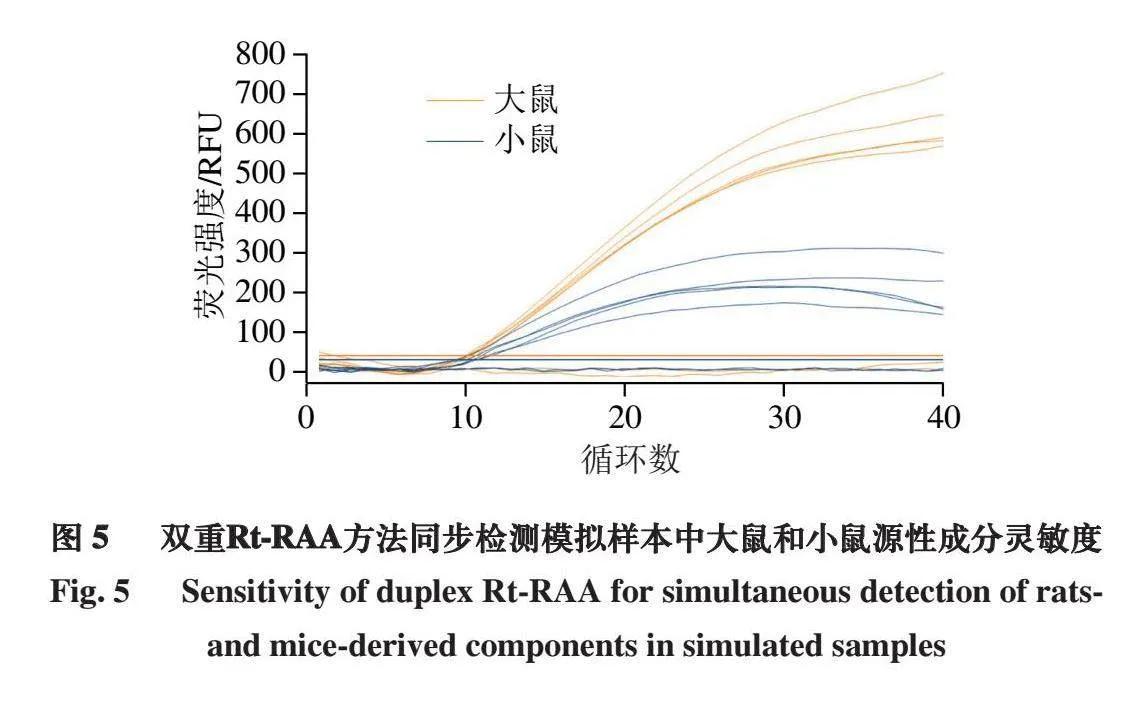
如图5所示,本方法对于大鼠肉和小鼠肉质量分数为0.5%的混合模拟市售熟肉制品仍能检出大鼠和小鼠源性成分。因此,表明本研究所建立的双重Rt-RAA方法可用于实际检测。
2.6 市售样品和模拟样品测定结果
为进一步验证本研究所建立的检测方法的适用性,用双重Rt-RAA方法和BJS 201904中real-time PCR方法对25 份市售样品进行检测,结果高度一致,如表4所示。由于检出阳性样本数较少,在实验中增加了模拟样品进行对比检测,2 种方法检测结果符合率为100%。
3 讨论与结论
在经济利益的驱使下,肉制品掺假屡禁不绝,不仅给消费者带来经济损失,且可能会对身体造成危害和引发疫病传染风险[15]。从欧洲的“马肉风波”至近年来被曝光的亚洲“鼠肉丑闻”事件,肉制品的掺假问题已经成为社会公众关注的焦点。随着科学技术不断发展,其掺假检测技术也在不断趋于完善。DNA作为绝大多数生物体遗传物质,具有高稳定性和保守性的特点,基于此建立的PCR检测技术[16]、real-time PCR检测技术[17]及等温扩增技术[18]等逐渐成为动物源性成分检测的国家标准或行业标准。目前,Ahamad等[19]建立多重PCR以区分兔肉、大鼠肉和松鼠肉。Suryawan等[20]基于细胞色素b(Cytb)基因开发了单重PCR方法,特异性检出印尼牛肉丸中的大鼠源性成分。王学政等[21]同样通过Cytb基因序列,设计针对鼠源性成分的荧光PCR法特异性引物。Duan Siqi等[4]建立并验证一种基于物种特异性PCR技术快速鉴别肉制品中鼠肉真伪的试剂盒。陈珍金等[22]分别开发了大鼠和小鼠源性成分的LAMP检测技术,用于羊肉制品中鼠源性成分的检测。然而,基于双重Rt-RAA技术同步检测大鼠和小鼠源性成分的技术鲜见报道。
鼠类是一种啮齿类哺乳动物,繁殖速度快、数量多,对生存环境要求低,生命力强。常携带流感病毒、冠状病毒及尼帕病毒等[23],严重威胁消费者健康。鼠肉为红肉,掺入可食用的肉及肉制品中难以通过外观判断。此外,复杂的样品基质相互干扰,对于检测的准确度和特异性同样产生严重的影响。随着人们对于肉制品的需求不断增加,已报道的鼠源性成分检测方法难以满足大批量的检测。
Rt-RAA是一种基于重组酶、DNA聚合酶及单链DNA结合蛋白3 种关键因子,在恒温条件下通过核酸外切酶(exonuclease,exo)探针实时监测特定DNA扩增过程的检测技术[24-25],exo探针含有与四氢呋喃(tetrahydrofuran,THF)残基紧密相连的内部荧光基团和猝灭基团[26]。当exo探针与目标序列相结合时,连接荧光基团与猝灭基团THF被切断,进而产生荧光,该荧光可以被常规的荧光定量仪器所检测,降低了Rt-RAA检测技术对仪器的要求。Rt-RAA检测技术具有简单、快速、特异性强和灵敏度高的优点[27]。相对于实时荧光重组酶聚合酶扩增(real-time recombinase polymerase amplification,Rt-RPA)检测技术,Rt-RAA重组酶从细菌或真菌中获得,来源范围广、成本低,且是我国自主研发的新型核酸扩增技术,而Rt-RPA重组酶则来自于T4噬菌体,来源范围窄、获取成本高[28-29]。因此,本研究基于大鼠的COX3基因和小鼠的16S rRNA基因序列建立双重Rt-RAA反应检测体系。实验结果表明,所建立的双重Rt-RAA特异性强、稳定性好,双重体系分别检测大鼠和小鼠源性成分的检出限分别为0.5%和0.2%,同步检测2 种源性成分检出限低至0.5%,并在模拟熟肉制品中同步检出限仍为0.5%,明显优于real-time PCR方法检测灵敏度。双重Rt-RAA方法与real-time PCR方法对市售样品和模拟样品检测结果具有高度一致性,符合率为100%。
与陈珍金等[22]建立的LAMP检测方法实验结果相比,Rt-RAA方法可在39 ℃恒温条件下30 min内完成检测,而LAMP方法则需要63 ℃恒温条件、45 min才能完成检测。同时,Rt-RAA检出限与LAMP检测大鼠和小鼠的检出限基本相当。此外,Rt-RPA检测方法并未出现交叉反应,通过6 次平行实验验证,本研究建立的检测方法具有很好的稳定性。因此,本研究建立的双重Rt-RAA检测方法适用于肉制品中大鼠和小鼠源性成分的快速检测,为现场快速检测肉制品掺假提供了另一条快捷、实用的检测方法。
参考文献:
[1] HAJI A, DESALEGN K, HASSEN H. Selected food items adulteration, their impacts on public health, and detection methods: a review[J]. Food Science & Nutrition, 2023, 11(12): 7534-7545. DOI:10.1002/fsn3.3732.
[2] WALKER M, BURNS M, BURNS D. Horse meat in beef products-species substitution 2013[J]. Journal of the Association of Public Analysts, 2013, 41: 67-106.
[3] AMARAL J S, SANTOS G, OLIVEIRA M B P P, et al. Quantitative detection of pork meat by EvaGreen real-time PCR to assess the authenticity of processed meat products[J]. Food Control, 2017, 72: 53-61. DOI:10.1016/j.foodcont.2016.07.029.
[4] DUAN S Q, AI J X, SUN L Y, et al. Development and validation of a rapid kit for authenticity of murine meat in meat products with a species-specific PCR assay[J]. Food Additives & Contaminants Part A: Chemistry, Analysis, Control, Exposure & Risk Assessment, 2020, 37(4): 552-560. DOI:10.1080/19440049.2020.1718218.
[5] NAAUM A M, SHEHATA H R, CHEN S, et al. Complementary molecular methods detect undeclared species in sausage products at retail markets in Canada[J]. Food Control, 2018, 84: 339-344. DOI:10.1016/j.foodcont.2017.07.040.
[6] 李欣南. 基于核酸分子检测的肉类源性成分快速鉴别技术的开发与应用[D]. 沈阳: 中国医科大学, 2018.
[7] CHEN A L, WEI C B, CHEN G, et al. Duplex PCR approach for the detection and quantification of donkey, horse and mule in raw and heat-processed meat products[J]. International Journal of Food Science &
Technology, 2015, 50(3): 834-839. DOI:10.1111/ijfs.12720.
[8] 梁子英, 刘芳. 实时荧光定量PCR技术及其应用研究进展[J]. 现代农业科技, 2020, 6(1): 1-3; 8.
[9] QUAN P L, SAUZADE M, BROUZES E. dPCR: a technology review[J]. Sensors, 2018, 18(4): 1271. DOI:10.3390/s18041271.
[10] HARSHITHA R, ARUNRAJ D R. Real-time quantitative PCR: a tool for absolute and relative quantification[J]. Biochemistry and Molecular Biology Education, 2021, 49(5): 800-812. DOI:10.1002/bmb.21552.
[11] BALTRUŠIS P, HÖGLUND J. Digital PCR: modern solution to parasite diagnostics and population trait genetics[J]. Parasites & Vectors, 2023, 16(1): 143. DOI:10.1186/s13071-023-05756-7.
[12] CHO A R, DONG H J, CHO S. Meat species identification using loop-mediated isothermal amplification assay targeting species-specific mitochondrial DNA[J]. Korean Journal for Food Science of Animal Resources, 2014, 34(6): 799-807. DOI:10.5851/kosfa.2014.34.6.799.
[13] KIM S H, LEE S Y, KIM U, et al. Diverse methods of reducing and confirming false-positive results of loop-mediated isothermal amplification assays: a review[J]. Analytica Chimica Acta, 2023, 1280: 341693. DOI:10.1016/j.aca.2023.341693.
[14] CUI H, TU F, ZHANG C, et al. Real-time reverse transcription recombinase-aided amplification assay for rapid amplification of the N gene of SARS-CoV-2[J]. International Journal of Molecular Sciences, 2022, 23(23): 15269. DOI:10.3390/ijms232315269.
[15] MOTALIB HOSSAIN M A, ALI M E, HAMID S B A, et al. Targeting double genes in multiplex PCR for discriminating bovine, buffalo and porcine materials in food chain[J]. Food Control, 2017, 73: 175-184. DOI:10.1016/j.foodcont.2016.08.008.
[16] AI J, SUN L, GAO L, et al. Development of a PCR-based assay for detection of Chinese mink tissue in meat products based on the mitochondrial DNA cytochrome-b gene[J]. Mitochondrial DNA Part B: Resources, 2019, 4(2): 2748-2750. DOI:10.1080/23802359.2018.1532828.
[17] CHEN X Y, LU L X, XIONG X H, et al. Development of a real-time PCR assay for the identification and quantification of bovine ingredient in processed meat products[J]. Scientific Reports, 2020, 10(1): 2052. DOI:10.1038/s41598-020-59010-6.
[18] 郭燕华, 陈遂, 王德莲, 等. 基于重组酶等温扩增技术快速检测生鲜肉中猪源性成分[J]. 食品安全质量检测学报, 2017, 8(6): 2012-2016.
[19] AHAMAD M N U, ALI M E, MOTALIB HOSSAIN M A, et al. Multiplex PCR assay discriminates rabbit, rat and squirrel meat in food chain[J]. Food Additives & Contaminants Part A: Chemistry, Analysis, Control, Exposure & Risk Assessment, 2017, 34(12): 2043-2057. DOI:10.1080/19440049.2017.1359752.
[20] SURYAWAN G Y, SUARDANA I W, WANDIA I N. Sensitivity of polymerase chain reaction in the detection of rat meat adulteration of beef meatballs in Indonesia[J]. Veterinary World, 2020, 13(5): 905-908. DOI:10.14202/vetworld.2020.905-908.
ad45cb2c60f6a4b2bcc3f827e32ecfcf[21] 王学政, 季福玲, 刘志胜, 等. 一种用于实时荧光PCR法检测肉制品中鼠源性成分特异性引物的研发[J]. 中国生物制品学杂志, 2018, 31(7): 775-777; 781. DOI:10.13200/j.cnki.cjb.002239.
[22] 陈珍金, 张璜, 石磊, 等. 利用LAMP技术快速检测羊肉制品中的鼠源性成分[J]. 食品科学, 2021, 42(12): 322-327. DOI:10.7506/spkx1002-6630-20201016-146.
[23] KINGSLEY D H. Emerging foodborne and agriculture-related viruses[J]. Microbiology Spectrum, 2016, 4(4). DOI:10.1128/microbiolspec.pfs-0007-2014.
[24] CHEN W X, FAN J D, LI Z Y, et al. Development of recombinase aided amplification combined with disposable nucleic acid test strip for rapid detection of porcine circovirus type 2[J]. Frontiers in Veterinary Science, 2021, 8: 676294. DOI:10.3389/fvets.2021.676294.
[25] WANG Z H, LI P, LIN X, et al. Application of portable real-time recombinase-aided amplification (Rt-RAA) assay in the clinical diagnosis of ASFV and prospective DIVA diagnosis[J]. Applied Microbiology and Biotechnology, 2021, 105(8): 3249-3264. DOI:10.1007/s00253-021-11196-z.
[26] DONG Y C, ZHOU D D, ZHANG B Z, et al. Development of a real-time recombinase-aided amplification assay for rapid and sensitive detection of Edwardsiella piscicida[J]. Frontiers in Cellular and Infection Microbiology, 2024, 14: 1355056. DOI:10.3389/fcimb.2024.1355056.
[27] FAN X X, LI L, ZHAO Y G, et al. Clinical validation of two recombinase-based isothermal amplification assays (RPA/RAA) for the rapid detection of African swine fever virus[J]. Frontiers in Microbiology, 2020, 11: 1696. DOI:10.3389/fmicb.2020.01696.
[28] 孙晓红, 后来旺, 李达容, 等. 重组酶等温扩增技术在分析检测中的应用研究进展[J]. 食品与发酵工业, 2020, 46(24): 265-270. DOI:10.13995/j.cnki.11-1802/ts.024735.
[29] WANG R P, XU S, WEI E J, et al. Recombinase-aided amplification coupled with lateral flow dipstick for efficient and accurate detection of Bombyx mori nucleopolyhedrovirus[J]. Folia Microbiologica, 2024, 69(3): 667-676. DOI:10.1007/s12223-023-01102-7.
