不同辐照处理对克氏原螯虾虾黄品质变化的影响
2024-10-09谭宏渊黄琪鲁怡婷刘煊涂子仪魏凌云乔宇
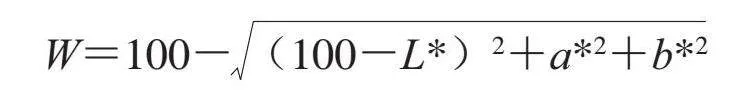


摘 要:为探究辐照杀菌对克氏原螯虾虾黄品质的影响,采用60Co γ射线辐照(6 kGy)对整虾和仅虾黄进行杀菌,以未杀菌组作为对照组,通过测定虾黄部位的色度、褐变指数、5-羟甲基糠醛含量、过氧化值、硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值、总酚及吡咯含量等理化指标,探究不同辐照处理对虾黄品质的影响。结果表明:经辐照杀菌后,整虾组与未杀菌组白度值无显著差异(P>0.05),但辐照虾黄组亮度值显著上升(P<0.05),红度值显著下降(P<0.05);辐照后虾黄在294 nm处的吸光度和褐变程度增加,但荧光强度及5-羟甲基糠醛含量下降,说明辐照会加剧美拉德反应,但也会分解反应产物;2 个辐照杀菌组的过氧化值、TBARS值、吡咯和总酚含量均高于未杀菌组,尤其是辐照整虾组显著上升(P<0.05),氧化程度更高。总体来说,辐照杀菌可以较好地维持虾黄的色泽,但也会促进其发生美拉德反应和脂质氧化,尤其是虾尾的存在更会促进这些反应进程。
关键词:克氏原螯虾虾黄;60Co辐照;美拉德反应;品质
Effect of Different Irradiation Treatments on the Quality of Crayfish Hepatopancreas
TAN Hongyuan1,2, HUANG Qi2, LU Yiting1,2, LIU Xuan2, TU Ziyi3, WEI Lingyun1,*, QIAO Yu2,*
(1. School of Environmental Ecology and Biological Engineering, Wuhan Institute of Technology, Wuhan 430205, China;
2. Institute of Agricultural Products Processing and Nuclear Agricultural Technology, Hubei Academy of Agricultural Sciences,
Wuhan 430064, China; 3. Hubei Crayfish Industry Technology Research Institute Co. Ltd., Qianjiang 433100)
Abstract: To investigate the effect of sterilization on the quality of crayfish hepatopancreas, hepatopancreas samples from whole crayfish and hepatopancreas irradiated with 60Co γ-ray (6 kGy) and non-irradiated hepatopancreas were evaluated for color, browning index, 5-hydroxymethylfurfural (5-HMF) content, peroxide value (POV), thiobarbituric acid reactive substances (TBARS) value, total phenol content, and pyrrole content. The results showed that there was no significant difference in whiteness between the irradiated whole crayfish group and the non-sterilized group (P > 0.05), but the former had significantly higher brightness (L*) and significantly lower redness (a*) value compared to the latter (P < 0.05). After irradiation, the absorbance at 294 nm and browning degree of crayfish hepatopancreas increased, but the fluorescence intensity and 5-HMF content decreased, indicating that irradiation could trigger the Maillard reaction but then decompose the reaction products. The POV, TBARs value, pyrrole content, and total phenol content of both irradiated groups were higher than those of the non-sterilized group. Notably, a significant increase in these parameters was observed for the irradiated whole crayfish group (P < 0.05) indicating a higher degree of oxidation. Overall, irradiation can maintain the color of crayfish hepatopancreas well, but also promote the Maillard reaction and lipid oxidation, especially for whole crayfish.
Keywords: crayfish hepatopancreas; 60Co irradiation; Maillard reaction; quality
DOI:10.7506/rlyj1001-8123-20240511-115
中图分类号:TS254.4 文献标志码:A 文章编号:1001-8123(2024)09-0036-06
引文格式:
谭宏渊, 黄琪, 鲁怡婷, 等. 不同辐照处理对克氏原螯虾虾黄品质变化的影响[J]. 肉类研究, 2024, 38(9): 36-41. DOI:10.7506/rlyj1001-8123-20240511-115. http://www.rlyj.net.cnTAN Hongyuan, HUANG Qi, LU Yiting, et al. Effect of different irradiation treatments on the quality of crayfish hepatopancreas[J]. Meat Research, 2024, 38(9): 36-41. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20240511-115. http://www.rlyj.net.cn克氏原螯虾(Procambarusclarkii)俗称小龙虾,因其超强的环境适应性及繁殖力,已逐步成为我国众多河湖水域的优势种群[1]。且近年来经过人工养殖发展,已遍布国内许多省市,成为我国重要的淡水经济类水产品[2]。小龙虾风味独特、肉质鲜美,具有高蛋白、低脂肪的特点,广受消费者欢迎[3]。小龙虾的虾黄也是重要的食用部位,约占小龙虾总质量的5%,具有独特的蟹黄味,富含不饱和脂肪酸、蛋白质和游离氨基酸,易被人体消化吸收[4]。刘文倩等[5]研究虾黄油脂肪酸组成,发现其脂肪酸组成与鱼油类似,尤其是多不饱和脂肪酸种类多、含量高,具有较高利用价值。然而,这些成分在为虾黄带来丰富口感和营养价值的同时,也使其更容易受到微生物的污染,进而引发一系列的生化反应,如脂质氧化等[6]。这些反应不仅会导致虾黄的营养价值下降,更会影响其食用品质和安全性[7]。
60Co辐照杀菌技术是一种利用放射性元素60Co产生的γ射线对食品进行非热杀菌的方法[8],能够在常温或低温条件下进行,避免了传统热杀菌方法对食品口感、色泽和营养成分的破坏。对于小龙虾虾黄而言,这一特点尤为重要。虾黄富含脂肪酸等营养成分,热杀菌方法可能导致其氧化和降解,而60Co辐照杀菌则能够在保持虾黄营养成分的同时有效杀灭其中的微生物。鲁怡婷等[9]比较高温高压和辐照2 种杀菌方式对小龙虾品质的影响,发现辐照对小龙虾的色泽及脂质氧化程度影响较小,而高温高压组存在明显褐变现象,且氧化程度加深。祁玉霞等[10]发现辐照杀菌可以保持烟熏鸭胸的感官和质构特性,而高温高压杀菌方式会导致产品内部结构变化程度较高,感官评分也低于辐照组,低温杀菌更有利于保持产品的食用品质。
因此,以小龙虾虾黄为研究对象,比较对整虾和仅虾黄进行辐照杀菌后的品质变化,以期为小龙虾加工产业的可持续发展提供科学依据和技术支持。
1 材料与方法
1.1 材料与试剂
冷冻克氏原螯虾尾购于湖北省绿亿园农产品有限公司。
氯化钠、三氯乙酸(trichloroacetic acid,TCA)、三氯甲烷、硫代硫酸钠、2-硫代巴比妥酸、可溶性淀粉、乙酸、甲醇、碘化钾、三氯甲烷、碳酸钠、草酸(均为分析纯) 国药集团化学试剂有限公司;1-(4-甲氧基苯基)-1H-吡咯标准品(纯度>98%)、5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)标准品(纯度>98%)、没食子酸标准品(纯度>98%)上海源叶生物科技有限公司。
1.2 仪器与设备
ZT125辐照装置 核工业第二设计研究院;ZY50F反压高温蒸煮锅 浙江新丰医疗器械有限公司;TGL-24MC台式高速冷冻离心机 长沙平凡仪器仪表有限公司;KQ5200DE超声波清洗器 昆山市超声仪器有限公司;CR-400色差仪 柯尼卡美能达株式会社;HSC-24A氮吹仪 上海翱艺仪器有限公司;EMS30恒温水浴锅 上海谦科仪器设备有限公司;FA1004万分之一天平 上海力衡仪器仪表有限公司;DF-101S集热式恒温加热磁力搅拌器 武汉亨泰达仪器设备有限公司;722N可见分光光度计 上海仪电分析仪器有限公司。
1.3 方法
1.3.1 样品制备
冷冻虾尾于流水下解冻10 min,沸水煮制10 min后捞出。分成3 组:未杀菌组:未进行任何杀菌处理,直接将虾黄剥离出来,备用;辐照整虾组:对整虾进行60Co静置辐照杀菌,辐照剂量6 kGy,杀菌后将虾黄剥离出来,备用;辐照虾黄组:先将虾黄剥离出来,再进行60Co静置辐照杀菌,辐照剂量6 kGy。
1.3.2 色度测定
使用色度仪测定虾黄部位亮度值(L*)、红度值(a*)和黄度值(b*),白度值(W)按下式计算:
1.3.3 美拉德反应产物含量测定
参照Jiang Qixing等[11]的方法并稍作修改,取1 g样品加入50 mL蒸馏水混合均质,8 000 r/min匀浆2 min后过滤,收集滤液备用,测定294 nm处吸光度代表美拉德反应中间产物的形成情况,420 nm处吸光度代表褐变指数。在370 nm和440 nm的激发和发射波长下测定荧光强度。实验重复3 次,取平均值。
参照Fan Yingchen等[12]的方法并稍作修改,称取1 g样品加入4.5 mL 0.15 mol/L草酸溶液混匀,5 000 r/min均质2 min后振荡提取30 min,加入3 mL 0.4 g/mL TCA溶液混合,静置10 min,在4 ℃下以4 000×g离心15 min,取2 mL上清液与0.5 mL 0.05 mol/L 2-硫代巴比妥酸溶液混合,40 ℃水浴30 min,冷却至室温,测定443 nm处吸光度。通过5-HMF标准品绘制标准曲线,所得标准曲线方程为y=0.124 5x+0.128 4(R2=0.999 1)。
1.3.4 油脂提取
参照Folch等[13]的方法提取。准确称取10.0 g虾黄装入烧杯,加入40 mL氯仿-甲醇溶液(2∶1,V/V)混合,经30 ℃磁力搅拌60 min,添加13 mL氯仿,静置30 min后过滤,滤液中加入0.2 倍体积0.1 g/mL NaCl溶液,7 800×g离心10 min,吸出多余上层液体,下层溶液使用旋转蒸发仪浓缩,最后经35 ℃氮吹得到油脂,用于测定过氧化值和吡咯含量。
1.3.5 过氧化值测定
参照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》,采用第一法进行测定。
1.3.6 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值测定
参照GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》中的分光光度法进行测定。
1.3.7 吡咯含量测定
参照Henna Lu等[14]的方法测定。取0.05 g油脂加入1 mL 150 mmol/L磷酸盐缓冲溶液(pH 7.0,含0.03 g/mL十二烷基硫酸钠)振荡混匀。然后向上述混合液中加入Ehrlich试剂(2.1 mL试剂A和0.51 mL试剂B),其中试剂A由乙醇与2.5 mol/L HCl(1∶4,V/V)配制而成,试剂B由200 mg对-(二甲基氨基)苯甲醛与10 mL试剂A配制而成,将最终混合液混匀,在45 ℃条件下反应30 min后于570 nm处测定吸光度。用1-(4-甲氧基苯基)-1H-吡咯标准品绘制标准曲线,所得标准曲线方程为y=21.981x+0.156 4(R2=0.999 5),结果以mmol/g表示。
1.3.8 总酚含量测定
参照Xie Hongkai等[15]的方法并略有修改。1 g样品与6 mL蒸馏水混合,3 000 r/min均质1 min,然后与2 mL氯仿振荡混匀以除去脂质,4 ℃、8 000×g离心15 min,取上清液1 mL加入10 mL容量瓶中,加入1 mL福林酚试剂,反应3 min,添加2 mL 0.1 g/mL Na2CO3溶液,蒸馏水定容。在室温黑暗条件下反应2 h,测定溶液在760 nm波长处吸光度。用没食子酸标准品绘制标准曲线,所得标准曲线方程为y=13.609x-0.032 6(R2=0.999 1),结果以μg/g表示。
1.4 数据处理及分析
使用SPSS 26.0软件进行显著性分析,方法为Tukey多重比较法,P<0.05时认为差异显著,采用Graphpad 9.5软件绘图,数据以平均值±标准差表示。
2 结果与分析
2.1 不同辐照处理方式下虾黄的色泽变化
虾黄是小龙虾重要的可食用部位,其色泽影响消费者对小龙虾的品质判断。如图1所示,杀菌后,辐照整虾组的L*、a*、b*、W相较于未杀菌组无显著变化(P>0.05),但辐照虾黄组的L*相较于未杀菌组显著上升,a*显著下降(P<0.05),b*和W无显著差异(P>0.05)。辐照处理可以促进虾黄中色素物质的氧化反应,这种反应可能使色素物质变得更加活跃,从而呈现出更加鲜艳的颜色[16]。在没有虾尾存在的情况下,仅对虾黄进行辐照杀菌,虾黄可能更容易受到辐照的影响,导致颜色变化更加明显。
小写字母不同表示差异显著(P<0.05)。下同。
2.2 不同辐照处理方式下虾黄的美拉德反应产物变化
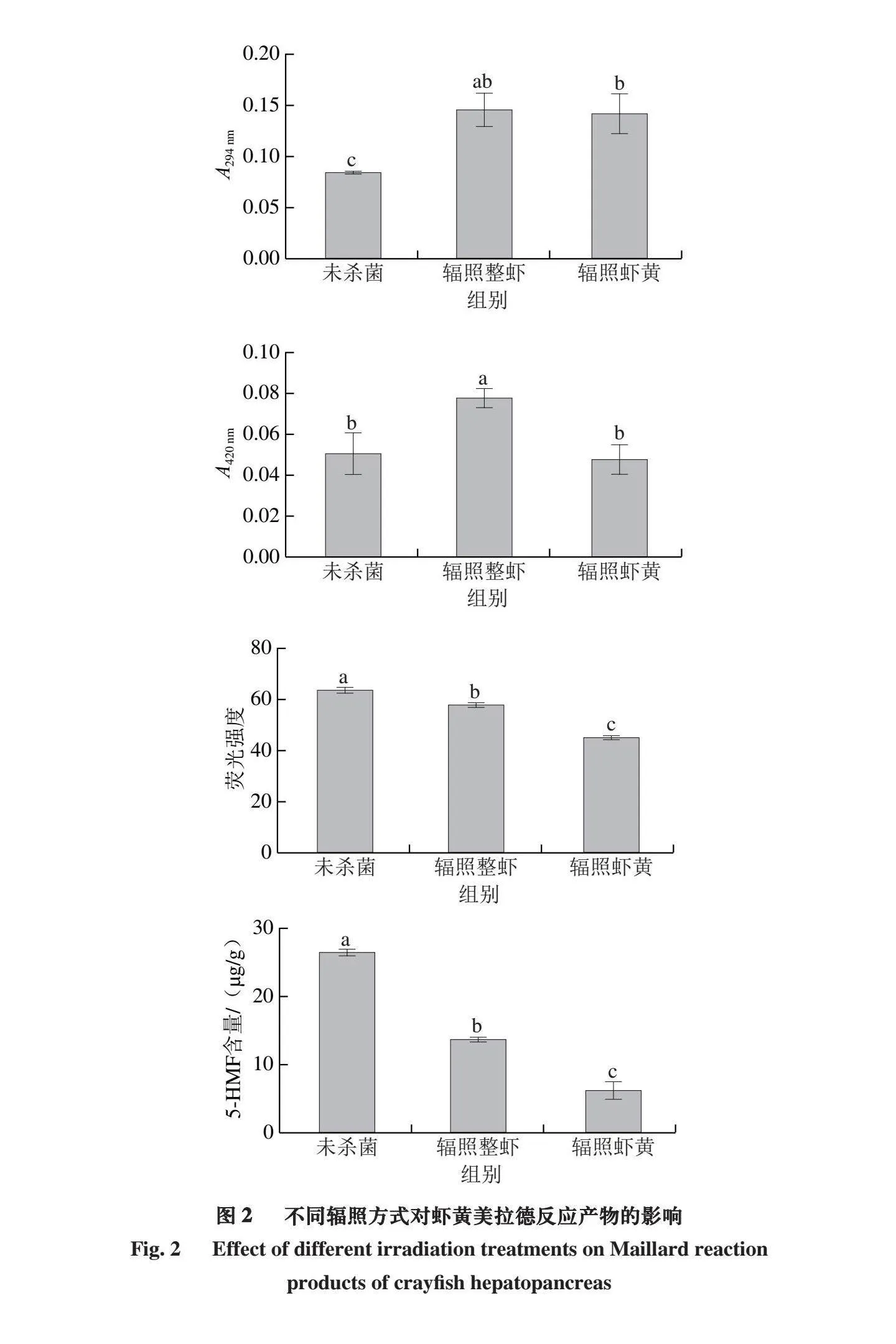
美拉德反应是最常见的非酶褐变反应,影响食品的颜色、风味和营养价值。测定294 nm处吸光度可以反映美拉德反应产生的糖、醛、小分子酮等非荧光性中间物质[17]。420 nm处吸光度可表征美拉德反应末期的褐变程度,也称褐变指数[18]。在美拉德反应中的高级阶段,Amadori化合物发生降解,特别是在碱性环境中发生的Strecker降解会产生荧光化合物,另外,Amadori化合物与邻近的蛋白质会形成具有荧光性的共价交联产物,即蛋白糖基化终产物,这些产物也具有荧光性[19]。5-HMF是美拉德反应的重要中间产物,可与伯胺基团进一步反应生成类黑素,因此,它的积累与样品的褐变速率有密切相关性[20]。
由图2可知,辐照整虾组的褐变指数相较于未杀菌组显著上升(P<0.05),增加52.94%,辐照虾黄组的褐变指数相较于未杀菌组无显著差异(P>0.05)。2 个杀菌组在294 nm处的吸光度无显著差异,但相较于未杀菌组均显著上升(P<0.05)。说明辐照杀菌加剧了美拉德反应的过程,导致糖、醛、小分子酮等非荧光中间产物的增加[21],从而294 nm处吸光度增加。但杀菌组相较于未杀菌组,5-HMF含量和荧光强度均显著下降(P<0.05),尤其是辐照虾黄组,分别下降47.96%、29.69%,这可能是由于辐照破坏了这些物质的分子结构,引起5-HMF和荧光产物的光降解,尤其是辐照虾黄组,与辐照射线直接接触,使虾黄中生成的5-HMF和荧光产物吸收辐照能量后,发生化学结构变化,从而分解,导致含量下降[22-23]。另外,可能是由于虾尾虾肉的存在,会提供更多的氨基参与美拉德反应,因此辐照整虾组A294 nm、荧光强度及5-HMF含量相较于辐照虾黄组更高。
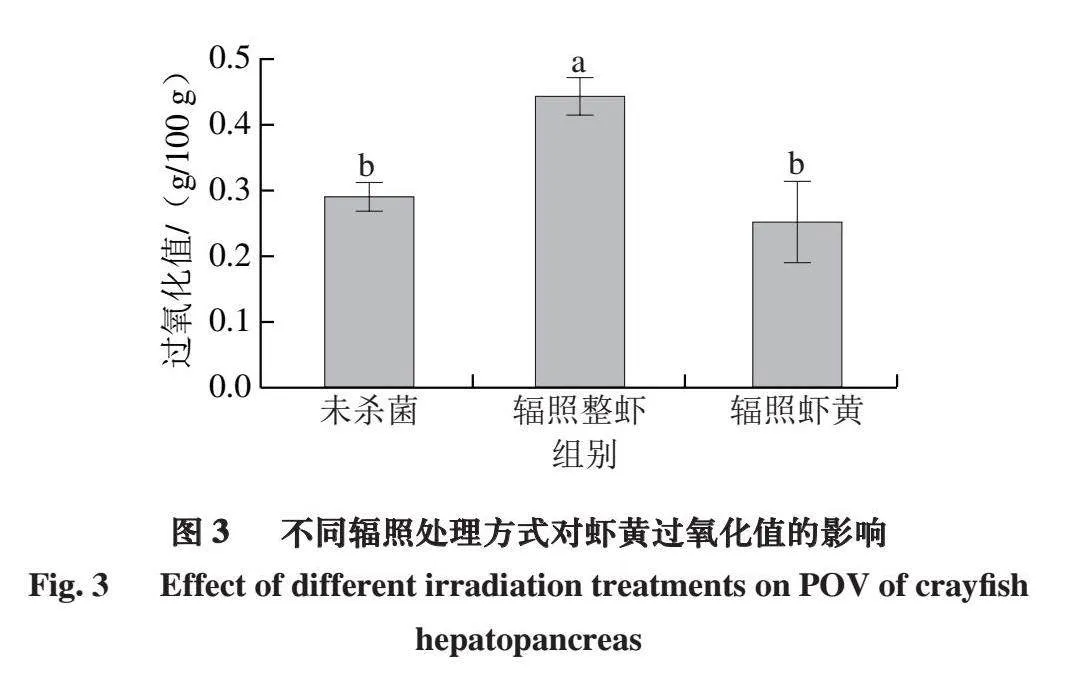
2.3 不同辐照处理方式下虾黄的过氧化值变化
过氧化值是衡量水产品脂质氧化程度的重要指标,直接反映样品中初级氧化产物氢过氧化物的含量。如图3所示,辐照整虾组的过氧化值相较于未杀菌组(0.29 g/100 g)显著上升52.20%(P<0.05),而辐照虾黄组(0.26 g/100 g)相较于未杀菌组过氧化值略微下降,但无显著差异(P>0.05)。这可能是由于当对整虾进行辐照时,虾尾的存在使整个被辐照样品组织结构较为复杂,从而导致辐照不均匀。这种不均匀性可能使某些区域的脂质更容易发生氧化,尤其是虾黄部分富含脂质,并且含有较高含量的不饱和脂肪酸,这些脂肪酸更容易被氧化。除此之外,虾肉本身含有丰富的酶和其他生物活性物质,这些物质在辐照下可能促进氧化反应[24]。当虾肉与虾黄紧密接触时,这些酶和活性物质可能更容易与虾黄中的脂质发生反应,从而加速虾黄的脂质氧化过程。因此,整虾辐照后虾黄的过氧化值显著上升(P<0.05)。除此之外,虽然辐照的主要目的是杀菌,但低剂量辐照时可产生具有抗氧化性的物质[25],从而减少脂质氧化,降低过氧化值,这可能是辐照虾黄组过氧化值下降的原因。
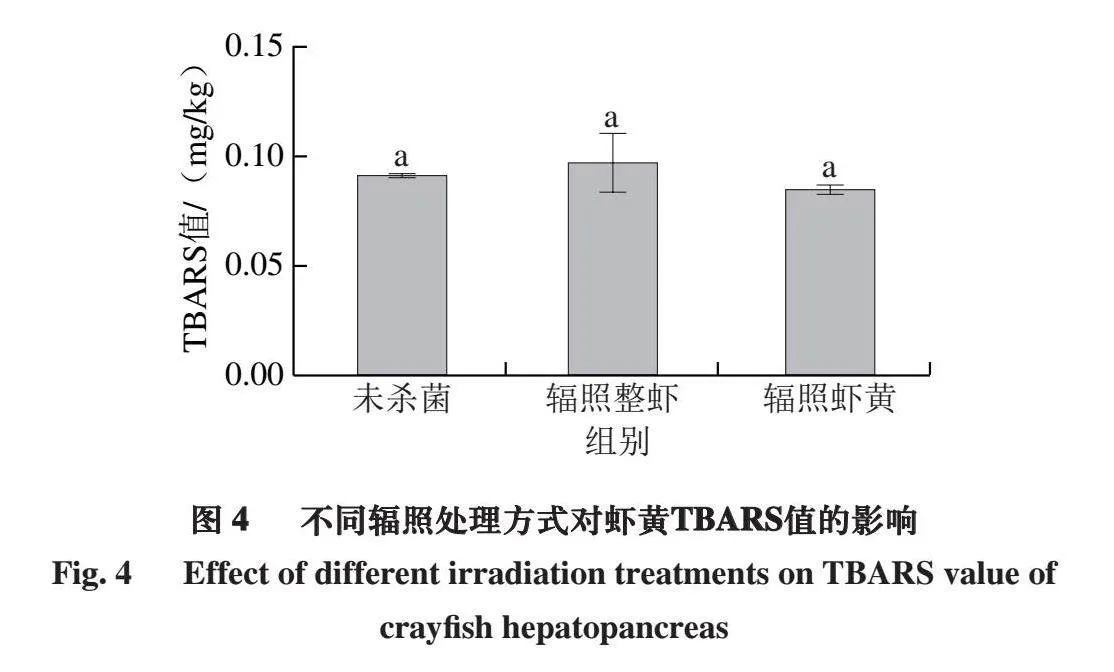
2.4 不同辐照处理方式下虾黄的TBARS值变化
TBARS值主要反映脂质氧化的次级产物,如脂肪族醛、醇、酮、烃等,以产生的丙二醛含量表示。由图4
可知,3 组之间TBARS值无显著差异(P>0.05),但辐照整虾组TBARS值相较于未杀菌组略有上升,这是由于辐照整虾组中的虾肉含有多种酶,可能具有促进脂质氧化的作用,在辐照过程中,这些酶可能没有被完全抑制或失活,仍具有活性,从而导致虾黄中脂质的氧化程度增加,TBARS值上升[26]。且所附带的虾肉本身也含有一些容易被氧化的物质,如多不饱和脂肪酸等[27],在辐照过程中,这些物质被氧化,产生氧化产物,这些产物再与虾黄中的脂质发生相互作用,导致TBARS值上升[28],因此辐照整虾组的TBARS值更高,这与过氧化值的结果一致。
2.5 不同辐照处理方式下虾黄的吡咯含量变化
由图5可知,经过辐照杀菌后,2 组虾黄中的吡咯含量分别为0.014、0.007 mmol/g,相较于未杀菌组(0.000 68 mmol/g)均显著上升(P<0.05)。吡咯通常在脂质氧化与蛋白质反应中形成,是颜色的重要前体,呈黄红色或棕色[29-30]。吡咯化是脂质氧化产物和伯胺基反应的一种替代途径,可以在含有氨基酸/蛋白质残基的脂质氧化产物之间形成[31]。辐照整虾组吡咯含量显著更高的原因在于虾尾的存在,导致会有更多的蛋白质与脂质发生反应,从而产生更多吡咯。
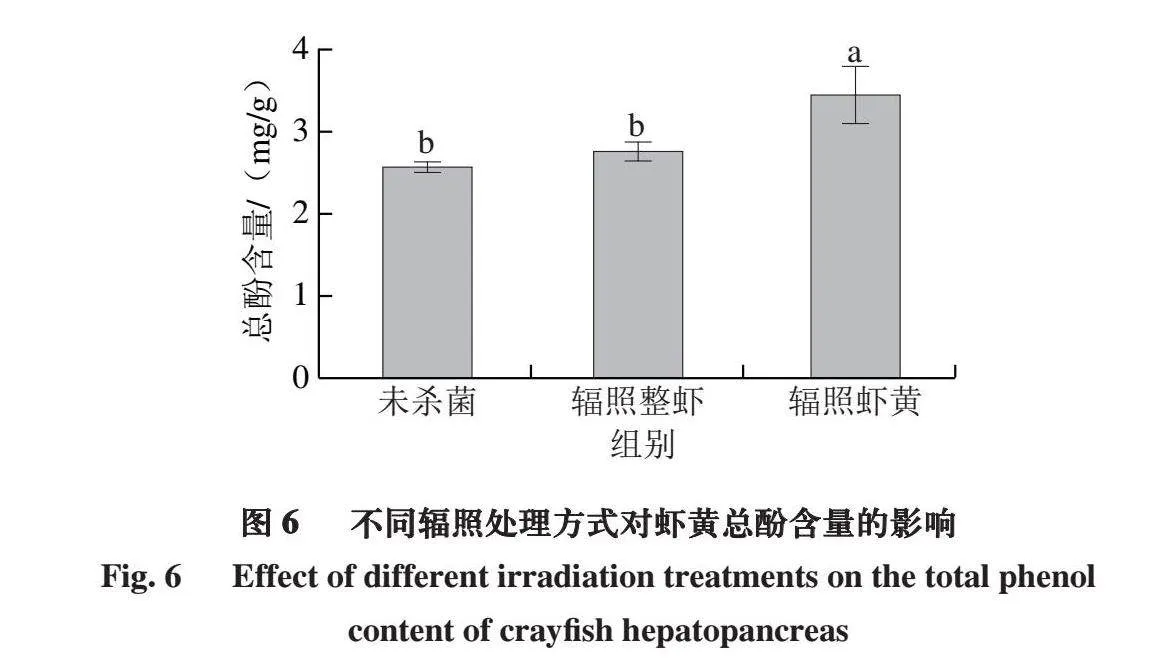
2.6 不同辐照处理方式下虾黄的总酚含量变化
酚类作为抗氧化剂,可以通过清除自由基和抑制过渡金属的螯合活性抑制脂质氧化[32-33]。但酚类也可以向脂质自由基提供氢原子,产生脂质衍生物和醌结构,然后氧化环化和聚合形成红色中间产物,最终形成深棕色色素[34-35]。如图6所示,经过辐照杀菌后,2 组虾黄中总酚含量均有所上升,尤其是辐照虾黄组,相较于未杀菌组(2.57 mg/g)显著上升(P<0.05),增加34.17%。这是因为辐照处理可使虾黄发生多种化学反应,如氧化、还原、水解、交联等,在这些过程中,虾黄中的某些化合物,如多酚氧化酶转化为酚类物质[36],并且可能刺激虾黄中的细胞产生更多的酚类抗氧化剂应对辐照带来的压力[37]。而在单独辐照虾黄组中,由于没有整虾的其他组织分散或吸收辐照能量,虾黄更直接地受到辐照的影响,从而显著增加了总酚含量(P<0.05)。
3 结 论
以未杀菌组为对照,比较对整虾和仅虾黄进行辐照杀菌后虾黄的品质变化。结果表明,辐照杀菌对虾黄颜色的影响较小,尤其是整虾组,与未杀菌组无显著差异(P>0.05),辐照虾黄组的L*和a*相较于其他2 组有显著差异(P<0.05),可能是由于没有虾肉的包裹更容易受到辐照的影响,导致颜色变化更加明显。辐照后虾黄的A294 nm和褐变程度增加,说明辐照会增加虾黄发生美拉德反应的程度,但荧光强度和5-HMF含量降低,可能由于辐照导致这些产物发生了光降解。过氧化值、TBARS值、吡咯及总酚含量的增加说明辐照会促进虾黄发生脂质氧化,但也会促进其产生酚类物质。综上分析发现,辐照杀菌方式对虾黄颜色的影响较小,可以有效维持虾黄的鲜黄色泽,同时会轻微加剧加工过程中的美拉德反应和脂质氧化,尤其是在虾肉存在的情况下,这种促进效果更为明显,但也在可接受范围内。本研究可以为小龙虾的精深加工和发展提供参考。
参考文献:
[1] 邹宇凡. 长江中下游地区典型克氏原螯虾群体遗传结构分析和养殖性能评价[D]. 上海: 上海海洋大学, 2023: 1-8. DOI:10.27314/d.cnki.gsscu.2023.000123.
[2] 何力, 喻亚丽, 甘金华, 等. 克氏原螯虾质量安全风险研究与分析[J]. 中国渔业质量与标准, 2020, 10(1): 1-12. DOI:10.3969/j.issn.2095-1833.2020.01.001.
[3] 王子凌, 张子豪, 曾璐瑶, 等. 不同卤制加工阶段中食盐添加量对小龙虾尾品质及挥发性风味的影响[J]. 食品科学, 2024, 45(11): 52-60. DOI:10.7506/spkx1002-6630-20231009-058.
[4] 公方朔. 熟制小龙虾食用安全性研究及工艺控制[D]. 无锡: 江南大学, 2024: 1-2. DOI:10.27169/d.cnki.gwqgu.2023.000487.
[5] 刘文倩, 王燕, 邓放明, 等. 超声辅助酶法提取虾黄油脂及其脂肪酸组成分析[J]. 食品科学, 2014, 35(12): 102-107. DOI:10.7506/spkx1002-6630-201412020.
[6] 何志刚, 王冬武, 李金龙, 等. 克氏原螯虾废弃物综合处理及在饲料中的应用[J]. 江西饲料, 2017(3): 1-6. DOI:10.3969/j.issn.1008-6137.2017.03.001.
[7] 范立成. 冻藏条件对中华绒螯蟹肝胰腺的脂质氧化稳定性及其风味品质的影响[D]. 上海: 上海海洋大学, 2022: 1. DOI:10.27314/d.cnki.gsscu.2022.000499.
[8] 梅俊, 许振琨, 郁慧洁, 等. 冷链物流中海水鱼的腐败机制及保鲜技术研究进展[J]. 食品与生物技术学报, 2022, 41(7): 84-99. DOI:10.3969/j.issn.1673-1689.2022.07.008.
[9] 鲁怡婷, 谭宏渊, 黄丽琪, 等. 杀菌方式对即食调味克氏原螯虾尾贮藏品质的影响[J]. 广东海洋大学学报, 2024, 44(2): 1-9. DOI:10.3969/j.issn.1673-9159.2024.02.001.
[10] 祁玉霞, 李宏宇, 吴熙, 等. 不同杀菌方式对烟熏鸭胸产品品质的影响[J]. 食品安全质量检测学报, 2023, 14(22): 259-267. DOI:10.19812/j.cnki.jfsq11-5956/ts.2023.22.045.
[11] JIANG Q X, SHEN H M, GAO P, et al. Non-enzymatic browning path analysis of ready-to-eat crayfish (Promcambarus clarkii) tails during thermal treatment and storage[J]. Food Bioscience, 2023, 51: 102334. DOI:10.1016/j.fbio.2022.102334.
[12] FAN Y C, YU M M, LI D Y, et al. Effects of non-enzymatic browning and lipid oxidation on color of ready-to-eat abalone during accelerated storage and its control[J]. Foods, 2023, 12(7): 1514. DOI:10.3390/foods12071514.
[13] FOLCH J, LEES M, SOLANE STANLEY G H. A simple method for the isolation and purification of total lipides from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509. DOI:10.1016/S0021-9258(18)64849-5.
[14] HENNA LU F S, NIELSEN N S, BARON C P, et al. Oxidative stability of dispersions prepared from purified marine phospholipid and the role of α-tocopherol[J]. Journal of Agricultural and Food Chemistry, 2012, 60(50): 12388-12396. DOI:10.1021/jf303560f.
[15] XIE H K, ZHOU D Y, LIU Z Y, et al. Effects of natural phenolics on shelf life and lipid stability of freeze-dried scallop adductor muscle[J]. Food Chemistry, 2019, 295: 423-431. DOI:10.1016/j.foodchem.2019.05.133.
[16] 王曼, 刘霄, 杜艳, 等. 重离子辐照育种对西蓝花幼苗生长及生理特性的影响[J]. 辐射研究与辐射工艺学报, 2024, 42(1): 71-84. DOI:10.11889/j.1000-3436.2023-0079.
[17] 刘晓丹, 肖瀛, 吴金鸿, 等. 加热对美拉德反应产物主要成分及其抗氧化活性的影响[J]. 粮食与油脂, 2024, 37(3): 139-143. DOI:10.3969/j.issn.1008-9578.2024.03.028.
[18] 王玉婷, 肖乃勇, 施文正. 超声辅助美拉德反应对鲢鱼酶解产物风味特性的影响[J]. 渔业现代化, 2023, 50(6): 84-92. DOI:10.3969/j.issn.1007-9580.2023.06.010.
[19] 石瑞桃, 许晓敏, 许喆, 等. 不同类型卡拉胶美拉德产物的制备及其对鲅鱼鱼糜凝胶品质的影响[J]. 食品与发酵工业, 2023, 49(17): 230-236. DOI:10.13995/j.cnki.11-1802/ts.032424.
[20] 彭丝兰, 刘思思, 刘汝宽, 等. 不同预热处理对压榨山茶油品质影响的研究进展[J]. 粮食与油脂, 2023, 36(11): 13-16. DOI:10.3969/j.issn.1008-9578.2023.11.004.
[21] 齐慧林. 护色剂对调味鱼杀菌及储藏过程中颜色品质的影响研究[D]. 无锡: 江南大学, 2021: 19-20. DOI:10.27169/d.cnki.gwqgu.2020.000321.
[22] 刘雅慧, 杨菁菁, 左都文, 等. 电子束辐照对板栗发芽的抑制效果及对板栗品质的影响[J]. 食品安全质量检测学报, 2024, 15(7): 276-282. DOI:10.19812/j.cnki.jfsq11-5956/ts.20240126009.
[23] 唐艺文, 黄敏, 付孟, 等. 高能电子束辐照对黄精品质的影响[J]. 食品研究与开发, 2024, 45(7): 74-80. DOI:10.13995/j.cnki.11-1802/ts.034986.
[24] 袁娜. 超声波辅助卤制牛肉工艺优化及贮藏品质研究[D]. 扬州:
扬州大学, 2024: 3-6. DOI:10.27441/d.cnki.gyzdu.2023.001519.
[25] 朴成浩. 辐照处理长白山红景天抗氧化和抗疲劳作用研究[D].
延边: 延边大学, 2021: 5-9. DOI:10.27439/d.cnki.gybdu.2020.001013.
[26] 李新, 熊光权, 廖涛, 等. 小龙虾虾肉辐照后理化指标与蛋白质性质分析[J]. 核农学报, 2016, 30(10): 1941-1946. DOI:10.11869/j.issn.100-8551.2016.10.1941.
[27] 杨冰, 张艳凌, 姜绍通, 等. 不同地区稻田小龙虾的营养品质比较研究[J]. 肉类研究, 2021, 35(12): 7-12. DOI:10.7506/rlyj1001-8123-20210528-162.
[28] 刘巧瑜, 陈俊文, 游云, 等. 辐照处理对冷鲜乳鸽品质的影响[J]. 食品科学, 2023, 44(7): 96-103. DOI:10.7506/spkx1002-6630-20220403-035.
[29] BEMIS-YOUNG G L, HUANG J, BERNHARD R A. Effect of pH on pyrazine formation in glucose-glycine model systems[J]. Food Chemistry, 1993, 46(4): 383-387. DOI:10.1016/0308-8146(93)90009-5.
[30] 毕家钰, 代曜伊, 郑炯. 褐变抑制剂对干制香蕉片护色效果的影响[J]. 食品与机械, 2016, 32(11): 194-197. DOI:10.13652/j.issn.1003-5788.2016.11.045.
[31] 陆婷婷. 鲢鱼糜单次漂洗工艺研究及对冻藏品质的影响[D]. 杭州: 浙江工商大学, 2023: 3-6. DOI:10.27462/d.cnki.ghzhc.2023.000973.
[32] 于文慧, 王雅利, 杨明川, 等. 高粱单宁研究进展[J]. 现代农业科技, 2022(21): 183-186. DOI:10.3969/j.issn.1007-5739.2022.21.046.
[33] LU M, YUAN B, ZENG M. Antioxidant capacity and major phenolic compounds of spices commonly consumed in China[J]. Food Research International, 2011, 44(2): 530-536. DOI:10.1016/j.foodres.2010.10.055.
[34] PARVEEN I, THREADGILL M D, MOORBY J M, et al. Oxidative phenols in forage crops containing polyphenol oxidase enzymes[J]. Journal of Agricultural and Food Chemistry, 2010, 58(3): 1371-1382. DOI:10.1021/jf9024294.
[35] KUMAR Y, YADAV D N, AHMAD T, et al. Recent trends in the use of natural antioxidants for meat and meat products[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14(6): 796-812. DOI:10.1111/1541-4337.12156.
[36] 孙茂, 邱国祥, 李景新, 等. 桑叶乌龙茶制作工艺流程中生物活性物质的稳定性研究[J]. 广东蚕业, 2022, 56(11): 1-6; 16. DOI:10.3969/j.issn.2095-1205.2022.11.01.
[37] 赵子茉, 赵领军. 食品辐照在提升食品质量安全与品质中的应用[J]. 农产品质量与安全, 2024(3): 101-104. DOI:10.3969/j.issn.1674-8255.2024.03.016.
