不同包装方式对冷鲜鸡肉中隆德假单胞菌和热死环丝菌混菌生长及腐败特性的影响
2024-10-09邓小芳刘芳王道营张幸

摘 要:采用空气包装(air packaging,AP)、气调包装(modified atmosphere packaging,MAP)和真空包装(vacuum packaging,VP)对外源接种隆德假单胞菌和热死环丝菌的冷鲜鸡肉进行包装,然后分别在-1~0 ℃、3~5 ℃和7~10 ℃下贮藏,定期取样检测样品的菌落总数、pH值、多肽含量、总挥发性盐基氮(the total volatile nitrogen,TVB-N)含量及挥发性气味的变化。结果表明:随着贮藏时间的延长,冷鲜鸡的菌落总数、pH值、多肽含量及TVB-N含量均明显上升;VP(-1~0 ℃)的保鲜效果最好,贮藏第6天,热死环丝菌和隆德假单胞菌的数量分别为7.71、7.18(lg(CFU/g)),pH值、多肽含量、TVB-N含量相较于AP(7~10 ℃、4 d)分别降低1.03、2.991 mg/g、55.91 mg/100 g;贮藏到第3天时,挥发性气体成分硫化物(W1W)、氮氧化物(W5S)的响应值降低。本研究结果表明,VP(-1~0 ℃)的冷鲜鸡品质最好,贮藏时间得到延长,且包装方式简单,能为未来更进一步探究冷鲜鸡保鲜提供理论参考。
关键词:冷鲜鸡;热死环丝菌;隆德假单胞菌;气调包装;真空包装
Effect of Different Packaging Methods on the Growth and Spoilage Characteristics of Pseudomonas lundensis and Brochothrix thermosphacta Inoculated in Chilled Chicken Meat
DENG Xiaofang1,2, LIU Fang2, WANG Daoying1,2,*, ZHANG Xing1,*
(1. School of Food and Pharmaceutical Engineering, Nanjing Normal University, Nanjing 210097, China;
2. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract: Fresh chicken meat was inoculated with Pseudomonas lundensis and Brochothrix thermosphacta, subjected to air packaging (AP), modified atmosphere packaging (MAP) or vacuum packaging (VP), and stored at −1–0, 3–5 or 7–10 ℃. During storage, samples were taken periodically for the measurement of total viable count (TVC), pH, polypeptide content, total volatile nitrogen (TVB-N) content and volatile odorants. The results showed that the TVC, pH, polypeptide content and TVB-N content of chilled chicken increased significantly with storage time. VP combined with storage at −1–0 ℃ had the best preservation effect, and on the 6th day of storage, the numbers of B. thermosphacta and P. lundensis were 7.71 and 7.18 (lg (CFU/g)). The pH, polypeptide content, and TVB-N content were reduced by 1.03, 2.991 mg/g and 55.91 mg/100 g
respectively, in comparison with those on the 4th day of storage at 7–10 ℃ under AP condition, and the electronic nose responses to volatile sulphur compounds (W1W) and nitrogen oxides (W5S) decreased on the 3rd day. The results of this study indicate that VP, a simple packaging method, combined with storage at −1–0 ℃ provides the best quality preservation for chilled chicken meat, extending the storage period, which provides a theoretical basis for further research on the preservation of chilled chicken meat.
Keywords: chilled chicken; Brochothrix thermosphacta; Pseudomonas lundensis; modified atmosphere packaging; vacuum packaging
DOI:10.7506/rlyj1001-8123-20240619-159
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2024)09-0057-07
引文格式:
邓小芳, 刘芳, 王道营, 等. 不同包装方式对冷鲜鸡肉中隆德假单胞菌和热死环丝菌混菌生长及腐败特性的影响[J]. 肉类研究, 2024, 38(9): 57-63. DOI:10.7506/rlyj1001-8123-20240619-159. http://www.rlyj.net.cn
DENG Xiaofang, LIU Fang, WANG Daoying, et al. Effect of different packaging methods on the growth and spoilage characteristics of Pseudomonas lundensis and Brochothrix thermosphacta inoculated in chilled chicken meat[J]. Meat Research, 2024, 38(9): 57-63. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20240619-159. http://www.rlyj.net.cn
鸡肉是最有价值的畜产品之一,除了为人类提供优质蛋白质外,鸡肉还富含必需氨基酸、矿物质和维生素。因此,由于鸡肉的特性,各种微生物可以在其中生长[1]。冷鲜鸡因嫩度好、口感好而广受欢迎,然而,冷鲜鸡的贮藏仍然面临许多挑战[2]。冷鲜鸡的高水分含量和高蛋白含量特性为微生物的生长提供了有利条件,微生物污染是导致鸡肉变质和质量下降的主要因素。污染可能会导致肉中形成黏液、异味和变色,最终使消费者无法食用[3]。各种微生物群落之间的竞争及其生物和非生物相互作用在肉类微生物腐败的复杂过程中也起着重要作用[4]。市场上常见的气调包装(modified atmosphere packaging,MAP)及真空包装(vacuum packing,VP)等联合低温冷藏不但可以抑制假单胞菌等优势腐败菌的繁殖,而且能维持鸡肉的光泽及风味[5]。
造成冷鲜鸡腐败的微生物种类繁多,产生的细菌种群与贮藏温度及包装方式密切相关[6]。不论MAP还是VP,冷鲜鸡的腐败往往是由一些优势腐败微生物造成。作为冷鲜鸡腐败后期的优势腐败菌隆德假单胞菌(Pseudomonas lundensis)和热死环丝菌(Brochothrix thermosphacta)成为必不可少的研究对象[6],它们能耐受较低的贮藏温度,在贮藏过程中生长迅速[7]。隆德假单胞菌是一种代谢能力较强的兼性好氧菌,可水解冷鲜鸡肉中的蛋白质和脂肪,产生有害挥发物,可在MAP和VP条件下生长[8]。热死环丝菌属于兼性厌氧菌,能产生硫化氢,水解胞外酶,加速高蛋白冷鲜鸡的变质,从而缩短冷鲜鸡货架期[9]。
尽管在不同包装条件下针对不同单菌株腐败微生物污染冷鲜鸡食品的研究已被广泛报道,例如它们在氧亲和力、葡萄糖消耗量方面不同,但关于不同温度、不同包装条件下混菌污染冷鲜鸡条件对其腐败特性影响以及它们在物种和/或菌株水平上演替的信息有限。随着市场对鸡肉的需求日益增长,延缓冷鲜鸡的腐败、延长其货架期十分重要。所以本研究以冷鲜鸡为研究对象,考察不同温度下空气包装(air packaging,AP)、MAP及VP对冷鲜鸡中隆德假单胞菌和热死环丝菌混菌生长及腐败特性的影响。旨在为冷鲜鸡贮藏期间延长货架期提供理论基础。
1 材料与方法
1.1 材料与试剂
冷鲜鸡胸肉购于盒马鲜生。
平板计数琼脂、STAA培养基、假单胞菌CFC选择性培养基 上海朝瑞生物科技有限公司;氯化钠、碳酸钾 北京伊诺凯科技有限公司;三氯乙酸(纯度≥99%)杭州高晟生物科技有限公司;硼酸 北京索莱宝科技有限公司;阿拉伯胶 南京钟鼎生物技术有限公司;甲基红指示剂、次甲基蓝指示剂 北京虹湖联合化工产品有限公司。
1.2 仪器与设备
ZX-56真空贴体包装机 浙江瑞宝包装机械有限公司;JG-31自动气调保鲜包装机 上海三景机械有限公司;GI100T高压灭菌锅 厦门致微仪器有限公司;B1-150A生化培养箱 施都凯仪器设备有限公司;PEN3电子鼻 北京康尔兴科技发展有限公司。
1.3 方法
1.3.1 细菌菌悬液的制备
将保存在甘油冻存管(50%(V/V)甘油,-80 ℃)的隆德假单胞菌和热死环丝菌菌株分别接种至5 mL无菌LB肉汤中活化12 h(28 ℃、200 r/min)。然后,按1%(V/V)的接种量将活化好的隆德假单胞菌和热死环丝菌菌株转接到10 mL无菌LB肉汤中培养至对数末期(OD600 nm≈1.0,浓度约108 CFU/mL)。之后,用0.9 g/100 mL无菌生理盐水将细菌培养物稀释至合适浓度(3~4(lg(CFU/mL)))备用[10]。
1.3.2 样品的制备与接种
对鸡胸肉进行辐照(8 kGy,南京喜悦科技股份有限公司)灭菌[11]。在人工污染之前,无菌鸡胸肉在超净工作台上切成肉糜。实验共设置4 组,分别为VP、MAP(20% CO2/80% N2)、AP和空气包装对照组(CK,不接菌)。分别准确吸取1 mL 1.3.1节制得的细菌稀释液,接种至10.00 g无菌鸡胸肉糜[12]。为了模拟冷鲜鸡肉的贮藏条件[13],所有样品在-1~0、3~5、7~10 ℃下分别进行贮藏实验(共6 d)。每天测定菌落总数和pH值。此外,在贮藏0、2、3、4、6 d时进行多肽含量、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量和挥发性气味测定[14]。
1.3.3 菌落总数计数
将5.00 g鸡胸肉糜放入含有45 mL 0.9 g/100 mL无菌生理盐水的离心管中,并在离心管中9 000 r/min均质2 min,使冷鲜鸡胸肉上的微生物分离。将均质得到的溶液从离心管中转移至10 mL无菌离心管中,根据预实验隆德假单胞菌和热死环丝菌生长曲线,对其菌液进行10 倍梯度稀释[15]。之后,将100 μL适当浓度稀释液均匀涂布在STAA培养基和假单胞菌CFC选择性培养基上(热死环丝菌和隆德假单胞菌分别在STAA培养基和CFC培养基上生长,且经过预实验证明两者均不在彼此培养基上生长),CK组稀释液均匀涂布在平板计数琼脂上进行计数。在37 ℃培养箱中培养36 h后分别对隆德假单胞菌和热死环丝菌的菌落总数进行计算,每个样品平行测定3 次。
1.3.4 pH值测定
将5.00 g鸡胸肉糜样品转移至45 mL超纯水中,均质(9 000 r/min)。然后,采用便携式pH计用pH值为4.00或7.00的缓冲液校准后测定不同样品的pH值[16],每个样品平行测定3 次。
1.3.5 多肽含量测定
采用双缩脲法测定腐败细菌分解鸡肉蛋白产生的多肽含量。取5.00 g样品与45 mL 0.9 g/100 mL无菌生理盐水混合,均质(9 000 r/min)后离心(4 000 r/min、10 min),取6 mL上清液于10 mL离心管,于沸水浴中反应15 min,取出后冷却至室温。4 000 r/min离心10 min,取5 mL上清。随后,加入2 mL 10 g/100 mL三氯乙酸溶液沉淀上清液中残余的蛋白质,振荡混匀后反应15 min再次离心(4 000 r/min、10 min),取上清,备用。准确吸取1 mL离心所得上清液,加入4 mL双缩脲试剂,涡旋混匀,置于37 ℃培养箱静置30 min进行显色反应,测定吸光度(540 nm)。以牛血清白蛋白为标准品,以蛋白质量浓度(0、0.5、1、1.5、2、4、6、8 mg/mL)为横坐标,吸光度为纵坐标绘制标准曲线,冷鲜鸡肉糜样品中的多肽含量按下式计算:
1.3.6 TVB-N含量测定
将5.00 g鸡胸肉糜样品与45 mL 0.9 g/100 mL无菌生理盐水混合并均质(9 000 r/min),使样品溶液均匀分散后离心(4 000 r/min、10 min)。取样品上清液后进行过滤以进行进一步测定[17]。TVB-N含量测定参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》微扩散法。
1.3.7 挥发性气味分析
采用电子鼻系统对鸡胸肉糜样品的气味组成进行分析。取5.00 g冷鲜鸡胸肉糜样品,装入检测杯后,用封口膜密闭。电子鼻检测器校准后,将顶空瓶放入实验台上进行测定。顶空瓶温度升温到35 ℃,检测时设置腔室流量为200 mL/min。测量时间设置为90 s,以获得平稳的数据[18]。中间换样前的清洗时间为90 s,有利于最大程度区分样品。注射流量为200 μL。每组冷鲜鸡胸肉糜样品包括3 个重复样本[19]。
1.4 数据处理
使用SPSS软件对结果进行统计分析,结果均采用单因素方差分析检验,采用Tukey检验比较平均值。使用Origin 2021软件作图。所有数据均以平均值±标准差表示。
2 结果与分析
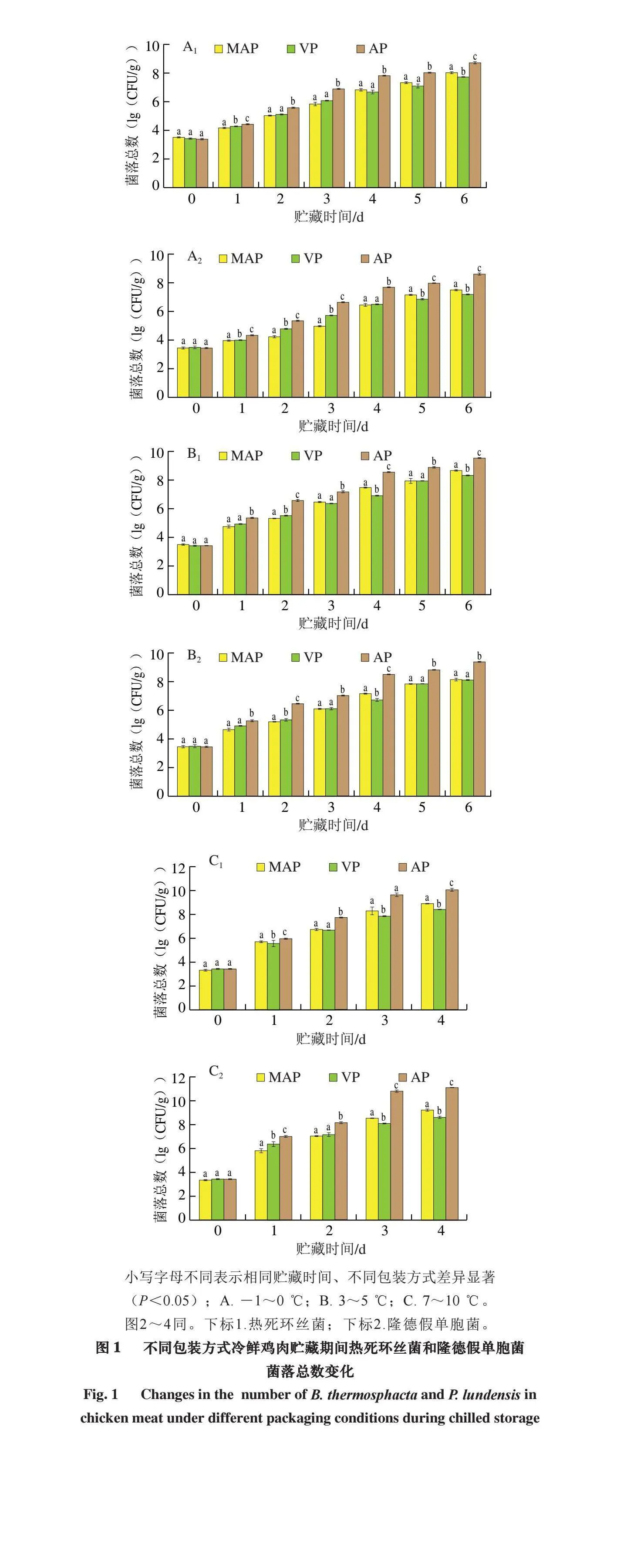
2.1 不同包装方式冷鲜鸡肉贮藏期间隆德假单胞菌和热死环丝菌菌落总数变化对照组样品在贮藏期间的菌落总数为0(lg(CFU/g)),如图1所示,实验组样品的混菌接种量均在3.65~3.71(lg(CFU/g))。冷鲜鸡菌落总数随着贮藏时间的延长持续上升。在-1~0、3~5 ℃ 2 组贮藏温度下MAP和VP组样品贮藏第5天隆德假单胞菌和热死环丝菌菌落总数约为7.0(lg(CFU/g)),AP组样品贮藏第3天隆德假单胞菌和热死环丝菌菌落总数约为7.0(lg(CFU/g));在7~10 ℃贮藏温度下,MAP和VP组样品仅贮藏第2天隆德假单胞菌和热死环丝菌菌落总数就已经接近7.0(lg(CFU/g)),AP组样品接近8.0(lg(CFU/g)),已经超过GB 16869—2005《鲜、冻禽产品》的细菌限量,这表明鸡胸肉已经完全腐败。并且在-1~0、3~5 ℃ 2 组贮藏温度下MAP和VP组样品贮藏6 d时隆德假单胞菌和热死环丝菌菌落总数为7.6~8.0(lg(CFU/g)),其中,VP组在-1~0 ℃贮藏温度下2 种菌菌落总数分别为7.18、7.71(lg(CFU/g))。
然而7~10 ℃的MAP和VP组样品中隆德假单胞菌和热死环丝菌菌落总数接近9.0(lg(CFU/g)),且均显著小于AP组(P<0.05)。综上,与AP组相较,MAP和VP组均可以显著抑制冷鲜鸡中隆德假单胞菌和热死环丝菌的生长。相较于7~10 ℃的较低温度,3~5 ℃以下的MAP和VP组抑菌作用更显著。冷鲜厌氧贮藏是一种常见的鸡肉贮藏方式,且冷鲜鸡隆德假单胞菌和热死环丝菌混菌的生长呈现共生关系[20]。
小写字母不同表示相同贮藏时间、不同包装方式差异显著(P<0.05);A. -1~0 ℃;B. 3~5 ℃;C. 7~10 ℃。图2~4同。下标1.热死环丝菌;下标2.隆德假单胞菌。
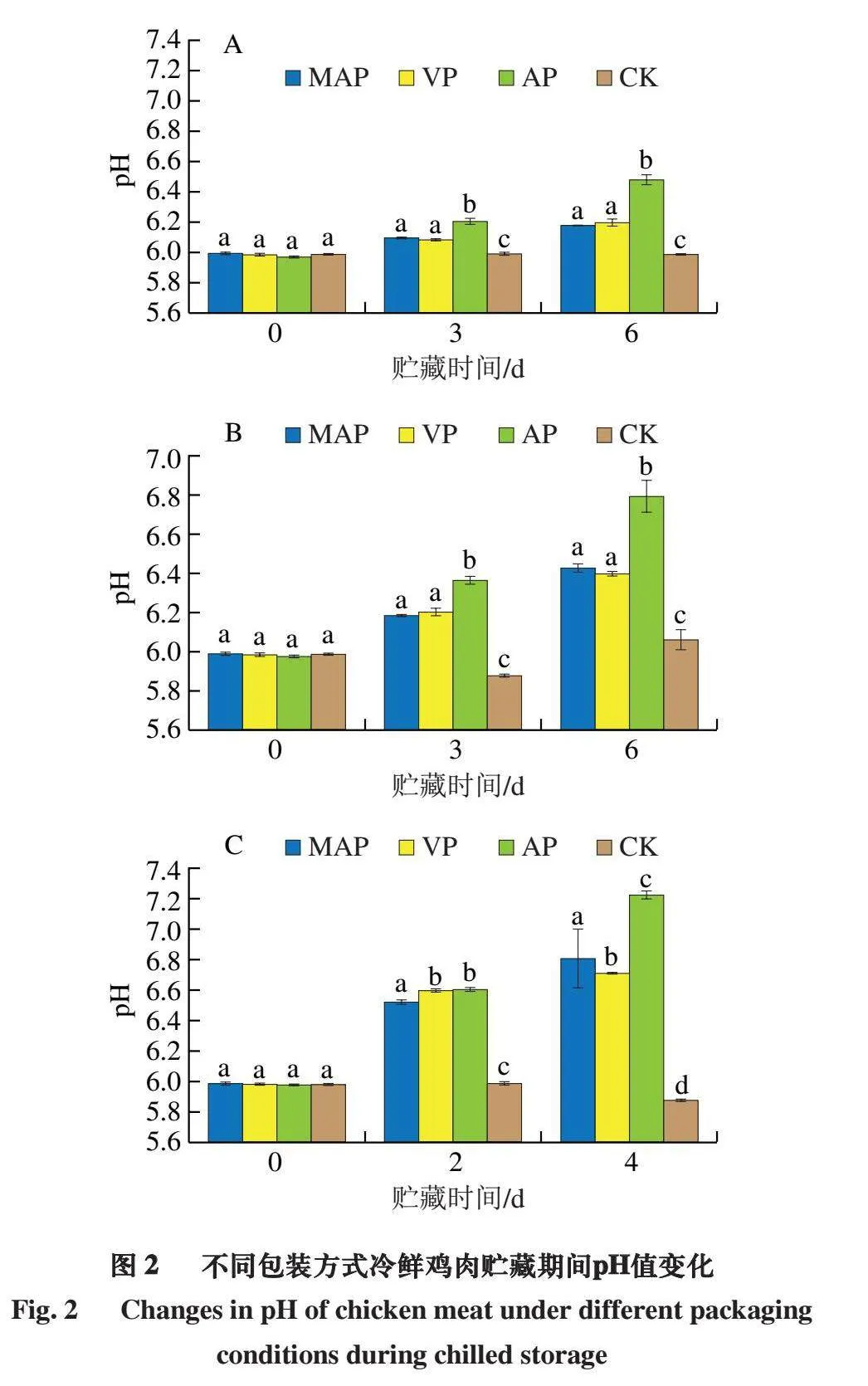
2.2 不同包装方式冷鲜鸡肉贮藏期间pH值变化
由图2可知,贮藏之初,样品的pH值均在5.87左右,这与以往研究所证明的新鲜鸡胸肉的初始pH值为5.7~6.0相对应[21]。与对照组相比,MAP、VP和AP组的pH值均随着贮藏时间的延长呈现上升趋势,其中,相对于MAP和VP组,AP组的pH值迅速增加。在7~10 ℃时,AP组pH值在第4天达到7.23,MAP和VP组分别达到6.81、6.71;在3~5 ℃时,AP组pH值在第6天达到6.79,MAP和VP组分别达到6.43、6.40;在-1~0 ℃时,AP组pH值在第6天为6.48,MAP和VP组分别为6.17、6.19,VP组相较于AP(7~10 ℃、4 d)降低1.03。结果表明,隆德假单胞菌和热死环丝菌的生长会导致冷鲜鸡的pH值上升,已有研究表明,隆德假单胞菌和热死环丝菌产生的副产物会使冷鲜鸡的pH值上升[22]。MAP和VP组pH值的上升速率明显低于AP组,且温度的增加会更有利于隆德假单胞菌和热死环丝菌快速产生副产物,继而导致肉类蛋白质的分解和营养物质的损失,最终造成冷鲜鸡的加速变质,从而使得其pH值显著上升[23]。
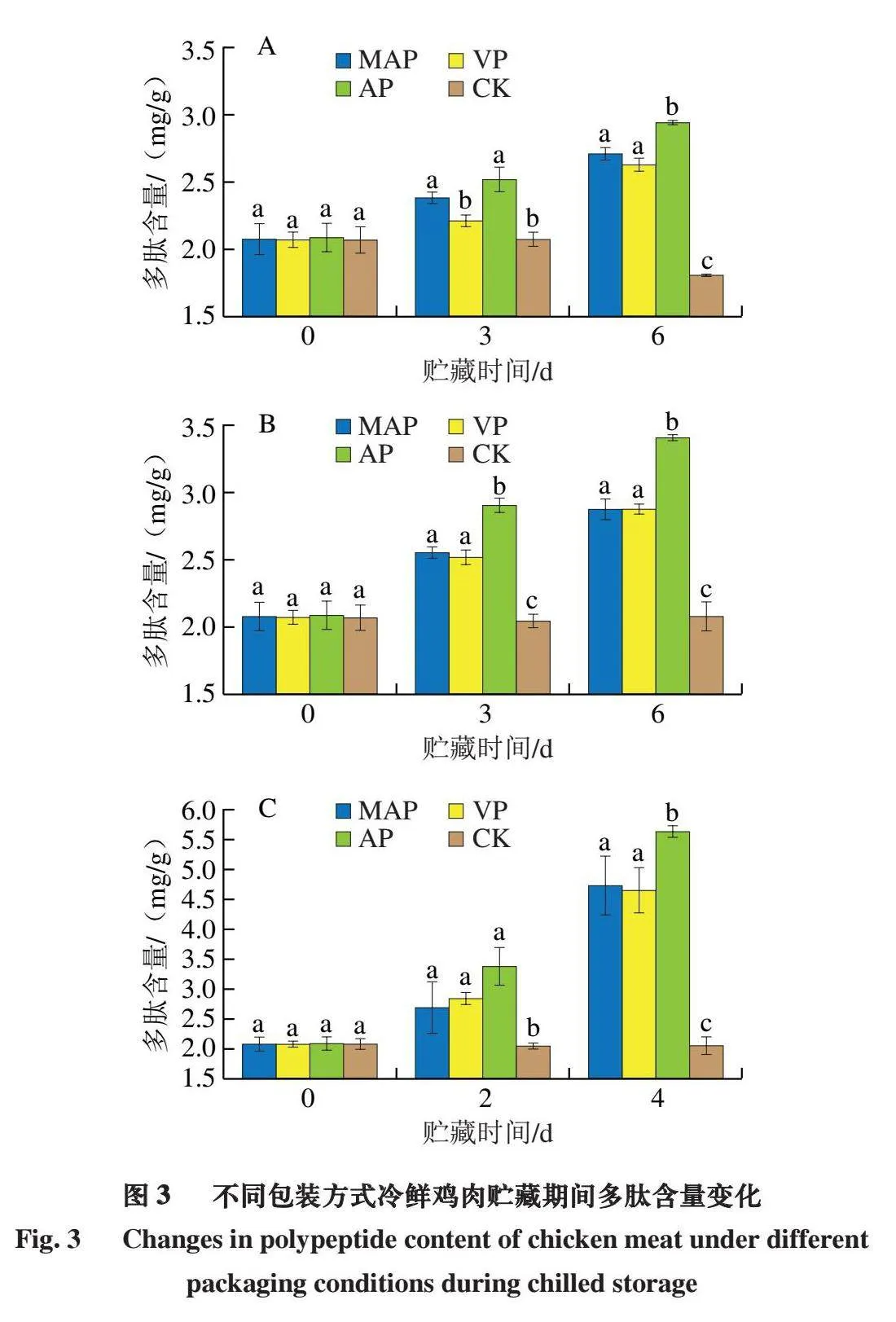
2.3 不同包装方式冷鲜鸡肉贮藏期间多肽含量变化
由图3可知,贮藏之初,样品的多肽含量均在2.0 mg/g
左右。肉类的三氯乙酸-可溶性肽含量通常用于监测肉类贮藏过程中的蛋白质降解,特别是微生物蛋白酶对肉类蛋白质的水解具有显著贡献[24]。通过测定贮藏中末期多肽含量,比较不同包装、不同温度下冷鲜鸡中隆德假单胞菌和热死环丝菌混菌的蛋白质水解活性。与对照组相比,MAP、VP和AP组的多肽含量均随着贮藏时间的延长呈现上升趋势,而MAP和VP组多肽含量的增长速率远小于AP组。在-1~0 ℃时,贮藏6 d时除了AP组的多肽含量增加比较明显,MAP和VP组只是略有增加,且MAP组的多肽含量稍高于VP组,该条件下VP组多肽含量相较于AP(7~10 ℃、4 d)降低2.991 mg/g;在3~5 ℃时,MAP和VP组的多肽含量增长速率几乎一样,比AP组的多肽含量增长速率小得多;在7~10 ℃时,AP组多肽含量的上升速率远远大于MAP和VP组。综上表明,隆德假单胞菌和热死环丝菌在MAP和VP组的腐败潜力弱于AP组,冷鲜鸡肉中多肽的大量产生可能来自于隆德假单胞菌和热死环丝菌在冷鲜鸡肉中的代谢,其增长规律与冷藏过程中隆德假单胞菌和热死环丝菌三氯乙酸-可溶性肽含量的变化规律一致,当贮藏过程中冷鲜底物的葡萄糖和乳酸耗尽时,具有蛋白水解活性的隆德假单胞菌和热死环丝菌需将蛋白质转换为多肽和氨基酸,作为新的能量来源[25]。
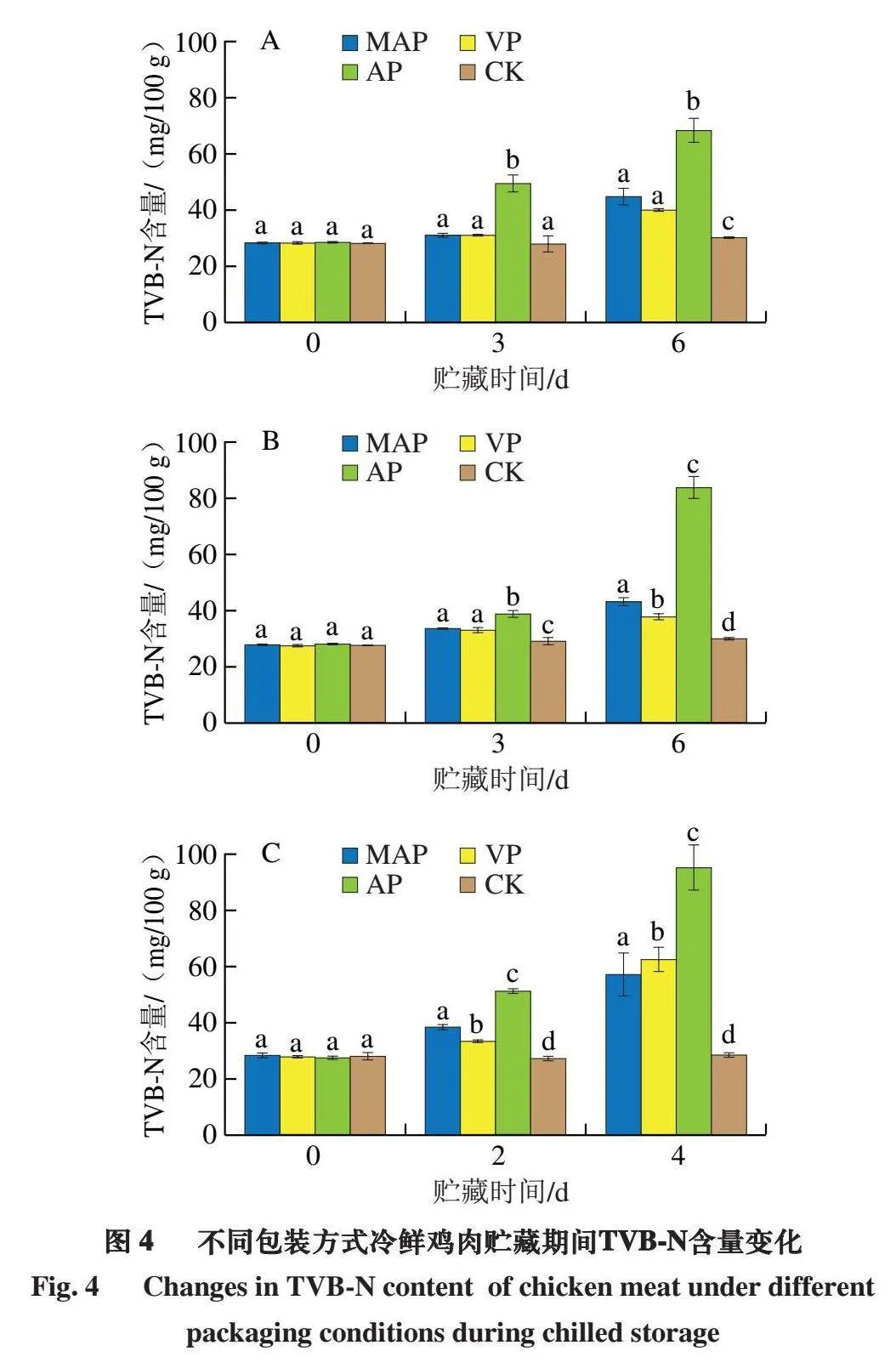
2.4 不同包装方式冷鲜鸡肉贮藏期间TVB-N含量变化
TVB-N含量常被用作反映肉类新鲜度和食品安全的生化指标[25]。由图4可知,贮藏之初,样品的TVB-N含量均在27.6~28.5 mg/100 g左右。在贮藏温度为-1~0 ℃和3~5 ℃时,贮藏到第6天时,MAP和VP组冷鲜鸡样品的TVB-N含量均在37.00~45.00 mg/100 g之间,其中,VP组相较于AP(7~10 ℃、4 d)降低55.91 mg/100 g,而AP组的TVB-N含量分别为68.18、84.11 mg/100 g,已经超过GB 2707—2016《食品安全国家标准 鲜(冻)畜、禽产品》中15 mg/100 g的限量;在贮藏温度为7~10 ℃时,贮藏到第4天,MAP和VP组TVB-N含量分别为57.44、67.72 mg/100 g,而AP组的TVB-N含量达到95.57 mg/100 g。综上,随着贮藏时间的延长,隆德假单胞菌和热死环丝菌的加速生长使贮藏期间冷鲜鸡中游离氨基酸和肽增加,从而推动TVB-N的积累[26],混菌的共生和代谢导致冷鲜鸡中的蛋白质加速降解,生成氨基酸甚至胺类化合物[27]。MAP和VP能够显著抑制TVB-N含量上升,其中VP的抑制效果在TVB-N含量小于50 mg/100 g时更加显著。
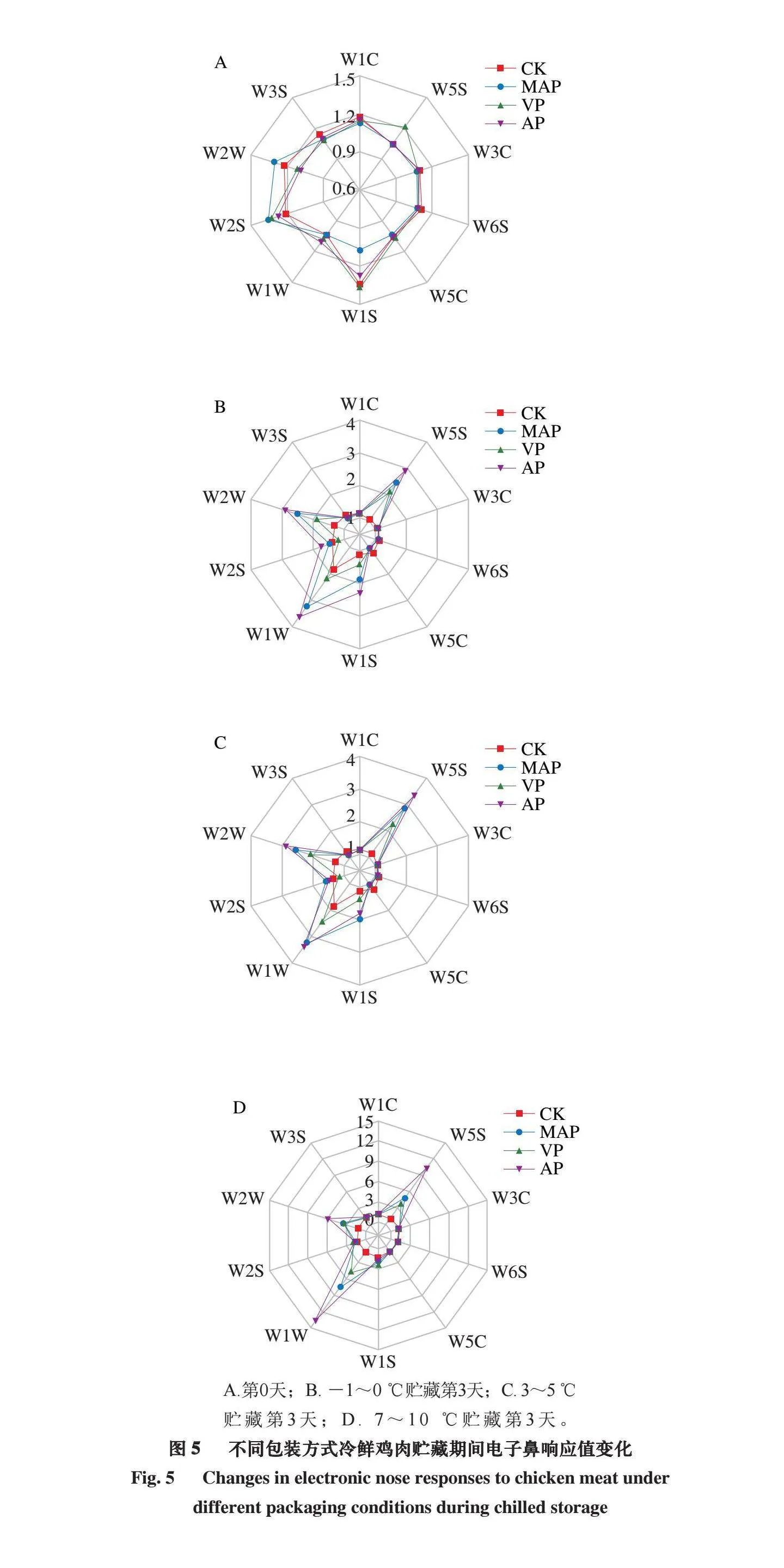
2.5 不同包装方式冷鲜鸡肉贮藏期间电子鼻响应值变化
电子鼻原理是仿照人或动物的鼻子,用于识别、检测和分析复杂气味和挥发性成分的新型仪器[18]。本研究通过电子鼻传感器对冷鲜鸡样品进行特征分析,以区分不同温度、不同包装条件下隆德假单胞菌和热死环丝菌混菌接种后的冷鲜鸡肉糜样品。由图5可知,随着冷鲜鸡肉糜贮藏时间的延长,电子鼻输出信号特征值的强度也逐渐递增;随着贮藏温度增加,电子鼻输出信号特征值也增加。7~10 ℃贮藏的鸡肉样品在3 d后,输出信号的特征值急剧增加,由于冷鲜鸡肉中热死环丝菌和隆德假单胞菌产生内源酶等因素的影响,产生的挥发性成分发生改变,导致电子鼻输出信号的特征值也随之发生变化,这种情况和TVB-N含量及菌落总数指标的情况一致,贮藏温度越高、贮藏时间越长,硫化物(W1W)、氮氧化物(W5S)、芳烃化合物(W2W)及含硫有机化合物(W2W)含量越高,样品散发的气味越重。但由于MAP和VP抑制了假单胞菌和热死环丝菌的生长,使其腐败产生硫化物和氮氧化物的含量远低于AP。然而,在-1~0 ℃和3~5 ℃贮藏的冷鲜鸡肉样品,在保存3 d内,虽然热死环丝菌和隆德假单胞菌的菌落总数产生了变化,但是其电子鼻特征值变化较缓慢,可能由于温度较低,其热死环丝菌和假单胞菌虽然生长但其内源酶活性并不是很强,所以腐败程度较低。
A.第0天;B. -1~0 ℃贮藏第3天;C. 3~5 ℃贮藏第3天;D. 7~10 ℃贮藏第3天。
3 结 论
本研究对不同温度、不同包装方式下隆德假单胞菌和热死环丝菌混菌生长变化对冷鲜鸡贮藏期间腐败特性的影响进行分析。结果表明,随着贮藏时间的延长,MAP和VP对冷鲜鸡的保鲜具有显著作用(P<0.05),VP(-1~0 ℃)能够很好地起到延长其商品货架期的作用,且包装简单美观;MAP(-1~0 ℃)效果次之,但是也能明显延缓热死环丝菌和隆德假单胞菌的生长。目前的MAP和VP虽然能够有效抑制混菌的生长,但进一步的研究仍很有必要,可以在此研究上再添加一些抗菌物质、抗菌材料或将天然细菌素与VP或MAP结合,在能够更好地延长冷鲜鸡货架期的同时,优化冷鲜鸡贮藏、运输及销售过程中的感官和营养品质。
参考文献:
[1] 尹茂源, 白婷, 宋晗, 等. 肉类加工过程中质量管理研究[J]. 中国食品工业, 2023(8): 61-63.
[2] CHMIEL M, HAĆ-SZYMAŃCZUK E, ADAMCZAK L, et al. Quality changes of chicken breast meat packaged in a normal and in a modified atmosphere[J]. Journal of Applied Poultry Research, 2018, 27(3): 349-362. DOI:10.3382/japr/pfy004.
[3] HYLDGAARD M, MEYER R L, PENG M, et al. Binary combination of epsilon-poly-L-lysine and isoeugenol affect progression of spoilage microbiota in fresh turkey meat, and delay onset of spoilage in Pseudomonas putida challenged meat[J]. International Journal of Food Microbiology, 2015, 215: 131-142. DOI:10.1016/j.ijfoodmicro.2015.09.014.
[4] DOULGERAKI A I, ERCOLINI D, VILLANI F, et al. Spoilage microbiota associated to the storage of raw meat in different conditions[J]. International Journal of Food Microbiology, 2012, 157(2): 130-141. DOI:10.1016/j.ijfoodmicro.2012.05.020.
[5] HUANG J C, GUO Y C, HOU Q, et al. Dynamic changes of the bacterial communities in roast chicken stored under normal and modified atmosphere packaging[J]. Journal of Food Science, 2020, 85(4): 1231-1239. DOI:10.1111/1750-3841.15038.
[6] 麦栩滔, 王文卓, 郑宇航, 等. 不同包装方式对冷鲜鸡肉微生物菌群多样性的影响[J]. 食品工业科技, 2023, 44(13): 367-374. DOI:10.13386/j.issn1002-0306.2022090004.
[7] ZHANG T, DING H, CHEN L, et al. Characterization of chilled chicken spoilage using an integrated microbiome and metabolomics analysis[J]. Food Research International, 2021, 144: 110328. DOI:10.1016/j.foodres.2021.110328.
[8] HILGARTH M, LEHNER E M, BEHR J, et al. Diversity and anaerobic growth of Pseudomonas spp. isolated from modified atmosphere packaged minced beef[J]. Journal of Applied Microbiology, 2019, 127(1): 159-174. DOI:10.1111/jam.14249.
[9] 方金玉. 冷鲜牛肉中假单胞菌和热死环丝菌致腐机制及其光动力杀菌控制研究[D]. 杭州: 浙江工商大学, 2023. DOI:10.27462/d.cnki.ghzhc.2022.000876.
[10] CARVALHEIRA A, FERREIRA V, SILVA J, et al. Enrichment of Acinetobacter spp. from food samples[J]. Food Microbiology, 2016, 55: 123-127. DOI:10.1016/j.fm.2015.11.002.
[11] LACROIX M, BORSA J, CHIASSON F, et al. The influence of atmosphere conditions on Escherichia coli and Salmonella typhi radiosensitization in irradiated ground beef containing carvacrol and tetrasodium pyrophosphate[J]. Radiation Physics and Chemistry, 2004, 71(1/2): 61-64. DOI:10.1016/j.radphyschem.2004.04.061
[12] WANG G Y, LI Q, TANG W Q, et al. AprD is important for extracellular proteolytic activity, physicochemical properties and spoilage potential in meat-borne Pseudomonas fragi[J]. Food Control, 2021, 124: 107868. DOI:10.1016/j.foodcont.2021.107868.
[13] CHA H Y, LIANG S M, SHI K Y, et al. Effect of modified atmosphere packaging on the quality characteristics and bacterial community succession of super-chilled chicken meat in biopreservation[J]. LWT-Food Science and Technology, 2023, 189: 115547. DOI:10.1016/j.lwt.2023.115547.
[14] WANG X X, WANG Z T, SUN Z L, et al. In vitro and in situ characterization of psychrotrophic spoilage bacteria recovered from chilled chicken[J]. Foods, 2022, 12(1): 95. DOI:10.3390/foods12010095.
[15] NARVHUS J A, BAEKKELUND O N, TIDEMANN E M, et al. Isolates of Pseudomonas spp. from cold-stored raw milk show variation in proteolytic and lipolytic properties[J]. International Dairy Journal, 2021, 123: 105049. DOI:10.1016/j.idairyj.2021.105049.
[16] HWANHLEM N, JAFFRES E, DOUSSET X, et al. Application of a nisin Z-producing Lactococcus lactis subsp lactis KT2W2L isolated from brackish water for biopreservation in cooked, peeled and ionized tropical shrimps during storage at 8 ℃ under modified atmosphere packaging[J]. European Food Research and Technology, 2015, 240(6): 1259-1269. DOI:10.1007/s00217-015-2428-8.
[17] HUANG M Y, WANG H H, XU X L, et al. Effects of nanoemulsion-based edible coatings with composite mixture of rosemary extract and ε-poly-L-lysine on the shelf life of ready-to-eat carbonado chicken[J]. Food Hydrocolloids, 2020, 102: 105576. DOI:10.1016/j.foodhyd.2019.105576.
[18] 柴春祥, 施婉君, 蔡悦, 等. 电子鼻检测鸡肉新鲜度的研究[J]. 食品科学, 2009, 30(2): 170-173. DOI:10.7506/spkx1002-6630-200902036.
[19] YIN X Y, LÜ Y C, WEN R X, et al. Characterization of selected Harbin red sausages on the basis of their flavour profiles using HS-SPME-GC/MS combined with electronic nose and electronic tongue[J]. Meat Science, 2021, 172: 108345. DOI:10.1016/j.meatsci.2020.108345.
[20] PIUS BASSEY A, PEI LIU P, CHEN J, et al. Antibacterial efficacy of phenyllactic acid against Pseudomonas lundensis and Brochothrix thermosphacta and its synergistic application on modified atmosphere/air-packaged fresh pork loins[J]. Food Chemistry, 2024, 430: 137002. DOI:10.1016/j.foodchem.2023.137002.
[21] PIN C, GARCÍA DE FERNANDO G D, ORDÓÑEZ J A. Effect of modified atmosphere composition on the metabolism of glucose by Brochothrix thermosphacta[J]. Applied and Environmental Microbiology, 2002, 68(9): 4441-4447. DOI:10.1128/AEM.68.9.4441-4447.2002.
[22] CALDERA L, FRANZETTI L, VAN COILLIE E, et al. Identification, enzymatic spoilage characterization and proteolytic activity quantification of Pseudomonas spp. isolated from different foods[J]. Food Microbiology, 2016, 54: 142-153. DOI:10.1016/j.fm.2015.10.004.
[23] WANG G Y, WANG H H, HAN Y W, et al. Evaluation of the spoilage potential of bacteria isolated from chilled chicken in vitro and in situ[J]. Food Microbiology, 2017, 63: 139-146. DOI:10.1016/j.fm.2016.11.015.
[24] KHALED A Y, PARRISH C A, ADEDEJI A. Emerging nondestructive approaches for meat quality and safety evaluation: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2021, 20(4): 3438-3463. DOI:10.1111/1541-4337.12781.
[25] FRANK D, HUGHES J, PIYASIRI U, et al. Volatile and non-volatile metabolite changes in 140-day stored vacuum packaged chilled beef and potential shelf life markers[J]. Meat Science, 2020, 161: 108016. DOI:10.1016/j.meatsci.2019.108016.
[26] Bekhit A E D A, Holman B W B, Giteru S G, et al. Total volatile basic nitrogen (TVB-N) and its role in meat spoilage: a review[J]. Trends in Food Science & Technology, 2021, 109: 280-302. DOI:10.1016/j.tifs.2021.01.006.
[27] BAI J, FAN Y, ZHU L, et al. Characteristic flavor of Antarctic krill (Euphausia superba) and white shrimp (Penaeus vannamei) induced by thermal treatment[J]. Food Chemistry, 2022, 378: 132074. DOI:10.1016/j.foodchem.2022.132074.
