双参数磁共振影像组学联合PSAD在前列腺癌Gleason分级分组中的应用价值
2024-10-02任大彬卫雨果刘丽秋徐祖良汪国余
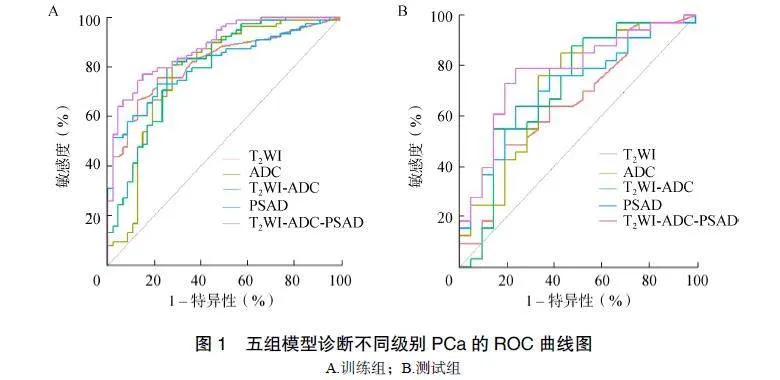

[摘要]目的探讨双参数磁共振成像(biparametricmagneticresonanceimaging,bpMRI)影像组学联合前列腺特异性抗原密度(prostate-specificantigendensity,PSAD)在低、高级别前列腺癌(prostatecarcinoma,PCa)中的诊断价值。方法回顾性分析2018年6月至2022年10月台州市中心医院经病理证实为PCa患者的临床及影像资料。根据Gleason分级分组(Gleasongradegroup,GGG),将GGG≤2定义为低级别PCa,GGG>2定义为高级别PCa。按7∶3比例将不同级别的PCa患者随机分为训练组和测试组。基于T2加权成像(T2weightedimaging,T2WI)、表观扩散系数(apparentdiffusioncoefficient,ADC)序列提取影像组学特征,采用最大相关最小冗余、最小绝对收缩和选择算子进行特征选择和降维,并进行5倍交叉验证,保留最佳特征组合构建影像组学模型。通过受试者操作特征曲线(receiveroperatingcharacteristiccurve,ROC曲线)和Delong检验评估各模型的诊断性能。采用决策曲线分析(decisioncurveanalysis,DCA)评价模型的临床效用。结果所有模型中,T2WI-ADC-PSAD联合模型的诊断效能最高,在训练组和测试组中的曲线下面积(areaunderthecurve,AUC)分别为0.882、0.772。Delong检验结果显示,在训练组中,T2WI-ADC-PSAD模型与T2WI模型的AUC比较差异无统计学意义(P>0.05),与其他模型的AUC比较差异均有统计学意义(P<0.05)。在测试组中,T2WI-ADC-PSAD模型与其他模型的AUC比较差异均无统计学意义(P>0.05)。DCA结果显示,当阈值概率低于97%时,T2WI-ADC-PSAD模型可为临床决策提供更高的净效益。结论BpMRI影像组学联合PSAD可提高对低、高级别PCa的诊断效能,并指导患者的治疗决策。
[关键词]双参数磁共振成像;前列腺特异性抗原密度;影像组学;预测模型;Gleason分级分组
[中图分类号]R737.25[文献标识码]A[DOI]10.3969/j.issn.1673-9701.2024.25.007
ApplicationvalueofbiparametricmagneticresonanceimagingradiomicscombinedwithPSADinGleasongradegroupofprostatecarcinoma
RENDabin1,WEIYuguo2,LIULiqiu1,XUZuliang1,WANGGuoyu1
1.DepartmentofRadiology,TaizhouCentralHospital(TaizhouUniversityHospital),Taizhou318000,Zhejiang,China;2.AdvancedAnalyticsCenter,GlobalMedicalService,GEHealthcare,Hangzhou310000,Zhejiang,China
[Abstract]ObjectiveToinvestigatethediagnosticvalueofbiparametricmagneticresonanceimaging(bpMRI)radiomicscombinedwithprostate-specificantigendensity(PSAD)inpredictinglow-gradeandhigh-gradeprostatecarcinoma(PCa).MethodsTheclinicalandimagingdataofpatientswithPCaconfirmedbypathologyinTaizhouCentralHospitalfromJune2018toOctober2022wereretrospectivelyanalyzed.AccordingtoGleasongradegroup(GGG),GGG≤2wasdefinedaslow-gradePCa,andGGG>2wasdefinedashigh-gradePCa.PCapatientswithdifferentgradeswererandomlydividedintotraininggroupandtestgroupaccordingtoaratioof7∶3.RadiomicsfeatureswereextractedbasedonT2weightedimaging(T2WI)andapparentdiffusioncoefficient(ADC)sequences.Featureselectionanddimensionalityreductionwerecarriedoutusingmaximumrelevanceminimumredundancy,leastabsoluteshrinkageandselectionoperator,and5-foldcrossvalidationwasperformedtoretainthebestradiomicsfeatures.Receiveroperatingcharacteristic(ROC)curveandDelong’stestwereusedtoevaluatetheperformanceofeachmodel.Decisioncurveanalysis(DCA)wasusedtoevaluatetheclinicalutilityofthemodel.ResultsAmongallthemodels,T2WI-ADC-PSADcombinedmodelhadthebestdiagnosticefficiency,theareaunderthecurve(AUC)intraininggroupandtestgroupwere0.882,0.772,respectively.Delong’stestshowedthatintraininggroup,therewasnosignificantdifferenceinAUCbetweenT2WI-ADC-PSADmodelandT2WImodel(P>0.05),butthereweresignificantdifferencesbetweenT2WI-ADC-PSADmodelandothermodels(P<0.05).IntestgrouptherewerenosignificantdifferencesinAUCbetweenT2WI-ADC-PSADmodelandothermodels(P>0.05).TheDCAshowedthattheT2WI-ADC-PSADmodelprovidedahighernetbenefitforclinicaldecision-makingwhenthethresholdprobabilitywaslessthan97%.ConclusionBpMRIradiomicscombinedwithPSADcanimprovethediagnosticefficiencyoflow-gradeandhigh-gradePCa,andguidethetreatmentdecisionofpatients.
[Keywords]Biparametricmagneticresonanceimaging;Prostate-specificantigendensity;Radiomics;Predictionmodel;Gleasongradegroup
前列腺癌(prostatecarcinoma,PCa)是男性第二大常见癌症,发病率在全球范围内呈上升趋势[1-2]。Gleason评分(Gleasonscore,GS)是反映PCa侵袭性的重要指标。2014年,国际泌尿病理协会提出Gleason分级分组(Gleasongradegroup,GGG),分别为GGG1(GS≤6)、GGG2(GS3+4)、GGG3(GS4+3)、GGG4(GS3+5、4+4、5+3)和GGG5(GS=9)[3]。虽然GS4+3和GS3+4总分同为7分,但在临床治疗策略及预后方面存在不同[4]。GS依赖于经直肠超声引导下活检,是一种有创检查,可导致一系列并发症[5]。影像组学通过将医学图像转化为高维数据反映肿瘤的组织病理学特征,实现对肿瘤的定量评估[6-7]。目前,影像组学已广泛应用于PCa的诊断、侵袭性评估、生化复发预测和转移等[8-12]。前列腺特异性抗原(prostate-specificantigen,PSA)是PCa的肿瘤标志物,但其特异性较差。与PSA相比,前列腺特异性抗原密度(prostate-specificantigendensity,PSAD)对PCa的筛查和诊断具有更高的特异性[13]。本研究旨在探讨双参数磁共振成像(biparametricmagneticresonanceimaging,bpMRI)影像组学联合PSAD在术前无创性诊断低级别(GGG≤2)和高级别(GGG>2)PCa的效能。
1资料与方法
1.1一般资料
回顾性分析2018年6月至2022年10月台州市中心医院经病理证实为PCa患者的临床资料。纳入标准:①使用相同的3.0T磁共振成像(magneticresonanceimaging,MRI)扫描仪,扫描序列和参数一致;②MRI图像清晰;③MRI检查后2周内行超声引导下穿刺或根治性切除术,并获得GS。排除标准:①MRI检查前行超声引导下穿刺、手术或其他治疗;②图像质量差;③临床资料不完整。本研究经台州市中心医院伦理委员会批准[伦理审批号:(研)2023-09-02],免除知情同意。
1.2bpMRI采集
使用3.0TMRI扫描仪(西门子医疗保健,德国),采用18通道腹部线圈,取平卧位,头部向前,患者在检查前充盈膀胱,扫描中心线与耻骨联合平齐。扫描序列包括轴位T2加权成像(T2weightedimaging,T2WI)和弥散加权成像(diffusionweightedimaging,DWI),基于DWI自动生成表观扩散系数(apparentdiffusioncoefficient,ADC)。MRI扫描参数见表1。
1.3临床资料
收集患者的临床资料,包括年龄、PSA;测量前列腺体积(prostatevolume,PV)3次取平均值,计算PSAD。PSAD定义为:PSAD=PSA/PV。
1.4病理分析
所有病理结果均来自靶向穿刺、12针系统穿刺和根治性前列腺切除术后标本。穿刺方法为经直肠超声引导下经会阴12针饱和前列腺穿刺活检。每根活检针长度均不小于1.5cm,并标记具体位置。由一位具有10年以上工作经验的泌尿生殖病理医生对病理标本进行评估,并获得GS。
1.5绘制感兴趣体积
将MRI图像导入ITK-SNAP软件(3.6.0版)。在不了解患者临床信息和病理结果的情况下,由具有5年泌尿放射诊断经验的医生A在T2WI和ADC图上手动勾画感兴趣体积(volumeofinterest,VOI),共勾画3层。VOI边界距病灶边缘1~2mm,尽量避开尿道、出血、坏死、钙化及邻近非肿瘤组织。所有VOI均由具有10年以上泌尿放射诊断经验的医生B进行验证,若医生B对VOI的勾画存疑,则医生B与医生A协商或由医生B对医生A的勾画进行修改。若患者存在多个病变且GS不同时,取GS最高且直径最大的病灶勾画。
1.6特征提取与选择
使用Python3.5.6中的Pyradiomics软件包提取影像组学特征。使用最大相关最小冗余、最小绝对收缩和选择算子进行特征选择和降维,并进行5倍交叉验证,以保留最佳特征组合。采用组内相关系数(interclasscorrelationcoefficient,ICC)评估影像组学特征提取的观察者内和观察者间可重复性。
1.7Logistic回归模型构建
按照7∶3的比例将所有患者随机分为训练组和测试组。基于提取的最佳特征组合,采用Logistic回归分析构建T2WI和ADC单序列影像组学模型。将PSAD作为独立的临床特征进行单因素Logistic回归分析。最后通过多因素Logistic回归分析构建T2WI-ADC和T2WI-ADC-PSAD两个联合模型。
1.8统计学方法
采用SPSS27.0和R3.5.1软件进行统计学分析。采用Kolmogorov-Smirnov检验行正态性检验,非正态分布的计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,组间比较采用Mann-WhitneyU检验。采用受试者操作特征曲线(receiveroperatingcharacteristiccurve,ROC曲线)评价模型的性能,计算模型的准确性、敏感度、特异性和曲线下面积(areaunderthecurve,AUC)。采用Delong检验比较AUC之间的差异。采用决策曲线分析(decisioncurveanalysis,DCA)评价模型的临床效用。P<0.05为差异有统计学意义。
2结果
2.1一般资料
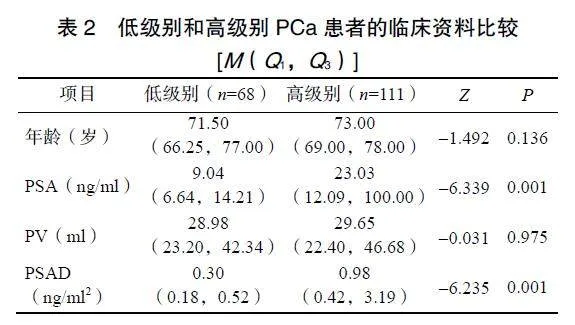
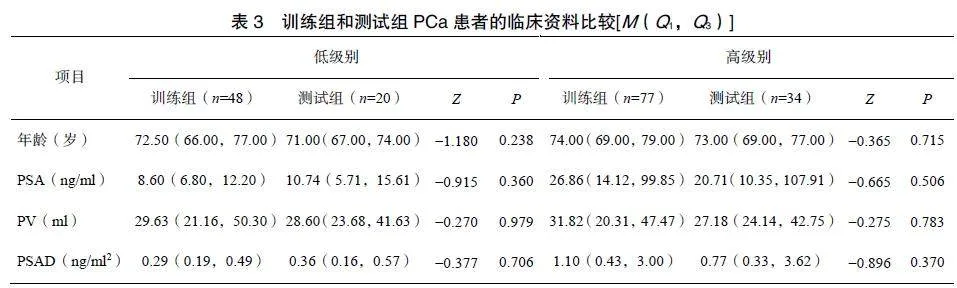
本研究共纳入179例PCa患者,低级别PCa患者68例,高级别PCa患者111例。低级别PCa患者的PSA、PSAD水平显著低于高级别PCa患者(P<0.05),见表2。按照7∶3比例随机分配,训练组患者125例,测试组患者54例。不同级别PCa患者的年龄、PSA、PV和PSAD在训练组和测试组间比较差异均无统计学意义(P>0.05),见表3。
2.2模型构建及性能评价
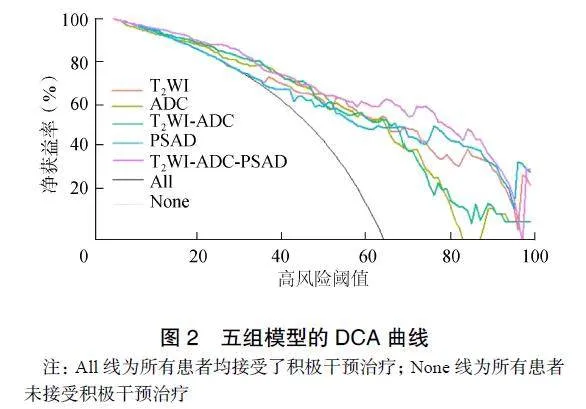
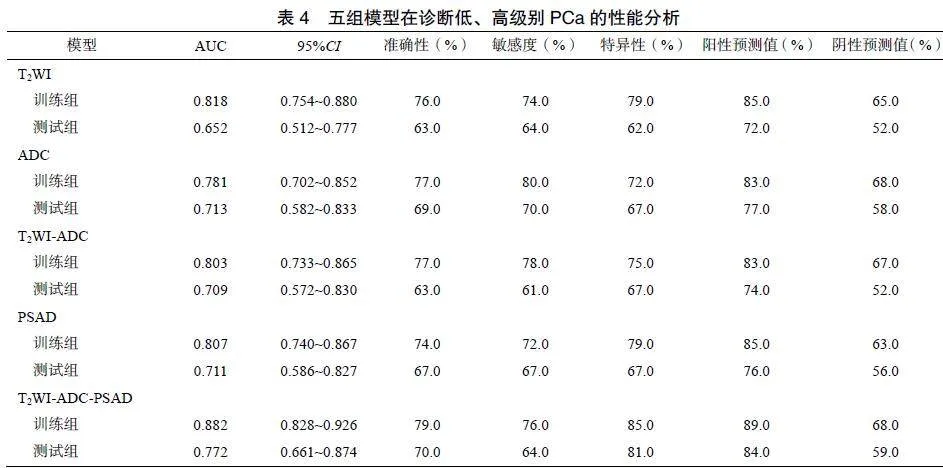
从T2WI、ADC和T2WI-ADC序列中分别提取出1316、1316和2632个特征参数。降维后分别获得6、6、7个最优特征参数,将最优特征参数联合并构建影像组学模型,分别为T2WI、ADC和T2WI-ADC模型。单因素Logistic回归分析显示,PSAD是GS分级的独立预测因素,将PSAD与影像组学结合,构建T2WI-ADC-PSAD联合模型。所有模型中,T2WI-ADC-PSAD联合模型的诊断效能最高,在训练组和测试组中的AUC分别为0.882、0.772,见表4、图1。Delong检验结果显示,在训练组中,T2WI-ADC-PSAD模型与T2WI模型的AUC比较差异无统计学意义(P=0.129),与其他模型比较差异有统计学意义(ADC:P=0.012;T2WI-ADC:P=0.004;PSAD:P=0.014)。在测试组中,T2WI-ADC-PSAD模型与其他模型的AUC比较差异均无统计学意义(T2WI:P=0.228;ADC:P=0.439;T2WI-ADC:P=0.231;PSAD:P=0.331)。DCA结果显示,当阈值概率低于97%时,T2WI-ADC-PSAD模型为临床决策提供更高的净效益,见图2。
3讨论
影像组学通过将医学图像转化为高维数据来反映肿瘤的组织病理学特征,实现对肿瘤的定量评估,为肿瘤诊断、侵袭性及预后评估提供新思路。本研究基于影像组学联合PSAD开发建立Logistic回归模型以诊断不同级别PCa,结果显示T2WI-ADC-PSAD联合模型的准确度、特异性和AUC均高于其他模型,表明影像组学和PSAD相结合具有更好的分类能力,可指导PCa的风险分层,为临床治疗决策提供帮助。
研究显示,MRI影像组学可预测PCa的侵袭性,且影像组学特征可作为预测PCaGS分级的无创性标志物[14]。Gong等[15]研究发现ADC模型预测GS≤7和GS>7PCa的诊断效能最佳,优于T2WI模型。本研究结果与之相似,在测试组中,ADC模型的诊断性能高于T2WI模型,分析原因:T2WI序列主要反映解剖价值,而ADC序列主要反映微循环中水分子的扩散信息,对病变组织的病理变化有更好的表达,能更好地反映肿瘤的异质性。另外,在ADC图像的分割过程中,可更准确地勾画肿瘤轮廓,使ADC模型在预测PCa侵袭性方面表现更好。
既往研究报道,ADC-T2WI联合模型的诊断效能要高于单一序列[15-16]。遗憾的是,本研究中这一联合模型并未提高诊断性能。刘金涛等[16]研究发现T2WI-ADC联合模型的诊断性能高于ADC模型,与本研究结果不同,可能是因为联合模型中T2WI及ADC特征参数占比不同。本研究中联合模型的7个影像组学特征有4个来自T2WI序列,3个来自ADC序列,T2WI特征参数在该模型中的占比较大,对联合模型的贡献大。相反,在刘金涛等[16]研究中,12个特征参数中有7个来自ADC序列。因此,推断组合模型中各序列的特征参数占比不同,可能影响诊断性能。T2WI和ADC序列是前列腺MRI扫描的常规序列。与多参数磁共振成像(multiparametricMRI,mpMRI)相比,bpMRI排除了动态增强扫描,可减少扫描和VOI勾画时间,减轻患者经济负担,提高患者耐受性。此外,既往研究表明基于bpMRI的影像组学预测PCaGS分级的性能优于基于mpMRI的前列腺影像报告和数据系统(prostateimagingreportinganddatasystem,PI-RADS)的视觉评估[17]。因此,基于bpMRI影像组学在临床具有更广泛的应用性和实用性。
Hu等[18]将临床指标和ADC值联合构建列线图以预测PI-RADS3分且PSA<10ng/ml患者中PCa的患病概率,结果发现临床资料中PSAD的表现最好,可有效帮助临床医生对双灰区患者做出活检决策。Lee等[19]认为活检前bpMRI联合PSAD分析有助于识别GS=7分或更高级别的PCa。本研究中,T2WI-ADC-PSAD模型的诊断性能明显优于其他模型,DCA结果显示,当阈值概率低于97%时,T2WI-ADC-PSAD模型可为临床决策提供更高的净获益,表明影像组学联合PSAD可提升高级别PCa的检出率,有望为临床治疗决策提供帮助。DCA显示有一小段曲线低于None线,笔者认为可归因于随机噪声引起,可忽略不计。
本研究仍有局限性。首先,这是一项回顾性研究,在群体选择中可能存在偏倚。其次,这是一项单中心研究,模型没有通过外部数据进行验证。第三,不同阅片者手工勾画VOI存在差异,可能会影响影像组学特征的稳定性,尽管通过ICC>0.8进行特征选择来解决这个问题,但未来仍需要应用自动化、准确的肿瘤分割方法。最后,本研究仅采用单一的机器学习算法,相比于其他算法的优劣势尚不明确,未来需要进一步研究以寻找更精准、稳定的机器学习算法。
综上所述,bpMRI影像组学可无创性诊断低、高级别PCa。各序列特征参数在组合模型中所占比例的不同可能会导致模型性能的差异。bpMRI影像组学与PSAD相结合可进一步提高诊断效能,帮助临床医生做出治疗决策。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] SIEGELRL,MILLERKD,WAGLENS,etal.Cancerstatistics,2023[J].CACancerJClin,2023,73(1):17–48.
[2] 李星,曾晓勇.中国前列腺癌流行病学研究进展[J].肿瘤防治研究, ;2021,48(1):98–102.
[3] EPSTEINJI,EGEVADL,AMINMB,etal.The2014InternationalSocietyofUrologicalPathology(ISUP)consensusconferenceonGleasongradingofprostaticcarcinoma:Definitionofgradingpatternsandproposalforanewgradingsystem[J].AmJSurgPathol,2016,40(2):244–252.
[4] KANECJ,EGGENERSE, SHINDELAW,etal.Variabilityinoutcomesforpatientswithintermediate-riskprostatecancer(Gleasonscore7,InternationalSocietyofUrologicalPathologyGleasongroup2-3)andimplicationsforriskstratification:Asystematicreview[J].EurUrolFocus,2017,3(4-5):487–497.
[5] PARKSY,OHYT,JUNGDC,etal.Diffusion-weightedimagingpredictsupgradingofGleasonscoreinbiopsy-provenlowgradeprostatecancers[J].BJUInt,2017,119(1):57–66.
[6] LAMBINP,RIOS-VELAZQUEZE,LEIJENAARR,etal.Radiomics:Extractingmoreinformationfrommedicalimagesusingadvancedfeatureanalysis[J].EurJCancer,2012,48(4):441–446.
[7] GILLIESRJ,KINAHANPE,HRICAKH.Radiomics:Imagesaremorethanpictures,theyaredata[J].Radiology,2016,278(2):563–577.
[8] 李天平,骆训容,罗明芳,等.基于MRI的机器学习模型预测PI-RADS3病变的良恶性及侵袭性[J].国际医学放射学杂志,2021,44(6):638–643.
[9] QIY,ZHANGS,WEIJ,etal.MultiparametricMRI-basedradiomicsforprostatecancerscreeningwithPSAin4-10ng/mltoreduceunnecessarybiopsies[J].JMagnResonImaging,2020,51(6):1890–1899.
[10] MAKOWSKIMR,BRESSEMKK,FRANZL,etal.DenovoradiomicsapproachusingimageaugmentationandfeaturesfromT1mappingtopredictGleasonscoresinprostatecancer[J].InvestRadiol,2021,56(10):661–668.
